Применение расширенной криобалонной аблации у пациентов с персистирующей и длительно персистирующей формами фибрилляции предсердий
Автор: Омеляненко А.С., Ускач Т.М., Мавлюдов Т.И., Насибуллина А.Р., Хазиахметов Д.Ф., Черкашин Д.И., Ардус Д.Ф., Сапельников О.В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Цель. Изучить эффективность и безопасность расширенной криобаллонной аблации у пациентов с персистирующей и длительно персистирующей формами фибрилляции предсердий в сравнении с классической методикой криобаллонной аблации.
Изоляция задней стенки левого предсердия, криобаллонная аблация, персистирующая фибрилляция предсердий
Короткий адрес: https://sciup.org/143184211
IDR: 143184211 | УДК: 616.12-008.313.2 | DOI: 10.38109/2225-1685-2025-1-6-15
Текст научной статьи Применение расширенной криобалонной аблации у пациентов с персистирующей и длительно персистирующей формами фибрилляции предсердий
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Не-коммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Фибрилляция предсердий (ФП) — наиболее распространённое нарушение ритма сердца, часто приводящее к госпитализации. С ростом продолжительности жизни заболеваемость ФП увеличивается. ФП повышает риск тромбоэмболических осложнений (в 3-4 раза), включая инсульт, способствует прогрессированию сердечной недостаточности и является независимым предиктором внезапной сердечной смерти [1, 2, 3].
Лечение фибрилляции предсердий (ФП) остаётся одной из самых сложных задач в кардиологии и аритмологии. Современные антиаритмические препараты не всегда эффективны в сохранении синусового ритма и предотвращении рецидивов ФП [4, 5, 6]. Необходимы дальнейшие исследования для разработки более эффективной медикаментозной терапии и углубления понимания механизмов ФП [7].
Катетерная аблация — минимально инвазивный метод лечения ФП, включающий радиочастотную и криобаллонную аблацию. Криобаллонная аблация (КБА) считается более простой в освоении и воспроизведении, обеспечивая надежную изоляцию устьев лёгочных вен (УЛВ) [8]. Этот метод широко применяется при пароксизмальной форме ФП благодаря своей эффективности и безопасности. Преимущества КБА включают равномерное повреждение ткани, четкие границы воздействия и меньшую зависимость от оператора [9, 10].
Исследование Fire and Ice подтвердило, что КБА реже требует повторных госпитализаций, аблаций и кардиоверсий по сравнению с радиочастотной аблацией [9, 10]. Aryana A. и соавторы выделили анатомическую область вокруг левого предсердия и лёгочных вен как ключевую в поддержании ФП, особенно при постоянной форме [11, 12].
Однако долгосрочная эффективность и безопасность КБА при персистирующей и длительно персистирующей ФП требуют дальнейшего изучения. В последние годы активно исследуется возможность проведения дополнительных катетерных воздействий в области задней стенки левого предсердия для повышения эффективности катетерной аблации при персистирующей ФП. Целью нашей работы стало исследование эффективности и безопасности расширенной КБА, включая такие дополнительные воздействия, у пациентов с персистирующей и длительно персистирующей формами ФП.
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2019 по 2021 год было проведено проспективное, рандомизированное исследование эффективности и безопасности расширенной КБА у пациентов с персистирующей и длительно персистирующей формами ФП. Все процедуры катетерной абляции проводились на базе Медико-санитарной части Федерального государственного автономного образовательного учреждения высшего образования «Казанский (Приволжский) федеральный университет», г. Казань, и Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр кардиологии имени академика Е.И. Чазова» Министерства здравоохранения Российской Федерации, г. Москва. Исследование выполнено в рамках протокола клинической апробации, одобренной Минздравом Российской Федерации. В исследование на основании представленных ниже критериев включения и исключения было отобрано 117 пациентов с симптомной персистирующей и длительно персистирующей формами ФП, ранее не оперированных методом КБА и имевших показания для проведения катетерных методов лечения ФП.
Клинико-демографические характеристики пациентов представлены в таблице 1. Среди включённых в исследование пациентов с диагнозом персистирующая и длительно персистирующая формы ФП 73 (62%) пациента имели длительность персистенции до 12 месяцев и 44 (38%) пациента имели длительность персистенции более года. Стоит отметить, что среди пациентов с длительно персистирующей формой медиана продолжительности аритмии составила 19,1 [15,8; 25,9] месяцев, а длительность анамнеза, связанного с ФП, составила 23,6 [19,1; 58,4] месяцев. Что же касается пациентов с длительностью персистенции до одного года, то их медиана продолжительности аритмии составила 5,7 [3,6; 8,5] месяцев, а длительность анамнеза по ФП составила 9,0 [5,9; 32,2] месяцев.
Возраст включённых в исследование пациентов составил 61,0 [55,0; 67,0] лет. Медиана индекса массы тела (ИМТ) была выше нормальных значений и составила 28,7 [26,4; 31,6]. По результатам эхокардиографии (ЭхоКГ) отмечалась дилатация левого предсердия (ЛП): объем – 87,0 [74,0; 95,0] мл, размер – 4,20 [4,00; 4,60] см. Медиана фракции выброса левого желудочка (ФВ ЛЖ) составила 58%.
Таблица 1. Клинико-демографические характеристики пациентов [собственные данные]
Table 1. Clinical and demographic characteristics of patients [own data]
|
Показатели |
Me |
Q1-Q3 |
min |
Max |
|
Возраст, Me (полных лет) |
61,0 |
55,0-67,0 |
35,0 |
75,0 |
|
ИМТ, Me (кг/м 2 ) |
28,7 |
26,4-31,6 |
19,0 |
42,4 |
|
CHA2DS2-VASC, Me (балл) |
2,00 |
1,00-3,00 |
0,00 |
6,00 |
|
Длительность персистирующей ФП, Me (месяцев) |
8,8 |
4,7-17,8 |
0,9 |
69,0 |
|
Длительность анамнеза ФП, Me (месяцев) |
19,1 |
8,5-54,1 |
0,9 |
189,9 |
|
Объем ЛП до операции, Me (мл) |
87,0 |
74,0-95,0 |
39,0 |
137,0 |
|
Размер ЛП до операции, Me (см) |
4,20 |
4,00-4,60 |
3,00 |
5,60 |
|
МН до операции, Me (степени) |
1,5 |
1,0-2,0 |
1,0 |
3,0 |
|
КДР до операции, Me (см) |
4,80 |
4,6-5,0 |
3,80 |
5,70 |
|
Толщина МЖП до операции, Me (см) |
1,10 |
1,10-1,20 |
0,80 |
1,50 |
|
СДЛА до операции, Me (мм рт. ст.) |
31,00 |
29,00-36,00 |
20,00 |
50,00 |
|
ФВ ЛЖ до операции, Me (%) |
58,0 |
54,0-60,0 |
27,0 |
68,0 |
Примечание: Me – медиана; ИМТ – индекс массы тела; ФП – фибрилляция предсердий; МН – митральная недостаточность; КДР – конечно-диастолический размер; МЖП – межжелудочковая перегородка; СДЛА – систолическое давление в легочной артерии; ЛП – левое предсердие; ФВ – фракция выброса; ЛЖ – левый желудочек.
Note: Me – median; BMI – body mass index; AF – atrial fibrillation; MR – mitral regurgitation; EDD – end-diastolic diameter; IVS – interventricular septum; PASP– pulmonary artery systolic pressure; LA – left atrium; EF – ejection fraction; LV – left ventricle.
Среди заболеваний сердечно-сосудистой системы у исследуемых пациентов (табл. 2) в 84,6% случаев была выявлена гипертоническая болезнь. Ишемическая болезнь сердца, сахарный диабет, хроническая сердечная недостаточность и острая недостаточность мозгового кровообращения (ОНМК) в анамнезе составили 19,7%, 12%, 10,3% и 8,5% соответственно. Другие сердечно-сосудистые заболевания составили 8%.
Таблица 2. Заболевания сердечно-сосудистой системы у исследуемых пациентов [собственные данные]
Table 2. Cardiovascular diseases in patients [own data]
|
Сопутствующие заболевания |
Пациентов (n) |
% |
95% ДИ |
|
ГБ |
99 |
84,6 |
76,8-90,6 |
|
ИБС |
23 |
19,7 |
12,9-28,0 |
|
СД |
14 |
12 |
6,7-19,3 |
|
ХСН |
12 |
10,3 |
5,4-17,2 |
|
ОНМК (ТИА) |
10 |
8,5 |
4,2-15,2 |
|
Другие ССЗ |
8 |
6,8 |
3,0-13,0 |
Примечание: ГБ – гипертоническая болезнь; ИБС – ишемическая болезнь сердца; СД – сахарный диабет; ХСН – хроническая сердечная недостаточность; ОНМК – острая недостаточность мозгового кровообращения; ТИА – транзиторная ишемическая атака; ССЗ – сердечнососудистые заболевания.
Note: AH – arterial hypertension; IHD – ischemic heart disease; DM – diabetes mellitus; CHF – chronic heart failure; ACHF – acute cerebrovascular insufficiency; TIA – transient ischemic attack; CVD – cardiovascular disease.
Проводилась простая случайная рандомизация. Пациенты, подвергавшиеся КБА, были разделены на две группы. В исследуемой группе (группа наблюдения, 61 случай) пациентам проведена КБА УЛВ и задней стенки левого предсердия (ЗСЛП) с последующим вольтажным картированием многополюсным катетером HD Grid на навигационной системе Ensite Precision. В группе сравнения (56 случаев) пациентам проводилась стандартная КБА УЛВ (табл. 3).
Критериями включения являлись достижение совершеннолетия, задокументированная симптоматическая персистирующая ФП, рефрактерная к антиаритмическим препаратам I и III классов, ожидаемая продолжительность жизни более 1 года.
От пациентов было получено информативное согласие на интервенционное вмешательство.
Критериями исключения были: серьёзные психические или неврологические расстройства, а также любые другие состояния или заболевания, которые могли бы помешать участию пациента в исследовании; резистентность к антикоагулянтной терапии, тромбозы полостей сердца, наличие ишемической болезни сердца, требующей хирургической реваскуляризации; острый коронарный синдром; острая сердечная недостаточность; выраженные коагулопатии, тяжёлые анемии; наличие показаний к коррекции клапанной патологии; лихорадка и тяжёлые инфекционные заболевания; язвенная болезнь в стадии обострения.
Оценка эффективности проводилась по результатам контрольного осмотра через 3, 6, 12, 18, 24 месяцев после проведённой процедуры. Контроль ритма производился путём контроля электрокардиограммы (ЭКГ) и 24-часового монитора ЭКГ при очном визите.
В группе наблюдения был имплантирован петлевой регистратор. В целом длительность наблюдения составила до 24 месяцев.
Методика проведения КБА УЛВ
Под ультразвуковым контролем осуществлялся венозный доступ, путём пункции яремной и бедренной вены устанавливались гемостатические интродьюсеры, проводилось позиционирование диагностических 10-полюсных электродов в коронарный синус и правый желудочек.
Пункция межпредсердной перегородки (МПП) выполнялась по стандартной методике с применением контрастного вещества или под контролем внутрисердечной эхокардиографии (ВСЭхоКГ). Системная гепаринизация достигалась путём внутривенного введения гепарина из расчета 100 ЕД на 1 кг массы тела. Вся процедура выполнялась под контролем активированного времени свертывания крови (ACT – activated clotting time) с целевыми значениями не менее 300 секунд.
По установленному проводнику во время пункции МПП в полость ЛП проводилась система доставки FlexCath Advance, через которую заводился криобаллонный катетер Аrctic Front Advance Pro 28 мм с диагностическим электродом Achieve (Medtronic).
Позиционировался криобаллонный катетер в УЛВ под рент-ген-контролем и/или ВСЭхоКГ с подтверждением окклюзии ЛВ.
Таблица 3. Исходные демографические данные пациентов в группах [собственные данные]
Table 3. Baseline demographic data of patients in groups [own data]
|
Показатель |
Группа наблюдения (n=61) |
Группа сравнения (n=56) |
p |
|
Возраст, лет |
62,0 [52;66] |
59,5 [56,8;68,2] |
0,855 |
|
Мужчины/женщины, n (%) |
35 (57,4)/ 26 (42,6) |
33 (58,9)/ 23 (41,1) |
0,865 |
|
ИМТ, кг/м 2 |
28,7 [26,9; 31,6] |
28,7 [26,4; 30,8] |
0,872 |
|
ФК EHRA, n (%): |
|||
|
IIa, n |
6 (9,8) |
2 (3,6) |
|
|
IIb, n |
16 (26,6) |
9 (16,1) |
0,209 |
|
III, n |
35 (57,4) |
45 (75) |
|
|
IV, n |
4 (6,6) |
3 (5,4) |
|
|
Анамнез ФП, мес. |
19,1 [8,5; 32,2] |
17,0 [7,2; 64,0] |
0,836 |
|
Персистирующая |
36 (59,0) |
37 (66,1) |
0,431 |
|
Длительно персистирующая форма ФП, n (%) |
25 (41,0) |
19 (33,9) |
|
|
Размер ЛП, см |
4,20 [3,90;4,60] |
4,25 [4,00;4,60] |
0,397 |
|
Объем ЛП, мл |
83,0 [74,0; 94,0] |
87,5 [75,0; 102,2] |
0,120 |
|
ФВ ЛЖ, % |
58,0 [54,0; 61,0] |
58,0 [54,0;60,0] |
0,569 |
Примечание: ИМТ – индекс массы тела; ФК – функциональный класс; EHRA – European Heart Rhythm Association; Me – медиана; ФП – фибрилляция предсердий; ЛП – левое предсердие; ЛЖ – левый желудочек.
Note: BMI – body mass index; FC – functional class; EHRA – European Heart Rhythm Association; Me – median; AF – atrial fibrillation; LA – left atrium; LV – left ventricle.
Контроль полной окклюзии УЛВ осуществлялся с применением рентгенконтрастного вещества, при использовании флюороскопического контроля. В момент обтурации устья ЛВ баллоном катетера подавалось контрастное вещество по доставляющему каналу в окклюзированную вену. По накоплению контрастного вещества в вене судили о наличии полной обтурации вены. Так же контроль осуществлялся путём введения физиологического раствора при поддержке внутрисердечного ультразвукового контроля. В момент обтурации УЛВ баллоном катетера, подавался физиологический раствор по доставляющему каналу в окклюзированную вену. По визуализации появления раствора в полости ЛП или его отсутствия можно судить о наличии полной обтурации вены.
Длительность криоаппликации каждой легочной вены составляла 240 сек при температуре выше –55 градусов Цельсия и 180 сек при достижении более низких температур. Последовательность аппликаций была следующей: левая верхняя ЛВ, левая нижняя ЛВ, правая нижняя ЛВ, правая верхняя ЛВ.
Перед проведением воздействий на правых ЛВ диагностический электрод из правого желудочка позиционировался на латеральной стенке верхней полой вены (ВПВ), и выполнялась стимуляция диафрагмального нерва для контроля возможного риска его повреждения.
Осуществлялся контроль изоляции ЛВ (оценка блокады входа и выхода, потенциалов ЛВ на электроде Achieve). При отсутствии изоляции ЛВ наносились дополнительные криовоздействия под рентген-контролем или под контролем ВСЭхоКГ.
Для окклюзии ЛВ баллоном были использованы несколько технических вариантов:
-
1) метод «прямой окклюзии» для правой и левой верхней ЛВ;
-
2) метод «hockey stick» или «хоккейной клюшки» для правой и левой нижней ЛВ;
-
3) в редких случаях, когда не удавалось полностью окклюзи-ровать ЛВ, использовался метод «pull down». При вытекании контраста в области нижнего полюса баллона на пятидесятой секунде криовоздействия проводилось опускание системы доставки для прижатия баллона к нижнему полюсу УЛВ. Данная методика проведения КБА УЛВ применялась в группе сравнения.
Методика изоляции ЗСЛП
В ходе проведения оперативных вмешательств в группе наблюдения изоляция УЛВ дополнялась изоляцией задней стенки левого предсердия (ИЗСЛП). Диагностический катетер Achieve устанавливался и «закреплялся» в верхней левой ЛВ. Изоляция задней стенки проводилась поэтапно, проводились поочередно аппликации от устья ЛВ в медиальном направлении последовательно по 2-4 воздействия от каждой ЛВ, прижимая криобаллон к задней стенке. Каждое последующее воздействие проводилось с частичным (30-50%) перекрытием предыдущего. Позиционирование криобаллонного катетера у УЛВ осуществлялось под рентген-контролем и ВСЭхоКГ. Затем Achieve переустанавливался в правую верхнюю ЛВ и так же поэтапно в медиальном направлении проводилось криовоздействие, создавая тем самым верхнюю линию изоляции ЗСЛП. Затем Achieve переставлялся в левую нижнюю и правую нижнюю ЛВ и аналогичным образом, поэтапно создавалась нижняя линия изоляции ЗСЛП. В ряде случаев применялся маневр «хоккейной клюшки» для увеличения площади ИЗСЛП.
Для обеспечения прижатия криобаллона к ЗСЛП проводился поворот интродьюсера по часовой стрелке при нахождении диагностического катетера в левых ЛВ и против часовой стрелки при нахождении Achieve в правых ЛВ. Степень поворота интродьюсера определялось по тактильным ощущениям и на основании рентгенологической картинки и данных ВСЭхоКГ.
Осуществлялся контроль за положением баллона, чтобы каждое последующее положение баллона для аппликации перекрывало предыдущее на 30-50 процентов. Таким образом, создавалась непрерывная линия изоляции. В каждой позиции производилась криоапликация длительностью в 150 секунд. Температура в пищеводе контролировалась пищеводным температурным датчиком, который устанавливался трансназально. Температура в пищеводе, в проекции проведения криовоздействия не должна была опускаться ниже 20 градусов, в случае достижения данной температуры, криовоздействие прекращалось. К окончанию ИЗСЛП сформировывались две непрерывных линии, между верхними ЛВ и нижними ЛВ. Проводился контроль ИЗСЛП (оценка блока входа и выхода, потенциалов ЗСЛП на электроде Achieve, позиционированного в области воздействий, и/или проводилось вольтажное картирование) (рис. 1).
Проводилась оценка отсутствия расхождения листков перикарда с помощью ЭхоКГ или ВСЭхоКГ, удаление катетеров и интродьюсеров, наложение давящих повязок на места пункции центральных вен.
Внутренний протокол безопасности
Пункции центральных, яремных и бедренных вен проводились под ультразвуковым контролем с целью снижения риска местных осложнений.
Перед введением криобаллона в интродьюсер баллон раздувался в ванночке с физиологическим раствором и с его поверхности удалялись пузырьки воздуха. Затем баллон, находясь в растворе, сдувался и на него одевалась пластиковая обойма. Через Y-коннектор еще раз под давлением прогонялся физиологический раствор с целью окончательного удаления остатков воздуха из внутреннего канала криобаллона и с поверхности находящегося в канале диагностического электрода Achieve.
Проведение всем пациентам мультиспиральной компьютерной томографии с контрастным усилением органов грудной клетки являлось неотъемлемой частью локального протокола безопасности. Проведение данного исследования позволяло заранее понимать анатомию, аномалии и возможные сопутствующие патологии. В нашей практике были выявлены тромбоэмболии легочной артерии, периферический рак левого легкого, тромбоз ВПВ, врождённое отсутствие нижней полой вены и другие патологии.
Статистический анализ проводился с использованием программы StatTech v. 4.0.1 (ООО "Статтех", Россия), встроенного пакета анализа табличного процессора Excel® 2016 (Microsoft, США), и программы статистического анализа SPSS v26.0 (IBM, США).
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50).
Количественные показатели, имевшие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ).
В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1-Q3).
Категориальные данные описывались с указанием абсолютных значений и процентных долей.
Сравнение двух групп по количественному показателю, имевшему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента.
Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни.
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10).
Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат Пирсона.
Оценка функции выживаемости пациентов проводилась по методу Каплана-Мейера. График оценки функции выживаемости представляет из себя убывающую ступенчатую линию, значения функции выживаемости между точками наблюдений считаются константными. Метод Каплана-Мейера позволяет выполнять анализ цензурированных данных, т.е. оценивать выживаемость с учетом того, что пациенты могут выбывать в ходе эксперимента или иметь разные сроки наблюдения.
При сравнении нормально распределенных количественных показателей, рассчитанных для двух связанных выборок, использовался парный t-критерий Стьюдента.
При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах, использовался критерий Уилкоксона.
РЕЗУЛЬТАТЫ
Из 117 пациентов, включённых в исследование, 68 (58,12%) были мужского пола. Медиана возраста пациентов в группе наблюдения составила 62 [52;66] года, в группе сравнения 59,5 [56,8;68,2] лет.
Анализ антропометрических данных, функциональный класс (ФК) EHRA, анамнез ФП и данных ЭхоКГ до операции в зависимости от групп показал, что исходные характеристики пациентов в обеих группах были схожи и группы сопоставимы (табл. 3). Стоит отметить, что все пациенты имели ограничение повседневной активности из-за симптомной ФП.
Рецидивом считались документированные эпизоды устойчивых приступов ФП или ТП продолжительностью более 30 секунд. Отсутствие жалоб и документированных эпизодов предсердной аритмии на протяжении до 24 месяцев наблю-
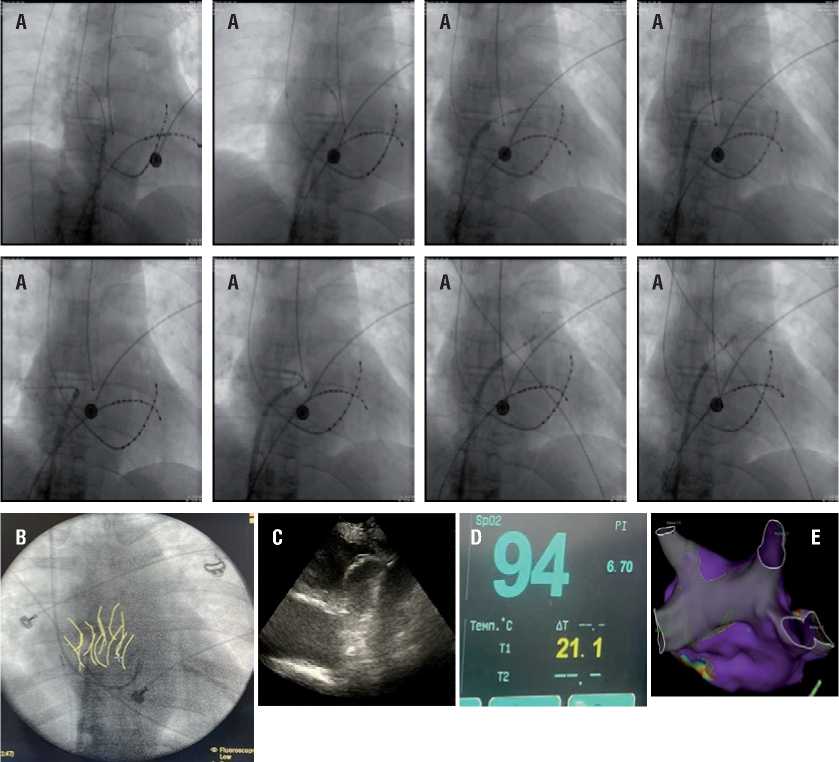
Рисунок 1. Основные этапы проведения и контроля процедуры ИЗСЛП [данные архива кардиохирургического отделения МСЧ ФГАОУ ВО КФУ]. A – Контроль позиционирования криобаллона при изоляции задней стенки левого предсердия (ИЗСЛП). B – обозначение края баллона проведённых аппликаций. C – контроль положения баллона методом внутрисердечной эхокардиографии. D – Контроль температуры в пищеводе в процессе криоаппликации, показания пищеводного температурного датчика. E – картирование левого предсердия после проведённой ИЗСЛП (навигационная система Ensite Precision)
Figure 1. Main stages of the isolation and control procedures of the PWI [from the archive, cardiac surgery department of the Medical and Sanitary Unit of the Institute of Fundamental Medicine and Biology, Kazan Federal University]. A – Control of the cryoballoon direction during the isolation of the posterior wall of the left atrium (PWI). B – designation of the edge of the balloon of the completed applications. C – control positions of the balloon by the method of intracardiac echocardiography. D – control of the temperature in the esophagus during cryoapplication, readings of the esophageal temperature sensor. E – mapping of the left atrium after the performed PWI (Ensite Precision navigation system)
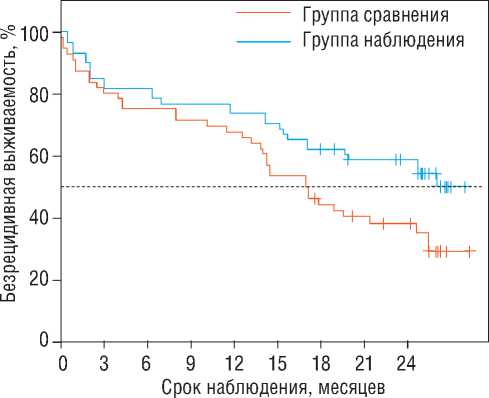
дения интерпретировались как двухгодичная эффективность вмешательства. Анализ свободы от аритмии показал, что медиана в группе сравнения составила 17 месяцев от начала наблюдения (95% ДИ: 14-25 месяцев), медиана в группе наблюдения не была достигнута. В группе сравнения 75 процентиль составил 4 месяцев от начала наблюдения (95% ДИ: 2-14 месяцев), 75 процентиль в группе наблюдения составил 12 месяцев от начала наблюдения (95% ДИ: 2-17 месяцев). Анализ показал, что 25 процентиль в группе сравнения не был достигнут, 25 процентиль в группе наблюдения так же не был достигнут (рис. 2), так же был рассчитан риск рецидива по группам (табл. 4).
Различия безрецидивной выживаемости, оцененные с помощью теста отношения правдоподобия, были статистически значимы (p=0,030).
Построение ROC-кривых с определением факторов, влияющих на рецидив аритмии была статистически значимой при оценке зависимости вероятности наличия рецидива от ИМТ.
Таким образом, при оценке зависимости вероятности наличия рецидива от ИМТ с помощью ROC-анализа была получена следующая кривая (рис. 3).
Площадь под ROC-кривой составила 0,622±0,051 с 95% ДИ: 0,521-0,723. Полученная модель была статистически значимой (p=0,024).
Пороговое значение ИМТ в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 28,075 кг/м 2 . Наличие прогнозировалось при значении ИМТ выше данной величины или равном ей. Чувствительность и специфичность модели составили 69,2% и 59,6%, соответственно (рис. 4).
Интраоперационные осложнения
Количество осложнений достоверно не отличалось в обеих группах.
Парез диафрагмального нерва возник у двух пациентов, по одному случаю в каждой группе. В первом случае он произошёл
Таблица 4. Значения риска рецидива [собственные данные]
Table 4. Recurrence risk values [own data]
|
Срок наблюдения (месяцев) |
Группа сравнения |
Группа наблюдения |
||
|
Риск рецидива (%) |
95% ДИ |
Риск рецидива (%) |
95% ДИ |
|
|
3,0 |
19,6 |
11,4-32,7 |
18,0 |
10,4-30,2 |
|
6,0 |
25,0 |
15,6-38,5 |
18,0 |
10,4-30,2 |
|
12,0 |
32,1 |
21,6-46,1 |
26,2 |
17,0-39,2 |
|
18,0 |
55,5 |
43,1-68,8 |
37,7 |
26,9-51,1 |
|
24,0 |
61,6 |
49,0-74,4 |
41,3 |
30,1-54,7 |
Примечание/Note: ДИ – доверительный интервал (CI – confidence interval)
Группа сравнения
|
Наблюдений |
56 |
45 |
42 |
40 |
38 |
30 |
23 |
18 |
15 |
|
Цензурировано |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
5 |
7 |
|
Событий |
0 |
11 |
14 |
16 |
18 |
26 |
31 |
33 |
34 |
|
Группа наблюдения |
|||||||||
|
Наблюдений |
61 |
50 |
50 |
47 |
45 |
43 |
37 |
32 |
28 |
|
Цензурировано |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
4 |
8 |
|
Событий |
0 |
11 |
11 |
14 |
16 |
18 |
23 |
25 |
25 |
Рисунок 2. Кривая свободы от аритмии в зависимости от групп [собственные данные]
Figure 2. Arrhythmia freedom curve depending on the groups [own data]
12 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 1, 2025
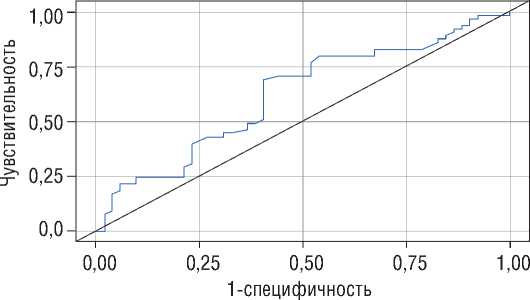
Рисунок 3. ROC-кривая, характеризующая зависимость вероятности наличия рецидива от ИМТ [собственные данные]
Figure 3. ROC curve characterizing the dependence of the probability of relapse on BMI [own data]
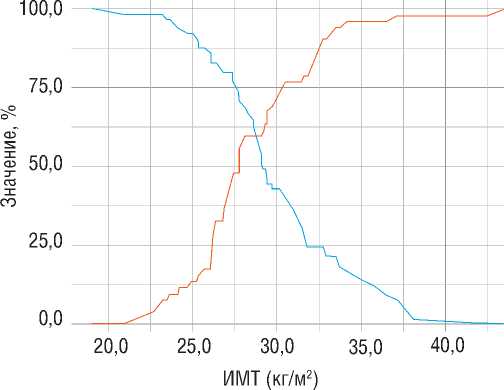
Специфичность
Чувствительность
Рисунок 4. Анализ чувствительности и специфичности модели в зависимости от пороговых значений индекса массы тела (ИМТ) [собственные данные]
-
Figure 4. Sensitivity and specificity analysis of the model depending on the threshold values of body mass index (BMI) [own data]
при работе на правой нижней ЛВ, во втором – на правой верхней ЛВ. Дальнейшее восстановление его функции произошло в первом случае через 4 месяца, во втором – в течение 3 дней.
Сепарация листков перикарда до 6 мм была выявлена у одного пациента в группе наблюдения в раннем послеоперационном периоде по данным контрольного ЭхоКГ. В ходе динамического наблюдения гемодинамика была стабильна. Дренирование полости перикарда не потребовалось. Пациент был выписан на 6-е сутки.
Гематома в области пункции бедренной вены была выявлена у одного пациента. Хирургического вмешательства не потребовалось, разрешилась консервативно.
В ходе данного исследования не было зарегистрировано жизнеугрожающих осложнений, таких как тампонада сердца, инсульт, транзиторная ишемическая атака, инфаркт миокарда.
Анализ рецидивов аритмии по результатам наблюдения
В течении первого года в группе наблюдения с рецидивом столкнулись 16 (26,2%) пациентов, а в группе сравнения – 18 (32,1%) больных. При анализе структуры рецидивов в группе наблюдения было выявлено, что у 12 (75,0%) пациентов регистрировались короткие и редкие пароксизмы ФП; у троих человек (18,8%) – зарегистрирована персистирующая форма ФП; у одного пациента (6,2%) на ЭКГ подтверждено атипичное трепетание предсердий. Трое пациентов с персистирующей формой ФП и один больной с атипичным трепетанием предсердий были подвергнуты повторной аблации. Стоит отметить, что причиной рецидивов, вероятно, являлись прорывы с ЗСЛП, которые были выявлены при вольтаж-ном картировании (рис. 5). При последующем наблюдении зарегистрированных случаев рецидива у этих пациентов не отмечалось.
В группе наблюдения пациентам был имплантирован петлевой регистратор. Длительность наблюдения достигала до 24
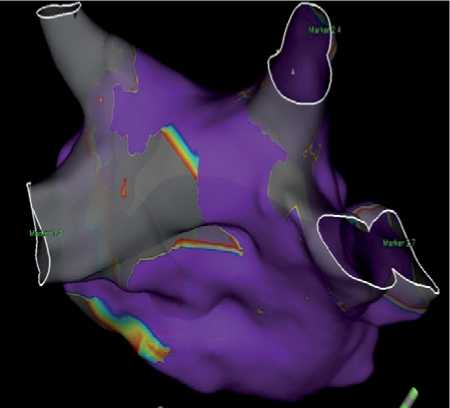
Рисунок 5. Прорыв по задней стенки левого предсердия [собственные данные]
-
Figure 5. Breakthrough along the posterior wall of the left atrium [own data]
Примечание: Вольтажная карта построена катетером HD-grid на системе Ensite Precision. Регистрация потенциалов проводилась от 0,1мВ. Свыше 0,5 мВ считалась потенциалы неизмененных зон предсердия
Note: The voltage map was constructed using the HD-grid catheter on the Ensite Precision system. Potentials were recorded from 0.1 mV. Potentials of unchanged atrial zones were considered to be above 0.5 mV.
месяцев. На момент итогового анализа данных 15 пациентов не преодолели рубеж наблюдений в 24 месяца (8 в группе наблюдения и 7 в группе сравнения). При оценке отчётов о нарушениях ритма, полученных с портала Medtronic Carelink, отмечена значительная эффективность проведённого хирургического лечения. Так, у 75,4% (n=46) пациентов за истекший период наблюдения нарушения ритма регистрировались менее 1% времени, преимущественно это были короткие, бессимптомные пароксизмы длительностью несколько секунд (рис. 6), в эту же группу вошли пациенты, у которых нарушения ритма не регистрировались вовсе. У 8,2% (n=5) пациентов «бремя» аритмии составилось от 1 до 5% – в этот процент попали пациенты с пароксизмами ФП длительностью не более 5 минут, такие пароксизмы также были практически бессимптомные. У 3,3% (n=2) пациентов длительность рецидивирования нарушений ритма составила от 5 до 10%, при прицельной оценке данных с петлевых регистраторов выявлены пароксизмы до 1 часа, однако не все пароксизмы были симптом-ными. Большинство эпизодов не сопровождалось ухудшением качества жизни. Оставшиеся 13,1% (n=8) прооперированных больных вернулись в персистирующую форму или имели длительные, более 24 часов, пароксизмы.
|
Detected Duration |
|
Type Date hh:mm hh:mm:ss Max Median |
|
V. Rate V. Rate |
Additional episodes may be available.
Request a remote interrogation to fill in additional information.
Summary Report 21-Jul-2023 -
|
AF |
30-Apr-2022 |
13:01 |
00:02:00 |
154 bpm |
133 bpm |
|
AF |
26-Feb-2022 |
13:31 |
00:04:00 |
240 bpm |
171 bpm |
|
AF |
15-Jan-2022 |
13:09 |
00:02:00 |
167 bpm |
140 bpm |
|
AF |
19-Dec-2020 |
10:45 |
00:02:00 |
162 bpm |
158 bpm |
Рисунок 6. Пример эпизода отчета петлевого регистратора [данные архива кардиохирургического отделения МСЧ ФГАОУ ВО КФУ]
-
Figure 6. Example of a loop recorder report episode [from the archive, cardiac surgery department of the Medical and Sanitary Unit of the Institute of Fundamental Medicine and Biology, Kazan Federal University]
ОБСУЖДЕНИЕ
Дискутабельным остаётся выбор тактики интервенционного лечения пациентов с персистирующей и длительно персистирующей формами ФП ввиду вариабельного процента эффективности при применении «классической» антральной изоляции устья ЛВ. В проведённом нами исследовании продемонстрировано преимущество расширенной методики изоляции ЛП в сравнении с классической КБА УЛВ. По результатам 12-ти месяцев наблюдения эффективность удержания синусового ритма при отсутствии рецидивов составила 73,8% в группе наблюдения против 67,9% в группе сравнения (p=0,030). Стоит отметить, что в большинстве работ процедура расширенной аблации сопровождалась более высокой эффективностью по сравнению с классической методикой. Одной из первых работ, в которой оценивалась эффективность ИЗСЛП при помощи криобаллона, было исследование A. Arayana и соавт [10]. В данной работе для достижения полной изоляции УЛВ (1,8%) и ЗСЛП в 32,4% случаев потребовалось нанесение дополнительных радиочастотных воздействий. По результатам 12 месяцев наблюдения процент свободы от рецидива ФП был статисти- EURASIAN HEART JOURNAL, 1, 2025 13
чески значимо ниже в группе расширенной КБА по сравнению с изолированной КБА устьев ЛВ (p=0,001). Впоследствии авторами были опубликованы отдаленные результаты эффективности изоляции УЛВ с ИЗСЛП [13]. За период 18±4 месяцев наблюдения среди 519 пациентов лишь 81 (15,6%) потребовалась повторная катетерная аблация ввиду развития симптомной ФП или атипичного трепетания предсердий. Основным предиктором повторной аблации являлся диаметр ЛП более 48 мм.
В исследовании T.Nishimura и соавт. было также получено преимущество эффективности КБА УЛВ в сочетании с ИЗСЛП по сравнению с изолированной изоляцией УЛВ у пациентов с персистирующей формой ФП [14]. Годовая эффективность процедуры расширенной КБА составила 80% против 55,1% в группе КБА УЛВ (p=0,01).
Аналогичные результаты эффективности «расширенной методики» КБА ЛП были получены в работе J. Ahn и соавт., где по результатам 457,9±61,8 дней наблюдения частота рецидивов предсердных аритмий в группе КБА УЛВ с ИЗСЛП была статистически значимо ниже по сравнению с КБА УЛВ (24% против 46%, р=0,035) [15].
Следует отметить, что методика расширенной КБА ЛП является относительно безопасной, и ее применение не повышает риск развития жизнеугрожающих осложнений как по результатам данной работы, так и при анализе данных зарубежной литературы [11, 14, 15]. В редких случаях (до 2%) по аналогии с полученными нами результатами у пациентов развивался парез диафрагмального нерва с последующим его разрешением.
Тем не менее, остаётся открытым вопрос о необходимости достижения полной ИЗСЛП для снижения частоты рецидивов ФП. Так, в ретроспективном исследовании T.Nishimura не было выявлено значительных преимуществ эффективности процедуры при достижении полной ИЗСЛП в сравнении со случаями, где после ИЗСЛП имелись прорывы по ЗСЛП. Авторы связывали это с большей зоной повреждения в антральной области ЛВ и как следствие, снижение критической массы указанной зоны, что способствовало элиминации внелегочного эктопического субстрата [14]. В работе J. Ahn также продемонстрирована значительно более высокая безрецидивная выживаемость у пациентов после КБА УЛВ с ИЗСЛП вне зависимости от достижения полной изоляции ЗС ЛП [15]. В проведенном нами исследовании пациентам проводилось вольтажное картирование после проведения ИЗСЛП и последующее нанесение дополнительных линий воздействия при обнаружении мест прорывов.
ЗАКЛЮЧЕНИЕ
Данное исследование показывает непосредственные и отдалённые результаты криобаллонной изоляции УЛВ с ИЗСЛП у пациентов с персистирующей и длительно персистирующей формами ФП в сравнении с классической изоляцией УЛВ. Стоит отметить, что обе методики показали сопоставимо безопасные результаты. Учитывая анализ рецидивов и дополнительных хирургических вмешательств, стоит рассматривать рутинное применение вольтажного картирования после проведения ИЗСЛП с подтверждением состоятельности всех линий воздействия, а при выявлении мест прорывов – проведение дополнительных воздействий. Выбор энергии для дополнительных воздействий остаётся за оператором. Несмотря на возможную необходимость проведения дополнительного контроля с последующим дополнительным воздействием, изоляция ЗСЛП является более эффективным методом катетерного лечения персистирующей и длительно персистирующей форм ФП в сравнении с классической изоляцией УЛВ. Также стоит рассматривать тот факт, что по данным, полученным с петлевых регистраторов, и по результату сбора анамнеза у пациентов, значимая часть рецидивов не привела к возврату симптомной персистирующей ФП на этапе наблюдения, что также можно оценить как благоприятный исход. Единственным фактором, ассоциированным с неэффективностью криоаблации фибрилляции предсердий в настоящем исследовании, являлись большие значения индекса массы тела. Это подчеркивает необходимость учёта данного параметра при планировании процедуры и оценке прогноза у пациентов с персистирующими формами ФП.


