Применение системы Vivostat® как метода профилактики несостоятельности анастомоза после низкой передней резекции прямой кишки. Клинический случай
Автор: Агапов М. А., Маркарьян Д. Р., Гарманова Т. Н., Казаченко Е. А., Цимайло И. В., Какоткин В. В.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 2 (50), 2022 года.
Бесплатный доступ
Введение: По данным современной литературы несостоятельность анастомоза занимает лидирующие позиции среди всех осложнений колоректальной хирургии. Отдельным направлением профилактики данного осложнения в колоректальной онкологии является изучение возможностей применения биологических клеевых смесей в качестве универсального биологического и механического барьера на пути распространения внутрипросветной микрофлоры и опухолевых клеток.Клинический случай: Пациентка 65 лет госпитализирована с диагнозом рак среднеампулярного отдела прямой кишки сT3сN1сM0 III стадии после проведения неоадъвантного химиолучевого лечения. Проведено хирургическое лечение в объеме лапароскопической низкой передней резекции прямой кишки с расширенной лимфодиссекцией, выведением протективной илеостомы. Анастомоз был сформирован на высоте 4 см от ануса. Интраоперационно выполнено укрепление линии анастомоза с помощью продукта системы VivostatR. Технология изготовления и применения смеси описана в работе. Послеоперационный период протекал без осложнений.Выводы: Вследствие возможных экономических, онкологических и послеоперационных преимуществ применение современных фибриновых клеевых композиций является достаточно перспективным для внедрения в хирургическую практику. Требуется проведение исследований, направленных на изучение эффективности данного способа профилактики несостоятельности колоректальных анастомозов.
Фибриновый клей, несостоятельность анастомоза, послеоперационные осложнения, низкая передняя резекция прямой кишки, рак прямой кишки
Короткий адрес: https://sciup.org/142234870
IDR: 142234870 | УДК: 616.351-089.87 | DOI: 10.38181/2223-2427-2022-2-84-92
Текст научной статьи Применение системы Vivostat® как метода профилактики несостоятельности анастомоза после низкой передней резекции прямой кишки. Клинический случай
Ежегодно в России выявляется около 30 тыс. случаев рака прямой кишки и ректосигмоидного отдела, который занимает 3место у мужчин и 4место у женщин среди всех онкологических заболеваний за 2020 год в нашей стране.[1] По данным современной литературы несостоятельность анастомоза (НА) занимает лидирующие позиции среди всех осложнений колоректальной хирургии, приводя к повторным оперативным вмешательствам в 64% случаев. [2] В ходе многочисленных исследований было выявлено,что несостоятельностью осложняются от 15 до 30% случаев колоректальных резекций. [3], [4] К наиболее значимым факторам риска НА после левосторонних резекций относят мужской пол, низкое расположение опухоли (в средне- и нижнеампулярном отделе прямой кишки) и низкий анастомоз (менее 5 см от ануса), размер опухоли более 5 см, конверсия доступа,выполнение тотальной мезоректумэк-томии, ожирение 3 степени, неоадъювантная химио-лучевая терапия,прием стероидных препаратов и нестероидных противовоспалительных средств, гипоаль-буминемия и гипопротеинемия,высокий предоперационный риск по шкале ASA>3, выполнение экстренных колоректальных резекций, трансфузии компонентов крови до или после операции, длительность вмешательства более 4 часов. [4]–[6] Несостоятельность анастомоза по-прежнему относится к жизнеугрожающим послеоперационным осложнениям, которые отрицательно влияют на выживаемость,онкологиче-ские исходы, качество жизни и экономические затраты. [3]
Часть перечисленных факторов риска является немодифицируемыми, поэтому пациенты данной группы изначально имеют высокий риск несостоятельности колоректального анастомоза и других осложнений.Ин-траоперационные факторы дополнительно могут увеличивать этот риск. Таким образом, разработка и поиск эффективных интраоперационных методов профилактики НА являются крайне необходимыми для снижения показателя послеоперационных осложнений и улучшения онкологических исходов.
На данный момент предлагается ряд пред-, интра- и послеоперационных мероприятий, направленных на снижение риска несостоятельности колоректального анастомоза. К дооперационным способам профилактики относят изменение модифицируемых факторов риска, таких как гипоальбуминемия, анемия, употребление алкоголя и курение, ожирение 3 степени, не- оадъювантная лучевая терапия менее чем за 17 дней до операции. Достаточно перспективным, но малоизученным методом ранней диагностики и профилактики НА является изучение микробиома кишечника до операции и сочетание механической подготовки и медикаментозной санации кишки. [7]
К современным методам интраоперационной оценки рисков НА относится флуоресцентная ангиография. Формирование превентивной стомы достоверно является фактором, снижающим риск несостоятельности, однако снижение качества жизни пациентов и возможные осложнения являются негативными последствиями данного оперативного приема [8]. В настоящее время также не потеряла свою популярность воздушная проба. [9], [10] По результатам мета-анализа Yang Y. [11] трансанальная интубация в целях декомпрессии зоны анастомоза является достаточно эффективной и экономически выгодной профилактикой НА в послеоперационном периоде.
В исследовании McGregor и соавторы [17] в экспериментальных условиях на крысах было показано, что циркулярное нанесение фибринового клея в зону колоректального анастомоза может служить механической защитой от распространения оставшихся в зоне анастомоза опухолевых клеток.
К одному из новейших герметиков на основе фибрина относится высокотехнологичная система Vivostat®, которая позволяет изготавливать аутогенный фибриновый клей и обогащенный тромбоцитами фибрин (PRF®), получаемые полностью из собственной крови пациента. Подробно этот метод рассмотрен в следующей главе.
Система Vivostat®
Согласно данным производителя,с помощью системы Vivo stat® (Датская компания Vivo stat A/S) возможно изготовление фибринового клея и фибрина, обогащенного тромбоцитами, из собственной крови пациентов. Данные продукты нашли широкое применение практически во всех областях хирургии. Так, фибрин, содержащийся в обоих продуктах, может использоваться в качестве герметика, гемостатика и лимфоста-тика, что было показано во многих исследованиях. [18]–[21] Благодаря такому компоненту, как тромбоциты, отмечается улучшение репарации и восстановления поврежденных тканей. Заживление ран и повреждений при использовании обогащенного тромбоцитами фибрина (Vivostat®) стимулируется благодаря нескольким механизмам. В исследовании A. Bayer и соавторов [22] на здоровых добровольцах было выявлено увеличение синтеза 2 пептидов кератиноцитов (человеческий бета-дефенсин-2 и -3 (human beta Defensin-2, ((hBD-2) and human beta-Defensin-3 (hBD-3))), которые участвуют в репарации тканей и имеют антимикробную активность, у 7 из 10 участников. Помимо этого также была выявлена повышенная экспрессия нескольких белков кератиноцитов (кератин-1, кератин-10, трансглутаминаза, инволюкрин), которые участвуют в заживлении эпителиальных тканей. Это происходит благодаря содержанию в тромбоцитах факторов роста, которые участвуют в конечной дифференцировке первичных кератиноцитов, и также факторов роста эндотелия сосудов. [23], [24] В ходе последних исследований было показано,что факторы роста тромбоцитов принимают участие и во внеклеточной организации матрикса при формировании тканей. [25] Помимо этого, в литературе имеются данные об антимикробной активности обоих продуктов в отношении E. coli, P. aeruginosa, E. faecalis and S. aureus. [24], [26] Наличие в смеси тромбоцитов также обеспечивает замедленное высвобождение факторов роста и других активных элементов и защищает от эндогенных протеолитических веществ. [27].
Процесс изготовления аутогенного фибринового клея и обогащенного тромбоцитами фибрина (PRF®) является автоматизированным и требует лишь набрать нужное количество крови пациента (130 мл) в специальную емкость,загрузить в процессорный блок и по окончании обработки крови (30 мин) поместить готовый продукт в блок управления аппликаторами, после чего можно приступать к процедуре нанесения с помощью одного из 4 аппликаторов. [18]
Продукты системы Vivostat® могут быть полимеризированы при высокой,низкой и комнатной температуре и храниться до 8 часов при комнатной температуре без потери механических свойств. [28]
Помимо всех вышеперечисленных свойств производителем также указывается возможность использования продуктов системы Vivostat® совместно с другим веществом, которое может быть внедрено в состав фибриновой матрицы.К таким веществам относятся антибиотики (например, Ванкомицин и Гентамицин), онкологические препараты (например, Цисплатин) или стволовые клетки. [18]
Ниже мы представляем наш первый опыт применения продуктов системы Vivostat® в колоректальной хирургии.
Описание клинического случая
Пациентка А. 65 лет в январе 2022 года поступила в МНОЦ МГУ им. М.В. Ломоносова с диагнозом Рак среднеампулярного отдела прямой кишки сT3N1M0. III стадии, состояние после НАЛТ с 27.09.2021 по 27.10.2021 г. РОД – 2 Гр, СОД – 42 Гр, РИП 75 см, ритм облучения 2 поля в день, 5 фракций в неделю для проведения радикального хирургического лечения.На момент осмотра жалоб у пациентки не было.
Из анамнеза пациентки известно, что в мае 2021 г. впервые отметила появление крови в стуле, после чего обратилась за консультацией к проктологу.
В рамках обследования была проведена колоноскопия от 28.07.2021 г.
Из протокола: в среднеампулярном отделе прямой кишки выявлено изъязвленное образование до 5.5 см в диаметре, контактно кровоточащее.
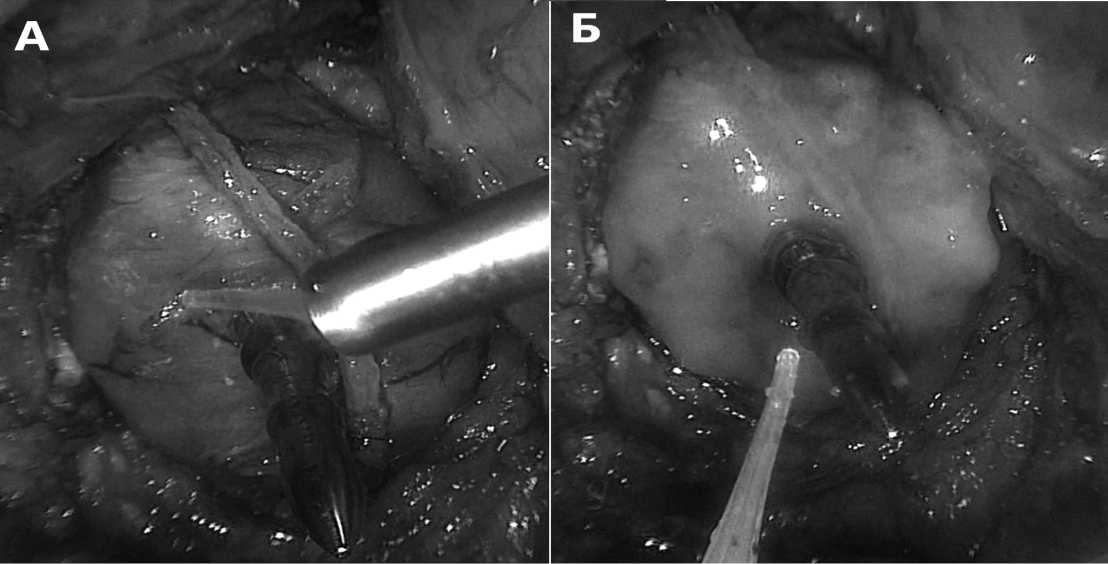
Рис. 1. Первый этап нанесения клея на культю прямой кишки. А – до нанесения. Б – после нанесения клея требуется 1 минута для активации смеси. Описание в тексте
Fig. 1. The first stage of applying glue to the stump of the rectum. A – before application. B – after applying the adhesive, it takes 1 minute to activate the mixture. Description in text
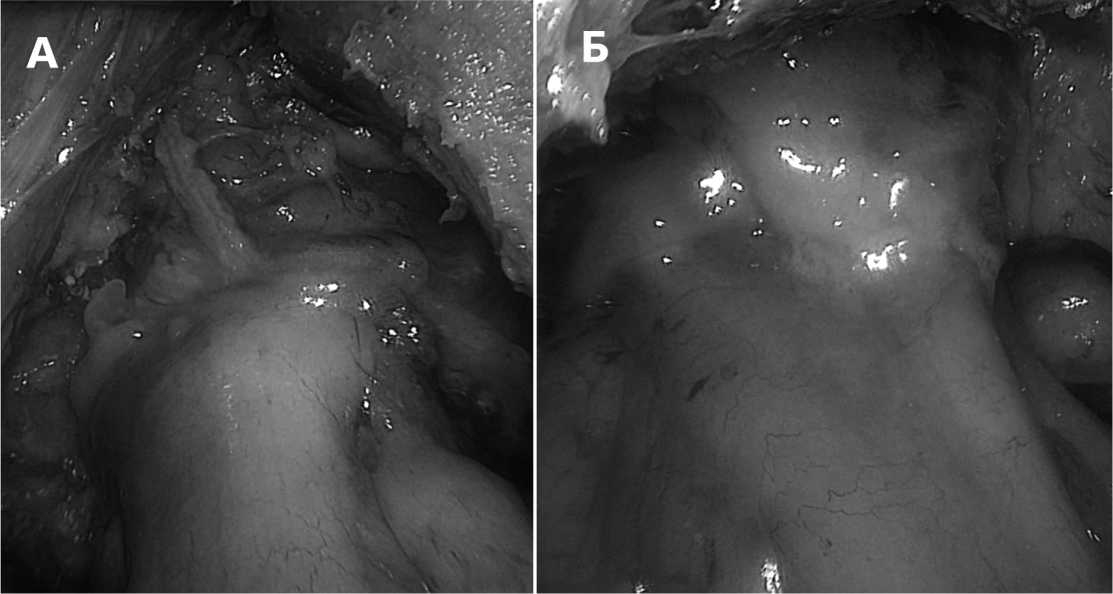
Рис. 2. Второй этап нанесения клея на анастомоз. А – до нанесения. Б – после нанесения клея. Описание в тексте Fig. 2. The second stage of applying glue to the anastomosis. A – before application. B – after applying the glue. Description in text
Выполнена биопсия, согласно данным морфологического исследования – аденокарцинома G2.
По данным МРТ органов малого таза выявлена МР-картина опухоли среднеампулярного отдела прямой кишки с вовлечение мезоректальной фасции и складки брюшины на 13-14 часах, МР-стадия Т3, лимфаденопатия мезоректальных лимфоузлов.
Проведена неоадъювантная лучевая терапия: с 27.09.2021 по 27.10.2021 г. РОД – 2 Гр, СОД – 42 Гр, РИП 75 см, ритм облечения 2 поля в день, 5 фракций в неделю.
По результатам повторной МРТ органов малого таза от 03.12.2021 – образование среднеампулярного отдела прямой кишки на высоте 6.2 см от m. puborectalis: утолщение стенок толщиной до 1.5 см и протяженностью до 3.5 см. без инвазии в мезоректальную фасцию, в соседние структуры; увеличенных лимфоузлов нет.
В ходе дообследования данных за наличие отдаленных метастазов не получено.
Сопутствующих заболеваний у пациентки на догоспитальном этапе не было выявлено.
19.01.2022 в МНОЦ МГУ было проведено хирургическое лечение в объеме лапароскопической низкой передней резекции прямой кишки с расширенной лимфодиссекцией, выведением протективной иле-остомы.Прямая кишка пересечена с помощью линей- ного сшивающего аппарата EndoGia 60 мм на 2 см ниже опухоли. После пересечения сигмовидной кишки сформирован сигморектальный анастомоз с помощью циркулярного сшивающего аппарата 28 мм.
Описание методики применения аутогенного обогащенного тромбоцитами фибрина:
До начала оперативного доступа,но не ранее чем за 8 часов до начала операции, у пациента производится забор 130 мл в специальную емкость, затем производится загрузка контейнера в процессорный блок расположенный вне стерильной зоны операционной. По окончании обработки крови (30 мин) готовый продукт в одноразовой стерильной емкости (6 мл) помещается в блок управления аппликаторами,расположен-ный у операционного стола.
Нанесение клея с помощью специальных аппликаторов производилось в два этапа:
-
• Первый этап – нанесение 2-3 мл клея на культю прямой кишки после введения в ее просвет сшивающего аппарата и выдвижения интегрированного в ствол аппарата троакара (рис.1).После нанесения клея необходима экспозиция последнего в течение 2минут.
-
• Второй этап – нанесение остатков клея на линию циркулярного степлерного шва после завершения цикла прошивания и рассекания тканей и уменьшения давления браншей аппарата (рис. 2). После нанесения
Результаты лабораторных анализов на 1,3 и 5 послеоперационные дни
The results of laboratory tests on 1,3 and 5 postoperative days
Таблица 1.
Table 1
Показатель
1 п/о день (19.01.22)
3 п/о день (21.01.22)
5 п/о день (24.01.22)
Лейкоциты
9.26 10Е9/л
5.07 10Е9/л
4.56 10Е9/л
С-реактивный белок
6.65 мг/л
79.91 мг/л
34.81 мг/л
Гемоглобин
10.20 г/дл
9.50 г/дл
9.70 г/дл
Тромбоциты
192.00 10Е9/л
185.00 10Е9/л
195.00 10Е9/л
Общий белок
62.40 г/л
55.30 г/л
61.40 г/л
Альбумин
40.5 г/л
34.3 г/л
38.6 г/л
26.01.2022 проведена проктография, в ходе которой данных за несостоятельность анастомоза не было полу-чено.Пациентка выписана из отделения на 7-е сутки после операции в удовлетворительном состоянии.
клея на данном этапе до проведения воздушной пробы также требуется экспозиция в течение 2 минут.
Операция и ранний послеоперационный период протекали без осложнений. Пациентке проводилась комплексная консервативная терапия. Антибактериальная терапия не проводилась.Энтеральное питание восстановлено в первые сутки после операции.
На 3день после операции выполнено контрольное УЗИ брюшной полости и малого таза: свободной жидкости в брюшной полости нет. Также на 3-и сутки удален дренаж из брюшной полости.
Результаты лабораторных анализов на 1,3 и 5 день после операции приведены в таблице 1.
Обсуждение
У данной пациентки присутствовали несколько факторов риска НА: снижение общего белка, в том числе и гипоальбуминемия на 1 сутки после операции, расположение опухоли в среднеампулярном отделе прямой кишки, неоадъювантная лучевая терапия, выполнение мезоректумэктомии, формирование низкого анастомоза (менее 5 см от ануса), а также применение НПВС в послеоперационном периоде. [29] Для уменьшения риска несостоятельности была сформирована протек-тивная илеостома и интраоперационно использован аутогенный фибриновый клей системы Vivostat®. При наблюдении за пациенткой через 1 месяц после операции никаких послеоперационных осложнений не отмечалось.
В отношении гастроинтестинальных анастомозов,в литературе имеются данные об успешном и безопасном использовании фибринового клея Vivostat® при формировании анастомозов на пищеводе. [30]
В общей хирургии продукты системы Vivostat® используются достаточно широко. Так, например, было показано, что фибрин, обогащенный тромбоцитами (PRF, Vivostat), способствует заживлению рефрактерных к стандартному лечению и осложненных гетерогенных язв нижних конечностей [22], [31] , при этом в одном исследовании всем пациентам удалось избежать ампутации конечности. [31] Как метод предупреждения образования послеоперационных фистул поджелудочной железы после дистальных резекций фибриновый клей (Vivostat®) не показал свою эффективность однако, было замечено, что в группе исследования ча- стота кровотечений была ниже,но все же не достигла значимой разницы (p = 0.079). [32]
Достаточно перспективным представляется возможность применения продуктов системы Vivostat® при лечении прямокишечных свищей при воспалительных заболеваниях кишечника,при ректовагинальных свищах, а также при рецидивных свищах после хирургического лечения. Однако, на данный момент в литературе имеются результаты комбинированного лечения несколькими методами, включая хирургический, дополнительное использование собственных стволовых клеток и применение других продуктов на основе компонентов крови. [33]–[34]
Вывод
В современной литературе предлагается несколько способов профилактики несостоятельности колоректального анастомоза,одним из которых является интраоперационное укрепление кишечного шва с помощью фибринового клея и фибрина,обогащенного тромбоцитами, из собственной крови пациентов. Данные субстанции обладают множественными положительными фармакологическими эффектами, благодаря чему нашли применение почти во всех отраслях современной хирургии.В виду возможных экономических, онкологических и послеоперационных преимуществ их применение является достаточно перспективным для внедрения в российскую хирургическую практику. Требуется проведение исследований, направленных на изучение эффективности данного способа профилактики несостоятельности колоректальных анастомозов.
Список литературы Применение системы Vivostat® как метода профилактики несостоятельности анастомоза после низкой передней резекции прямой кишки. Клинический случай
- Федеральная служба государственной статистики (Росстат). Здравоохранение в России 2021г. Статистический сборник, 173 с., 2021, [Federalnaya sluzhba gosudarstvennoj statistiki (Rosstat). Zdravoohranenie v Rossii 2021g. Statisticheskij sbornik, 173 p, 2021. (In Russian)] Online. Available: https://rosstat.gov.ru/storage/mediabank/Zdravoohran-2021.pdf.
- P. Fransvea, G. Costa, L. D’Agostino, G. Sganga, and A. Serao, Redo-laparoscopy in the management of complications after laparoscopic colorectal surgery: a systematic review and meta-analysis of surgical outcomes, Techniques in Coloproctology, vol. 25, no. 4. 2021, https://doi.org/10.1007/s10151-020-02374-8
- C. Foppa, S. C. Ng, M. Montorsi, and A. Spinelli. Anastomotic leak in colorectal cancer patients: New insights and perspectives. European Journal of Surgical Oncology, vol. 46, no. 6. 2020, https://doi.org/10.1016/j.ejso.2020.02.027
- R. E. Clifford, H. Fowler, N. Govindarajah, D. Vimalachandran, P.A. Sutton. Early anastomotic complications in colorectal surgery: a systematic review of techniques for endoscopic salvage. Surgical Endoscopy, vol. 33, no. 4. 2019, https://doi.org/10.1007/s00464-019-06670-9
- Sciuto A, Merola G, De Palma GD, Sodo M, Pirozzi F, Bracale UM, Bracale U. Predictive factors for anastomotic leakage after laparoscopic colorectal surgery. World J Gastroenterol. 2018 Jun 7;24(21):2247-2260. doi:10.3748/wjg.v24.i21.2247
- Vasiliu EC, Zarnescu NO, Costea R, Neagu S. Review of Risk Factors for Anastomotic Leakage in Colorectal Surgery. Chirurgia (Bucur). 2015 Jul-Aug;110(4):319-26.
- Meyer J, Naiken S, Christou N, Liot E, Toso C, Buchs NC, Ris F. Reducing anastomotic leak in colorectal surgery: The old dogmas and the new challenges. World J Gastroenterol. 2019 Sep 14;25(34):5017-5025. doi:10.3748/wjg.v25.i34.5017
- Галлямов Э.А., Агапов М.А., Луцевич О.Э., Кубышкин В.А., Какоткин В.В. Попытка оптимизации сроков реконструкции гастроинтестинального тракта на примере раннего закрытия илеостом у больных раком прямой кишки. рандомизированное мультицентровое исследование. Хирургическая практика. 2019;(3):24-31. https://doi.org/10.38181/issn2223-2427.2019.3.24-31 [Galliamov E.A., Agapov M.A., Lucevich O.E., Kubyshkin V.A., Kakotkin V.V. Trying to optimize the timing of reconstruction of gastrointestinal tract, on the example of early closure of the ileostomy in patients with rectal cancer. randomized multicenter study. Surgical practice. 2019;(3):24-31. (In Russ.)] https://doi.org/10.38181/issn2223-2427.2019.3.24-31
- Allaix ME, Lena A, Degiuli M, Arezzo A, Passera R, Mistrangelo M, Morino M. Intraoperative air leak test reduces the rate of postoperative anastomotic leak: analysis of 777 laparoscopic left-sided colon resections. Surg Endosc. 2019 May;33(5):1592-1599. https://doi.org/10.1007/s00464-018-6421-8
- Wu Z, van de Haar RC, Sparreboom CL, Boersema GS, Li Z, Ji J, Jeekel J, Lange JF. Is the intraoperative air leak test effective in the prevention of colorectal anastomotic leakage? A systematic review and meta-analysis. Int J Colorectal Dis. 2016 Aug;31(8):1409-17. https://doi.org/10.1007/s00384-016-2616-4
- Y. Yang, Y. Shu, F. Su, L. Xia, B. Duan, and X. Wu. Prophylactic transanal decompression tube versus non-prophylactic transanal decompression tube for anastomotic leakage prevention in low anterior resection for rectal cancer: a metaanalysis. Surg. Endosc., vol. 31, no. 4, 2017, https://doi.org/10.1007/s00464-016-5193-2
- H. J. Kim, J. W. Huh, H. R. Kim, and Y. J. Kim. Oncologic impact of anastomotic leakage in rectal cancer surgery according to the use of fibrin glue: Case-control study using propensity score matching method. Am. J. Surg., vol. 207, no. 6, 2014, https://doi.org/10.1016/j.amjsurg.2013.07.047
- J. Lago Oliver. The systematic use of fibrin-based biological adhesive to prevent leakage due to healing defects in rectal anastomosis significantly reduces сosts. J. Surg., vol. 3, no. 2, 2015, https://doi.org/10.11648/j.js.20150302.12
- S. Panda, M. P. Connolly, M. G. Ramirez, and J. B. de Heredia. Costs analysis of fibrin sealant for prevention of anastomotic leakage in lower colorectal surgery. Risk Manag. Healthc. Policy, vol. 13, 2020. doi:10.2147/RMHP.S221008
- Vakalopoulos KA, Daams F, Wu Z, Timmermans L, Jeekel JJ, Kleinrensink GJ, van der Ham A, Lange JF. Tissue adhesives in gastrointestinal anastomosis: a systematic review. J Surg Res. 2013 Apr;180(2):290-300. https://doi.org/10.1016/j.jss.2012.12.043
- Plat VD, Bootsma BT, van der Wielen N, Straatman J, Schoonmade LJ, van der Peet DL, Daams F. The role of tissue adhesives in esophageal surgery, a systematic review of literature. Int J Surg. 2017 Apr;40:163-168. https://doi.org/10.1016/j.ijsu.2017.02.093
- J. R. McGregor, D. H. Reinbach, S. W. Dahill, and P. J. O’Dwyer. Effect of fibrin sealant on perianastomotic tumor growth in an experimental model of colorectal cancer surgery. Dis. Colon Rectum, vol. 36, no. 9, 1993, https://doi.org/10.1007/BF02047379
- Schips L, Dalpiaz O, Cestari A, Lipsky K, Gidaro S, Zigeuner R, Petritsch P. Autologous fibrin glue using the Vivostat system for hemostasis in laparoscopic partial nephrectomy. Eur Urol. 2006 Oct;50(4):801-5. https://doi.org/10.1016/j.eururo.2006.03.010
- A. Garayev, Ö. Aytaç, and F. Atuğ. Effect of autologous fibrin glue (VivostatTM) on lymphatic drainage and lymphocele formation in extended pelvic lymph node dissection in robot assisted radical prostatectomy, Eur. Urol. Suppl., vol. 18, no. 1, 2019, https://doi.org/10.1016/s1569-9056(19)31318-1
- Graziano F, Certo F, Basile L, Maugeri R, Grasso G, Meccio F, Ganau M, Iacopino DG. Autologous fibrin sealant (Vivostat(®)) in the neurosurgical practice: Part I: Intracranial surgical procedure. Surg Neurol Int. 2015 May 12;6:77. https://doi.org/10.4103/2152-7806.156871
- F. Graziano, R. Maugeri, L. Basile, F. Meccio, and D. G. Iacopino, Aulogous fibrin sealant (Vivostat®) in the neurosurgical practice: Part II: Vertebro-spinal procedures, Surg. Neurol. Int., vol. 7, 2016, https://doi.org/10.4103/2152-7806.174894
- Bayer A, Höntsch G, Kaschwich M, Dell A, Siggelkow M, Berndt R, Rusch R, Harder J, Gläser R, Cremer J. Vivostat Platelet-Rich Fibrin® for Complicated or Chronic Wounds-A Pilot Study. Biomedicines. 2020 Aug 6;8(8):276. https://doi.org/10.3390/biomedicines8080276
- Bayer A, Tohidnezhad M, Lammel J, Lippross S, Behrendt P, Klüter T, Pufe T, Jahr H, Cremer J, Rademacher F, Gläser R, Harder J. Platelet-Released Growth Factors Induce Differentiation of Primary Keratinocytes. Mediators Inflamm. 2017;2017:5671615. https://doi.org/10.1155/2017/5671615
- C. Cipriani. Levels and kinetic of the growth factor release and antibacterial activity in allogenic platelet gel for treatment of GVHD ulcers: A study from the Rome transplant network. Bone Marrow Transplant., vol. 50, no. SUPPL. 1, 2015.
- Bayer A, Wijaya B, Möbus L, Rademacher F, Rodewald M, Tohidnezhad M, Pufe T, Drücke D, Gläser R, Harder J. Platelet-Released Growth Factors and Platelet-Rich Fibrin Induce Expression of Factors Involved in Extracellular Matrix Organization in Human Keratinocytes. Int J Mol Sci. 2020 Jun 20;21(12):4404. https://doi.org/10.3390/ijms21124404
- C. Cipriani, Vivostat® System: clinical efficacy and antimicrobial activity, Transfus. Apher. Sci., vol. 50, 2014, https://doi.org/10.1016/s1473-0502(14)50044-4
- R. Lundquist, M. H. Dziegiel, and M. S. Ågren, Bioactivity and stability of endogenous fibrogenic factors in platelet-rich fibrin. Wound Repair Regen., vol. 16, no. 3, 2008, doi:10.1111/j.1524-475X.2007.00344.x
- J. L. Velada and D. A. Hollingsbee. Physical Characteristics of Vivostat® Patient-Derived Sealant. Eur. Surg. Res.,vol. 33, no. 5–6, 2001, https://doi.org/10.1159/000049737
- M. Klein, “Postoperative non-steroidal anti-inflammatory drugs and colorectal anastomotic leakage: NSAIDs and anastomotic leakage,” Dan. Med. J., vol. 59, no. 3, 2012.
- V. D. Plat, B. T. Bootsma, N. van der Wielen, D. L. van der Peet, and F. Daams, “Autologous activated fibrin sealant for the esophageal anastomosis: a feasibility study,” J. Surg. Res., vol. 234, 2019, https://doi.org/10.1016/j.jss.2018.08.049
- L. G.C. and H. I., “Ducest-therapy, an innovative treatment for therapy of refractory chronic lower leg ulcers,” Transfusion Medicine and Hemotherapy, vol. 42. 2015.
- K. Udo, W. Claudio, Q. Rodrigo, L. Francisco, J. Claudio, and Z. Alejandro, “P-115 Local Experience for Treatment of IBD-Related Recurrent Anal Fistulae Based on Autologous Stem-Cells and Platelet Rich Plasma,” Inflamm. Bowel Dis., vol. 20, 2014, https://doi.org/10.1097/01.mib.0000456844.47907.0a
- R. Tutino, Autologous adipose-derived stem cells and platelets concentrates for the treatment of complex perianal fistulas, Tech. Coloproctol., vol. 24, 2020.
- A. Moreno-Serrano, J. J. García-Díaz, M. Ferrer-Márquez, R. Alarcón-Rodríguez, A. Álvarez-García, and Á. Reina-Duarte, Using autologous platelet-rich plasma for the treatment of complex fistulas, Rev. Esp. Enferm. Dig., vol. 108, no. 3, 2016, https://doi.org/10.17235/reed.2016.3946/2015


