Применение СО2 для создания оптического окна при проведении внутрисосудистой оптической когерентной томографии у пациента с аллергической реакцией на йодсодержащий контраст
Автор: Тарасов М.Г., Пекарский С.Е., Баев А.Е., Гергерт Е.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.37, 2022 года.
Бесплатный доступ
Необходимым условием получения качественного изображения при оптической когерентной томографии (ОКТ) является вытеснение крови из визуализируемого сегмента сосуда для обеспечения прозрачной среды между сосудистой стенкой и фотодетектором. Традиционно для этого используется жидкий йодсодержащий контраст, что может быть опасно у пациентов с аллергией на йод или с почечной недостаточностью. Мы представляем клинический случай успешного проведения ОКТ с использованием CO2 у пациента с анафилактической реакцией на йодсодержащий контраст. ОКТ проводили для контроля безопасности радиочастотной (РЧ) денервации почек. СО2 вводили стандартным способом в проводниковый катетер, расположенный в почечной артерии. С помощью СО2 удалось эффективно вытеснить кровь из почечной артерии и получить качественные ОКТ изображения микроструктуры сосудистой стенки.
Оптическая когерентная томография, ангиография, карбоксиангиография, ренальная денервация, клинический случай
Короткий адрес: https://sciup.org/149140243
IDR: 149140243 | УДК: 616.133.32-073.53-073.756.8:616-056.43:546.15 | DOI: 10.29001/2073-8552-2022-37-2-129-133
Текст научной статьи Применение СО2 для создания оптического окна при проведении внутрисосудистой оптической когерентной томографии у пациента с аллергической реакцией на йодсодержащий контраст
УДК 616.133.32-073.53-073.756.8:616-056.43:546.15
Оптическая когерентная томография (ОКТ) – революционная технология визуализации в современной рент-генэндоваскулярной хирургии. Обладая высоким разрешением, ОКТ позволяет видеть структуру стенки сосуда практически на клеточном уровне. Для получения изображения оптическое устройство, располагающееся на конце специального катетера, излучает свет и регистрирует его отражение от окружающих структур. Для проведения исследования необходимо наличие прозрачной среды между оптическим устройством и визуализируемыми объектами. То есть получение изображения стенки сосуда требует полного вытеснения крови из просвета, поскольку любое количество остаточных эритроцитов вызывает ослабление сигнала. Обычно это достигается с помощью инъекции йодсодержащего контрастного вещества. При получении необходимой прозрачности система выполняет автоматическую протяжку датчика внутри оболочки катетера ОКТ и визуализирует участок артерии длиной от 4 до 6 см менее чем за 3 с. Для получения изображения используется ближний инфракрасный спектр с длиной волны в диапазоне 1250–1350 нм. Это позволяет получить изображение стенки сосуда на глубину от 1 до 3 мм, с аксиальным разрешением 12–20 мкм и латеральным 20–90 мкм [1, 2].
Высокое разрешение изображения ОКТ обеспечивает возможность интраоперационного контроля эффективности и безопасности эндоваскулярных манипуляций и воздействий. Сегодня для лечения лекарственно-резистентной артериальной гипертонии (АГ) применяют радиочастотную (РЧ) ренальную денервацию (РДН) [3]. По данным гистологических исследований, РЧ РДН вызывает локальные повреждения в точках контакта электродов со стенкой артерии, а в наблюдениях in vivo обнаружено, что эта процедура может вызвать диссекцию, деформацию сосудистой стенки или образование пристеночных тромбов, т. е. потенциально опасные изменения, которые могут привести к нарушению кровотока [4].
У пациентов с хронической почечной недостаточностью или аллергией на йод использование йодсодержащих контрастных веществ небезопасно. Альтернативой может быть применение углекислого газа (CO2) в качестве контрастного агента. Использование для этих целей диоксида углерода восходит к 1920-м гг., когда газ использовали для визуализации забрюшинных структур. Однако из-за потенциальной нейротоксичности и аритмогенности CO2 не следует использовать для контрастирования грудной аорты, коронарных артерии и сосудов головного мозга. В отличие от жидкого контрастного вещества, которое в просвете сосуда смешивается с кровью, CO2 вытесняет кровь. А благодаря высокой растворимости, углекислый газ за короткое время полностью растворяется и высвобождается капиллярами легких. Несмотря на разницу в физических свойствах, артериограммы, полученные с помощью газообразного CO2 и жидкого контрастного вещества, вполне сопоставимы [5].
Клинический случай
Пациентка Н., 73 года, поступила в плановом порядке в кардиологическое отделение № 3 НИИ кардиологии Томского НИМЦ с жалобами на ухудшение состояния в течение нескольких недель, неэффективный контроль артериального давления (АД) на фоне комбинированной антигипертензивной терапии, эпизоды дискомфорта за грудиной.
Анамнез. Гипертоническая болезнь более 10 лет с максимальным АД 240/110 мм рт. ст. Около года назад была экстренная госпитализация с диагнозом острого инфаркта миокарда (ОИМ). Выполнили стентирование передней нисходящей артерии (ПНА) (инфаркт-связанная коронарная артерия), после выписки принимала назначенные препараты. Через 3 мес. при плановой госпитализации, по данным коронарной ангиографии, стент проходим, выполнили стентирование ветви тупого края (ВТК). Процедура осложнилась анафилактоидной реакцией II степени на йодсодержащее контрастное вещество.
При поступлении состояние удовлетворительное, АД 180/85 мм рт. ст. на фоне комбинированной антигипертензивной терапии: азилсартан 40 мг + гидрохлортиазид 25 мг + карведилол 25 мг + лерканидипин 20 мг.
Нагрузочная сцинтиграфия миокарда: достоверных данных о нарушении перфузии миокарда левого желудочка (ЛЖ) не выявлено. Эхокардиография: толщина стенок и масса миокарда ЛЖ на верхней границе нормы. Общая сократимость ЛЖ в норме, фракция выброса ЛЖ – 65%. Ультразвуковое исследование почек: паренхима нормальной толщины, дифференцируется от синусов, однородная. С обеих сторон небольшое расширение отдельных групп чашечек, конкрементов нет. Допплерография почечных артерий: кровоток симметричный, признаков стенозирования и аномалий развития не выявлено.
Биохимический анализ крови: глюкоза 7,40 ммоль/л (N = 3,80–6,10); мочевина 7,80 ммоль/л (N = 2,20–7,20); креатинин 119,00 мкмоль/л (N = 44,00–80,00).
Учитывая резистентность и отсутствие данных за симптоматический характер АГ, принято решение о выполнении РЧ РДН. Принимая во внимание указание на анафилактоидную реакцию в анамнезе, в качестве контрастного вещества решено использовать СО2. Кроме того, принято решение выполнить интраоперационную оценку безопасности РЧ воздействия и выявить возможные повреждения сосудистой стенки с помощью внутрисосудистой ОКТ. При этом для создания бескровного поля также было решено вместо йодсодержащего контраста использовать СО2, а внутреннее пространство катетера ОКТ между оптоволокном и оболочкой заполнить вместо обычно используемого контрастного вещества раствором NaCl 0,9% (который во время автоматической протяжки оператор непрерывно подавал шприцем для исключения попадания крови во внутреннее пространство катетера).
Процедура РДН и ОКТ исследование
Перед процедурой РДН внутривенно ввели нефрак-ционированный гепарин в дозе, необходимой для дости- жения активированного времени свертывания крови более 300 с. Радиальным доступом через направляющий катетер 6F, по проводнику 0,014”, катетер ОКТ Dragonfly OPTIS Kit (Abbot Medical, США) провели в зону запланированного РЧ воздействия. С помощью автоматического инъектора СО2 ANGIODROID (Angiodroid, Италия), подключенного к направляющему катетеру, выполнили инъекцию углекислого газа. При получении бескровного поля аппарат Ilumien (St. Jude Medical, США) произвел автоматическую тракцию катетера ОКТ с записью поперечных срезов почечной артерии с интервалом 0,2 мм. Следующим этапом провели саму процедуру РЧ РДН с использованием генератора Symplicity G3 и многоэлектродного катетера Symplicity Spyral (Medtronic, США) по стандартной методике, под контролем карбоксиангиографии. После этого процедуру ОКТ повторили. Основываясь на ранее опубликованных в литературе данных, мы предполагали обнаружить следующие изменения стенки артерии: отек, коагуляцию, диссекцию, спазм, тромб [4]. При сравнительной оценке поперечных срезов мы не нашли вышеуказанных изменений, однако выявили небольшие повреждения эндотелия в проекции РЧ воздействия, не видимые при ангиографии (рис. 1).
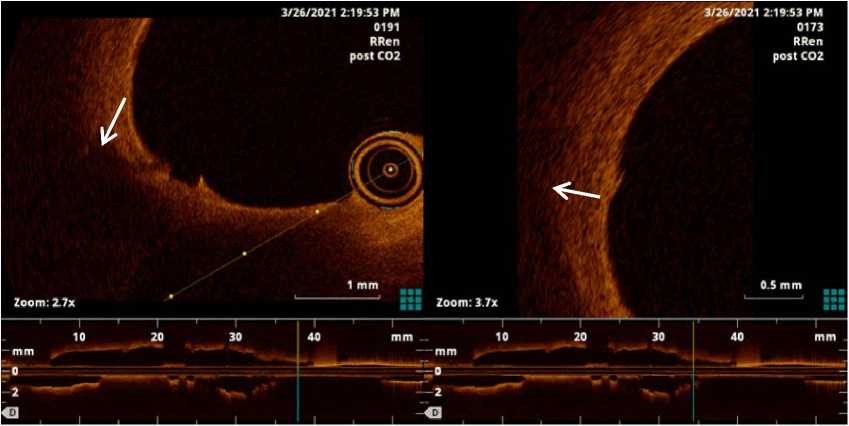
Рис. 1. Участки повреждения эндотелия (обозначены стрелкой) после РЧ РДН на поперечных ОКТ срезах правой почечной артерии, полученных с помощью инъекции углекислого газа
Fig. 1. Areas of endothelial damage (indicated by an arrow) after radiofrequency renal denervation on the cross sectional optical coherence tomography images of the right renal artery obtained with injection of carbon dioxide
Повреждения носили локальный характер, занимали < 10 ° окружности просвета сосуда и прослеживались на протяжении не более двух последовательных кадров. Осложнений в послеоперационном периоде выявлено не было.
Обсуждение
По нашим данным, это первое применение СО2 для выполнения ОКТ. Нам удалось обеспечить эффективное вытеснение крови с получением качественных ОКТ изображений. Однако на некоторых поперечных срезах часть изображения просвета артерии осталась скрытой из-за остаточного объема крови между катетером ОКТ и стенкой сосуда (рис. 2).
Для преодоления этой проблемы мы предлагаем выполнять нескольких протяжек ОКТ с изменением положения катетера в просвете артерии, при этом дополнительное введение инертного СО2 не увеличивает риск вмешательства. Кроме того, на части изображений сохранялся пристеночный слой крови, который однако существенно не влиял на качество изображения, позволяя детально оценить структуру стенки артерии.
При этом следует отметить, что наличие пристеночного слоя крови может привести к занижению истинного диаметра просвета сосуда, измеренного по рентгенографическим изображениям.
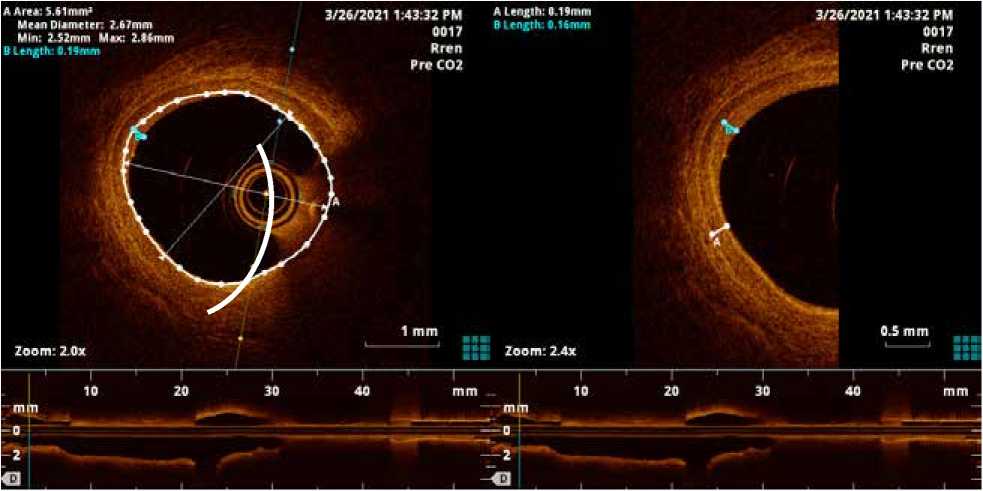
Рис. 2. Поперечный ОКТ срез правой почечной артерии, выполненный на фоне инъекции СО2. Видно остаточный объем крови между катетером
ОКТ и стенкой сосуда (обозначен дугой), измерены толщина комплекса интима-медиа (А) и остаточный пристеночный слой крови (В)
Fig. 2. Cross sectional optical coherence tomography image of the right renal artery performed with CO2 injection. The residual volume of blood between the optical coherence tomography catheter and the vessel wall is visible (indicated by an arc); the thickness of the intima-media complex (A) and the residual wall layer of blood (B) are measured
Заключение
Таким образом, у пациентов с аллергической реакцией на йодсодержащие рентгеноконтрастные препараты внутрисосудистое ОКТ исследование можно выполнить с использованием углекислого газа в качестве агента для создания бескровного поля. При этом качество изображе- ния позволяет провести необходимые измерения и оценить строение стенки сосуда, выявить наличие локальных повреждений, вызванных РЧ воздействием. Данную методику можно рекомендовать и пациентам с нарушением функции почек для предотвращения контраст-индуци-рованной нефропатии.
Список литературы Применение СО2 для создания оптического окна при проведении внутрисосудистой оптической когерентной томографии у пациента с аллергической реакцией на йодсодержащий контраст
- Lowe H.C., Narula J., Fujimoto J.G., Jang I.K. Intracoronary optical diagnostics current status, limitations, and potential. JACC Cardiovasc. Interv. 2011;4(12):1257-1270.
- DOI: 10.1016/j.jcin.2011.08.015
- Gutierrez-Chico J.L., Alegria-Barrero E., Teijeiro-Mestre R., Chan P.H., Tsujioka H., de Silva R. et al. Optical coherence tomography: From research to practice. Eur. Heart J. Cardiovasc. Imaging. 2012;13(5):370-384.
- DOI: 10.1093/ehjci/jes025
- Kandzari D.E., Bohm M., Mahfoud F., Townsend R.R., Weber M.A., Pocock S. et al. Effect of renal denervation on blood pressure in the presence of antihypertensive drugs: 6-month efficacy and safety results from the SPYRAL HTN-ON MED proof-of-concept randomised trial. Lancet. 2018;391(10137):2346-2355.
- DOI: 10.1016/S0140-6736(18)30951-6 EDN: VHCIEM
- Roleder T., Skowerski M., Wiecek A., Adamczak M., Czerwienska B., Wanha W. et al. Long-term follow-up of renal arteries after radio-frequency catheter-based denervation using optical coherence tomography and angiography. Int. J. Cardiovasc. Imaging. 2016;32(6):855-862.
- DOI: 10.1007/s10554-016-0853-9
- Cho K.J. Carbon dioxide angiography: Scientific principles and practice. Vasc. Specialist Int. 2015;31(3):67-80.
- DOI: 10.5758/vsi.2015.31.3.67


