Применение стереотаксической лучевой терапии в лечении неоперабельных пациентов с локализованным раком почки
Автор: Сабельникова Ж.Е., Сарычева М.М., Мозерова Е.Я., Важенин А.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Цель исследования - оценить результаты применения стереотаксической лучевой терапии (СТЛТ) в лечении неоперабельных пациентов с локализованным раком почки с учетом показателей общей выживаемости и локального контроля. материал и методы. С 2011 по 2021 г. на базе Челябинского областного клинического центра онкологии и ядерной медицины (ЧОКЦО и ЯМ) 42 пациентам с морфологически верифицированным диагнозом рака почки проводилась СТЛТ до СОД от 30 до 45 Гр за 3 фракции на аппарате CyberKnife. СТЛТ проводилась в случае неоперабельности пациента с учетом различных факторов (возраст, тяжесть сопутствующей патологии, степень анестезиологического риска ASA IV), отказа пациентов от хирургического лечения, в случае размеров опухоли до 5,0 см в диаметре. Не проводилась СТЛТ при размерах опухоли более 5,0 см в диаметре, при значимом нарушении функции почек (хроническая болезнь почек С5), генерализации процесса, при декомпенсации сопутствующей патологии. Средний возраст больных составил 67,9 года. У 93 % пациентов была I стадия рака почки. Первичная опухоль была диагностирована в 37 случаях, в 6 - рецидив после предшествующего оперативного лечения, в том числе у 1 пациента - рецидив рака обеих почек. Средний объем опухоли составил 28,1 см3. Результаты. Медиана общей выживаемости (ОВ) не была достигнута в связи с тем, что большинство пациентов (n=36) на момент анализа результатов исследования были живы. Показатели 1-, 3- и 5-летней ОВ составили 94,1; 88,7 и 72,6 % соответственно. Зафиксирован уровень 1-летнего локального контроля в 93 %. Частичный ответ по критериям RECIST 1.1 спустя 3-6 мес после СТЛТ отмечен в 26,2 % случаев, в 66,8 % - стабилизация процесса, в 7 % (n=3) - прогрессирование процесса. Ренальная токсичность возникла у 23,8 % пациентов спустя 3 мес после проведенной лучевой терапии, но в течение года функция почек у этих пациентов была восстановлена. заключение. СТЛТ рака почки демонстрирует высокую эффективность при минимальной токсичности, что позволяет применять данный метод в лечении рака почки у неоперабельных пациентов.
Стереотаксическая лучевая терапия, рак почки, рецидив рака почки
Короткий адрес: https://sciup.org/140300157
IDR: 140300157 | УДК: 616.61-006.6-085.849.1 | DOI: 10.21294/1814-4861-2023-22-2-120-128
Текст научной статьи Применение стереотаксической лучевой терапии в лечении неоперабельных пациентов с локализованным раком почки
В настоящее время стандартом лечения почечноклеточного рака (ПКР) является операция в объеме нефрэктомии или резекции почки [1]. Однако в силу различных причин, в том числе из-за выраженности сопутствующей патологии, проведение хирургического лечения не всегда возможно. В связи с этим существует необходимость в поиске альтернативных методов лечения неоперабельных пациентов или отказавшихся от операции. Согласно литературным данным, на данный момент существуют следующие виды лечения неоперабельных пациентов с опухолью почки: криотерапия, радиочастотная или микроволновая абляция, активное наблюдение, а также все чаще применяемая в последнее время стереотаксическая лучевая терапия (СТЛТ) [2]. Традиционно рак почки считается устойчивым к лучевой терапии и химиотерапии. Однако разработка таргетных препаратов, таких как сунитиниб, темсиролимус, бевацизумаб, интерферон-альфа, сорафениб, улучшила результаты [2]. Способность доставлять высокие дозы с помощью СТЛТ позволила преодолеть радиорезистентность опухоли почки и сделать этот вид лечения оптимальной альтернативой хирургическому лечению у неоперабельных или отказавшихся от операции пациентов [3, 4].
Разумеется, хирургическое лечение обеспечивает высокие показатели общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП). Однако для неоперабельных пациентов и пациентов, отказавшихся от оперативного вмешательства, СТЛТ может быть многообещающим вариантом неинвазивного лечения ПКР. Так, в 2020 г. были опубликованы результаты крупного ретроспективного исследования, включавшего больше 200 тысяч пациентов, сравнивающего результаты хирургического лечения, криоабляции, СТЛТ и режима наблюдения. В общей сложности 165 298 больных перенесли хирургическое вмешательство, 17 196 – подверглись абляции опухоли, 104 пациента перенесли СТЛТ и 18 241 пациент наблюдался. Медиана наблюдения составила 51 мес. При многофакторном анализе отмечено, что операция, абляция опухоли и СТЛТ были связаны со снижением риска смерти по сравнению с контрольной группой. Когорта пациентов, получивших СТЛТ, продемонстрировала более высокие показатели ОВ по сравнению с пациентами, находившимися под наблюдением [5].
Все чаще в последнее время мы видим исследования, посвященные лечению больных опухолью почки с помощью СТЛТ. W. Haque et al. показали, что использование СТЛТ для данной патологии увеличилось с 2004 по 2013 г. с 25 до 95,4 % [6]. Применение СТЛТ в лечении рака почки сопряжено с высоким уровнем локального контроля, а также высокими показателями ОВ и ВБП. S. Siva et al. отмечен 5-летний локальный контроль от 87 до 100 %, 1-летняя общая выживаемость – 100 %, 2-летняя – 92 % [7]. В проспективном исследовании, проведенном М. Staehler et al. в 2015 г., 40 пациентов с нерезектабельной опухолью почки, размером менее 4 см получали лечение на CyberKnife с однократной дозой 25 Гр при 70 % изодозе. Стабилизация процесса получена в 86,7 % случаев [8]. В 2018 г. S. Siva et al. опубликовали результаты многоцентрового исследования по лечению 223 пациентов, из которых 118 получали радиохирургическое лечение с разовой очаговой дозой в 25 Гр и 105 пациентов – 40 Гр за 2–10 фракций. Показатели 4-летнего локального контроля, 4-летней онкоспецифической выживаемости и общей выживаемости составили 97,8; 91,9 и 70,7 % соответственно [9]. В 2019 г. R.J.M. Correa et al. проанализировали результаты лечения 81 пациента с опухолью в единственной почке и представили показатели локального контроля, ВБП, онкоспецифической выживаемости и ОВ через 2 года, равные 98; 77,5; 98,2 и 81,5 % соответственно [10].
В прогностическом плане важным является размер опухоли почки. В 2019 г. R.E. Wegner et al. опубликовали данные Национальной базы данных по раку с 2004 по 2016 г., которые включали 347 пациентов с опухолью почки, получавших лечение в дозе 34–54 Гр за 1–5 фракций. Средний размер опухоли составил 3,8 см. Предикторами снижения выживаемости стали возраст >74 лет, опухоль больше 4 см в диаметре, стадия N1 или M1 [11]. В продолжение этого в 2020 г. S. Siva et al. провели многоцентровое исследование по изучению роли СТЛТ при опухоли почки размером более 4 см (>T1b), включавшее 95 пациентов со средним диаметром опухоли – 4,9 см. Онкоспецифическая выживаемость, ОВ и ВБП составили 96,1; 83,7 и 81 % через 2 года и 91,4; 69,2 и 64,9 % через 4 года соответственно. Многомерный анализ показал, что увеличение размера опухоли связано с уменьшением онкоспецифической выживаемости [12].
Не менее важным является вопрос выбора режима СТЛТ: радиохирургия или гипофракционирование. По результатам крупных метаанализов, включавших почти 400 пациентов, были продемонстрированы высокие показатели ОВ, локального контроля, ВБП в обеих группах. Следует отметить, что у пациентов, которые получили СТЛТ в режиме радиохирургии, реже наблюдалось прогрессирование, и они имели более высокие показатели ОВ [4, 10]. Но, вероятнее всего, это связано с более молодым возрастом пациентов и небольшим размером опухоли.
На данный момент оптимальные доза и фракционирование не определены. В исследованиях использовались дозы от 25–26 Гр за одну фракцию до 21–48 Гр за 3–5 фракций. L. Ponsky et al. в анализе результатов лечения 19 пациентов сравнивали 24, 32, 40 и 48 Гр за 4 фракции. Авторы показали, что 48 Гр за 4 фракции можно применять без ограничивающей дозу токсичности, что позволяет достичь частичного ответа в 20 % [13]. В подтверждение этих данных S. Siva et al. в 2016 г. продемонстрировали отсутствие глобальных изменений почечных функций как через 2 нед после завершения лечения, так и спустя 12 мес [7].
Токсичность лучевого лечения оценивалась не только в аспекте нарушения почечной функции. В некоторых исследованиях изучалась неренальная токсичность: общая слабость, диарея, боль в грудной клетке, тошнота. В исследовании S. Siva et al. (2020) из 38 пациентов, перенесших СТЛТ опухоли почки, у 40 % возникла токсичность I–II степени, при этом токсичность III–V степени отсутствовала [12]. A.V. Peddada et al. сообщили о токсичности I степени в 14,2 % случаев без каких-либо других нежелательных явлений [14]. Однако вопрос влияния СТЛТ на почечную функцию остается крайне важным. Частота диализа после СТЛТ при раке почки низкая [2]. М. Staehler et al. не сообщают о пациентах с нарушением функции почек после радиохирургического лечения с разовой очаговой дозой 25 Гр [8]. A.V. Peddada et al. наблюдали снижение СКФ в среднем на 1,5 % через 1 год, 7 % ‒ через 2 года и 14,2 % ‒ через 5 лет [14]. С. Senger et al. продемонстрировали стабильность почечной функции у 10 пациентов после курса СТЛТ [15]. Еще одним показателем дисфункции почек после СТЛТ является почечная атрофия. Т. Yamamoto et al. продемонстрировали сильную корреляцию после СТЛТ между V20 и V30 и почечной атрофией [2, 16].
Несмотря на возможную почечную токсичность после СТЛТ, появляются данные, указывающие на то, что у пациентов с уже существующим повреждением почек СТЛТ может быть безопасной стратегией. Так, из 9 пациентов с СКФ 52 мл/мин/1,73м2, которые считались подверженными высокому риску диализа после СТЛТ, никому не пришлось его проводить [2, 7].
После любого лечения важным является вопрос дальнейшего качества жизни пациентов. В 2021 г. были опубликованы результаты небольшого исследования, включавшего 28 пациентов, которые перенесли СТЛТ опухоли почки до СОД 30–42 Гр за 3–5 фракций. Качество жизни оценивалось с помощью опросника качества жизни Европейской организации по исследованию и лечению рака Core-15 Palliative (EORTC-QLQ-C15-PAL), опросника индекса почечных симптомов FACT FKSI-19 и опросника EuroQol-5D-3L на исходном уровне, через 1 нед и 1, 3 и 6 мес после лечения. Авторы сообщили о снижении качества жизни в целом в 1-ю нед после СТЛТ с последующим восстановлением [17].
Таким образом, для неоперабельных или отказавшихся от операции пациентов оптимальной опцией лечения может являться СТЛТ как альтернатива хирургическому вмешательству.
Цель исследования ‒ оценить результаты применения стереотаксической лучевой терапии в лечении неоперабельных пациентов с локализованным раком почки с учетом показателей общей выживаемости и локального контроля.
Материал и методы
В данном ретроспективном исследовании с 2011 по 2021 г. в ЧОКЦО и ЯМ 42 пациентам с морфологически подтвержденным диагнозом рака почки была проведена СТЛТ. Решение о лучевой терапии по поводу почечноклеточного рака принималось на мультидисциплинарном консилиуме. Проведение исследования одобрено решением этического комитета Челябинского областного клинического онкологического диспансера, выписка из протокола № 6 от 02.03.11.
Средний возраст больных – 67,9 года (от 49 до 93 лет). СТЛТ проводилась в случае неоперабель-ности пациента с учетом различных факторов (возраст, тяжесть сопутствующей патологии, степень анестезиологического риска – ASA IV), отказа пациентов от операции при размерах опухоли до 5,0 см в диаметре. Не проводилась СТЛТ при размерах опухоли более 5,0 см в диаметре, при значимом нарушении функции почек (хроническая болезнь почек С5), генерализации процесса, декомпенсации сопутствующей патологии. СТЛТ проводилась при первичной опухоли почки и при рецидивах ПКР после хирургического лечения.
Во всех случаях опухоль почки имела гистологическую структуру ПКР, в большинстве случаев – светлоклеточный вариант (36 почек), в 4 почках – папиллярный рак, в 1 случае – темноклеточный вариант, в остальных – смешанный рак. В 37 случаях диагностирована первичная опухоль, а в 6 – рецидив после предшествующего хирургического лечения, в том числе у 1 пациента – рецидив рака обеих почек (табл. 1). Пациент с ПРК IV стадии изначально имел метастатический очаг в контрлатеральной (левой) почке, по поводу чего ему было проведено хирургическое лечение в объеме резекции обеих почек, а лучевая терапия проводилась по поводу рецидива рака в правой почке.
Лечение проводилось на аппарате CyberKnife. Подготовка к лечению включала в себя установку минимум 3 рентгеноконтрастных маркеров в опухоль почки под УЗ-контролем. Важно отметить, что маркеры должны устанавливаться на расстоянии не менее 2 см и под углом не менее 15° друг от друга, поскольку при физико-техническом планировании они должны быть визуализированы во всех плоскостях. Ввиду возможной миграции маркеров в опухоли, в среднем на 3–5 мм, следующий этап подготовки к лечению, а именно МСКТ-разметка, проводился не ранее чем через 7–10 дней после имплантации маркеров. Лечение и разметка на компьютерном томографе проводились с использованием индивидуального фиксирующего матраса. Физико-техническое планирование осуществлялось по 80 % изодозе с учетом индексов конформности и однородности, учитывая толерантность критических структур. Лечение проводилось с обязательным использованием системы слежения за дыханием Synchrony®.
Всем пациентам проводилась СТЛТ в режиме гипофракционирования. Средний объем опухоли составил 28,1 см3. Средняя доза в опухоли – 52 Гр (от 30 до 63 Гр). СТЛТ проводилась с суммарной очаговой дозой от 30 до 45 Гр за 3 фракции на аппарате CyberKnife (Accuray, USA). Выбор разовой очаговой дозы (РОД) и режима фракционирования зависел от объема первичной опухоли, толерантности критических структур (преимущественно – тонкой кишки, при расстоянии между опухолью и тонким кишечником менее 5 мм РОД и СОД уменьшались). Чаще всего использовался режим подведения 45 Гр за 3 фракции (n=31).
При оценке результатов лечения мы руководствовались наиболее значимыми показателями, определяющими эффективность проведенной терапии: медиана общей выживаемости (период времени, который переживает половина пациентов с определенным диагнозом), локальный контроль (оценка размеров опухоли после лечения), токсичность лучевой терапии в аспекте нарушения почечной функции (по изменению скорости клубочковой фильтрации).
Статистическая обработка данных производилась при помощи пакетов прикладных программ IBM SPSS Statistics Version 20 (IBM, USA). Основным критерием оценки результатов были показатели 1-, 3- и 5-летней общей выживаемости (время от момента начала лечения до смерти от любой при-
Òàблицà 1/Table 1
Õàðàêтåðиñтиêà пàциåнтîв
Characteristics of patients
Результаты и обсуждение
Медиана ОВ не была достигнута в связи с тем, что большинство пациентов (n=36) на момент анализа результатов исследования были живы. В среднем продолжительность жизни составила 124 мес (95 % ДИ 97–152). Показатели 1-, 3- и 5-летней ОВ составили 94,1; 88,7 и 72,6 % соответственно (рис. 1). 1-летняя онкоспецифическая выживаемость – 100 %.
Анализируя результаты локального контроля, в большинстве случаев мы отметили тенденцию к стабилизации процесса (рис. 2). Частичный ответ по критериям RECIST 1.1 спустя 3–6 мес после СТЛТ наблюдался в 26,2 % случаев, стабилизация – в 66,8 %, прогрессирование – в 7 % (n=3). Уровень 1-летнего локального контроля составил 93 %.
Токсичность лучевой терапии оценивали по изменению показателя скорости клубочковой фильтрации (СКФ), которую рассчитывали по формуле CKD-EPI, через 1, 3 и 6 мес после лечения. Отмечено появление ренальной токсичности у 23,8 % пациентов спустя 3 мес после проведенной лучевой терапии (табл. 2), но в течение года функция почек у этих пациентов была восстановлена.
Таким образом, проведение СТЛТ сопряжено с низкой токсичностью, что крайне важно, учитывая высокие разовые очаговые дозы. Лучевых повреждений ни у одного пациента зафиксировано не было.
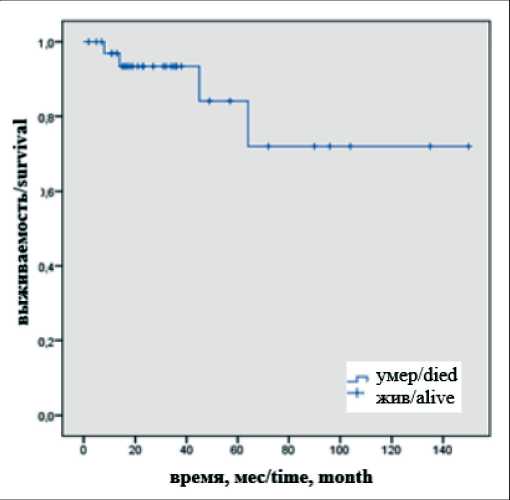
Рис. 1. Общая выживаемость у пациентов с опухолью почки Fig. 1. Overall survival in patients with kidney cancer
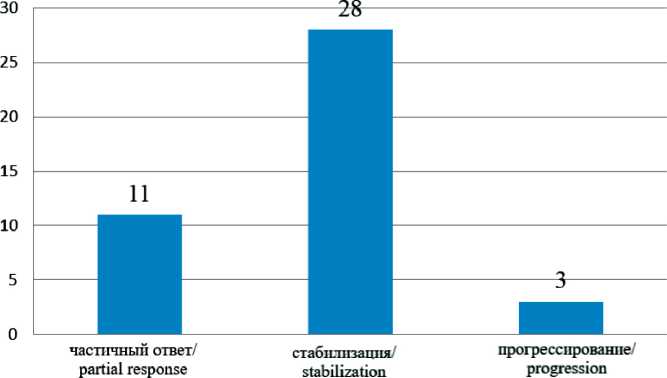
Рис. 2. Ответ на лечение по критериям RECIST 1.1 (по оси ординат – количество пациентов)
Fig. 2. Response to treatment according to RECIST1.1 criteria (Y-axis – number of patients)
Òàблицà 2/Table 2
Динàмиêà ÑÊФ чåðåз 3 мåñ пîñлå ÑÒЛÒ
Changes in the glomerular filtration rate 3 month after SBR
|
Показатель/ Index |
Количество/Number of patients |
|
Снижение СКФ/Decline of glomerular filtration rate |
10 (23,8 %) пациентов/ 10 (23,8 %) patients |
|
Стабилизация СКФ/Stabilization of glomerular filtration rate |
32 (76,2 %) пациента/ 32 (76,2 %) patients |
|
Максимальное снижение СКФ/Maximum decline of glomerular filtration rate |
33 % |
|
Минимальное снижение СКФ/Minimum decline of glomerular filtration rate |
6 % |
|
Среднее снижение СКФ/Average decline of glomerular filtration rate |
18 % |
Клинический пример
Пациент Т., 58 лет, в 2010 г. перенес резекцию обеих почек по поводу почечноклеточного рака. Далее наблюдался с диагнозом: 1) Рак правой почки I ст. Состояние после резекции правой почки в 2010 г. 2) Рак левой почки I ст. Состояние после резекции левой почки в 2010 г. Состояние после иммунотерапии в течение 1 года.
В 2012 г. при ПЭТ-КТ выявлен рост образований в обеих почках, при биопсии данные образования верифицированы как почечноклеточный рак. Установлен диагноз рецидива рака обеих почек. С учетом объема ранее проведенного оперативного вмешательства, двустороннего поражения принято решение о СТЛТ на область рецидивной опухоли обеих почек.
В июне 2012 г. проведен курс СТЛТ на область рецидива опухоли левой почки с РОД 15 Гр за 3 фракции до СОД 45 Гр, объем опухоли составил 12 см3. Физико-техническое планирование представлено на рис. 3. В сентябре 2012 г. проведен курс СТЛТ на область рецидива опухоли правой почки с РОД 10 Гр за 3 фракции до СОД 30 Гр, объем опухоли составил 80 см3. Физико-техническое планирование представлено на рис. 4.
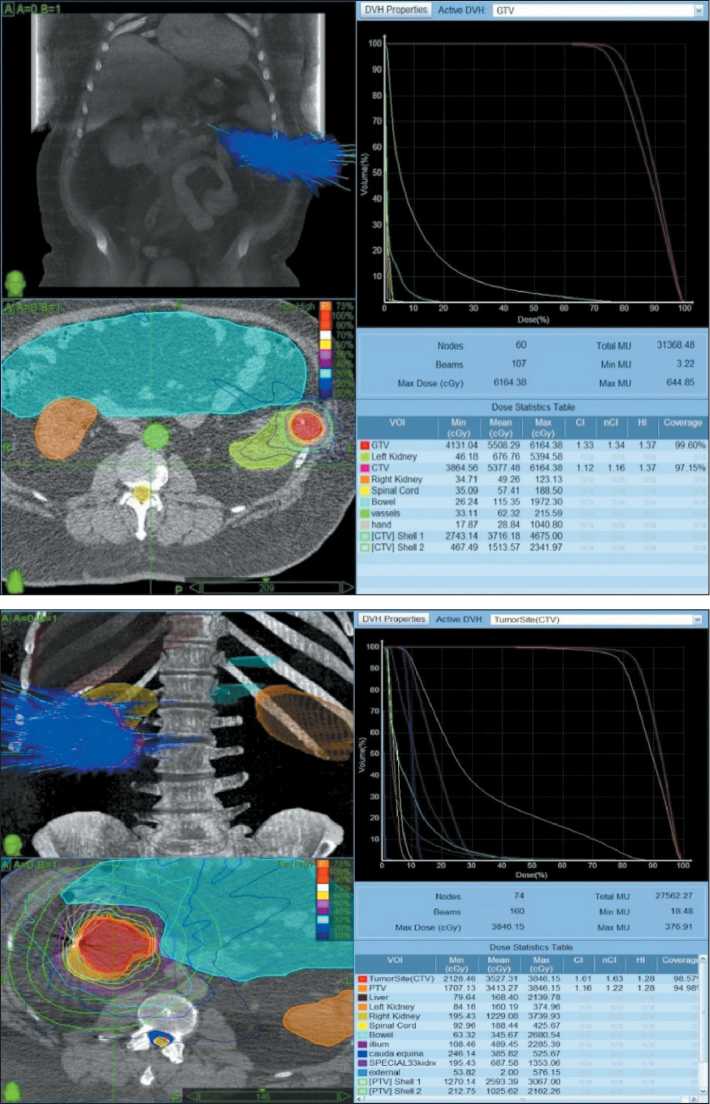
Рис. 4. Физико-техническое планирование СТЛТ рецидива опухоли правой почки (2012) Fig. 4. Physical and technical planning of SBRT for tumor recurrence in the right kidney (2012)
Рис. 3. Физико-техническое планирование СТЛТ рецидива опухоли левой почки
Fig. 3. Physical and technical planning of SBRT for tumor recurrence in the left kidney
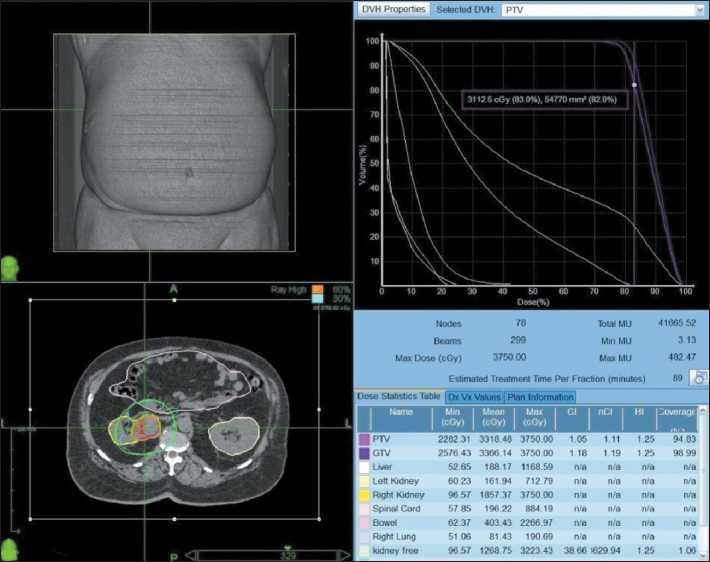
Рис. 5. Физико-техническое планирование СТЛТ рецидива опухоли правой почки (2022) Fig. 5. Physical and technical planning of SBRT for tumor recurrence in the right kidney (2022)
В дальнейшем наблюдался без признаков рецидива и прогрессирования процесса до 2021 г., иммунотерапию не получал. В декабре 2021 г. зафиксирован рост образования в правой почке, подтвержден рецидив почечноклеточного рака. С учетом объема ранее проведенного лечения, длительной ремиссии принято решение о повторной СТЛТ на область рецидивной опухоли правой почки. Лечение проведено в марте 2022 г., подведена СОД 45 Гр за 3 фракции (физико-техническое планирование представлено на рис. 5). Лечение перенес удовлетворительно.
В настоящее время пациент наблюдается без признаков рецидива процесса, почечная функция после СТЛТ восстановлена.
Заключение
Таким образом, на основании полученных данных мы пришли к предварительному выводу, что проведение СТЛТ у неоперабельных пациентов с локализованным раком почки демонстрирует многообещающие результаты. Однако вопрос о режиме дозирования и фракционирования остается открытым и требует дальнейшего изучения.
Список литературы Применение стереотаксической лучевой терапии в лечении неоперабельных пациентов с локализованным раком почки
- NCCN Guidelines Updates: Kidney Cancer. 2022; 20(1). https:// doi.org/10.6004/jnccn.2022.201glup.
- de la Pinta C., Latorre R.G., Fuentes R. SBRT in Localized Renal Carcinoma: A Review of the Literature. Anticancer Res. 2022; 42(2): 667-74. doi: 10.21873/anticanres.15525.
- Chang J.H., Cheung P., Erler D., Sonier M., KorolR., Chu W. Stereotactic Ablative Body Radiotherapy for Primary Renal Cell Carcinoma in Non-surgical Candidates: Initial Clinical Experience. Clin Oncol (R Coll Radiol). 2016; 28(9): 109-14. doi: 10.1016/j.clon.2016.04.002.
- Siva S., Chesson B., BresselM., Pryor D., Higgs B., ReynoldsH.M., Hardcastle N., Montgomery R., Vanneste B., Khoo V, Ruben J., Lau E., Hofman M.S., De Abreu Lourenco R., Sridharan S., Brook N.R., Martin J., LawrentschukN., Kron T., Foroudi F. TROG 15.03 phase II clinical trial of Focal Ablative STereotactic Radiosurgery for Cancers of the Kidney -FASTRACK II. BMC Cancer. 2018; 18(1): 1030. doi: 10.1186/s12885-018-4916-2.
- GrantS.R., LeiX., Hess K.R., Smith G.L., Matin S.F., Wood C.G., Nguyen Q., Frank S.J., Anscher M.S., Smith B.D., Karam J.A., Tang C. Stereotactic Body Radiation Therapy for the Definitive Treatment of Early Stage Kidney Cancer: A Survival Comparison With Surgery, Tumor Ablation, and Observation. Adv Radiat Oncol. 2020; 5(3): 495-502. doi: 10.1016/j.adro.2020.01.002.
- Haque W., Verma V., Lewis G.D., Lo S.S., Butler E.B., Teh B.S. Utilization of radiotherapy and stereotactic body radiation therapy for renal cell cancer in the USA. Future Oncol. 2018; 14(9): 819-27. doi: 10.2217/fon-2017-0536.
- Siva S., Jackson P., Kron T., Bressel M., Lau E., Hofman M., Shaw M., Chander S., Pham D., Lawrentschuk N., Wong L.M., Goad J., Foroudi F. Impact of stereotactic radiotherapy on kidney function in primary renal cell carcinoma: Establishing a dose-response relationship. Ra-diother Oncol. 2016; 118(3): 540-6. doi: 10.1016/j.radonc.2016.01.027.
- StaehlerM., BaderM., Schlenker B., Casuscelli J., KarlA., Roosen A., StiefC.G., BexA., WowraB.,MuacevicA. Single fraction radiosurgery for the treatment of renal tumors. J Urol. 2015; 193(3): 771-5. doi: 10.1016/j. juro.2014.08.044.
- Siva S., Louie A.V., Warner A., Muacevic A., Gandhidasan S., Ponsky L., Ellis R., Kaplan I., Mahadevan A., Chu W., Swaminath A., Onishi H., Teh B., Correa R.J., Lo S.S., Staehler M. Pooled analysis of stereotactic ablative radiotherapy for primary renal cell carcinoma: A report from the International Radiosurgery Oncology Consortium for Kidney (IROCK). Cancer. 2018; 124(5): 934^2. doi: 10.1002/cncr.31156.
- Correa R.J.M., Louie A.V, Zaorsky N.G., Lehrer E.J., Ellis R., Ponsky L., Kaplan I., Mahadevan A., Chu W, Swaminath A., Hannan R., Onishi H., Teh B.S., Muacevic A., Lo S.S., Staehler M., Siva S. The Emerging Role of Stereotactic Ablative Radiotherapy for Primary Renal Cell Carcinoma: A Systematic Review and Meta-Analysis. Eur Urol Focus. 2019; 5(6): 958-69. doi: 10.1016/j.euf.2019.06.002.
- Wegner R.E., Abel S., Vemana G., Mao S., Fuhrer R. Utilization of Stereotactic Ablative Body Radiation Therapy for Intact Renal Cell Carcinoma: Trends in Treatment and Predictors of Outcome. Adv Radiat Oncol. 2019; 5(1): 85-91. doi: 10.1016/j.adro.2019.07.018.
- Siva S., Correa R.J.M., Warner A., Staehler M., Ellis R.J., Ponsky L., Kaplan I.D., Mahadevan A., Chu W, Gandhidasan S., Swaminath A., Onishi H., Teh B.S., Lo S.S., Muacevic A., Louie A.V. Stereotactic Ablative Radiotherapy for >T1b Primary Renal Cell Carcinoma: A Report From the International Radiosurgery Oncology Consortium for Kidney (IROCK). Int J Radiat Oncol Biol Phys. 2020; 108(4): 941-9. doi: 10.1016/j.ijrobp.2020.06.014.
- Ponsky L, Lo S.S., Zhang Y, Schluchter M, Liu Y, Patel R, Abouassaly R., Welford S., Gulani V, Haaga J.R., Machtay M., Ellis R.J. Phase I dose-escalation study of stereotactic body radiotherapy (SBRT) for poor surgical candidates with localized renal cell carcinoma. Radiother Oncol. 2015; 117(1): 183-7. doi: 10.1016/j.radonc.2015.08.030.
- Peddada A.V., Anderson D., Blasi O.C., McCollough K., Jennings S.B., MonroeA.T. Nephron-Sparing Robotic Radiosurgical Therapy for Primary Renal Cell Carcinoma: Single-Institution Experience and Review of the Literature. Adv Radiat Oncol. 2019; 5(2): 204-11. doi: 10.1016/j.adro.2019.10.001.
- Senger C., Conti A., Kluge A., Pasemann D., KufeldM., Acker G., Lukas M., Grün A., Kalinauskaite G., Budach V., Waiser J., Stromberger C. Robotic stereotactic ablative radiotherapy for renal cell carcinoma in patients with impaired renal function. BMC Urol. 2019; 19(1): 96. doi: 10.1186/s12894-019-0531-z.
- Yamamoto T., KadoyaN., TakedaK., MatsushitaH., UmezawaR., Sato K., Kubozono M., Ito K., Ishikawa Y., Kozumi M., Takahashi N., Katagiri Y., Onishi H., Jingu K. Renal atrophy after stereotactic body radiotherapy for renal cell carcinoma. Radiat Oncol. 2016; 11: 72. doi: 10.1186/s13014-016-0651-5.
- Swaminath A., Cheung P., Glicksman R.M., Donovan E.K., Niglas M., Vesprini D., Kapoor A., Erler D., Chu W. Patient-reported Quality of Life following Stereotactic Body Radiation Therapy for Primary Kidney Cancer - Results from a Prospective Cohort Study. Clin Oncol (R Coll Radiol). 2021; 33(7): 468-75. doi: 10.1016/j.clon.2021.03.002.


