Применение техники аутологичного индуцированного матрицей хондрогенеза в лечении пациентов с остеоартритом первого плюснефалангового сустава
Автор: Нурмухаметов Максим Ринатович, Макаров Максим Анатольевич, Бялик Евгений Иосифович, Хренников Ярослав Борисович, Бялик Валерий Евгеньевич, Нестеренко Вадим Андреевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.27, 2021 года.
Бесплатный доступ
Введение. На сегодняшний день не существует единого подхода к выбору тактики хирургического лечения остеоартрита первого плюснефалангового сустава (ОА I ПФС). С другой стороны, известно, что при наличии костно-хрящевых дефектов в тазобедренном, коленном и голеностопном суставах успешно применяется техника аутологичного индуцированного матрицей хондрогенеза. В связи с этим нами предложено применение данной техники в лечении пациентов с ОА I ПФС. Цель. Изучить возможность хирургического лечения пациентов с ОА I ПФС с использованием хондропластики по технике аутологичного индуцированного матрицей хондрогенеза, продемонстрировать ближайшие и среднесрочные результаты выполненных операций. Материалы и методы. К настоящему времени хондропластика выполнена 15 пациентам (16 стоп) с ОА I ПФС. При обследовании определялся объем движений в I ПФС; состояние оценивалось по таким шкалам как ВАШ боли, AOFAS, FFI. Хондропластика I ПФС осуществлялась по технике индуцированного хондрогенеза с использованием коллагеновой матрицы. Результаты операций оценивались через 3, 6 и 12 месяцев. Результаты. Уже через 3 месяца после операции отмечено выраженное значимое увеличение объема движений и уменьшение боли в I ПФС. Через 6 и 12 месяцев наблюдалась умеренная положительная динамика. Заключение. Результаты проведенных операций показали, что хондропластика I ПФС является эффективным методом хирургического лечения, позволяющим купировать боль и существенно улучшать качество жизни пациентов с ОА I ПФС. При этом необходимо изучение отдаленных результатов.
I плюснефаланговый сустав, остеоартрит, хондропластика, хондрогенез, коллагеновая матрица
Короткий адрес: https://sciup.org/142230172
IDR: 142230172 | УДК: 617.588-002.2-089.844 | DOI: 10.18019/1028-4427-2021-27-2-220-226
Текст научной статьи Применение техники аутологичного индуцированного матрицей хондрогенеза в лечении пациентов с остеоартритом первого плюснефалангового сустава
Остеоартрит первого плюснефалангового сустава (ОА I ПФС) – заболевание, которое характеризуется болью, усиливающейся при ходьбе, скованностью в I ПФС и снижением объема движений в нём, в особенности, тыльного сгибания. ОА I ПФС является вторым по частоте после вальгусной деформации первого пальца патологическим состоянием стопы и встречается, по разным данным, у 2,5–10 % взрослого населения [1, 2]. В настоящее время существует множество различных способов хирургического лечения ОА I ПФС, таких как хейлэктомия, укорачивающие остеотомии первой плюсневой кости (I ПК), гемиартропластика, эндопротезирование и артродез I ПФС, и все они имеют как достоинства, так и недостатки [3–7]. Для пациентов, имеющих I и II рентгенологическую стадию заболевания с умеренным или периодически возникающим болевым синдромом и скованностью, рекомендованным методом хирургического лечения является хейлэктомия [8]. Однако стоит отметить, что хейлэктомия не позволяет восстановить поврежденные участки суставного хряща, следовательно, болевой синдром может рецидивировать. Также K. Canseco и соавт. [9] в своем исследовании не наблюдали увеличения объема активных движений в I ПФС после хейлэктомии и указывали на необходимость разработки реабилитационных мероприятий после хирургического лечения. В свою очередь, согласно исследованию Seibert и соавт. [10], хейлэктомия противопоказана на поздних стадиях заболевания, когда интактной остается менее 50 % суставной поверхности I ПФС. Harrison и соавт. утверж-
дают, что боль в среднем диапазоне движений в I ПФС связана с наличием обширных дефектов суставного хряща, и в таких случаях эффект от выполненной хей-лэктомии сомнителен [11]. В свою очередь, Coughlin и Shurnas, разработавшие клинико-рентгенологическую классификацию ОА I ПФС, не рекомендуют выполнять хейлэктомию на 3 и 4 стадиях заболевания [12]. Peace и соавт. указывают на то, что основной проблемой, связанной с хейлэктомией, является послеоперационный хондролиз и повторное формирование остеофитов и, как следствие, дальнейшая деформация суставных поверхностей I ПФС [13]. Perler и соавт. сообщали о том, что рецидив формирования дорсальных остеофитов после хейлэктомии возникает у 30 % прооперированных пациентов [14].
На сегодняшний день не существует единого подхода к выбору тактики хирургического лечения ОА I ПФС. В свою очередь, известно, что при наличии костно-хрящевых дефектов в коленном [15, 16], тазобедренном [17, 18] и голеностопном [19] суставах довольно успешно применяется техника аутологичного индуци- рованного матрицей хондрогенеза. В РФ лицензированы такие коллагеновые матрицы как Chondro-Gide фирмы Geistlich и Aesculap Novocart Basic фирмы BBraun, и у производителей есть указание на возможность применения их на голеностопном суставе. Следовательно, было предположено, что данные матрицы можно использовать также и на переднем отделе стопы. В связи с этим нами предложено использование данной техники в лечении пациентов с ОА I ПФС, в том числе и на поздних стадиях заболевания [20, 21]. Данное исследование полностью соответствовало этическим нормам и было одобрено этическим комитетом ФГБНУ НИИР им. В.А. Насоновой в 2018 г. Все пациенты были информированы в полном объеме о предстоящей операции, были подписаны информированные согласия.
Цель исследования – изучить возможность хирургического лечения пациентов с ОА I ПФС с использованием хондропластики I ПФС по технике аутологичного индуцированного матрицей хондрогенеза, продемонстрировать ближайшие и среднесрочные результаты выполненных операций.
МАТЕРИАЛЫ И МЕТОДЫ
К настоящему времени в НИИ ревматологии им. В.А. Насоновой хондропластика I ПФС по технике индуцированного хондрогенеза выполнена 15 пациентам с ОА I ПФС. 10 пациентов – женщины, 5 – мужчины. Одной пациентке прооперировано обе стопы, соответственно, всего выполнено 16 операций. Набор пациентов в исследование осуществлялся с учетом следующих критериев исключения: возраст моложе 18 и старше 74 лет, индекс массы тела > 40, наличие системных заболеваний средней и высокой активности, наличие инфекционных заболеваний. Медиана возраста пациентов – 55 лет (минимальный возраст – 20 лет, максимальный – 71 год). Для оценки состояния пациентов до операции определялся объем движений в I ПФС, а также использовались следующие анкеты:
-
1) визуальная аналоговая шкала (ВАШ) боли – от 0 до 100 мм, где 0 – отсутствие боли, 100 мм – максимальная интенсивность;
-
2) шкала Американской ассоциации ортопедов стопы и голеностопного сустава (American Orthopedic Foot & Ankle Society – AOFAS) – от 0 до 100 баллов, где 0 – наихудшее состояние стопы, 100 – наилучшее [22];
-
3) функциональный индекс стопы (Foot Function Index – FFI) – от 0 до 10, где 0 – наилучший показатель, 10 – наихудший [23].
В связи с наличием небольшой выборки принято решение, что для каждого из оцениваемых параметров вместо среднего значения целесообразнее высчитывать медиану.
В таблице 1 представлены клинические показатели пациентов до операции. Все пациенты до операции испытывали значительное ограничение движений в I ПФС. Минимальный объем движений составил 15 0 , максимальный – 50 0 , медиана – 20 0 . Медиана боли по ВАШ составила 70 мм (минимальный уровень боли – 40 мм, максимальный – 90 мм), при этом по шкале AOFAS медиана составила 52 (минимальный балл – 39, максимальный – 62). Медиана FFI до операции составила 6,1 (минимальный индекс – 2,1, максимальный – 8,2) (табл. 1, рис. 6–9).
Для оценки клинико-рентгенологической картины до операции была использована упомянутая выше классификация Coughlin-Shurnas (табл. 2) [12]. В дан- ной классификации выделяется пять стадий заболевания (от 0 до 4) и такие характеристики как состояние суставной щели I ПФС, характер болевого синдрома и ограничение объема движений в суставе.
Таблица 1 Клинические показатели до операции
|
Возраст, лет |
ВАШ боли, мм |
AOFAS |
FFI |
Объем движений в I ПФС, градусы |
|
|
1. |
22 |
80 |
52 |
6,9 |
20 |
|
2. |
27 |
70 |
55 |
6,2 |
25 |
|
3. |
25 |
90 |
52 |
7 |
20 |
|
4. |
40 |
80 |
39 |
7,6 |
15 |
|
5. |
70 |
70 |
52 |
6,5 |
30 |
|
6. |
58 |
60 |
54 |
4,3 |
30 |
|
7. |
71 |
70 |
52 |
6,5 |
15 |
|
8. |
37 |
50 |
62 |
3,7 |
20 |
|
9. |
52 |
50 |
47 |
2,7 |
20 |
|
10. |
20 |
90 |
44 |
6,3 |
15 |
|
11. |
63 |
80 |
52 |
5,8 |
20 |
|
12. |
66 |
90 |
52 |
8,2 |
15 |
|
13. |
59 |
70 |
39 |
5,9 |
15 |
|
14. |
66 |
40 |
55 |
2,1 |
20 |
|
15. |
59 |
60 |
45 |
4,4 |
50 |
|
16. |
52 |
50 |
52 |
3,2 |
40 |
|
Медиана |
55 |
70 |
52 |
6,1 |
20 |
В соответствии с классификацией Coughlin и Shurnas, у двух пациентов была 2 стадия ОА I ПФС, у девяти пациентов (при этом, у одной пациентки процесс двусторонний) 3 стадия и у четырех пациентов 4 стадия заболевания.
Наличие и размер дефекта хрящевого покрытия головки 1 ПК определялись интраоперационно. Пластике подвергались единичные дефекты хряща диаметром более 3 мм (рис. 1), а также множественные дефекты вне зависимости от размера. В большинстве случаев (11 операций) обнаруживались множественные дефекты хряща в сочетании с наличием остеофитов (рис. 2), при этом выполнялась тотальная хейлэктомия с покрытием всей площади головки 1 ПК коллагеновой матрицей.
Таблица 2
Клинико-рентгенологическая классификация ОА I ПФС по Coughlin-Shurnas
|
Стадия |
Тыльное сгибание |
Рентгенологическая картина |
Клиническая картина |
|
0 |
От 400 до 600 и/или от 10 до 20 % потери объема по сравнению со здоровой стопой |
Норма |
Боли нет; при осмотре определяется незначительное ограничение движений |
|
1 |
От 300 до 400 и/или от 20 до 50 % потери объема по сравнению со здоровой стопой |
Наличие тыльного остеофита на головке I ПК, минимальное сужение суставной щели, минимальный периартикулярный склероз, минимальное уплощение головки I ПК |
Незначительный или случайный болевой синдром, при осмотре боль возникает в крайней точке тыльного и/или подошвенного сгибания |
|
2 |
От 100 до 300 и/или от 50 до 75 % потери объема по сравнению со здоровой стопой |
Наличие тыльного, латерального и, возможно, медиального остеофитов, создающих картину уплощения головки I ПК; в боковой проекции – вовлечение в патологический процесс не более ¼ суставной щели с тыльной стороны; сужение суставной щели, склероз суставных поверхностей – от легкой до умеренной степени; сесамовидные кости, как правило, не вовлечены в патологический процесс |
Болевой синдром от умеренного до выраженного и скованность, которые могут носить постоянный характер; при осмотре боль возникает до максимальных точек тыльного и подошвенного сгибания |
|
3 |
≤ 100 и/или от 75 до 100 % потери объема по сравнению со здоровой стопой. Также имеется значительное ограничение подошвенного сгибания (как правило, ≤ 100) |
Выраженное сужение суставной щели, возможно наличие периартикулярных кистовидных просветлений, вовлечение в патологический процесс более ¼ суставной щели с тыльной стороны, а также сесамовидных костей |
Практически постоянный болевой синдром и выраженная скованность в крайних точках объема движения, но не на среднем уровне |
|
4 |
То же, как и при 3 стадии |
Та же, как и при 3 стадии |
Та же, как и при 3 стадии, но имеется болевой синдром в среднем диапазоне движений |
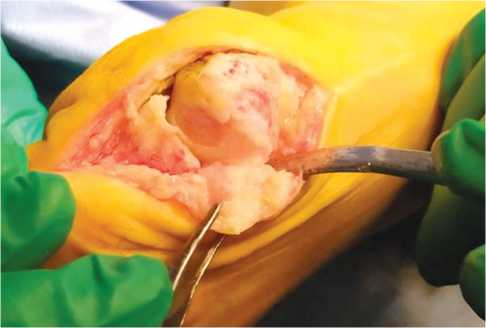
Рис. 1. Единичный дефект хряща диаметром более 3 мм
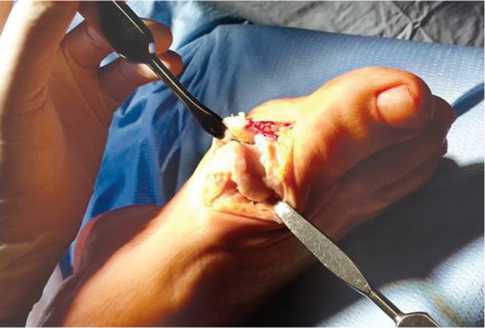
Рис. 2. Множественные остеофиты и дефекты хряща
Хондропластика 1 плюснефалангового сустава осуществлялась по технике аутологичного индуцированного матрицей хондрогенеза с использованием коллагеновых матриц Chondro-Gide и Aesculap Novocart Basic. Матрица состоит из коллагенов I и III типа. Она имеет двуслойное строение с плотной и пористой сторонами. Плотный слой имеет гладкую, не проницаемую для клеток поверхность, препятствующую проникновению мезенхимальных стволовых клеток в полость сустава. Пористый слой состоит из рыхлых коллагеновых волокон, способствующих адсорбции клеток. Матрица изготавливается из свиного коллагена, который через некоторое время после операции резорбируется естественным путем под действием ферментов до свободных аминокислот. В процессе изготовления из коллагена удаляются телопептиды – главные детерминанты антигенности. Таким образом, коллагеновая матрица обладает минимальным иммуногенным потенциалом [15, 16].
Операция производилась следующим образом: выполнялся прямой медиальный кожный разрез в проекции I ПФС длиной 4 см с последующей мобилизацией кожи с подкожно-жировой клетчаткой, обнажением капсулы сустава и артротомией. Осуществлялось удаление остеофитов с головки I ПК и основания проксимальной фаланги первого пальца – хейлэктомия; обрабатывалась зона дефекта хряща на головке плюсневой кости до субхондральной кости (рис. 3), выполнялось микрофракту-рирование (рис. 4) данного участка с помощью тонкой спицы или шила (расстояние между микроперфорациями – 2–3 мм), и дефект укрывался предварительно подготовленной двуслойной коллагеновой матрицей, которая фиксировалась по краям к неповрежденному хрящу и/или надкостнице с помощью тонких рассасывающихся нитей – PDS, Vicryl или Monosyn 6–0 (рис. 5). При этом важно обратить внимание на то, что матрица накладывалась на дефект пористым слоем к поверхности кости.
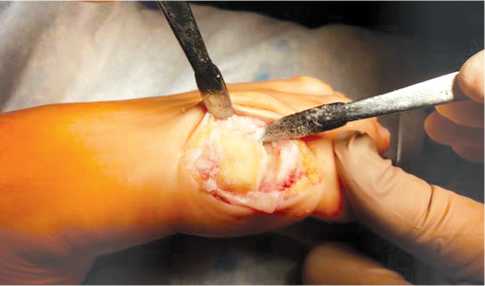
Рис. 3. Хейлэктомия, удаление остатков поврежденного хряща
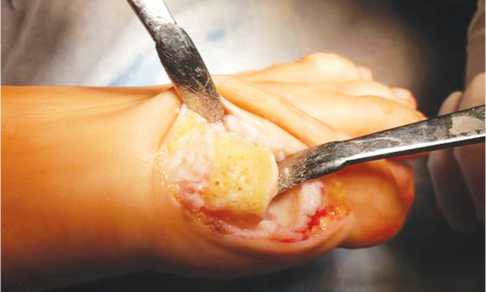
Рис. 4. Микрофрактурирование зоны дефекта
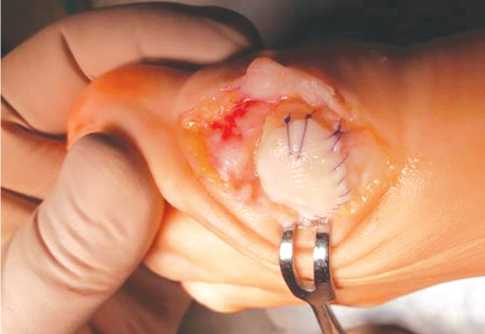
Рис. 5. Укладка и фиксация коллагеновой матрицы тонкими рассасывающимися нитями
Перед укладкой коллагеновая матрица в течение 7 минут выдерживалась в 0,9 % растворе NaCl, после чего следовала обрезка матрицы по краю дефекта.
В послеоперационном периоде пациенты вертика-лизировались на следующие сутки после операции. По технике индуцированного хондрогенеза, следует исключить осевую нагрузку на оперированный сустав в течение
4–6 недель после операции [15, 18], следовательно, обязательным условием послеоперационной реабилитации для наших пациентов было ношение обуви Барука для разгрузки переднего отдела стопы в течение 6 недель. Что касается разработки движений, то после хондропластики крупных суставов по технике индуцированного матрицей хондрогенеза рекомендовано в течение двух недель после операции исключить движения в оперированном суставе, а затем - начинать постепенную разработку [15, 18]. С другой стороны, после хейлэктомии ряд авторов, в частности, Seibert и соавт., указывают на необходимость ранней агрессивной разработки движений в I ПФС [10]. Исходя из этого, мы рекомендовали нашим пациентам приступить к постепенной разработке пассивных движений в безболевом диапазоне через неделю после операции. Через 3 недели после операции рекомендовалось начать разработку активных движений. После перехода к ношению обычной обуви пациентам было рекомендовано использование индивидуальных стелек.
Результаты проведенного хирургического лечения оценивались по вышеуказанным опросникам через 3, 6 и 12 месяцев после операции.
В качестве статистического теста использовался критерий Уилкоксона (W), суть которого заключается в том, что сопоставляются абсолютные величины выраженности сдвигов в том или ином направлении [24, 25]. Следовательно, чем больше величина выраженности сдвига, тем меньше вероятность случайных сдвигов. Если сдвиг происходит в сторону уменьшения, критерий W приобретает положительное значение (+); если сдвиг происходит в сторону увеличения, критерий W приобретает отрицательное значение (–).
Выбор данного теста обусловлен небольшим объемом выборки (минимально допустимое количество испытуемых – 5 человек, максимальное – 50).
Статистические расчеты критерия Уилкоксона, а также уровня статистической значимости (p) проводились с помощью программы BioStat®.
РЕЗУЛЬТАТЫ
Динамика уровня боли по ВАШ представлена на рисунке 6. Как видно из рисунка, уже к третьему месяцу отмечено выраженное достоверное снижение болевого синдрома с 70 до 27,5 мм (минимальное значение – 10 мм, максимальное – 40 мм; p < 0,024, W = 36,0). Положительная динамика наблюдалась и через 6 мес. – уровень боли по ВАШ составил 10 мм (минимальное значение – 0 мм, максимальное – 40 мм; p < 0,024, W = 36,0). К концу первого года наблюдения медиана боли по ВАШ осталась на том же уровне – 10 мм (минимальное значение – 0 мм, максимальное – 40 мм; p < 0,024, W = 36,0).
На рисунке 7 представлена динамика показателей по шкале AOFAS. Как видно, к третьему месяцу после операции медиана AOFAS увеличилась с 52 до 78,5 (минимальный балл – 67, максимальный – 85 (учитывалось наличие минимального уровня боли и ограничение объема движений менее 75 0 ); p < 0,024, W = -36,0). Через 6 месяцев продолжала наблюдаться положительная динамика – медиана AOFAS увеличилась до 90 (минимальный балл – 67, максимальный – 95; p < 0,024, W = -36,0), а через 12 месяцев также составила 90 (минимальный балл – 67, максимальный – 95; p < 0,024, W = -36,0).
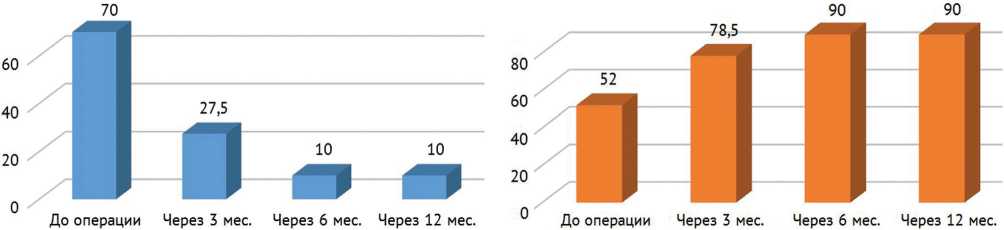
Рис. 6. Динамика уровня боли по ВАШ
Рис. 7. Динамика показателей по шкале AOFAS
Динамика показателей индекса FFI представлена на рисунке 8. Через 3 месяца после выполненной хондропластики медиана индекса снизилась с 6,4 до
2,3 (минимальный индекс – 1,1, максимальный – 4,7; W = -36,0).
p < 0,024, W = 36,0). Через 6 месяцев продолжило наблюдаться снижение индекса FFI до 1,1 (минимальный индекс – 0,5, максимальный – 3,9; p < 0,024, W = 36,0), а через 12 месяцев показатель индекса стабилизировался на уровне 1,1 (минимальный индекс – 0, максимальный – 2,7; p < 0,024, W = 36,0).
Что касается объема движений в I ПФС (рис. 9–11), то через 3 месяца после операции также наблюдалось значительное его увеличение – медиана объема движений с 200 возросла до 600 (минимальное значение – 300, максимальное – 700, p < 0,024, W = -36,0). Через 6 ме- ние – 300, максимальное – 800, p < 0,024, W = -36,0), а через год наблюдения увеличилась уже до 67,50 (минимальное значение – 400, максимальное – 900, p < 0,024,
Рентгенография стоп после операции демонстрировала значительное увеличение суставной щели I ПФС (рис. 12). Однако при контрольном осмотре через 3, 6, 12 мес. наблюдалось сужение суставной щели. Тем не менее, клинически данное явление не проявлялось снижением объема движений. Напротив, пациенты с 3 по 12-й месяц после операции, в целом, отмечали увеличение объема движений в I ПФС (см. рис. 9).
Особый интерес представляет собой картина МРТ после операции. В области оперированной головки I ПК определяются гроздевидные образования – «арте- сяцев положительная динамика сохранялась – медиана факты» (рис. 13). Вероятнее всего, так на МРТ выгля- объема движений составила 650 (минимальное значе- дит образовавшаяся гиалиноподобная ткань.
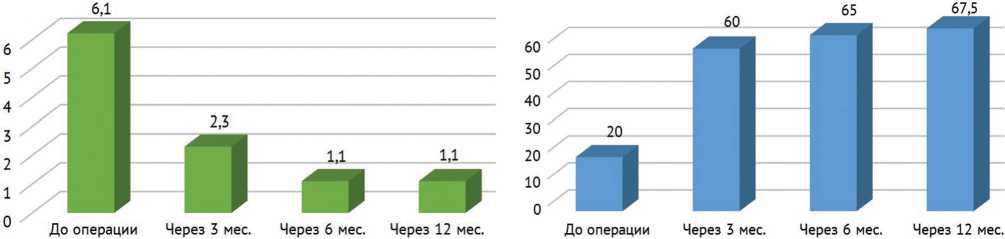
Рис. 8. Динамика показателей индекса FFI Рис. 9. Динамика объема движений в I ПФС
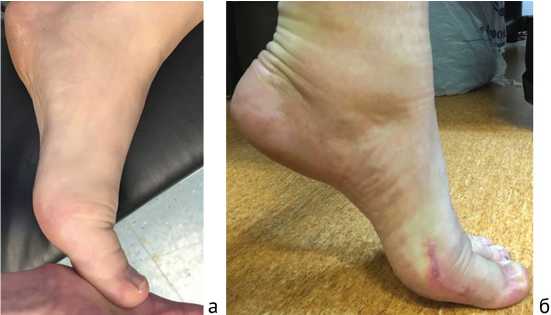
Рис. 10. Объем тыльного сгибания в I ПФС : а – до операции – 30 0; б – через 3 мес. после операции – 55 0 (пациент П., 52 года; ВАШ боли до операции – 50 мм, через 3 мес. – 20 мм; AOFAS до операции – 52, через 3 мес. после – 63)
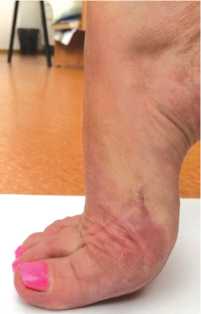
Рис. 11. Объем тыльного сгибания в I ПФС через 6 мес. после операции – 80 0 (пациентка Ш., 58 лет; объем тыльного сгибания до операции – 30 0 , ВАШ боли до операции – 60 мм, через 12 мес. – 0 мм; AOFAS до операции – 52, через 12 мес. после – 95)
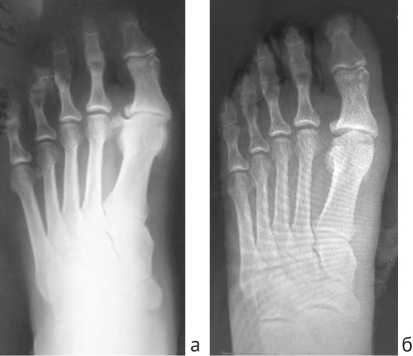
Рис. 12. Рентгенограммы стопы: а – до операции; б – в первые сутки после операции
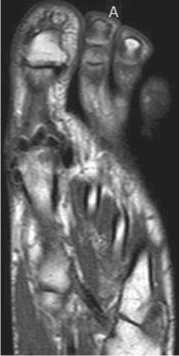
Рис. 13. МРТ стопы через 12 мес. после операции (пациентка Д., 40 лет)
ОБСУЖДЕНИЕ
Проблемой хирургического лечения ОА I ПФС в мире занимаются не один десяток лет. Разработаны классификации заболевания, описано множество операционных методов. Такие методики как укорачивающая остеотомия I ПК [26, 27], хейлэктомия или, при запущенных стадиях, артродез I ПФС [28–30] применяются чаще всего и зарекомендовали себя, в целом, с положительной стороны. Тем не менее, эти методы не лишены определенных недостатков. В частности, зачастую наблюдается избыточное укорочение I ПК при остеотомии, что приводит к развитию перегрузочной метатарзалгии [31]. При всех достоинствах артродеза в достижении полного отсутствия болевого синдрома, главный недостаток данного способа – отсутствие движений в I ПФС и, как следствие, нарушение биомеханики стопы при ходьбе [32, 33]. Хейлэктомия неэффективна на поздних стадиях заболевания [10], в то время как хондропластика использовалась, в том числе, при 3 и 4 стадиях. Более того, в отличие от индуцированного хондрогенеза, хейлэктомия не позволяет восстанавливать хрящевую ткань I ПФС. Что касается гемиартропластики и эндопротезирования I ПФС, то, несмотря на постоянное совершенствование технологии изготовления эндопротезов, риск развития асептической нестабильности остается высоким, и данный способ не может быть рекомендован как метод выбора [1, 34]. Таким образом, проблема хирургического лечения ОА I ПФС к настоящему времени до сих пор не решена.
В мировой литературе описано только одно исследование, проведенное в 2016 году, в котором автор предлагает метод хирургического лечения ОА I ПФС, схожий с тем, который использовался в нашем исследовании – модифицированный вариант индуцированного хондрогенеза – MAST (matrix-associated stem cell transplantation) [35]. M. Richter проводил наблюдение пациентов (n = 20) в течение 2-х лет после выполненной хондропластики I ПФС, при этом отмечал значительное улучшение клинических показателей как в раннем послеоперационном периоде, так и через вышеуказанный промежуток времени (в т.ч., увеличение объема движений в I ПФС): объем движений в I ПФС увеличился с 29,1 0 до 60 0 .
В своем исследовании Erdil M. и соавт. сравнивали эффективность эндопротезирования (группа A), гемиартропластики (группа B) и артродеза (группа C) I ПФС [5].
Они наблюдали за пациентами (n = 38) в течение 24-66 месяцев после операции. В группе A уровень боли по ВАШ уменьшился с 76,7 до 15,8 мм, показатель AOFAS увеличился с 45,4 до 92,7, объем движения в I ПФС увеличился с 15,1 0 до 40 0 . В группе B боль по ВАШ снизилась с 78,6 до 13,6 мм, показатель AOFAS увеличился с 38,4 до 86,1, объем движения в I ПФС увеличился с 20,5 0 до 47,9 0 . В группе C наблюдалось снижение уровня боли по ВАШ с 80 до 5 мм и увеличение показателя AOFAS с 33,6 до 76,1. Объем движений в связи с выполнением артродеза I ПФС у данной группы пациентов снизился с 13,3 0 до 0 0 .
Coughlin и Shurnas, в свою очередь, проанализировали отдаленные результаты после хейлэктомии I ПФС (средняя продолжительность наблюдения составила 9,6 года). При этом уровень боли по ВАШ снизился с 80 до 15 мм, показатель AOFAS увеличился с 45 до 90, объем движений в I ПФС увеличился с 39,2 0 до 63,7 0 [12].
В нашем исследовании к 12-му месяцу наблюдения объем движений в I ПФС с 20 0 увеличился до 71,5 0 ; при этом уровень боли по ВАШ снизился с 70 до 5 мм, а показатель AOFAS с 52 увеличился до 92,5. По сравнению с вышеупомянутыми исследованиями полученные нами результаты лучше, однако у нас, в отличие от других исследований, в настоящее время недостаточно данных по отдаленным результатам.
Особенно значительная разница показателей до и после операции наблюдается в раннем периоде – через 3 месяца: уровень боли по ВАШ снижается в среднем на 42,5 мм, AOFAS увеличивается на 26,5, FFI – на 2,1. Стоит отметить, что при этом разница показателей статистически значимая (p < 0,024).
Значительное улучшение состояния пациентов в раннем послеоперационном периоде можно связать с ношением послеоперационной обуви Барука, обеспечивающей разгрузку переднего отдела стопы. Однако пациенты используют данную обувь только в течение 6 недель после операции, и, тем не менее, положительная динамика сохраняется также и через 6 месяцев после операции: наблюдается дальнейшее снижения уровня боли по ВАШ на 17,5 мм, увеличение AOFAS на 12,5, FFI – на 1,2. Разница показателей также при этом статистически значимая (p < 0,024).
В дальнейшем, через 12 месяцев наблюдения, состояние пациентов, в целом, стабилизируется на положительном уровне.
ЗАКЛЮЧЕНИЕ
Ближайшие и среднесрочные результаты проведенных операций показали, что хондропластика I ПФС с использованием коллагеновой матрицы может являться довольно эффективным методом хирургического лечения, позволяющим купировать боль и существенно улучшать качество жизни пациентов, страдающих ОА I ПФС. Уже через 3 месяца по сле операции у пациентов наблюдается значительная положительная динамика, и в течение года состояние стабилизируется на хорошем уровне. Дать более полную оценку эффективности хондропластики I ПФС по технике аутологичного индуцированного матрицей хондрогенеза позволит изучение отдаленных результатов операций.
Список литературы Применение техники аутологичного индуцированного матрицей хондрогенеза в лечении пациентов с остеоартритом первого плюснефалангового сустава
- Бережной С.Ю. Артроз первого плюснефалангового сустава: чрескожное оперативное лечение, выбор хирургической методики, клинико-рентгенологическая классификация // Травматология и ортопедия России. 2017. Т. 23, № 1. С. 8-22. DOI: 10.21823/2311-2905-2017-23-1-8-22
- McNeil D.S., Baumhauer J.F., Glazebrook M.A. Evidence-based analysis of the efficacy for operative treatment of hallux rigidus // Foot Ankle Int. 2013. Vol. 34, No 1. P. 15-32. DOI: 10.1177/1071100712460220
- Sorbie C., Saunders G.A. Hemiarthroplasty in the treatment of hallux rigidus // Foot Ankle Int. 2008. Vol. 29, No 3. P. 273-281. DOI: 10.3113/ FAI.2008.0273
- The modified oblique Keller capsular interpositional arthroplasty for hallux rigidus / R.B. Mackey, A.B. Thomson, O. Kwon, MJ. Mueller, I.E. Johnson // I. Bone Joint Surg. Am. 2010. Vol. 92, No 10. P. 1938-1946. DOI: 10.2106JBJS.I.00412
- Comparison of Arthrodesis, Resurfacing Hemiarthroplasty, and Total Joint Replacement in the Treatment of Advanced Hallux Rigidus / M. Erdil, N.M. Elmadag, G. Polat, N. Turner, K. Bilsel, V. U?an, O.F. Erko^ak, C.Sen // J. Foot Ankle Surg. 2013. Vol. 52. P. 588-593. DOI: 10.1053/j. jfas.2013.03.014
- The importance of the length of the first metatarsal and the proximal phalanx of hallux in the etiopathogeny of the hallux rigidus / A. Calvo, R. Viladot, J. Gine, F. Alvarez // Foot Ankle Surg. 2009. Vol. 15, No 2. P. 69-74. DOI: 10.1016/j.fas.2008.08.001
- Keiserman L., Sammarco J., Sammarco G.J. Surgical treatment of the hallux rigidus // Foot Ankle Clin. N. Am. 2005. Vol. 10. P. 75-96. DOI: 10.1016/j. fcl.2004.09.005
- Mid- and long-term results of the joint preserving therapy of hallux rigidus / H. Waizy, M.A. Czardybon, C. Stukenborg-Colsman, C. Wingenfeld, M. Wellmann, H. Windhagen, D. Frank // Arch. Orthop. Trauma Surg. 2010. Vol. 130, No 2. P. 165-170. DOI: 10.1007/s00402-009-0857-1
- Quantitative motion analysis in patients with hallux rigidus before and after cheilectomy / K. Canseco, J. Long, R. Marks, M.S. Khazzam, G. Harris // J. Orthop. Res. 2009. Vol. 27, No 1. P. 128-134. DOI: 10.1002/jor.20711
- Seibert N.R., Kadakia A.R. Surgical management of hallux rigidus: cheilectomy and osteotomy (phalanx and metatarsal) // Foot Ankle Clin. 2009. Vol. 14, No 1. P. 9-22. DOI: 10.1016/j.fcl.2008.11.002
- Prospective Assessment of Dorsal Cheilectomy for Hallux Rigidus Using a Patient-reported Outcome Score / T. Harrison, E. Fawzy, F. Dinah, S.H. Palmer // J. Foot Ankle Surg. 2010. Vol. 49, No 3. P. 232-237. DOI: 10.1053/j.jfas.2010.02.004
- Coughlin M.J., Shurnas P.S. Hallux rigidus. Grading and long-term results of operative treatment // J. Bone Joint Surg. Am. 2003. Vol. 85, No 11. P. 2072-2088. DOI: 10.2106/00004623-200311000-00003
- Peace R.A., Hamilton G.A. End-Stage Hallux Rigidus // Clin. Podiatr. Med. Surg. 2012. Vol. 29, No 3. P. 341-353. DOI: 10.1016/j.cpm.2012.04.002
- End-stage osteoarthritis of the great toe/hallux rigidus: a review of the alternatives to arthrodesis: implant versus osteotomies and arthroplasty techniques / A.D. Perler, V. Nwosu, D. Christie, K. Higgins // Clin. Podiatr. Med. Surg. 2013. Vol. 30, No 3. P. 351-395, DOI: 10.1016/j. cpm.2013.04.011
- Benthien J.P., Behrens P. Autologous matrix-induced chondrogenesis (AMIC): combining microfracturing and a collagen I/III matrix for articular cartilage resurfacing // Cartilage. 2010. Vol. 1, No 1. P. 65-68. DOI: 10.1177/1947603509360044
- Outcome of Autologous Matrix Induced Chondrogenesis (AMIC) in cartilage knee surgery: data of the AMIC Registry / J. Gille, P. Behrens, P. Volpi, L. de Girolamo, E. Reiss, W. Zoch, S. Anders // Arch. Orthop. Trauma Surg. 2013. Vol. 133, No 1. P. 87-93. DOI: 10.1007/s00402-012-1621-5
- Jannelli E., Fontana A. Arthroscopic treatment of chondral defects in the hip: AMIC, MACI, microfragmented adipose tissue transplantation (MATT) and other options // SICOT J. 2017. Vol. 3. P. 43. DOI: 10.1051/sicotj/2017029
- All-arthroscopic AMIC® (AT-AMIC®) technique with autologous bone graft for talar osteochondral defects: clinical and radiological results / F.G. Usuelli, R. D'Ambrosi, C. Maccario, M. Boga, L. de Girolamo // Knee Surg. Sports Traumatol. Arthrosc. 2018. Vol. 26, No 3. P. 875-881. DOI: 10.1007/s00167-016-4318-4
- Fontana A., De Girolamo L. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment // Bone Joint J. 2015. Vol. 97-B, No 5. P. 628-635. DOI: 10.1302/0301-620X.97B5.35076
- Использование хондропластики I плюснефалангового сустава по технике аутологичного индуцированного матрицей хондрогенеза для лечения пациентов с hallux rigidus: ближайшие результаты / М.Р. Нурмухаметов, М.А. Макаров, Е.И. Бялик, В.Е. Бялик, В.А. Нестеренко // Научно-практическая ревматология. 2020. Т. 58, № 1. С. 97-101. DOI: 10.14412/1995-4484-2020-97-101
- Хондропластика по технике аутологичного индуцированного матрицей хондрогенеза (AMIC) как новый метод хирургического лечении пациентов с hallux rigidus. Ближайшие и среднесрочные результаты / М.Р. Нурмухаметов, М.А. Макаров, С.А. Макаров, Е.И. Бялик, Я.Б. Хренников, В.Е. Бялик, В.А. Нестеренко // III Международный конгресс ассоциации ревмоортопедов : тез. докл. Воронеж : Научная книга, 2019. С. 85-87.
- Clinical rating systems for the ankle-hindfoot, midfoot, hallux and lesser toes / H.B. Kitaoka, I.J. Alexander, R.S. Adelaar, J.A. Nunley, M.S. Myerson, M. Sanders // Foot Ankle Int. 1994. Vol. 15, No 7. P. 349-353. DOI: 10.1177/107110079401500701
- Budiman-Mak E., Conrad K.J., Roach K.E. The Foot Function Index: a measure of foot pain and disability // J. Clin. Epidemiol. 1991. Vol. 44, No 6. P. 561-570. DOI: 10.1016/0895-4356(91)90220-4
- Pratt J. Remarks on Zeros and Ties in the Wilcoxon Signed Rank Procedures // Journal of the American Statistical Association. 1959. Vol. 54, No 287. P. 655-667. DOI: 10.2307/2282543
- Сидоренко Е.В. Методы математической обработки в психологии. СПб. : Речь, 2000. 350 с.
- A plantar-flexor-shortening osteotomy for hallux rigidus: a retrospective analysis / R. Derner, K. Goss, H.N. Postowski, N. Parsley // J. Foot Ankle Surg. 2005. Vol. 44, No 5. P. 377-389. DOI: 10.1053/j.jfas.2005.07.010
- Freeman B.L., Hardy M.A. Multiplanar phalangeal and metatarsal osteotomies for hallux rigidus // Clin. Podiatr. Med. Surg. 2011. Vol. 28, No 2. P. 329-344. DOI: 10.1016/j.cpm.2011.03.002
- Goucher N.R., Coughlin M.J. Hallux metatarsophalangeal joint arthrodesis using dome-shaped reamers and dorsal plate fixation: a prospective study // Foot Ankle Int. 2006. Vol. 27, No 11. P. 869-876. DOI: 10.1177/107110070602701101
- Bennett G.L., Sabetta J. First metatarsal phalangeal joint arthrodesis: evaluation of plate and screw fixation // Foot Ankle Int. 2009. Vol. 30, No 8. P. 752-757. DOI: 10.3113/ FAI.2009.0752
- Review of 107 hallux MTP joint arthrodesis using dome-shaped reamers and a stainless-steel dorsal plate / J.K. Ellington, C.P. Jones, B.E. Cohen, W.H. Davis, F. Nickisch, R.B. Anderson // Foot Ankle Int. 2010. Vol. 31, No 5. P. 385-390. DOI: 10.3113/FAI.2010.0385
- Хирургическое лечение перегрузочной метатарзалгии / Д.С. Бобров, Л.Ю. Слиняков, А.Г. Сухарева, М.Ю. Холодаев, Л.А. Якимов // Московский хирургический журнал. 2014. № 3 (37). С. 25-27.
- Foot function after fusion of the first metatarsophalangeal joint / D.J. van Doeselaar, P.J. Heesterbeek, J.W. Louwerens, B.A. Swierstra // Foot Ankle Int. 2010. Vol. 31, No 8. P. 670-675. DOI: 10.3113/FAI.2010.0670
- First metatarsophalangeal arthrodesis: a clinical, pedobarographic and gait analysis study / P.F. DeFrino, J.W. Brodsky, F.E. Pollo, S.J. Crenshaw, A.D. Beischer // Foot Ankle Int. 2002. Vol. 23, No 6. P. 496-502. DOI: 10.1177/107110070202300605
- Hallux rigidus: joint preserving alternatives to arthrodesis - a review of the literature / H. Polzer, S. Polzer, M. Brumann, W. Mutschler, M. Regauer // World J. Orthop. 2014. Vol. 5, No 1. P. 6-13. DOI: 10.5312/wjo.v5.i1.6
- Richter M., Zech S., Andreas Meissner S. Matrix-associated stem cell transplantation (MAST) in chondral defects of the 1st metatarsophalangeal joint is safe and effective - 2-year-follow-up in 20 patients // Foot Ankle Surg. 2017. Vol. 23, No 3. P. 195-200. DOI: 10.1016/j.fas.2016.05.318


