Применение технологий виртуальной реальности в остром периоде церебрального инсульта и их влияние на постинсультные аффективные нарушения
Автор: Маслюк О.А., Смоленцева И.Г., Амосова Н.А., Шевченко Н.С., Милагина В.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Неврология
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
Цель; изучение технологий виртуальной реальности в реабилитации больных с церебральным инсультом и их влияния на постинсультные аффективные нарушения. Материал и методы. В исследование включено 88 пациентов с ишемическим инсультом: 59 мужчин (67%) и 29 женщин (33%). Средний возраст пациентов составил 62,05±11,74 года. В основную группу исследования включены 46 пациентов, 44 пациента составили контрольную группу. Группы были сопоставимы по возрасту, срокам от начала заболевания, тяжести заболевания, степени выраженности двигательных, аффективных и когнитивных нарушений. В основной группе в дополнение к программе ранней реабилитации использовался индивидуальный тренинг с применением технологий виртуальной реальности (BTS NIRVANA). Тренинг проводился в течение 21 дня, 3 раза в неделю по 40 мин. Результаты. На фоне реабилитации в основной группе больных отмечалось более значимое уменьшение неврологического дефицита (р
Виртуальная реальность, инсульт, постинсультные аффективные нарушения, реабилитация
Короткий адрес: https://sciup.org/14918060
IDR: 14918060
Текст научной статьи Применение технологий виртуальной реальности в остром периоде церебрального инсульта и их влияние на постинсультные аффективные нарушения
1 Введение. Последствия церебрального инсульта приводят к снижению функциональной активности, инвалидизации пациентов, а также к социально-экономическим потерям [1]. Поэтому методы медицинской реабилитации, наряду с медикаментозной терапией, в настоящее время прочно заняли позиции приоритетного направления Российского здравоохранения. В последнее время все чаще стали применять в реабилитации роботизированные системы и инновационные технологии с биологической обратной связью. После перенесенного инсульта, кроме двигательного дефицита, развиваются когнитивные и аффективные нарушения, которые в половине случаев выходят на первый план и ухудшают реабилитационный прогноз и выживаемость. На нарушения в психической сфере пациентов, перенесших инсульт, обратили внимание еще 100 лет назад [2], хотя до последнего времени им не уделялось такого внимания. Последние десятилетия объектами исследований в основном были постинсультная деменция и депрессия, в то время как другие аффективные нарушения, такие, как тревога, патологическая утомляемость и апатия, были освещены лишь косвенно, и до настоящего времени остаются открытыми вопросы патогенеза и, соответственно, малоизвестны способы их лечения.
На наш взгляд, представляется интересным рассмотреть наиболее важные аффективные нарушения и немедикаментозные методы их коррекции. Постинсультная депрессия наблюдается в 18-61% [3]. Риск возникновения «тяжелого депрессивного эпизода» или «большой депрессии» согласно DSM–IV в течение следующих 18 месяцев после инсульта составляет от 20 до 79%. Частота развития депрессии зависит от сроков инсульта и максимальна в период от 3 до 6 месяцев от его начала, по данным одних авторов [4], однако, по данным Е. И. Гусева и др. [5], наибольшая частота депрессии (до 72,2%) выявлена именно у больных в позднем восстановительном периоде инсульта (от 7 месяцев до 1 года). Кроме того, в рамках аффективных расстройств большое значение имеет тревога, частота симптомов которой достигает 24-30% [6]. В более ранних работах тревога, обладая высокой коморбидностью с депрессией [7], рассматривалась в рамках понятия «тревожная депрессия» [8] и только позднее была выделена в самостоятельный синдром с временным ограничением более 6 месяцев согласно критериям (DSM–IV) [9]. Постинсультная тревога достоверно повышает риск развития депрессии, диссомнических расстройств и повторных нарушений мозгового кровообращения.
Постинсультная апатия как изолированный синдром встречается у каждого третьего пациента в среднем в 34,6% (от 25 до 40%) [10] и является гетерогенным синдромом, который характеризуется дефицитом целенаправленного поведения (goal-directed behaviour) с ослаблением как эмоционального, так и когнитивного компонента. В свою очередь, уже легкая степень апатии может привести к снижению когнитивного уровня, к депрессии, а также увеличить бремя коморбидных заболеваний на пациента и снизить повседневную активность, а следовательно, качество жизни. Патогенез постинсультной апатии достаточно сложен и, так же как и в случае с другими постинсультными аффективными нарушениями, его связь с очагом инсульта неоднозначна, а достоверность факторов риска, влияющих
на развитие апатии, пока не доказана. Специфическое лечение постинсультной апатии не разработано, в связи с чем существует необходимость в соответствующих контролируемых исследованиях. Патологическая утомляемость — симптом, который может наблюдаться при многих неврологических заболеваниях; например, в постинсультном периоде частота составляет 40-70% [11]. Если у пациента имеют место апатия, тревога или патологическая утомляемость, не связанные непосредственно с когнитивными нарушениями и/или депрессией, то применение немедикаментозных способов лечения (реабилитация) предпочтительнее, поскольку снижает полипрагмазию и уменьшает частоту побочных эффектов. Только в наиболее тяжелых случаях должен быть рассмотрен вопрос о фармакологической терапии. Таким образом, к стандарной мультидисци-плинарной реабилитации необходимо дополнение специальных методов реабилитации, таких, как технологии виртуальной реальности [12, 13], позволяющие безопасно корректировать последствия церебрального инсульта.
Виртуальная реальность (ВР) — это замещающая симуляция, созданная с помощью цифровых средств и имеющая обратную связь. Система ВР состоит из: устройства вывода визуальной, звуковой и тактильной информации, формирующей виртуальную среду; устройства ввода (трекеры, перчатки, мыши), которые считывают информацию о позиции и движениях пользователя; базы данных и программного обеспечение для создания и поддержания подробной и реалистичной модели виртуального мира [14].
Наибольшую популярность приобретают технологии с полным погружением и без дополнительных устройств распознавания движения, так как последние ограничивают объем движений и дают нагрузку за счет веса устройства ввода, вызывая преждевременную утомляемость пациента в процессе занятий.
Цель: изучение применения технологий виртуальной реальности и биологической обратной связи в реабилитации больных с церебральным инсультом и их влияния на постинсультные аффективные нарушения.
Материал и методы. В исследование было включено 88 пациентов с ишемическим инсультом (длительность наблюдения в остром периоде в среднем составила 20,09+1,21 дня). Из них 59 мужчин (67%), 29 женщин (33%). Пациенты были в возрасте от 29 до 87 лет, средний возраст составил 62,05±11,74 года. 48 (54,5%) пациентов перенесли ишемический инсульт в бассейне правой средней мозговой артерии, 26 (29,5%) пациентов — в бассейне левой средней мозговой артерии, 14 (16%) пациентов — в бассейне основной артерии. Среди патогенетических вариантов развития ишемического инсульта у 23 (26,1 %) пациентов наблюдался атеротромботический вариант, у 16 (18,2%) пациентов — кардиоэмболический вариант, у 34 (38,6%) пациентов лакунарные инсульты и у 17,1% — причины другой установленной этиологии, среди них венозные инсульты и спонтанные диссекции. В основную группу исследования включены 46 пациентов, 44 пациента составили контрольную группу. Группы были сопоставимы по возрасту, срокам от начала заболевания, тяжести заболевания, степени выраженности двигательных, аффективных и когнитивных нарушений. Средняя оценка по шкале NIHSS в основной группе составила 4,76±2,58 балла, а в контрольной группе 5,3±2,69 балла, т.е. большинство больных, были с легким и среднетяжелым двигательным дефицитом. Индекс активности Бартела в основной группе составил 76,54±7,86, а в контрольной группе 79,75±9,21, что позволяло использовать реабилитационные подходы без ограничений. Когнитивные нарушения выявлялись с помощью нейропсихологического исследования с использованием шкал: MMSE, монреальской шкалы когнитивных нарушений (MOCA), теста рисования часов, теста вербальной активности. Постинсультные аффективные нарушения оценивались по следующим шкалам: шкале депрессии Бека (BDI), госпитальной шкале оценки тревоги и депрессии (HADS), шкале оценки утомляемости (FAS), шкале оценки апатии (AES-С). У 79 пациентов выявлены симптомы тревоги и депрессии, у 47 пациентов — патологической утомляемости, у 69 пациентов наблюдалась легкая или умеренная апатия. Качество жизни всех пациентов оценивалось по визуально-аналоговой шкале EuroQul-5D, краткой рейтинговой шкале функциональных расстройств. В основной группе в дополнение к программе ранней реабилитации использовался индивидуальный тренинг с применением технологий виртуальной реальности и биологической обратной связью (безмаркер-ная интерактивная система виртуальной реальности BTS NIRVANA). Тренинг проводился в течение 21 дня, 3 раза в неделю по 40 мин. Эффективность тренинга оценивались на фоне реабилитации и через 3 месяца после окончания дополнительной реабилитационной программы.
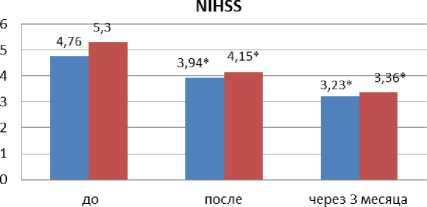
Результаты. На фоне реабилитации в основной группе больных отмечалось достоверное уменьшение неврологического дефицита по шкале NIHSS на 38,2% (p<0,05) vs. 22,7% (p<0,05) в контрольной группе (рис. 1).
На фоне реабилитации в основной группе достоверно улучшились нейродинамические и регуляторные когнитивные функции в субтестах MMSE и MOCA (p<0,05), увеличилась вербальная активность (p<0,01).
В основной группе на фоне реабилитации по шкале Бека статистически достоверно наблюдалось уменьшение симптомов депрессии c 14,45±3,38 балла до 10,82+5,57 балла, что составило 31,7% (p<0,05) vs. с 14,3+3,59 до 11,3+7,06 (20,9%) (p<0,05) в контрольной. По шкале HADS наблюдалось уменьшение симптомов депрессии c 12,12±1,8 баллав до 10,1±1,9 балла, что составило 16,66% (p<0,05) vs. с 12,2+1,4 до 11,9+1,6 (2,4%) в контрольной; тревоги с 13,05±2,1 балла до 10,64±2,4 балла, что составило 18,46% (p<0,05) vs. с 13,81+2,2 до 12,12+3,0 (12,23%) (p<0,05) в контрольной (рис. 2).
Увеличение мотивации и снижение выраженности симптомов апатии в основной группе пациентов на фоне реабилитации по шкале AES-C составило 13,78% (p<0,05) vs. 1,01% в контрольной. Показатели по шкале AES-C распределились следующим образом: поведенческие нарушения уменьшились на 1,79% в основной группе, а в контрольной остались без изменений, когнитивные уменьшились на 6,51 % vs. 2,9% в контрольной, эмоциональные уменьшились на 11,94% (p<0,05) в основной группе, а в контрольной отмечалось усиление симптомов апатии на 6,32% по сравнению с исходной оценкой. Следовательно, инициатива пациентов и мотивация на реабилитацию у больных в основной группе была выше, чем в контрольной (рис. 3).
На фоне реабилитации в основной группе пациентов не отмечалось различий между показателями патологической мышечной и психической утомляемости: оценка по шкале FAS снизилась на 13,32% (p<0,05) vs. 11,45% в контрольной группе (рис. 4).
■ основная группа ■ контрольная группа
Рис. 1. Оценка динамики неврологического дефицита на фоне реабилитации и через 3 месяца от начала заболевания по сравнению с контрольной группой. П римечание: * — p<0,05.
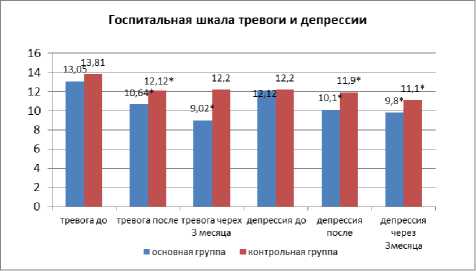
Рис. 2. Оценка динамики симптомов тревоги и депрессии на фоне реабилитации и через 3 месяца от начала заболевания по сравнению с контрольной группой. Примечание: * — p<0,05.
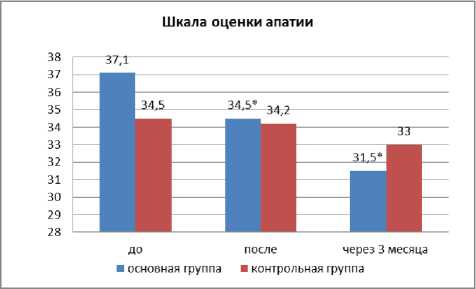
Рис. 3. Оценка динамики апатии на фоне реабилитации и через 3 месяца от начала заболевания по сравнению с контрольной группой. Примечание: * — p<0,05.
Через 3 месяца после инсульта на 19,43% (p<0,05) увеличился индекс повседневной активности Бартела в основной группе и на 11,8% (p<0,05) в контрольной группе, что говорит о более быстром функциональном восстановлении пациентов в группе с применением дополнительных методов реабилитации (рис. 5).
Через 3 месяца после реабилитации в основной группе не отмечалось возвращение симптомов депрессии к исходному уровню, тогда как в контрольной группе сохранялись симптомы апатии и утомляемости.
Показатели качества жизни через 3 месяца увеличились за счет мобильности в субтесте «помощь» краткой шкалы функциональных расстройств на 22,8% (p<0,05) в основной группе vs. 15,84% (p<0,01) в контрольной, в субтесте «степень тяжести» в ос-
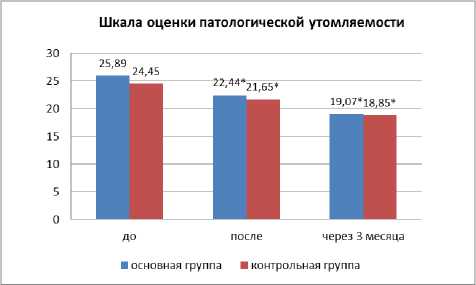
Рис. 4. Оценка динамики утомляемости на фоне реабилитации и через 3 месяца от начала заболевания по сравнению с контрольной группой. Примечание: * — p<0,05.
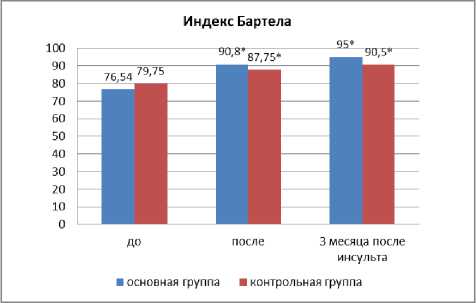
Рис. 5. Оценка повседневной активности по шкале Бартела на фоне реабилитации и через 3 месяца от начала заболевания по сравнению с контрольной группой. Примечание: * — p<0,05.
новной группе на 17,17% (p<0,05) vs. 13% (p<0,01) в контрольной.
Обсуждение. К настоящему моменту в реферируемых журналах опубликованы результаты рандомизированных исследований и метаанализа, по данным которых использование технологий виртуальной реальности — безопасный и достоверно эффективный метод улучшения мобильности, координации, устойчивости и функции верхней конечности у пациентов с церебральным инсультом и другими очаговыми поражениями головного мозга. Существенно меньше исследований, которые рассматривали бы этот метод реабилитации как способ немедикаментозной коррекции постинсульных аффективных нарушений. Согласно полученным данным использование виртуальной реальности в дополнение к стандартной программе реабилитации позволило более чем на 15% уменьшить симптомы депрессии и профилактически повлиять на них, уменьшив риск развития в отдаленном периоде инсульта, тогда как через 3 месяца в контрольной группе наблюдалась тенденция к утяжелению симптомов депрессии и «малые» депрессивные эпизоды. Симптомы тревоги также наблюдались реже в группе исследования, а через 3 месяца наблюдалась положительная динамика, на фоне которой показатели симптомов тревоги не вернулись к исходному уровню по сравнению с контрольной группой пациентов. Дополнение виртуальной реальности уменьшило симптомы апатии в остром периоде инсульта и позволило уменьшить риск возникновения симптомов через 3 месяца после инсульта. В контрольной группе на фоне стандартной реабилитации наблюдалась минимальная положительная динамика в блоках шкалы оценки апатии а через 3 месяца наблюдалось усиление апатии, за счет снижения показателей мотивации и инициативы. Мы не получили отрицательных результатов в оценке мышечной и психической утомляемости, несмотря на то что в группе исследования количество занятий с пациентами и общая продолжительность реабилитации были больше, а следовательно, и показатели утомляемость должны были увеличиться.
Заключение. Дополнение технологий виртуальной реальности к стандартной реабилитационной программе позволило эффективно воздействовать на постинсультные аффективные нарушения. На фоне реабилитации отмечалось достоверное уменьшение тяжести симптомов депрессии, главным образом за счет тревоги и апатии, что позволило увеличить повседневную активность и улучшить качество жизни.
Список литературы Применение технологий виртуальной реальности в остром периоде церебрального инсульта и их влияние на постинсультные аффективные нарушения
- Гусев Е.И., Скворцова В.И., Стаховская Л.В. Проблема инсульта в Российской Федерации: время активных совместных действий. Журнал неврологии и психиатрии 2007; (8): 4-10
- Kraepelin Е. Manic depressive insanity and paranoia. Edinburgh (GB): E&S Livingstone, 1921
- Carota A, Bogousslavsky J. Mood disorders after stroke. Front Neurol Neurosci 2012; 30: 70-4
- House A. Depression associated with stroke. J Neuropsy-chiatry Clin Neurosci 1996; 8: 453-457
- Гусев Е.И., Гехт А.Б., Боголепова A.H., Сорокина И.Б. Особенности депрессивного синдрома у больных, перенесших ишемический инсульт. Журнал неврологии и психиатрии. Прил. "Инсульт" 2001; (3): 28-31
- Sagen U, Vik TG, Mourn T, Morland T, Finset A, Dam-men T. Screening for anxiety and depression scale and the Montgomery and Asberg depression rating scale. J Psychosom Res 2009; 67 (4): 325-332
- Hirschfeld RM. The Comorbidity of Major Depression and Anxiety Disorders: Recognition and Management in Primary Care. Prim Care Companion J Clin Psychiatry 2001; 3 (6): 244-254
- Paykel ES. Classification of depressed patients: a cluster analysis derived grouping. Br J Psychiatr Mar 1971; 118 (554): 275-288
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. Forth Edition. 1994, p. 886
- Петрова E.A., Савина M.A., Георгиевская H.A., Шаклунова Н.В., Скворцова В. И. Постинсультные аффективные расстройства. Журнал неврологии и психиатрии 2011; (10): 12-17
- Staub F, Bogousslavsky J. Fatigue after stroke: a major but neglect issue. Cerebrovasc Dis 2001; 12: 75-81.
- Смоленцева И.Г., Амосова Н.А., Кривонос О.В., Маслюк О.А. Реабилитация больных с церебральным инсультом с использованием метода виртуальной реальности. Здоровье и образование: электрн. науч.-образ, вестник 2013; 15(12)
- Saposnik G, Levin М. Outcome Research Canada (SOR-Can) Working Group. Virtual reality in stroke rehabilitation: a me-ta-analysis and implications for clinicians. Stroke 2011 May; 42 (5): 1380-6
- Burdea G, Coiffet P. Virtual Reality Technology. 2nd edition with CD. Wiley, New Jersey, 2003.


