Принципы организации и технологии развития службы безопасности лекарств и фармаконадзора в Самарской области
Автор: Зарубина Елена Григорьевна, Бакчеева Раиса Филипповна, Родимова Марина Васильевна, Девяткин Анатолий Анатольевич
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 (3), 2011 года.
Бесплатный доступ
Значительные успехи в различных областях медицины, достигнутые за последние годы, во многом обязаны внедрению в медицинскую практику новых высокоэффективных лекарственных средств. Вместе с тем, большую тревогу вызывают все чаще появляющиеся сообщения об осложнениях лекарственной терапии. Однако врач сегодня не может работать без лекарств. Внедрение в его практику новых лекарственных препаратов способно в значительной мере продлить жизнь пациентам и обеспечить качество их жизни.
Фармаконадзор, лекарственное средство, биологически активные добавки, безопасность лекарств
Короткий адрес: https://sciup.org/14343982
IDR: 14343982
Текст научной статьи Принципы организации и технологии развития службы безопасности лекарств и фармаконадзора в Самарской области
Проблема безопасности лекарств в последнее время стала одной из актуальнейших проблем здравоохранения в мире. Это вызвано появлением множества лекарственных средств с высокой биологической активностью, возросшей сенсибилизацией людей к химическим и биологическим веществам, нерациональным применением лекарств, взаимодействием препаратов друг с другом и с биологически активными добавками, с использованием недоброкачественных препаратов. В результате у многих пациентов возникают тяжелые, подчас необратимые осложнения, возрастает число госпитализации и летальных исходов, вызванных лекарственной терапией.
Общеизвестно, что осложнения лекарственной терапии вышли на четвертое место среди причин смертности после сердечно-сосудистых заболеваний, травм и несчастных случаев, онкозаболеваний (Lazaran I. et al., 1998). В то же время процент госпитализации в связи с неблагоприятными побочными реакциями (НПР) составляет: Норвегия - 11,5 %, Франция – 13 %, Великобритания – 16 %. Кроме того, 15-20 % бюджета больниц расходуется на лечение больных с НПР и на контроль безопасности лекарственных средств (КБЛС) (Wite I. et al., 1999) .
Таких данных по России нет. Поэтому можно констатировать, что в России недостаточно ведется работа по выявлению, регистрации, научному анализу НПР, что сказывается на ограниченности КБЛС. В стране не налажена система сбора и обобщения информации по НПР и КБЛС, отсутствуют четкие рекомендации, а там, где они имеются, они не соблюдаются: использование лекарственных средств (ЛС) у беременных женщин, у детей, особенно младших возрастов. В геронтологии до сих пор не получило должной оценки явление полипрагмазии.
Научный международный и национальный опыт показывает, что такая ситуация приводит к существенному росту суммарного бремени общественных затрат как за счет чисто медицинских (повышения сроков госпитализации и нетрудоспособности), так и социальных (повышение процента инвалидности, снижение продолжительности жизни, повышение летальности и смертности) последствий от НПР и недостаточности контроля КБЛС. Все это привело к тому, что практически во всех развитых странах созданы и функционируют специальные службы по контролю безопасности лекарств (фармаконадзор).
Всемирная Организация Здравоохранения (ВОЗ) уделяет большое внимание этой чрезвычайно актуальной проблеме и проводит специальный проект «Создание и развитие фармаконадзора в странах СНГ», в том числе и в Российской Федерации. Российская Федерация в декабре 1997 года стала полноправным участником этой программы. Федеральный центр по изучению побочных действий лекарств Минздрава России начал активное сотрудничество с Центром ВОЗ, в базе данных которого имеется около 2 миллионов сообщений о неблагоприятных побочных действиях лекарств.
Условиями включения в международную Программу ВОЗ по мониторингу лекарств являются:
Наличие Национального Центра по контролю НПР, утвержденного МЗ РФ. Пути обмена информацией о нежелательных побочных действиях лекарств рассматриваются в схеме, изображенной на рис. 1.
Рис. 1. Пути обмена информацией о нежелательных побочных действиях лекарств
Рассмотренные выше статистические данные привели к необходимости создания pharmacovigilance (фармакобдительность, фармаконадзор) - системы контроля безопасности лекарств, которая включает в себя выявление, изучение, оценку и профилактику неблагоприятных побочных реакций.
Учитывая важность и масштаб проблемы лекарственных осложнений, во многих странах были приняты специальные законы о лекарственных средствах, которые, в частности, обязывают медицинских и фармацевтических работников, а также производителей лекарств сообщать в соответствующие государственные службы здравоохранения о выявленных и подозреваемых случаях НПР (Астахова А.В., Лепахин В.К., 2001). В 1998 г. в России был принят федеральный закон «О лекарственных средствах», статья 41. Субъекты обращения лекарственных средств обязаны сообщать... обо всех случаях побочных действий лекарственных средств и об особенностях взаимодействия лекарственных средств с другими лекарственны- ми средствами, которые не соответствуют сведениям о лекарственных средствах, содержащихся в инструкциях по их применению».
Структура контрольно-разрешительной системы нашей страны приведена на рис. 2.
Проблема лекарственной терапии осложняется еще тем, что сегодня очень важно определить, какими лекарствами надо пользоваться российскому врачу: инновационными препаратами или, как многие страны мира, воспроизведенными ЛС. Безусловно, наиболее приемлемо сочетанное применение оригинальных и дженериковых ЛС. Однако по словам члена-корреспондента РАМН, главного клинического фармаколога России Белоусова Ю.Б., на фармацевтическом рынке России сегодня реализуют свою продукцию 1500 дженериковых компаний, и в такой ситуации нельзя гарантировать качество ЛС и отсутствие их риска для больных, в то время как, например, на рынке США работают порядка 10 крупных производителей дженериков, но не возникает вопросов к качеству ЛС, так как крупная компания с большими продажами никогда не пойдет на то, чтобы сэкономить на качестве препарата и поставить под удар здоровье пациента, а, следовательно, свою репутацию.
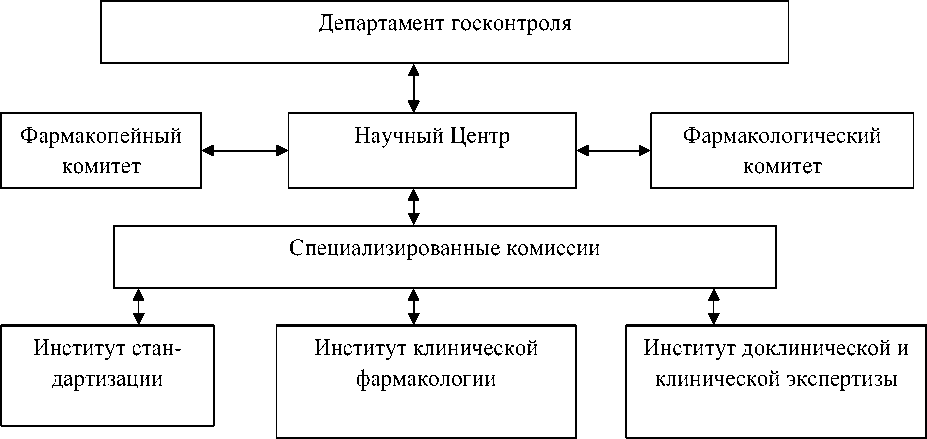
Рис. 2. Структура контрольно-разрешительной системы в РФ
Отечественный и зарубежный опыт, связанный с выявлением и изучением НПР, свидетельствует о том, что для повышения результативности в этой работе в стране с большой территорией и многомиллионным населением создание сети региональных центров является абсолютно необходимым. В настоящее время в России функционируют более 30 региональных центров по изучению неблагоприятных побочных действий лекарств. Самарский региональный центр начал работать с марта 2004 года на базе ООО «Информ-бюро». Основными задачами центра являются организация работы по выявлению и учету НПР на лекарственные препараты в регионе, анализ, систематизация, верификация сообщений о побочных реакциях, информирование медицинской общественности о побочных реакциях и о проблемах, связанных с лекарственными осложнениями. Несмотря на то, что изучение переносимости и выявление побочных реакций на новые препараты проводится на стадии доклинического и клинического изучения, истинное представление о переносимости препарата может быть по- лучено только в процессе их широкого применения на большом количестве больных. Особенности действия лекарственных препаратов у больных различных категорий (дети, беременные, лица старших возрастных групп, больные с поражением функций почек, печени), а также последствия взаимодействия лекарств выясняются, как правило, после регистрации лекарств и их многолетнего применения в реальной жизни. Поэтому необходим послереги-страционный мониторинг. Нежелательные побочные реакции могут возникать при приеме любых лекарственных препаратов и главная задача врача, провизора, фармацевта - раннее выявление и предупреждение этих реакций. При этом чем более наблюдательным и ответственным будет врач, тем меньше времени пройдет до открытия относительно редких негативных воздействий и принятия мер для их предупреждения, соответствующих дополнений в инструкции по применению лекарства, или вообще запрещения использования препарата в медицинской практике. Жизнь показала, что заставить врача сообщать о негативных эффектах лекарств не могут никакие законы и приказы. Здесь необходимы образование, убеждение, принципиальность, воспитание соответствующей культуры. Врач должен понимать свою ответственность не только перед конкретным больным, но и перед тысячами других пациентах, которые будут принимать препарат. Сообщая о побочных действиях лекарств, врач не должен бояться наказания за назначение препарата, ведь таково свойство всех лекарств - кроме терапевтического иметь побочные явления. Прежде всего, необходимо отметить, что врач не обязательно должен быть уверен в наличии причинно-следственной связи между приемом препарата и возникновением осложнения. Врач должен заполнить карту извещения о подозреваемой неблагоприятной реакции на лекарственное средство, разработанную и утвержденную Минздравом РФ. Сообщать следует в Центр:
-
1) обо всех подозрениях по новым лекарственным средствам (новыми считаются препараты в течение пяти лет после их регистрации);
-
2) о неожиданных реакциях на «старые» препараты;
-
3) о серьезных неблагоприятных эффектах на все препараты или при взаимодействии лекарственных средств;
-
4) о негативных влияниях на плод и новорожденных;
-
5) о неэффективности лекарственного препарата.
Напоминаем врачам и провизорам, что, согласно статье 41 Федерального закона «О лекарственных средствах», все медицинские работники обязаны сообщать о любых случаях побочных действий лекарств и об особенностях их взаимодействия, не соответствующих сведениям, содержащимся в инструкциях по применению, в региональный центр по контролю НПР в виде правильно заполненных карт извещений по адресу: 443 045 г. Самара, ул. Уссурийская 2а, «Самарский региональный центр по контролю побочных неблагоприятных действий лекарств» ООО «Информ-бюро».
Неблагоприятные побочные реакции - это вредные, нежелательные эффекты, которые возникают при использовании доз ЛС, рекомендованных для профилактики и лечения заболеваний (Белоусов Ю.Б., Леонова М.В., 2002). Механизмами развития неблагоприятных побочных реакций лекарственных средств являются: тератогенные эффекты, прямое токсическое действие препарата или его метаболита, аллергические реакции, канцерогенные эффекты, генетические нарушения.
Побочные реакции типа А («действие лекарства») связаны с токсичностью самого препарата или его метаболита, фармацевтическими, генетическими факторами, а также заболеваниями почек и печени, приводящими к изменениям фармакокинетики препарата и, как следствие этого, развитию нежелательных реакций. Они зависят от дозы ЛС, обычно предсказуемы, возникают довольно часто, большая часть побочных реакций выявляется до широкого применения препарата в клинической практике, большую часть побочных реакций можно избежать индивидуальным подбором доз. Для них характерна относительно низкая летальность.
Реакции типа В чаще всего являются реакциями аллергической природы, к этому типу относятся также некоторые генетически детерминированные реакции. Неблагоприятные побочные реакции типа В - это реакции гиперчувствительности, обычно связанные с иммунологическими или генетическими механизмами, они не зависят от дозы, непредсказуемы и возникают редко, обычно выявляются на стадии широкого применения, чаще серьезные, Для них характерна относительно высокая летальность.
Неблагоприятные побочные реакции типа С возникают при длительном использовании лекарственного вещества. Обычно они проявляются развитием толерантности, лекарственной зависимости, «эффектом отмены». Примеры побочных реакций типа С: «эффект отмены» - гипертензия после резкого прекращения приема «Празозина», тахикардия после отмены β-блокаторов; медленная нейролептическая дискинезия; пневмосклероз, вызванный «Бромокриптином», «Фенитоином», «Метотрексатом»; «обратная связь» при применении гормонов щитовидной железы, кортикостероидов; «ломка» при использовании опиоидов.
Реакции типа Д (отсроченные реакции) возникают через месяцы или годы после лечения. Неблагоприятные побочные реакции типа Д включают: канцерогенность, нарушение репродуктивной функции, тератогенность, мутагенные эффекты. Примерами побочных реакций типа Д являются синдром Крейцфильда - Якобса, проявляющийся годы спустя после инъекций экстракта гормона роста; аденокарцинома у дочерей женщин, принимавших «Ди-этилстильбэстрол» во время беременности; лимфоцитарная лейкемия при длительном использовании иммунодепрессантов.
К факторам, определяющим побочные реакции лекарственного вещества (зависящие от используемого вещества), относятся:
физико-химические и фармакокинетические характеристики:
-
а) эксципиенты (индифферентная составная часть лекарства);
-
б) биодоступность препарата;
доза, способ введения и длительность применения.
Факторами, определяющими побочные реакции лекарственного вещества (пациент и состояние здоровья), являются следующие: физиологические особенности (возраст, пол, беременность, недостаточность питания), патологические особенности (заболевания почек, печени, прочее), аллергический статус, генетическая предрасположенность.
К иным внешним факторам, определяющим побочные реакции лекарственного вещества, относятся: параллельное назначение иных лекарственных веществ (количество препарата, вид лекарства), загрязнение окружающей среды, употребление алкоголя, курение.
На возникновение НПР также оказывают влияние физиологические показатели, изменяющиеся с возрастом: концентрация альбуминов в плазме, объем мышечной массы, объем жидкости в организме, сердечный выброс, функция почек, активность энзимов в печени, двигательная активность ЖКТ.
Неблагоприятные побочные реакции могут быть ожидаемые и неожиданные, серьезные и несерьезные. Неожиданная неблагоприятная побочная реакция - это реакция, сведения о природе и тяжести которой отсутствуют в брошюре исследователя или инструкции по применению препарата и ее не ожидают, исходя из существующих знаний о свойствах препарата, т.е. речь идет о неизвестной реакции на препарат (Фармаконадзор, 2000).
Серьезные неблагоприятные побочные реакции составляют угрозу жизни, приводят к смерти, приводят к потере работоспособности, требуют удлинения срока или длительной госпитализации, вызывают возникновение опухоли и врожденные аномалии, могут быть следствием передозировки.
Несерьезные неблагоприятные побочные реакции определяются как любая из побочных реакций, которая не отвечает критериям серьезной побочной реакции. Различие между серьезными и тяжелыми неблагоприятными побочными реакциями состоит в том, что в случае серьезных НПР предполагается значительный вред или ущерб для больного вследствие развития состояний, предусмотренных определением «серьезной побочной реакции». А в случае тяжелых НПР предполагается степень выраженности побочных явлений.
НПР могут возникать также в результате различных вариантов фальсификации лекарств. К методам выявления и изучения НПР относятся: исследования на животных, клинические испытания, эпидемиологические методы (спонтанные сообщения, постмаркетинговые исследования, интенсивные стационарные исследования и др.). Тем не менее, наиболее доступным и распространенным методом являются спонтанные сообщения, поступающие от врачей ЛПУ, которые заполняют специально разработанную и утвержденную МЗ РФ карту-извещение.


