Приоритезация генов нейронального апоптоза по их структурной роли в ассоциативной генной сети нарушений аутического спектра с помощью подходов ANDSystem
Автор: Лаврик И.Н., Иванисенко В.А., Деменков П.С., Сайк О.В., Янкина М.А.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Биологические науки
Статья в выпуске: 9 (12), 2017 года.
Бесплатный доступ
Нарушения аутистического спектра (НАС) по оценкам эпидемиологических исследований могут поражать до 1% населения в мире. НАС сопровождается проблемами в социальной коммуникации, наличием ограниченных интересов, стереотипного и повторяющегося поведения. К числу важных факторов патогенеза НАС относится нейрональный апоптоз. В данной работе проведена приоритезация генов, вовлеченных в биологический процесс Gene Ontology нейрональный апоптоз, по их потенциальной важности для патогенеза НАС. Были использованы стандартные методы приоритезации ToppGene и Endeavor, а также подходы, реализованные в системе ANDSystem, учитывающие структуру генной сети НАС. Анализ показал, что наиболее перспективными для дальнейшего исследования в экспериментах по генотипированию могут быть гены GRIN1, NTRK2, GRIK5, PTK2B, CTNNB1 и ADORA2A.
Нейрональный апоптоз, нарушения аутистического спектра (нас), ассоциативные генные сети, приоритезация генов, гены-кандидаты
Короткий адрес: https://sciup.org/170190348
IDR: 170190348
Текст научной статьи Приоритезация генов нейронального апоптоза по их структурной роли в ассоциативной генной сети нарушений аутического спектра с помощью подходов ANDSystem
НАС [3]. Исследования показывают, что одним из важных факторов патогенеза НАС выступает нейрональный апоптоз [46].
Нейрональный апоптоз является одной из форм клеточной гибели и характеризуется блеббингом и потерей асимметрии плазматической мембраны, конденсацией хроматина и расщеплением ДНК. Во время эмбрионального развития этот процесс является критическим для обеспечения элиминации избыточного числа нейронов [7]. При ряде заболеваний, таких как болезнь Альцгеймера, эпилепсия, судорожные расстройства, нейротравмы и др. наблюдаются нарушения нейронального апоптоза [810].
Целью данной работы была приоритезация генов нейронального апоптоза по их потенциальной важности для НАС с помощью стандартных методов ToppGene [11] и Endeavor [12], а также критериев специфичности и центральности, реализованных в разработанной нами ранее системе ANDSystem [13, 14]. Критерии специфичности и центральности ANDSystem позволяют учитывать структуру генной сети НАС. На основе проведенного анализа были выявлены новые гены-кандидаты, перспективные для дальнейшего исследования в экспериментах по генотипированию.
Материалы и методы
Список генов, ассоциированных с НАС, был экстрагирован из базы данных MalaCards [15] по запросу «Autism Spectrum Disorder». Список генов нейронального апоптоза был экстрагирован из базы данных AmiGO 2 [16] по запросу «neuron apoptotic process» (GO:0051402).
Ассоциативные генные сети были реконструированы с помощью системы ANDSystem [13, 14]. Система ANDSystem позволяет строить сети молекулярногенетических взаимодействий между генами, белками, микроРНК, метаболитами и другими биологическими объектами в норме и при различных заболеваниях [1725].
Для приоритезации использовались программы ToppGene [11] и Endeavour version: 3.71 [12]. На вход программам подавался тренировочный и тестовый наборы генов. Тренировочный набор включал гены, ассоциированные с НАС, за исключением генов, одновременно ассоциированных с НАС и входящих в нейрональный апоптоз. Тестовый набор включал все гены нейронального апоптоза. Настройки программ использовались по умолчанию. Для ранжирования генов использовались ранги, рассчитываемые программами ToppGene и Endeavour.
Приоритезация с помощью системы ANDSystem проводилась по двум показателям: центральности CTC (cross-talk centrality) и специфичности CTS (cross-talk specificity), которые были рассчитаны с помощью функции “Intelligent Filtration”, реализованной в программе “ANDVisio” системы ANDSystem. Для расчета центральности CTC использовалась формула: CTCi=Ni/M, где Ni – число связей i-го гена с участниками ассоциативной генной сети НАС, в глобальной сети (базе знаний) системы ANDSystem; M – число участников (вершин) ассоциативной генной сети НАС. Специфичность CTS рассчитывалась как CTSi=Ni/Ki, где Ki – общее число связей i-го гена в глобальной сети (базе знаний) ANDSystem. Гены ранжировались согласно убыванию показателей центральности CTC и специфичности CTS. Наименьшее значение ранга (наибольший приоритет гена) соответствовало наибольшему показателю центральности CTC (специфичности CTS).
Средний ранг рассчитывался как среднее арифметическое значение четырех рангов критериев ToppGene, Endeavor, центральность CTC и специфичность CTS.
Обогащенность списка наиболее приоритетных генов генами, ассоциированными с НАС, оценивалась согласно гипергеометрическому распределению с помощью веб-ресурса GeneProf .
Анализ перепредставленности участниками биологических процессов для наборов генов проводился с помощью системы DAVID 6.8 [26], p-value с поправкой Бенджамини—Хохберга на множественность сравнений менее 0.05.
Результаты и обсуждение
В настоящей работе рассматривался список из 98 генов, ассоциированных с НАС согласно информации из базы данных Malacards [15]. С помощью системы ANDSystem [13, 14] между этими генами и их продуктами была реконструирована ассоциативная генная сеть НАС. Из 98 генов 40 оказались не связанными в ассоциативной генной сети НАС. Между остальными 58 генами/белками было найдено 377 взаимодействий, включая 248 ассоциативных связей, 58 связей типа «экспрессия гена», 53 белок-белок взаимодействия и 18 регуляторных связей (см. рисунок).
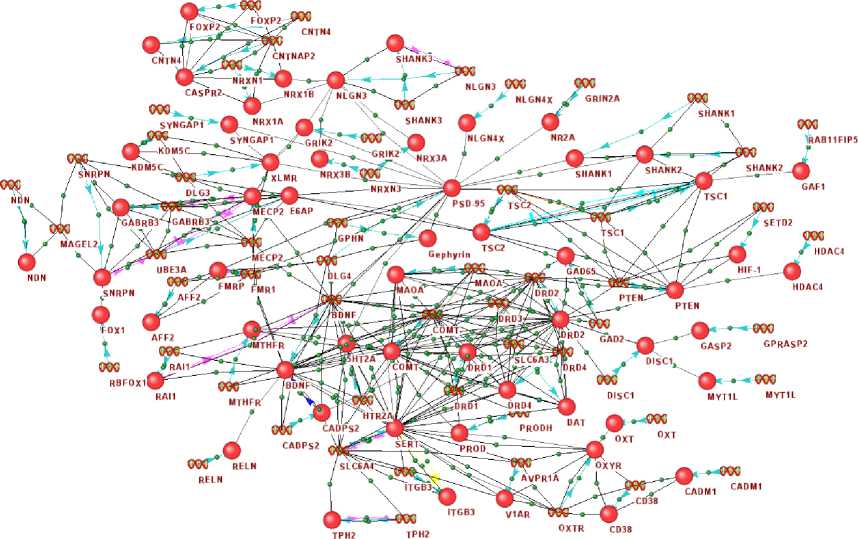
Рисунок 1. Ассоциативная генная сеть НАС, реконструированная с помощью системы ANDSystem
На основании информации из базы данных AmiGO 2 [16] был сформирован список из 218 генов, вовлеченных в нейрональный апоптоз. Оказалось, что из них 11 генов (ADNP, BDNF, DLX1, EN2, GABRA5, GABRB3, GRIK2, HDAC4, MECP2, SCN2A и SYNGAP1) входят в ассоциативную генную сеть НАС. Эти гены принимают участие в различных биологических процессах. Например, гены ADNP, BDNF и MECP2 участвуют в биологических процессах Gene Ontology, отвечающих за процессы, связанные с формирова- нием памяти; BDNF, DLX1, EN2, GABRA5, GABRB3, HDAC4, MECP2 и SYNGAP1 – в развитии нервной системы и структур мозга; GRIK2 – в механизмах ответа на страх; SCN2A – в миелинизации и др.
Приоритезация генов нейронального апоптоза проводилась с помощью стандартных методов ToppGene [11] и Endeavor [12], а также показателей центральности CTC и специфичности CTS системы ANDSystem. Список 10 наиболее приоритетных генов приведен в таблице.
Таблица 1. Наиболее приоритетные гены нейронального апоптоза, выявленные соглас- но четырем критериям (ToppGene, Endeavor, центральность CTC и специфичность CTS)
|
Ген |
GeneId |
Ранг ToppGene |
Ранг Endevaour |
Ранг CTC |
Ранг CTS |
Средний ранг |
|
GRIN1 |
2902 |
2 |
1 |
4,5 |
8 |
3,875 |
|
GABRB3* |
2562 |
1 |
4 |
22,5 |
2 |
7,375 |
|
NTRK2 |
4915 |
6 |
2 |
22,5 |
17 |
11,875 |
|
BDNF* |
627 |
8 |
26 |
2 |
19 |
13,75 |
|
GRIK2* |
2898 |
3 |
3 |
56,5 |
7 |
17,375 |
|
MECP2* |
4204 |
20 |
7 |
22,5 |
26 |
18,875 |
|
GRIK5 |
2901 |
11 |
6 |
56,5 |
9 |
20,625 |
|
PTK2B |
2185 |
13 |
38 |
15 |
27 |
23,25 |
|
CTNNB1 |
1499 |
34 |
30 |
3 |
38 |
26,25 |
|
ADORA2A |
135 |
18 |
11 |
56,5 |
20 |
26,375 |
|
TP53# |
7157 |
77 |
27 |
1 |
80 |
46,25 |
|
TFAP2B# |
7021 |
65 |
141 |
56,5 |
1 |
65,875 |
Примечание: * гены, ассоциированные с НАС; # гены, не входящие в список из 10 наиболее приоритетных по среднему рангу, но обладающие наилучшим рангом по отдельно взятым критериям центральность CTC и специфичность CTS.
Оказалось, что в числе 10 наиболее приоритетных генов нейронального апоптоза статистически значимо перепредстав-лены гены (BDNF, GABRB3, GRIK2, MECP2), ассоциированные с НАС, (p-value< 0.001). Наиболее интересными для дальнейшего изучения являются шесть генов (GRIN1, NTRK2, GRIK5, PTK2B, CTNNB1, ADORA2A), которые оказались в числе 10 наиболее приоритетных и не были ассоциированы с НАС по данным MalaCards. Анализ сверхпредставленности биологических процессов DAVID показал, что эти гены преимущественно вовлечены в отрицательную регуляцию нейронального апоптоза (GO:0043524), глутаматерги-ческий синаптическую передачу сигнала (GO:0035235, GO:0035249) и появление возбуждающего постсинаптического потенциала (GO:0060079). Анализ литературы показал, что для генов GRIN1, NTRK2, PTK2B, CTNNB1 и ADORA2A уже есть сведения о возможной взаимосвязи мутаций в этих генах с НАС [27-31]. Для гена GRIK5 данных об ассоциации с НАС в системе PubMed найти не удалось. Этот ген кодирует рецептор глутамата и вовлечен в синаптическую передачу [32]. Мута- ции в гене GRIK5 ассоциированы с шизофренией [33].
Гены TP53 и TFAP2B не попали в список из 10 наиболее приоритетных по среднему рангу, но имели первый ранг по отдельно взятым критериям центральность CTC и специфичность CTS, соответственно. Ген TP53 является супрессором опухолей и вовлечен в регуляцию клеточного цикла [34]. Ген TFAP2B кодирует сайт-специфичный ДНК-связывающий белок, который участвует в широком спектре важных биологических процессов, включая развитие глаз, лица, тела, конечностей, почечного эпителия и нервной трубки [35]. Дальнейшее изучение этих генов может быть интересным для выявления молекулярно-генетических механизмов патогенеза НАС.
Заключение
Анализ приоритезации генов нейронального апоптоза с учетом их структурной роли в генной сети НАС, проведенной с помощью методов ToppGene, Endeavor и ANDSystem, позволил выявить шесть генов (GRIN1, NTRK2, GRIK5, PTK2B,
CTNNB1, ADORA2A), наиболее перспективных для их дальнейшего экспериментального изучения в патогенезе НАС.
Список литературы Приоритезация генов нейронального апоптоза по их структурной роли в ассоциативной генной сети нарушений аутического спектра с помощью подходов ANDSystem
- Grice D. E., Buxbaum J. D. The genetics of autism spectrum disorders//Neuromolecular medicine. -2006. -Т. 8. -№4. -С. 451-460.
- Developmental D. M. N. S. Y. et al. Prevalence of autism spectrum disorder among children aged 8 years-autism and developmental disabilities monitoring network, 11 sites, United States, 2010//Morbidity and mortality weekly report. Surveillance summaries (Washington, DC: 2002). -2014. -Т. 63. -№2. -С. 1.
- Bourgeron T. From the genetic architecture to synaptic plasticity in autism spectrum disorder//Nature Reviews. Neuroscience. -2015. -Т. 16. -№9. -С. 551.
- Ghanizadeh A. Targeting neurotensin as a potential novel approach for the treatment of autism//Journal of neuroinflammation. -2010. -Т. 7. -№1. -С. 58.
- Malik M., Sheikh A. M., Wen G., Spivack W., Brown W. T., Li X. Expression of inflammatory cytokines, Bcl2 and cathepsin D are altered in lymphoblasts of autistic subjects//Immunobiology. -2011. -Т. 216. -№1. -С. 80-85.


