Прямая невротизация анального неосфинктера как способ улучшения его функциональной морфологии
Автор: Бацаленко Н.П., Решетов И.В.
Журнал: Хирургическая практика @spractice
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
В настоящее время существует множество методик по устранению каловой инконтиненции. Используя материал мышц тазового дна, удается физически воссоздать неосфинктер, но его функциональные возможность не всегда соответствуют потребностям больного. Использование микрохирургической техники в реконструктивной хирургии привело к появлению новых методик, к которым относят невротизацию мышцы.
Неосфинктер, невротизация, функция, хирургия, практика
Короткий адрес: https://sciup.org/142221871
IDR: 142221871 | УДК: 159.9.07 | DOI: 10.17238/issn2223-2427.2019.1.38-44
Текст научной статьи Прямая невротизация анального неосфинктера как способ улучшения его функциональной морфологии
Недержание кишечного содержимого – тяжелое заболевание, которое ведет к инвалидизации больного, исключая его из активной трудовой деятельности и общественной жизни, ставит в сложные взаимоотношения с окружающими, снижает уровень социальной активности [1,7,8]. У взрослого населения она может встречаться на фоне закрытия дефектов у пациентов, перенесших экстирпацию прямой кишки и удаление запирательного аппарата, у пациентов с травмами и ранениями прямой кишки. У детей причиной данного заболевания могут быть пороки аноректального развития [9]. Прямая невротизация мышцы впервые была описана Хейни-ке более века назад, который имплантировал центральный конец добавочного нерва спины в парализованную трапециевидную мышцу [4,5]. Стендлер и Эльсберг, проводя эксперименты на собаках, доказали, что имплантированные в денервированную мышцу нервы образуют соединения, которые приводят к мышечной реиннервации и восстановле-
-
a E-mail: morbus007@mail.ru
-
b E-mail: 2487784@mail.ru
нию двигательной активности через восемь недель [4,5,11]. В клинической практике невротизацию используют при реконструктивных операциях на плечевом сплетении и лице, а также для восстановления чувствительности при реконструкции молочной железы [3-6,10].
Для стимуляции посттравматической регенерации нервных стволов перспективным представляется применение нейрональных факторов роста (нейротрофинов) [12-14]
Обобщая изложенное выше, можно предположить, что выполнение прямой невротизации мышцы при проведении пластики запирательного аппарата, в том числе с использованием нейротрофинов, является перспективным направлением хирургии.
Настоящее экспериментальное исследование было проведено с целью оценки функциональной морфологии сформированного неосфинктера в зависимости от того, проводилась ли невротизация и использовались ли для этого нейротро-фины.
Материалы и методы
Настоящее исследование одобрено Локальным комитетом по этике ФГБАУ ВО Первого МГМУ им И.М. Сеченова (протокол № 10-18 от 05.12.2018).
Экспериментальные исследования проводились на 18 самцах крыс линии Wistar средним весом 350 г и возрастом 4-6 месяцев. Во время проведения эксперимента было выделено 3 группы животных:
-
1. Группа крыс, которым выполнялась пластика запирательного аппарата прямой кишки без прямой невротизации мышцы
-
2. Группа крыс, которым выполнялась пластика запирательного аппарата прямой кишки с прямой невротизацией мышцы
-
3. Группа крыс, которым выполнялась пластика запирательного аппарата прямой кишки с прямой невротизацией мышцы и созданием градиента нейротрофинов
Все оперативные вмешательства проводились под общим наркозом препаратом «Золетил-100» (0,1мл на 1 кг тела внутрибрюшинно). Профилактика инфекций проводилась с помощью препарата «Байтрил» (0,1 мл в течение 5 дней внутримышечно).
Первой группе живаотных выполнялась пластика запирательного аппарата прямой кишки без прямой невротизации мышцы.
Под общей анестезией препаратом Золетил-100 выполнен линейный разрез, длинной около 7 см, по срединной линии дорзальной поверхности крысы. С обеих сторон выделена длинная мышца, отводящая хвост. Контроль гемостаза. С целью профилактики циркуляторных нарушений мышцы с обеих сторон накрыты салфетками с тёплым физраствором.
Двумя окаймляющими разрезами выделен и полностью иссечен сфинктер прямой кишки с удалением её участка на расстоянии 1,5 см от уровня кожи. Прямая кишка низведена, подшита к окружающим тканям
Длинная мышца, отводящая хвост, с обеих сторон отсечена от места крепления к хвосту, взята на швы-держалки. Через сформированный с обеих сторон канал, по средствам тоннелёра, длинная мышца, отводящая хвост, низведена к прямой кишке. Концы длинной мышцы, отводящей хвост, фиксированы друг другу, подшиты к прямой кишке по типу окаймляющей манжеты. Сформирован неосфинктер. Послойный шов раны.
Второй группе животных выполнялась пластика запирательного аппарата прямой кишки с прямой невротизацией мышцы.
Под общей анестезией препаратом Золетил-100 выполнен линейный разрез, длинной около 7 см, по срединной линии дорзальной поверхности крысы. С обеих сторон выделена и денервирована длинная мышца, отводящая хвост. Контроль гемостаза. С целью профилактики циркуляторных нарушений мышцы с обеих сторон накрыты салфетками с тёплым физраствором.
Двумя окаймляющими разрезами выделен и полностью иссечен сфинктер прямой кишки с удалением её участка на расстоянии 1,5 см от уровня кожи. Прямая кишка низведена, подшита к окружающим тканям
Длинная мышца, отводящая хвост, с обеих сторон отсечена от места крепления к хвосту, взята на швы-держалки. Через сформированный с обеих сторон канал, по средствам тоннелёра, длинная мышца, отводящая хвост, низведена к прямой кишке. Концы длинной мышцы, отводящей хвост, фиксированы друг другу, подшиты к прямой кишке по типу окаймляющей манжеты. Сформирован неосфинктер.
Со стороны левой длинной мышцы, отводящей хвост, в проекции крыла подвздошной кости выделен седалищный нерв. Основываясь на анатомических ориентирах, а так же, на сокращении мышц тазового дна, выделена ветвь промежностного нерва. На расстоянии 1,5 см от седалищного нерва ветвь промежностного нерва отсечена. Выполнена прямая невротизация мышцы: культя ветви промежностного нерва разделена на фасцикулы, выполнено введение культи ветви промежностного нерва в толщу длинной мышцы, отводящей хвост на глубину 1\3, нерв фиксирован к мышце Викрилом 10\0. Неразделенная часть ветви промежностного нерва укрыта в виде манжеты основанием длинной мышцы, отводящей хвост. Послойный шов раны.
Третьей группе животных выполнялась пластика запирательного аппарата прямой кишки с прямой невротизацией мышцы и созданием градиента нейротрофинов
Под общей анестезией препаратом Золетил-100 выполнен линейный разрез, длинной около 7 см, по срединной линии дорзальной поверхности крысы. С обеих сторон выделена и денервирована длинная мышца, отводящая хвост. Контроль гемостаза. С целью профилактики циркуляторных нарушений мышцы с обеих сторон накрыты салфетками с тёплым физраствором.
Двумя окаймляющими разрезами выделен и полностью иссечен сфинктер прямой кишки с удалением её участка на расстоянии 1,5 см от уровня кожи. Прямая кишка низведена, подшита к окружающим тканям
Длинная мышца, отводящая хвост, с обеих сторон отсечена от места крепления к хвосту, взята на швы-держалки. Через сформированный с обеих сторон канал, по средствам тоннелёра, длинная мышца, отводящая хвост, низведена к прямой кишке. Концы длинной мышцы, отводящей хвост, фиксированы друг другу, подшиты к прямой кишке по типу окаймляющей манжеты. Сформирован неосфинктер.
Со стороны левой длинной мышцы, отводящей хвост, в проекции крыла подвздошной кости выделен седалищный нерв. Основываясь на анатомических ориентирах, а так же, на сокращении мышц тазового дна, выделена ветвь промежностного нерва. На расстоянии 1,5 см от седалищного нерва ветвь промежностного нерва отсечена. Выполнена прямая невротизация мышцы: культя ветви промежностного нерва разделена на фасцикулы, выполнено введение культи ветви промежностного нерва в толщу длинной мышцы, отводящей хвост на глубину 1\3, нерв фиксирован к мышце Викрилом 10\0. Неразделенная часть ветви промежностного нерва укрыта в виде манжеты основанием длинной мышцы, отводящей хвост.
Далее от места проведенной прямой невротизации мышцы, в направлении сформированного неосфинктера выполнено создание градиента нейротрофинов непосредственно в длинной мышце, отводящей хвост с увеличением концентрации нейротрофинов при удалении от места невротизации к сформированному неосфинктеру.
Для улучшения прямой невротизации мышцы применяли гелеобразный раствор нейротрофинов в плюронике, который в диапазоне температур до +25 °С имеет свойства жидкости, а выше свойства геля, что позволяет ему оставаться продолжительное время в тканях. Раствор готовили следующим образом: стерильную навеску плюроника F-127 (Thermo Fisher) растворяли в физ. растворе в концентрации 27% при +4 °С в течении суток. После чего вносили ней-ротрофины NGF, NT-3, EGF, BDNF, GDNF, SDF-1a, ILGF-II (Thermo Fisher) и перемешивали еще 2 часа при +4 °С.. Градиент нейротрофинов создали путем разбавления исходного раствора в 5 и 10 раз. Затем раствор отбирали в инсулиновые шприцы и замораживали при -20 ˚С на срок не более 3 недель. Шприцы с нейротрофинами размораживали при +4 °C непосредственно перед операциями, с целью избежать разрушения нейротрофинов. Во время операции растворы в трех концентрациях вводилась в мышцу по градиенту роста нерва с минимальной концентрацией у места иннервации.
Введение нейротрофинов осуществлено в трех концентрациях: малая, средняя, большая, в соответствующей последовательности в объеме не более 0,1 мл каждого типа. После создания градиента нейротрофинов выполнен послойный шов раны.
Животные содержались в стандартных условиях вивария с режимом день/ночь 12/12, со свободным доступом к воде и пище.
Через 90 дней после операции у животных был забран биоматериал для гистологического исследования: длинная мышца, отводящая хвост, с левой (на ней была выполнена невротизация и градиент нейротрофином во второй и третьей экспериментальных группах) и правой стороны, сформированный неосфинктер и фрагменты ветви промежностного нерва слева (у животных из второй и третьей экспериментальных групп).
Образцы тканей фиксировали в 10% нейтральном забу-ференном формалине в течение 24 часов и пропускали через стандартный протокол проводки для гистологического обследования. Препараты были залиты в парафиновые блоки.
Препараты окрасили гематоксилином-эозином. Для им-мунофлуоресцентного исследования образцы депарафини- ровали и проводили демаскировку антигена в Трис-ЭДТА буфере pH 10.0 (abcam), блокировали не специфическое связывание антител 5% раствором бычьего сывороточного альбумина (БСА) в фосфатном солевом буфере (ФБС) с добавлением 0.05% детергента Твин-20. Препараты окрашивали первичными моноклональными мышиными антителами к b3-тубулину (Thermo Fisher) и кроличьими поликлональными антителами к синаптотагмину (Sigma), отмывали в ФБС буфере и антиген детектировали при помощи конъюгированных вторичных козьих антител против мыши, меченными флуоресцентной меткой Alexa 488 (Thermo Fisher) и козьих антител против кролика меченными Alexa 594 (Thermo Fisher). Стекла отмывали, ядра прокрашивали DAPI (Thermo Fisher) и заключали под покровное стекло в 80% глицерин в ФБС.
Затем препараты были изучены и описаны двумя опытными патологоанатомами независимо друг от друга. Патологоанатомы не имели сведений о принадлежности гистологических препаратов к экспериментальным группам. Микроскопическое исследование препаратов проводили на универсальном микроскопе LEICA DM4000 B LED с камерой LEICA DFC7000 T, с использованием компьютера с программным обеспечением LAS V4.8 software (Leica Microsystems, Switzerland).
Морфометрическое исследование гистологических препаратов проводили на увеличении ×200 с помощью описанного выше микроскопа с программным обеспечением. Для получения статистически достоверных результатов каждый препарат фотографировали в 10 случайно отобранных участках (размер поля зрения 623 × 467 мкм). На каждом изображении сформированного неосфинктера измеряли толщину слизистой оболочки толстой кишки и толщину прилежащего эпидермиса, в мышцах измеряли суммарную площадь их пучков в процентах от площади поля зрения, а также – их минимальный и максимальный диаметры.
Статистический анализ данных исследований был проведен на GraphPad Prism версии 8.00 для Windows (GraphPad Software, Inc.). Межгрупповые различия были оценены однофакторным дисперсионным анализом с поправкой Тьюки (исследование толщин) и двухфакторным дисперсионным анализом с поправкой Сидака (исследование площади мышечной ткани). Результаты представлены в виде столбиковых графиков со средними значениями и SEM. Уровень статистической значимости был принят р < 0,05.
Результаты
У всех животных первой группы, которым проводилась пластика запирательного аппарата без прямой невротизации мышцы, в области сформированного неосфинктера, определялся стык между слизистой оболочкой толстой кишки и эпидермисом кожи (рис. 1а). В области стыка отмечалась эрозивные и язвенные дефекты, окруженные выраженной полиморфноклеточной (лимфоциты, макрофаги, нейтрофилы, плазмоциты) инфильтрацией подлежащей ткани. Эпителий слизистой толстой кишки был преимущественно регенераторного типа, с немногочисленными бокаловидными клетками. Эпидермис прилежащих к сформированному неосфинктеру кожных покровов был несколько утолщен, незрелый, местами отмечался акантоз.
Правые и левые мышцы были представлены тканью с тонкими фиброваскулярными прослойками (рис. 1 б, в). Их строение не отличалось между собой.
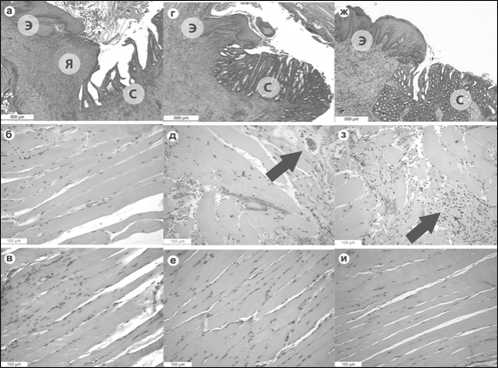
Рис.1. Гистологические препараты неосфинктера. Группа экспериментальных животных 1 (а-в), 2 (г-е) и 3 (ж-и): а, г, ж – фрагменты неосфинктера: в каждом из препаратов виден стык между слизистой оболочкой толстой кишки (С) и эпидермисом (Э), в группе 1 в этом месте определяется язвенный дефект (Я) (рис. а); окраска гематоксилином и эозином, ×50; б, д, з – левые мышцы, в, е, и – правые мышцы: в группах 2 и 3 диаметр мышечных волокон в составе левых мышц местами превышает 100 мкм, в отличие от правых, также видны нервные стволики (обозначены стрелками), окраска гематоксилином и эозином, ×200.
У всех экспериментальных животных второй группы, которым была проведена пластика запирательного аппарата прямой кишки с выполнением прямой невротизации мышцы без создания градиента нейротрофинов, признаки воспаления в области стыка эпидермиса и слизистой прямой кишки были несколько меньше, чем в первой группе экспериментальных животных, эрозивные и язвенные дефекты отсутствовали, а эпителий слизистой и эпидермис характеризовались несколько большей степенью зрелости (рис. 1г). Общая толщина слизистой оболочки прямой кишки, по сравнению с первой группой, была несколько больше.
Во второй группе экспериментальных животных были отмечены различия между правой и левой мышцами. Так, в левой длинной мышце, отводящей хвост, которая была не-вротизирована, встречались нервные стволики и гипертрофированные мышечные волокна (рис. 1 д, е).
У всех экспериментальных животных третьей группы, которым проводилась пластика запирательного аппарата с выполнением прямой невротизации мышцы и созданием градиента нейротрофинов, признаки воспаления в области стыка эпидермиса и слизистой прямой кишки практически отсутствовали, что значительно отличало их от живаотных остальных групп. Также как и во второй группе экспериментальных животных, у животных третьей группы эрозивные и язвенные дефекты в области стыка слизистой кишки и эпидермиса отсутствовали, а эпителиальная выстилка кожи и слизистой характеризовались наибольшей степенью зрелости (рис. 1ж). Общая толщина слизистой оболочки прямой кишки, по сравнению с остальными группами, была максимальной.
Различия между правой и левой мышцами у экспериментальных животных третьей группы были умеренно выраженными. Так, в левых мышцах часто встречались относительно крупные нервные стволики и гипертрофированные мышечные волокна (рис. 1 з, и), что было сходно со второй группой.
При реакции иммунофлуоресценции было доказано наличие клеток, содержащих b3-тубулин, — нервные стволики, вокруг которых выявлялась слабая экспрессия синаптотаг-мина (рис. 2).
В препаратах от животных третьей группы были выявлены относительно толстые нервные волокна в левых мышцах, и незначительное количество в правых мышцах. В то время как в правых мышцах первой и второй групп они не обнаруживались, что подтвердили данные статистического анализа (рис. 2г).
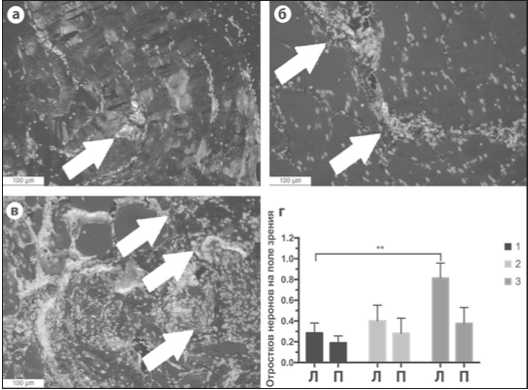
Рис.2. Фрагменты левых мышц, флюоресцентная микроскопия (×200). Препараты от животных группы 1 — (а), 2 — (б), 3 — (в). Зеленая флуоресценция — b3-тубулин, красная флуоресценция — синапто-тагмин, голубая флуоресценция — ядра клеток, желтая и оранжевая флуоресценция — неспецифическая и аутофлуоресценция. Стрелками обозначены b3-тубулин положительные нервные пучки. (г) количество отростков нейронов в поле зрения; двухфакторный дисперсионный анализ с поправкой Сидака, Л – левая мышца, П – правая мышца, графики отображают среднее значение ± SEM, ** - p <0.010
Толщины слизистых во всех группах экспериментальных животных достоверно отличались, причем максимальное среднее значение соответствовало третьей группе экспери-ментальныхживотных, минимальное-первойгруппе(рис.3а). Достоверные отличия были выявлены так же в толщинах эпидермиса между первой и третьей группами в сравнении со второй группой (рис. 3б). При исследовании различий в морфологии мышц было выявлено достоверное отличие между правой и левой мышцей во второй группе экспериментальных животных, при этом левая мышца первой группы экспериментальных животных достоверно была меньше левой мышцы второй группы. У экспериментальных животных третьей группы отличий между правой и левой мышцами практически не наблюдалось (рис. 3в). В левых и отчасти в правых мышцах часто встречались относительно крупные нервные стволики и гипертрофированные мышечные волокна.
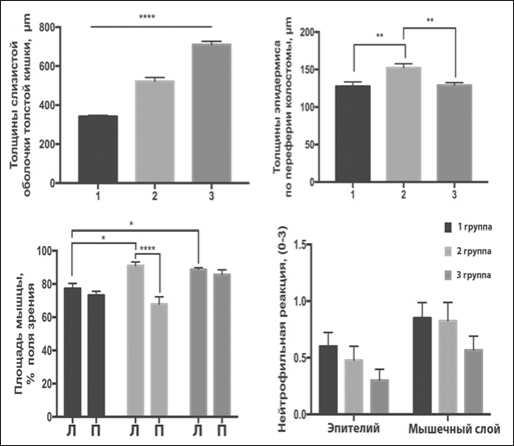
Рис.3. Морфометрический анализ состояния неосфинктера: (а) толщина слизитостой оболочки толстой кишки в области неосфинктера; (б) толщина эпидермиса в области неосфинктера; (в) площадь мышц неосфинкетра; (г) оценка интенсивности воспаления области неосфинктера. Л – левая мышца, П – правая мышца, графики отображают среднее значение ± SEM, * - p <0.05, ** - p <0.01, *** - p <0.001, **** - p <0.0001
Интенсивность воспалительной реакции была минимальной в третьей группе животных (рис. 3г), которым проводилась невротизация с использованием нейротрофинов.
Обсуждение полученных результатов
Выявленные морфологические изменения косвенно подтверждают эффективность применения невротизации для улучшения работы неосфинктера, особенно при дополнительном использовании нейротрофинов.
Выраженная воспалительная инфильтрация, эрозивные и язвенные дефекты, незрелость эпидермиса и слизистой прямой кишки у животных, которым была проведена пластика запирательного аппарата прямой кишки без прямой невротизации мышцы, свидетельствуют о постоянном раз- дражении этой области каловыми массами, вследствие отсутствия нормальной сократительной активности неосфинктера.
В то же время, у животных из второй группы, которым проводилась пластика запирательного аппарата прямой кишки с выполнением прямой невротизации мышцы без создания градиента нейротрофинов, признаки воспаления в области стыка эпидермиса и слизистой прямой кишки были меньше, чем в первой группе экспериментальных животных, эрозивные и язвенные дефекты отсутствовали, а эпителий слизистой оболочки и эпидермис характеризовались несколько большей степенью зрелости. Общая толщина слизистой оболочки прямой кишки, по сравнению с первой группой, была несколько больше. Также во второй группе экспериментальных животных были отмечены различия между правой и левой длинной мышцей, отводящей хвост. Так, в левой длинной мышце, отводящей хвост, которая подверглась невротизации, встречались нервные стволики и гипертрофированные мышечные волокна, в то время как в правой нет. Все это косвенно свидетельствует о хорошей функции неосфинктера.
У всех экспериментальных животных третьей группы, которым проводилась пластика запирательного аппарата с выполнением прямой невротизации мышцы и созданием градиента нейротрофинов, признаки воспаления в области стыка эпидермиса и слизистой прямой кишки практически отсутствовали, что значительно отличало их от остальных групп. Так же, как и во второй группе экспериментальных животных, у животных третьей экспериментальной группы эрозивные и язвенные дефекты в области стыка слизистой кишки и эпидермиса отсутствовали, а эпителиальная выстилка кожи и слизистой характеризовались наибольшей степенью зрелости. Общая толщина слизистой оболочки прямой кишки, по сравнению с остальными группами, была максимальной.
Различия между правой и левой мышцами у экспериментальных животных третьей группы были умеренно выраженными. Так, в левых мышцах часто встречались относительно крупные нервные стволики и гипертрофированные мышечные волокна. При реакции иммунофлуоресценции было доказано наличие клеток, содержащих b3-тубулин, – нервные стволики, вокруг которых выявлялась слабая экспрессия синаптотагмина.
Кроме того, от первой к третьей группе возрастала относительная толщина слизистой оболочки кишки, что, в сочетании с приведенными выше данными, указывает на ее полноценную регенерацию во второй и третьей группах. Эта тенденция обусловлена более физиологичным функционированием неосфинктера.
На основании полученных данных можно сказать, что предложенная методика пластики неосфинктера с невротизацией и созданием градиента нейротрофинов позволя- ет получить гистологическую картину, близкую к таковой нормально функционирующего сфинктера, и в перспективе может быть применена при лечении больных недержанием кишечного содержимого.
Список литературы Прямая невротизация анального неосфинктера как способ улучшения его функциональной морфологии
- Андреев А.В., Чеканов М.Н., Гатилов А.В. О функциональных результатах сфинктеросохраняющих резекций прямой кишки // Сибирский медицинский журнал. 2009. № 6. С. 41-45
- Байтингер В. Ф., Байтингер А. шов нерва конец-в-бок: стратегия "получения" аксонов из интактного нерва (часть III) // Вопросы реконструктивной и пластической хирургии. 2013. T. 16. № 2. C. 13-19
- Байтингер В. Ф., Силкина К. А., Байтингер А. В., Фёдоров Е. В. Total Breast Reconstruction: от неприятия до золотого стандарта // Вопросы реконструктивной и пластической хирургии 2014. T. 3. C. 50
- Говенько Ф., Монашенко Д., Лукин Д., Команцев В. Невротизация трех крупных нервов при тракционном повреждении плечевого сплетения // Вестник Российской военно-медицинской академии. 2012. № 4. C. 12-19
- Горшков Р. П., Нинель В., Норкин И., Делиникайтис С., Коршунова Г. Возможности тендомиопластики в реабилитации больных с грубыми повреждениями стволов плечевого сплетения // Саратовский научно-медицинский журнал. 2009. T. 5. №3
- Задоянный Л., Жданова В., Братусь Н. Клиника и лечение паралитического лагофтальма у больных с нейрохирургической патологией // Офтальмологический журнал. 2012. № 2. C. 63-67
- Иванов П.В., Киргизов И.В., Баранов К.Н., Шишкин И.А. Этапное лечение аноректальных пороков у детей // Медицинский вестник Северного Кавказа. 2010. № 3. С. 88-89
- Карпов О.Э., Максименков А.В., Степанюк И.В., Левчук А.Л., Назаров В.А., Стойко Ю.М. Лапароскопические и роботические технологии в лечении больных раком прямой кишки // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2016. Т. 11. № 2. С. 49-53
- Морозов Д.А., Окулов Е.А., Пименова Е.С. Российский консенсус по хирургическому лечению детей с аноректальными пороками. Первые шаги // Российский вестник детской хирургии, анестезиологии и реаниматологии. 2013. Т.3. №4. С. 8-13
- Ханнанова И.Г., Масгутов Р.Ф., Галлямов А.Р., Ризванов А.А., Богов А.А. Восстановление функции двуглавой мышцы плеча методом невротизации в сочетании с аутотрансплантацией клеток стромальной васкулярной фракции жировой ткани // Практическая медицина. Т. 4 (89). С. 197-199
- Konofaos P., Wallace R.D. Basic science of muscle neurotization: a review. Journal of reconstructive microsurgery, 2015, T. 31, no. 07, pp. 481-486
- Netta R. Blondheim, Yossef S. Levy, Tali Ben-Zur, Alex Burshtein, Tirza Cherlow, Inna Kan, Ran Barzilai, Merav Bahat-Stromza, Yael Barhum, Shlomo Bulvik, Eldad Melamed, And Daniel Offen. Human Mesenchymal Stem Cells Express Neural Genes, Suggesting a Neural Predisposition. Stem cells and development, 2006, 15, pp. 141-164
- Nnodim J.O. Testosterone mediates satellite cell activation in denervated rat levator ani muscle. The Anatomical Record: An Official Publication of the American Association of Anatomists, 2001, T. 263, no. 1, pp. 19-24
- Robert Sullivan, Travis Dailey, Kelsey Duncan, Naomi Abel and Cesario V. Borlongan. Peripheral Nerve Injury: Stem Cell Therapy and Peripheral Nerve Transfer. International Journal of Molecular Sciences, 2016, pp. 1-12


