Пробиотики как компонент патогенетической терапии в современной медицине: предпосылки и перспективы
Автор: Белозеров Е.С., Хохлов М.П.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Обзоры
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Организм человека можно рассматривать как совокупность клеток собственно тела и клеток микробиоты, соотношение которых составляет 1:1,3. Микробиом каждого человека уникален, у одного человека на разных участках тела колонии микроорганизмов отличаются друг от друга. Ведущую роль в микробиоме человека играет микробиота кишечника. Так, жизнедеятельность бактерий является определяющим фактором метаболизма желудочно-кишечного тракта, состояния иммунитета. С дисбиозом кишечника сопряжено развитие некоторых заболеваний (ожирение, сахарный диабет 2-го типа, гипертоническая болезнь и др.). Цель настоящей работы – анализ научной литературы, касающейся роли микробиоты в жизнедеятельности человека и применения микроорганизмов в патогенетической терапии. Для поиска источников информации использовались электронные библиотеки Pubmed, eLIBRARY, CyberLeninka. Пробиотики оказывают иммуномодулирующее и антитоксическое действие, а также способствуют продуцированию бактерицидных веществ. К возможностям современной пробиотичекой терапии относятся оптимизация гомеостаза, лечение острых кишечных заболеваний, повышение иммунотолерантности, нивелирование побочных действий химиотерапии, стресс-протекция. Для коррекции микробиома в последние годы, кроме пробиотиков, начали применяться новые группы препаратов: пребиотики (содержат вещества, стимулирующие рост полезных бактерий в кишечнике), синбиотики (комбинация прои пребиотиков) и метабиотики (содержат продукты метаболизма и структурные компоненты пробиотических микроорганизмов). К перспективным направлениям развития пробиотической медицины относятся таргетная терапия, применение факторов микробного антагонизма, препаратов на основе антисмысловых РНК с искусственными фрагментами и др.
Пробиотики, пребиотики, синбиотики, метабиотики, микробиота, микробиом, пробиотическая терапия
Короткий адрес: https://sciup.org/14132984
IDR: 14132984 | УДК: 615.331 | DOI: 10.34014/2227-1848-2025-2-19-36
Текст научной статьи Пробиотики как компонент патогенетической терапии в современной медицине: предпосылки и перспективы
В конце своего доклада на Международной конференции «Антимикробная терапия» президент Международного общества по химиотерапии профессор Жан-Клод Пешере сказал: «Настоящие хозяева Земли – бактерии, а не люди!» [1]. Эти слова невольно напомнили цитату Нильса Бора по поводу одной высказанной идеи: «Ваша идея, конечно, безумна. Весь вопрос в том, достаточно ли она безумна, чтобы оказаться верной» [2].
Общепризнанным является факт, что первыми представителями жизни на нашей планете были микроорганизмы. Американский физик, профессор Пол Дэвис предположил, что 3 млрд лет назад первые микробы с обломками метеорита попали на Землю. Таким образом, человечество можно назвать результатом эволюции исходных представителей жизни – микробов или вирусов.
Согласно метаанализу I.A. Hatton et al. организм взрослого человека состоит из 28–36 трлн клеток, при этом число бактерий, входящих в биом человека, еще больше: соотношение первых и вторых достигает 1:1,3. Таким образом, человека можно рассматривать как суперорганизм, представляющий собой совокупность собственно тела и микробов, или своеобразный инкубатор, в котором бактериям удобно размножаться и совершенствоваться [3].
Установлено, что человеческий организм не просто функционально взаимосвязан с населяющими его микробами – эта взаимосвязь обеспечивает жизнь как человека, так и микробов. Микробная часть человека – микробиом – представляет собой совокупность генов микробных популяций человека, которые включают в себя, кроме бактерий, грибы, вирусы, простейшие и продуцируемые ими метаболиты, слизь (муцин), эпителиальные клетки слизистой оболочки и их гликокаликс, клетки стромы слизистой оболочки (фибробласты, лейкоциты, нейроэндокринные клетки, клетки микроциркуляторного русла и др.) [4].
Микробиом – это сообщество микроорганизмов, населяющих отдельные экосистемы (кожи, кишечника, ротовой полости и др.) – микробиоты [5]. Микробиом можно сравнить с отпечатками пальцев: у каждого человека он уникален. Кроме того, у одного и того же человека на разных участках тела колонии микроорганизмов (микробиоты) отличаются друг от друга (рис. 1). На сегодняшний день неизвестно, как достигается это микробное разнообразие, однако доказана зависимость состава микробиоты от особенностей питания, места проживания и других факторов [6, 7].
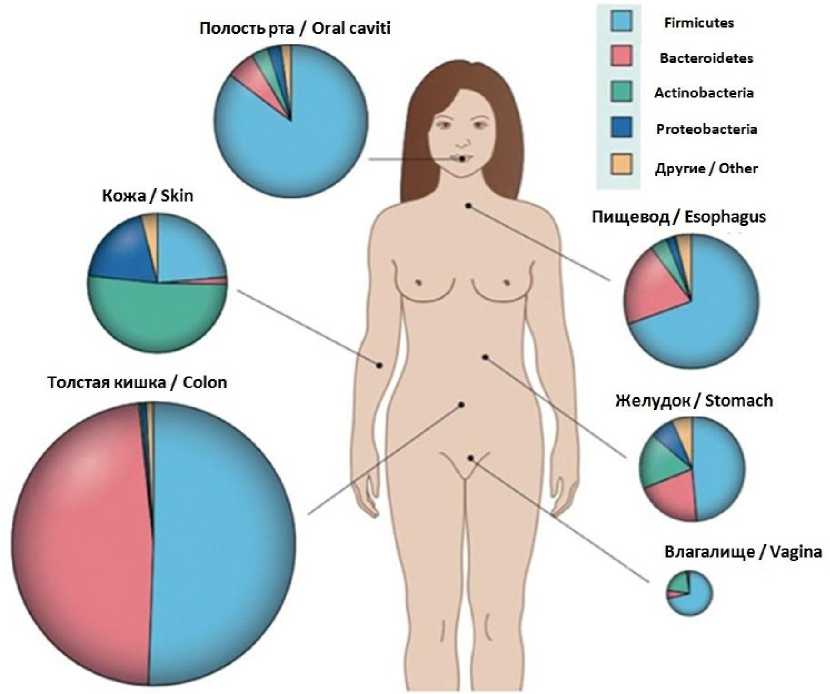
Рис. 1. Преобладающие типы бактерий различных локусов организма [8]
Fig. 1. Predominant types of bacteria in different loci of the body [8]
По своим количественным и качественным характеристикам, функциональной значимости ведущее место в микробиоме занимает микро- биота кишечника (рис. 2). Она составляет 60 % микробиома, а суммарная масса ее бактерий (2,5– 3 кг) больше, чем масса мозга (около 1,5 кг) [9].
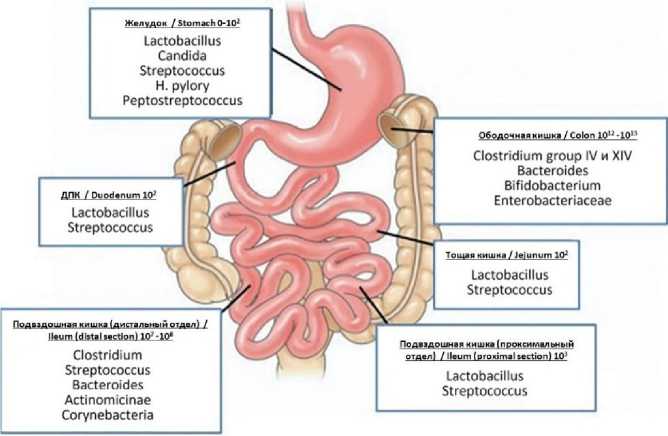
Рис. 2. Численность и основные представители микробиоты различных отделов пищеварительного тракта человека [10]
Fig. 2. The number and main representatives of the microbiota in various parts of the human digestive tract [10]
Микробиота кишечника вырабатывает 20 % общей энергии и на 90 % обеспечивает энергией клетки желудочно-кишечного тракта (ЖКТ). Именно микробиота кишечника определяет метаболизм клеток ЖКТ. К примеру, применение per os культуры некоторых живых бактерий приводило к изменению активности 42 генов, принимающих участие в регуляции клеточного цикла, апоптоза и межмикробного обмена информацией. Иссле- дования на животных, выращенных со стерильным кишечником, показали, что отсутствие микробиоты кишечника приводит к выраженному снижению иммунитета. Дисбиоз микробиоты кишечника тесно связан с получившими в наши дни пандемическое распространение рядом заболеваний: ожирением, сахарным диабетом 2-го типа, гипертонической болезнью, воспалительными заболеваниями кишечника (рис. 3) [11–13].
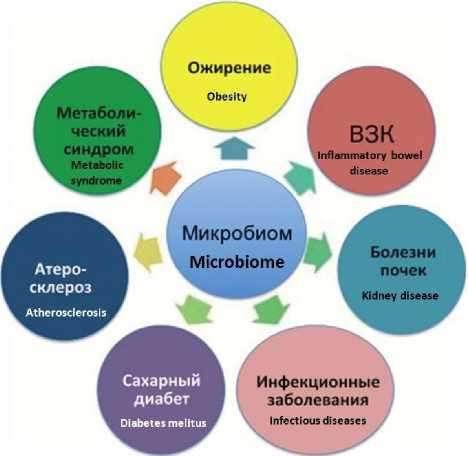
Рис. 3. Заболевания, ассоциированные с нарушением микробиома [14]
Fig. 3. Diseases associated with microbiome imbalance [14]
На состав микробиоты человека в течение жизни влияют такие факторы, как возраст, пол, пищевые предпочтения, социально-эко- номический статус, характер питания, прием лекарственных средств, особенно антибиотиков и др. (рис. 4) [15].
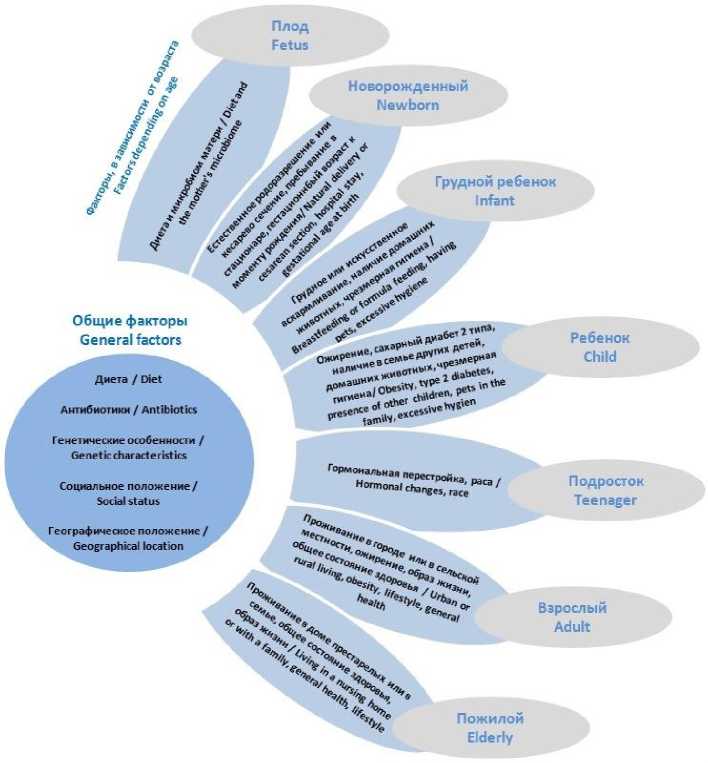
Рис. 4. Факторы, влияющие на состав микробиоты желудочно-кишечного тракта [16]
Fig. 4. Factors affecting the composition of the gastrointestinal microbiota [16]
Так, например, доказано, что белковая пища способствует росту протеолитических бактерий (например, бактероидов), а жирная – росту бактерий, участвующих в метаболизме желчных кислот [17–19].
Симбиотические отношения между микробиотой и организмом-хозяином являются взаимовыгодными. Организм человека обеспечивает адекватную среду обитания и питательные вещества для микробиома, а микробиота, особенно кишечника, поддерживает развитие метаболической системы, созревание и функционирование иммунной системы
(например, синтезирует витамины, короткоцепочечные жирные кислоты). Взаимодействие между микробиотой и иммунной системой кишечника (около 80 % иммунокомпетентных клеток локализованы именно в слизистой оболочке кишечника) значительно влияет на гомеостаз ЖКТ [20].
Отметим, что сегодня получено практическое подтверждение взаимосвязи микробиоты и иммунной системы: доказано, что английский иммуно-пробиотик БАК-СЕТ Колд/Флю укрепляет иммунитет, повышает сопротивляемость организма к простудным и вирусным заболеваниям, способствует ускорению процесса выздоровления [21].
Бактерии, содержащиеся в пробиотике, запускают врожденный неспецифический иммунный ответ – синтез интерферона и секреторного IgА, который вырабатывается на всей поверхности слизистых оболочек организма (ЖКТ, органов дыхания, глаз). Кроме того, известно, что в процессе прохождения через ЖКТ некоторые молчащие гены пробиотических микроорганизмов способны активироваться и запускать биосинтез многих продуктов микробиоты [22, 23].
К основным методам диагностики дисбио-тических нарушений следует отнести генотипирование микробиоты методом полимеразноцепной реакции (ПЦР) Real-time (в режиме реального времени), посев микрофлоры и микроскопию. Наиболее часто микрофлора исследуется помощью метода ПЦР. Ген 16S рРНК является идеальной мишенью для классификации бактерий из-за его девяти областей, которые помогают различить виды с помощью отдельных нуклеотидных полиморфизмов [24].
Методы биоинформатики (QIIME, Mothur, Genbore) позволяют обрабатывать таксономическую информацию, полученную из исследований 16S, что упрощает процесс фильтрации качества, выбора таксономических единиц работы и удаления химерной последовательности. Кроме того, они позволяют выполнять базовый анализ микрофлоры [25]. Исследования MetaHit и Human Microbiome Project позволили уточнить молекулярный профиль кишечной микрофлоры здорового человека [26].
Новые методы молекулярной биологии – омикс-технологии – способствовали изучению концентрации различных биологических молекул, что сегодня позволяет определить вариации микроорганизмов в различных биологических состояниях в рамках генома [27].
Роль микробиоты в обеспечении жизнедеятельности человека определяется влиянием непосредственно самих микроорганизмов на состояние обменных процессов, а также влиянием метаболитов кишечной микробиоты (табл. 1).
Таблица 1
Table 1
Gut microbiota metabolites and their functions [28]
|
Метаболит / Metabolite |
Функция / Function |
|
Короткоцепочечные жирные кислоты: ацетат, бутират, пропионат, гексаноат, валерат Short-chain fatty acids: acetate, butyrate, propionate, hexanoate, valerate |
Регуляция метаболизма через систему рецепторов, сопряженных с G-белком: энергообеспечение эпителия; антибактериальный эффект; увеличение продукции лептина; повышение толерантности к глюкозе и чувствительности к инсулину; стимуляция пролиферации клеток кишечника; глюконеогенез; липогенез в кишечном эпителии; иммуномодулирующий эффект, активация дендритных клеток иммунной системы кишечника Regulation of metabolism via the G-protein-coupled receptor system: energy supply to the epithelium; antibacterial effect; increased leptin production; increased glucose tolerance and insulin sensitivity; stimulation of intestinal cell proliferation; gluconeogenesis; li-pogenesis in the intestinal epithelium; immunomodulatory effect, activation of dendritic cells of intestinal immune system |
|
Производные индола: индол, индоксил сульфат, индол-3-пропионовая кислота Indole derivatives: indole, indoxyl sulfate, indole-3-propionic acid |
Антиоксидантное действие; противовоспалительный эффект; снижение проницаемости кишечной стенки Antioxidant effect; anti-inflammatory effect; reduction of intestinal wall permeability |
|
Метаболиты желчных кислот: дезоксихолевая кислота, литохолевая кислота Bile acid metabolites: deoxycholic acid, lithocholic acid |
Активация ядерных рецепторов и сигнальных путей клетки-хозяина: регуляция метаболизма желчных кислот, холестерина, глюкозы, липидов и энергетического обмена; антимикробное действие Activation of nuclear receptors and host cell signaling pathways: regulation of bile acids, cholesterol, glucose, lipids and energy metabolism; antimicrobial action |
|
Метаболиты холина: холин, N-оксид триметиламина, бетаин Choline metabolites: choline, trimethylamine N-oxide, betaine |
Регуляция метаболизма липидов и гомеостаза глюкозы; ассоциированы с развитием неалкогольной жировой болезни печени и сердечно-сосудистых заболеваний Regulation of lipid metabolism and glucose homeostasis associated with non-alcoholic fatty liver disease and cardiovascular diseases |
|
Производные фенола: фенилуксусная кислота, уролитины, эквол, энтеродиол, энтеролактон, 8-пренилнарингенин, 2-(3,4-дигидроксифенил)-пропионовая кислота, 3-(4-гидроксифенил)-пропио-новая кислота, 5-(3,4-дигидроксифе-нил)-пропионовая кислота Phenol derivatives: phenylacetic acid, urolithins, equol, enterodiol, enterolactone, 8-prenylnaringenin, 2-(3,4-dihy-droxyphenyl) propionic acid, 3-(4-hy-droxyphenyl) propionic acid, 5-(3,4-di-hydroxyphenyl), propionic acid |
Угнетение роста патогенной микробиоты; модуляция состава микробиоты кишечника; антиоксидантный эффект; эстроген-модулирующий эффект; антиагрегантное действие Inhibition of pathogenic microbiota growth; modulation of intestinal microbiota composition; antioxidant effect; estrogen-modulat-ing effect; antiplatelet action |
|
Витамины: В 1 , В 2 , В 3 , В 6 , В 5 , В 7 , В 12 , К 2 Vitamins: B 1 , B 2 , B 3 , B 6 , B 5 , B 7 , B 12 , K 2 |
Кофакторы разнообразных биохимических реакций; репликация, репарация и метилирование ДНК; регуляция пролиферации клеток Cofactors for biochemical reaction diversity; DNA replication, repair and methylation; regulation of cell proliferation |
|
Полиамины: путресцин, спермидин, спермин Polyamines: putrescine, spermidine, spermine |
Синтез нуклеотидов, витаминов и аминокислот; поддержание высокого пролиферативного индекса эпителия кишечника; участие в синтезе белков плотных контактов; участие в созревании адаптивной (приобретенной) иммунной системы; регуляция активности макрофагов Synthesis of nucleotides, vitamins and amino acids; maintenance of high proliferative index of intestinal epithelium; tight junction protein synthesis; maturation of the adaptive (acquired) immune system; regulation of macrophage activity |
Метаболиты кишечной микробиоты и их функции [28]
Среди проблем, стоящих перед мировым здравоохранением последних десятилетий, наиболее актуальной является нарастающая антибиотикоустойчивость к возбудителям инфекционных заболеваний.
Согласно оценке ВОЗ ежегодно от «супервозбудителей» инфекционных заболеваний погибает около 8 млн человек. Нарастающая плотность населения способствует рас- пространению вирусных инфекций и появлению новых возбудителей. Как полагают эксперты ВОЗ, к 2050 г. «супервозбудители» унесут уже 39 млн жизней. Поэтому перед учеными стоит задача создания новых антибиотиков, а также поиск альтернативных методов лечения инфекционных заболеваний [29].
Сегодня в мире все шире распространяется идея возможности снижения фармакохи- мической нагрузки на организм человека путем применения препаратов, созданных самой природой, в частности производных бактериальных клеток.
В развитии нового направления в медицине в нашей стране ― микробной экологии человека – ведущая роль принадлежит бывшему директору Института эпидемиологии и микробиологии им. Г.Н. Габричевского, ученому с мировым именем в области микробиологии, гнотобиологии, функциональных продуктов питания Б.А. Шендерову (1940–2020). В 1990 г. он обосновал концепцию клинической микробной экологии, согласно которой нарушения симбиотических микробиоценозов человека являются механизмами, запускающими патогенез большинства соматических и метаболических заболеваний человека. Его исследования послужили основой для массового внедрения в повседневную жизнь населения страны пробиотиков на основе штаммов лактобацилл и бифидобактерий человеческого происхождения. Б.А. Шендеров представление о человеке как о сообществе эукариотических клеток заменяет идеей о том, что человек – это суперорганизм, сообщество эукариотических, прокариотических клеток и вирусов. Поскольку микроорганизмы участвуют в формировании заболеваний, ученый внедряет эффективный способ профилактики и лечения болезней – управление микробиотой [30, 31].
Микробиоту кишечника многие ученые рассматривают как «второй мозг», влияющий на регуляцию генов и индивидуальное развитие организмов. Более того, этим «мозгом» можно управлять, поскольку вариабельность микробиоты кишечника только на 10 % зависит от ее генома, а на 90 % определяется пищей и факторами окружающей среды [32–35].
Профессор Е.И. Ткаченко в докладе на конференции «Микробиота как средство преодоления антибиотикорезистентности» представил вариант взаимодействия сетевых структур с основными системами организма, который представляет собой как горизонтальную, так и вертикальную взаимосвязь (рис. 5). Представленная система взаимоотношений имеет самодовлеющий характер, а коррекция нарушений сетевых структур (применение пробиотиков) является новым вариантом патогенетической терапии [7, 36].
Центральная нервная система Central nervous system
\______________________________________
Энтеральная нервная система Enteric nervous system
Рис. 5. Взаимодействие сетевых структур с основными системами организма
Fig. 5. Interaction of network structures with the main systems of the body
Хотя первый пробиотик (от греч. pro – «для», bios – «жизнь») был открыт в 1905 г. болгарским микробиологом С. Григоровым (штамм бациллы Lactobacillus bulgaricus в болгарском йогурте), а научное обоснование его применения дал И.И. Мечников в 1907 г, настоящее внедрение пробиотических продукцтов началось только в 1960-е гг. В 1965 г. D.M. Lilly и R.H. Stillwell ввели термин «пробиотики» для обозначения микробных метаболитов, а современное толкование слова дали G.R. Gibson, M.B. Robertroid в 1995 г. [35].
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозя- ина [37]. Пробиотики могут быть моноштам-мовые (содержащие лишь один штамм микроорганизмов) и мультиштаммовые (содержащие два и более штамма).
Ряд связанных с питанием социально-экономических, экологических проблем последних десятилетий ХХ в. определил актуальность включения в рацион пробиотиков в виде пищевых добавок или уже готовых продуктов, произведенных на основе Lactobacillus acidophilus, бифидобактерий и других микроорганизмов. Особенно широко они используются в США, Японии, Германии и Франции [38, 39]. Рис. 6 демонстрирует принцип действия пробиотиков.
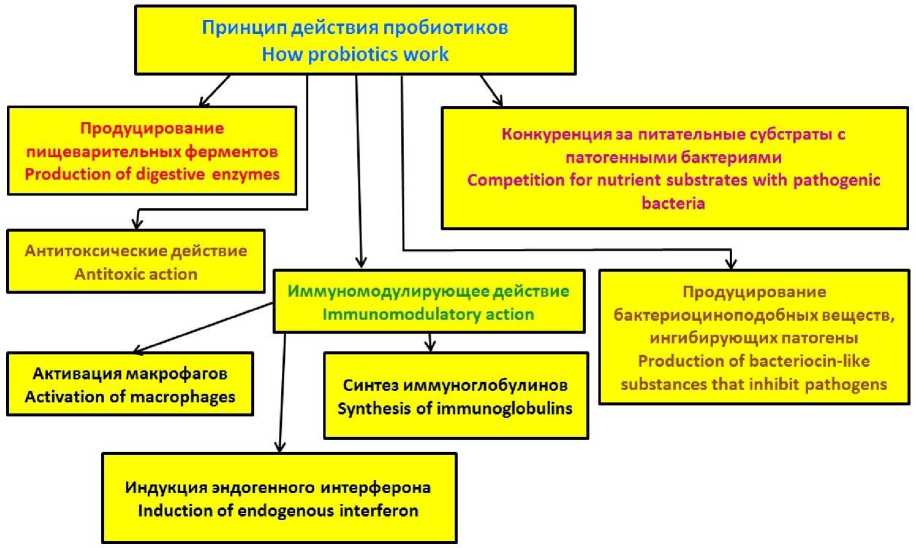
Рис. 6. Спектр действия пробиотиков
Fig. 6. Spectrum of action of probiotics
Широту спектра действия пробиотиков обеспечивает наличие осей взаимодействия: «микробиота кишечника – эндокринные органы» (в кишечнике масса эндокринных клеток больше, чем масса всех эндокринных органов); «микробиота кишечника – кожа»; «микробиота кишечника – головной мозг»; «микробиота кишечника – печень»; «микробиота кишечника – легкие»; «микробиота кишечника – почки»; «микробиота кишечника – мочевой пузырь» и т.д. [40, 41]. На сегодняшний день к возможностям пробиотической терапии следует отнести:
-
• коррекцию дисбиоза кишечника и оптимизацию гомеостатических параметров организма у терапевтических больных различного профиля;
-
• лечение острых кишечных инфекций, профилактику антибиотикоассоциированной диареи;
-
• повышение иммунотолерантности, потенцирование действия антибиотиков в борьбе с инфекционно-септическими осложнениями;
-
• снижение выраженности побочных эффектов полихимиотерапии, коррекцию статуса питания, снижение риска развития рецидивов и генерализации неопластического процесса; оптимизацию психологического статуса, нивелирование личностных расстройств;
-
• стресс-протекцию, повышение адаптационного потенциала, умственной и физической работоспособности, интеллектуальных возможностей организма.
В последние два десятилетия появились пребиотики и синбиотики.
Пребиотики – это не перевариваемые пищеварительными ферментами человека, но ферментируемые кишечной микробиотой субстанции, которые приводят к специфическим изменениям в составе и/или активности желудочно-кишечной микробиоты, принося таким образом пользу здоровью организма [42].
Синбиотики – это продукты, имеющие в своем составе пробиотические штаммы и пре-биотические субстанции и совмещающие их свойства. Синбиотики разделяют на синергетические (содержат пребиотический субстрат, стимулирующий размножение и активность входящих в его состав бактерий) и дополнительные (препараты, в которых пробиотические и пребиотические компоненты приносят пользу организму человека независимо друг от друга) [43].
ХХI в. ознаменовался появлением принципиально нового продукта – метабиотиков. Метабиотики – это сочетание структурных компонентов пробиотических микроорганизмов с их метаболитами и/или сигнальными молекулами, способное оптимизировать физиологические функции организма хозяина, метаболические и поведенческие реакции, связанные с симбиотической микробиотой [44, 45]. К метабиотикам относятся инактивированные микробные клетки, компоненты клеточной стенки бактерий и метаболиты микробного происхождения: короткоцепочечные жирные кислоты, бактериоцины, энзимы, аминокислоты с разветвленной цепью, углеводы, органические кислоты, витамины и др. [46, 47].
В нашей стране для лечения и профилактики заболеваний гастроэнтерологического профиля у взрослых применяются следующие препараты и функциональные пищевые продукты, содержащие пробиотики, пребиотики, синбиотики и метабиотики: «Актибио», «Ак-тимуно», «Бактимунал», «Бифиформ», «Нео-биотик Лактобаланс», «Линекс Форте», «Па-лека», «Пробиолог», «Пробиолог-СРК», «Симбиозис Альфлорекс», «Хелинорм», «Эн-терол», «Энтеролактис Фибра», «Инулин», «Лактулоза», «Олигофруктоза» [48].
Альтернативным средством коррекции нарушений кишечной микробиоты является трансплантация фекальной микробиоты (ТФМ) – введение фекальной суспензии, полученной от здорового человека, в ЖКТ другого человека [49, 50]. Сегодня изучается возможность применения ТФМ в лечении различных заболеваний (воспалительных заболеваний кишечника, сахарного диабета, злокачественных опухолей и т.д.). Однако недостаточность доказательной базы по подавляющему спектру патологий затрудняет широкое распространение этого метода [51].
Взаимодействие микробиоты кишечника и легких было продемонстрировано в исследовании, проведенном в Ульяновском государственном университете [52]. Так, включение в стандартное лечение курса сипингового питания смесью «Эншур 2» (Abbot), содержащей пребиотические компоненты, у пациентов с обострением аллергической бронхиальной астмы сопровождалось улучшением показателей функции внешнего дыхания и снижением расхода противоастматических препаратов по сравнению с контрольной группой, пациенты которой получали только стандартную проти-воастматическую терапию. Кроме того, зарегистрировано снижение количества патогенных микроорганизмов в мокроте пациентов, получавших питательную смесь с пребиотиком.
Следующим этапом развития данного направления медицины должно стать внедрение таргетной (англ. target «цель, мишень») терапии в целях повышения эффективности, доступности и сравнительной безопасности пробиотической продукции. Кроме того, отметим, что традиционная фармакотерапия инфекционных болезней основывается на использовании вакцин, антитоксических сывороток, антибиотиков, противовирусных препаратов, в т.ч. и прямого действия. В качестве нового перспективного метода можно рассматривать применение про-, пре-, сим-, сини метабиотиков, факторов микробного антагонизма, препаратов на основе антисмысловых РНК с искусственными фрагментами (гибридов молекул информационной РНК с искусственными фрагментами РНК, блокирующими синтез токсинов и т.п.), препаратов, блокирующих образование регуляторов «чувства кворума», перехода микроорганизмов с планктонной форму на пленочную [41, 43, 53, 54].
В 2024 г. вышли Методические рекомендации Научного сообщества по содействию клиническому изучению микробиома человека (НСОИМ) и Российской гастроэнтерологической ассоциации (РГА) по применению пробиотиков, пребиотиков, синбиотиков, ме-табиотиков и обогащенных ими функциональных пищевых продуктов для лечения и профилактики заболеваний гастроэнтерологического профиля у взрослых и детей, которые содержат информацию о терминологии, классификации, механизмах действия, требованиях к реализации на территории Российской
Федерации, доказательствам эффективности и безопасности [48].
Согласно данным рекомендациям препараты пре- и пробиотического ряда применяются для профилактики антибиотик-ассоции-рованной и инфекционной диареи, С. difficile-ассоциированной болезни, функциональных нарушений гастроэнтерологического профиля у здоровых взрослых (включая период после перенесенной инфекции COVID-19), улучшения исходов эрадикации инфекции H. pylori и синдрома избыточного бактериального роста, лечения синдрома раздраженного кишечника, функционального (хронического) запора, заболеваний печени (цирроза печени и метаболически ассоциированной болезни печени) [48].
Заключение. Микробиота (прежде всего кишечника) играет значительную роль в жизнеобеспечении человеческого организма. Нарушение микробного баланса может сопровождаться развитием различных заболеваний, в т.ч. снижением иммунитета. Таким образом, применение пробиотиков и других групп препаратов, способствующих нормализации состава кишечной микрофлоры (пребиотиков, синбиотиков, метабиотиков), влияет на патогенез определенных заболеваний. Таргетная терапия, применение факторов микробного антагонизма, препаратов на основе антисмысловых РНК с искусственными фрагментами, препаратов, блокирующих образование регуляторов «чувства кворума», переход микроорганизмов с планктонной форму на пленочную являются перспективными направлениями дальнейшего развития пробиотической медицины.


