Проблемные аспекты применения оральных антикоагулянтов у пациентов с легочной артериальной гипертензией различного генеза
Автор: Грацианская Светлана Евгеньевна, Мартынюк Тамила Витальевна, Наконечников Сергей Николаевич, Чазова Ирина Евгеньевна
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзор
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Использование пероральных антикоагулянтов у больных с легочной артериальной гипертензией (ЛАГ) остаётся спорным вопросом на протяжении десятилетия. Несмотря на отсутствие убедительных доказательств, современные рекомендации предлагают использование антикоагулянтов у больных с идиопатической легочной гипертензией (ИЛГ), но в то же время представляют неоднозначную рекомендацию для других форм ЛАГ. В настоящем обзоре рассмотрены современные возможности и проблемные аспекты пероральной антикоагулянтной терапии при ЛАГ различной этиологии, влияние на течение заболевания и прогноз.
Легочная артериальная гипертензия, идиопатическая легочная гипертензия, пероральные антикоагулянты, тромбоз in situ
Короткий адрес: https://sciup.org/143165080
IDR: 143165080
Текст обзорной статьи Проблемные аспекты применения оральных антикоагулянтов у пациентов с легочной артериальной гипертензией различного генеза
Легочная артериальная гипертензия (ЛАГ) относится к заболеваниям, которое очень часто диагностируется на поздней стадии с функциональным классом (ФК) легочной гипертензии (ЛГ) III или IV по классификации Всемирной организации здравоохранения (ВОЗ), и приводит к тяжелой правожелудочковой недостаточности с последующим летальным исходом. К диагностическим критериям ЛАГ относят уровень среднего давления в легочной артерии (ДЛАср.) >25 мм рт. ст. в покое по данным катетеризации правых отделов сердца (КПОС), давление заклинивания в легочной артерии (ДЗЛА) ≤ 15 мм рт. ст., легочное сосудистое сопротивления (ЛСС) >3 ед. по Вуду, при исключении прекапиллярной ЛГ, связанной с патологией легких, хронической тромбоэмболической легочной гипертензией (ХТЭЛГ) и другими редкими заболеваниями [1;2].
Так, ХТЭЛГ является уникальной, потенциально излечимой формой ЛГ, которая характеризуется механической обструкцией легочных артерий эластического типа за счет организованных тромбов. Основой патофизиологических процессов является формирование тромботических масс, не подвергшихся лизису, которые далее фиброзируются, что приводит к механической обструкции легочных артерий. Причиной служат нарушения в каскаде свертывания крови, в том числе дисфункции эндотелиальных клеток и тромбоцитов [42]. Таким образом, в отличие от ЛАГ при ХТЭЛГ приём оральных антикоагулянтов является обязательным на протяжении всей жизни, в том числе у оперированных пациентов [43].
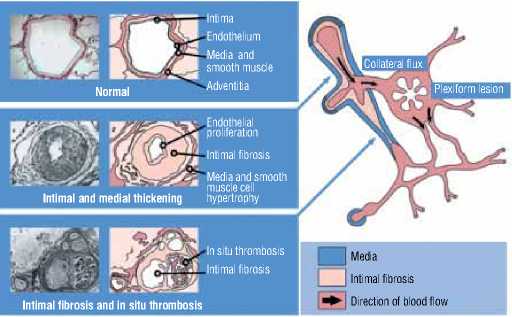
Известно, что в патогенезе ЛАГ выделяют четыре основных механизма: вазоконстрикцию, редукцию легочного сосудистого русла, снижение эластичности легочных сосудов, облитерацию легочных сосудов (тромбоз in situ, пролиферация гладкомышечных клеток) (рис. 1). До настоящего времени точно не установлены процессы, играющие пусковую роль в развитии патологических изменений в легочных сосудах при ЛГ. Современные теории патогенеза ЛГ фокусируются на дисфункции или повреждении эндотелия, приводящей к нарушению баланса между вазоконстриктивными и вазодилатирующими веществами и развитию вазоконстрикции. Освобождение не-идентифицированных хемотаксических агентов из поврежденных клеток эндотелия вызывает миграцию гладкомышечных клеток в интиму легочных артериол. Секреция локально активных медиаторов с выраженным вазоконстрикторным действием способствует развитию тромбоза in situ, трансформируя состояние легочного сосудистого русла из обычного антикоагулянтного состояния (вследствие освобождения простациклина и ингибитора тканевого активатора плазминогена) в прокоагулянтное. В результате образуется порочный круг: повреждение эндотелия неуклонно прогрессирует и приводит к ремоделированию легочных сосудов, нарастанию сосудистой обструкции и облитерации. При этом патологические процессы затрагивают все слои сосудистой стенки, различные типы клеток – эндотелиальные, гладкомышечные, фибробласты. В адвентиции отмечается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Воспалительные клетки и тромбоциты также играют существенную роль в развитии ЛГ. В плазме крови больных с ЛГ повышены уровни провоспалительных цитокинов, в тромбоцитах нарушается метаболизм серотонина. Таким образом, дисбаланс между тромботическими, митогенными, провоспа-лительными, вазоконстриктивными факторами и механизмами обратного действия – антикоагулянтными, антимитоген-ными, вазодилатирующими, способствует вазоконстрикции и тромбозам, пролиферативным и воспалительным изменениям в легочном микроциркуляторном русле [2].
Media
Intimal fibrosis
Direction of blood flow
Intima
Endothelium
Adventitia
Normal
In situ thrombosis
Intimal fibrosis
Intimal fibrosis and in situ thrombosis
Plexiform lesion гу Endothelial i proliferation
Intimal fibrosis
Intimal and medial thickening
Media and smooth muscle cell hypertrophy
Media and smooth muscle
Рисунок 1. Патогенетические аспекты ЛАГ
Использование антикоагулянтов у больных с ЛАГ остаётся спорным вопросом на протяжении десятилетия. Несколько клинических испытаний показали благоприятное воздействие антикоагулянтной терапии на прогноз больных с идиопатической легочной гипертензией (ИЛГ), однако большинство этих исследований носили ретроспективный характер и отличались малой выборкой. Не смотря на отсутствие убедительных доказательств, современные рекомендации предлагают использование антикоагулянтов у больных с ИЛГ, но в то же время представляют неоднозначную рекомендацию для других форм ЛАГ [3]. Так, ситуация ещё менее ясна для пациентов с другими формами ЛАГ, для которых нет почти никаких опубликованных доказательств «за» или «против» использования антикоагулянтов. Некоторые из этих пациентов подвержены повышенному риску кровотечений, особенно пациенты с заболеваниями соединительной ткани, врожденными пороками сердца и заболеваниями печени [4; 5; 6].
Таблица 1. Фармакокинетические свойства НОАК (TCmax – время достижения максимальной концентрации в плазме крови, T1/2 – время полувыведения) [44]
|
Препарат |
TCmax, ч |
T1/2, ч |
Биодоступность |
Связь с белками плазмы крови |
|
Ривароксабан |
2-4 |
5-9 ч** |
80-100% |
92-95% |
|
Дабигатран |
0,5-2 |
12-14 |
6,5% |
34-35% |
|
Apixaban |
3-4 |
12 |
50% |
87% |
ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ ЛАГ
В течение длительного времени основным оральным антикоагулянтом, применяемым для лечения и профилактики тромботических осложнений, был синтетический антагонист витамина К – препарат варфарин. Необходимо отметить, что и по настоящее время он остается наиболее часто назначаемым лекарственным средством этой группы. Однако опасность развития побочных эффектов на фоне его применения, таких как кровотечение, сложности в применении (достаточно длительный период восстановления нормальной свертываемости крови после отмены препарата, подбор дозы и регулярный контроль МНО) обусловили потребность в более безопасных и удобных в применении новых пероральных антикоагулянтов (НОАК). В настоящее время в России зарегистрированы 3 препарата: дабигатран, ривароксабан, апиксабан (табл. 1), отличающиеся сниженным риском геморрагических событий и не требующие контроля МНО (табл. 2).
M. Delbeck и соавт. на животных моделях сравнивали действие прямого ингибитора Ха фактора, ривароксабана, с вар----------------------------------------1 123 I фарином и эноксапарином на профилактику дисфункции и гипертрофии правого желудочка при монокроталиновой модели легочной гипертензии. Так, крысы линии Спрег-Доули (n=10 в каждой группе) были рандомизированы для получения ривароксабана, варфарина, эноксапарина или плацебо прежде, чем получить подкожную инъекцию 60 мг/кг моно-кроталина или солевого раствора. Ривароксабан и эноксапа-рин давали в течение 28 дней, начиная за 4 ч до инъекции монокроталина; терапия варфарином продолжалась в течение 35 дней, начиная за 7 дней до инъекции монокроталина. Гемодинамические показатели и показатели гипертрофии оценивались через 28 дней после введения монокротали-на. Ривароксабан дозо-зависимо снижал систолическое и повышенное конечно-диастолическое давление в правом желудочке и уменьшал гипертрофию правого желудочка. Варфарин только снижал повышенное давление в правом желудочке. Эноксапарин не имел никакого эффекта ни на один параметр. Серьезное кровотечение возникло у четырех и пяти крыс группы варфарина и эноксапарина, соответственно, тогда как никаких кровотечений не наблюдалось у крыс группы ривароксабана. Таким образом, авторы пришли к выводу, что селективное, прямое ингибирование Хa фактора ривароксабаном эффективно предотвращало дисфункцию и гипертрофию правого желудочка у крыс, которым вводили моно-кроталин, что указывает на роль факторов свертываемости при экспериментальной легочной гипертензии. В связи с чем следует провести клиническое исследование по воздействию ранней и продолжительной терапии ингибитора Xa фактора, такого как ривароксабан, на течение ЛАГ [41].
ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ ИЛГ
В ряде работ, опубликованных, главным образом, в 1970-е годы, С.А. Wagenvoort и соавт. описали тромбоз мелких ветвей легочных артерий как одну из типичных гистопатологических особенностей ИЛГ, в то время носившей название первичной легочной гипертензии [7; 8; 9]. Это наблюдение, вместе с исследованиями, демонстрирующими повышенную свертываемость крови у больных с тяжелой легочной гипертензией, привели к гипотезе, что тромбоз in situ измененных легочных сосудов может способствовать прогрессированию заболевания, а антикоагулянтная терапия может иметь положительный эффект [10; 11; 12]. Поддерживая эту гипотезу, V. Fuster и со-авт. в 1984 году опубликовали результаты наблюдательного исследования, которое подтвердило наличие тромботических повреждений легочных сосудов у пациентов с ИЛГ и продемонстрировало на основе ретроспективного анализа 120 пациентов, что использование антикоагулянтов связано с лучшими показателями выживаемости [13]. В более позднем исследовании S. Rich и соавт. показатели выживаемости были также выше у больных, получавших антикоагулянты. В данном исследовании показанием для назначения антикоагулянтов служили отклонения в перфузии легких при сцинтиграфическом исследовании [14]. Систематический обзор литературы обнаружил 7 исследований, в 5 из которых антикоагулянтная терапия имела положительный эффект и в 2 – эффект был отрицательный [15]. До сих пор не было проведено проспективного рандомизированного клинического исследования по оценке использования антикоагулянтов у больных с ИЛГ. Существует четкое патофизиологическое объяснение для использования антикоагулянтов у больных с ИЛГ, которое поддержано предварительными клиническими данными, но научные доказательства остаются ограниченными [3].
Учитывая отсутствие точных доказательств в пользу использования антикоагулянтов у пациентов с ЛАГ, существует противоположное мнение. Так, вышеупомянутые данные были получены во времена, когда еще не были доступны почти никакие патогенетические методы лечения для ЛАГ. Развитие применения эффективной ЛАГ-специфической терапии привело к улучшениям со стороны гемодинамики, двигательной активности и выживаемости [16; 17]. В то же время, по крайней мере в Европе, изменилась демография этих пациентов, и теперь ЛАГ часто диагностируют у пожилых пациентов с множественными коморбидными состояниями [18; 19; 20; 21]. В связи с чем, неясно насколько необходима антикоагулянтная терапия таким пациентам, особенно учитывая, что уровень кровотечения у пациентов с ИЛГ составляет 5,4 в 100 лет и 19 в 100 лет у ЛАГ, ассоциированной с заболеваниями соединительной ткани [22].
K.M. Olsson и соавт. описали европейский реестр COMPERA, который проспективно регистрирует пациентов с легочной гипертензией. Выборка состояла из 1283 пациентов с недавно диагностированной ЛАГ. Антикоагулянтная терапия применялась в 66% случаев из 800 пациентов с ИЛГ и в 43% случаев из 483 пациентов с другими формами ЛАГ. У больных с ИЛГ трехлетняя выживаемость на антикоагулянтной терапии была достоверно выше, по сравнению с пациентами, в схему лечения которых никогда не входили антикоагулянты (P=0,006). Многофакторный регрессионный анализ подтвердил благоприятное воздействие антикоагулянтов на выживаемость пациентов с ИЛГ (отношение рисков, 0,79; ДИ 95%, 0,66–0,94). Напротив, использование антикоагулянтов у пациентов с другими формами ЛАГ не было связано с увеличением выживаемости, по факту, имела место тенденция худшего исхода у пациентов с ЛАГ, ассоциированной со склеродермией (P=0,08). Таким образом, эти данные свидетельствуют в пользу применения антикоагулянтов у больных с ИЛГ, но не с другими формами ЛАГ [3].
-
D. Caldeira и соавт. в системном обзоре и мета-анализе стремились определить воздействие оральных антикоагулянтов на выживаемость пациентов с ЛАГ. Однако не было найдено ни одного рандомизированного контролируемого исследования. Так, в мета-анализ были включены 9 когортных исследо-
Таблица 2. НОАК в сравнении с варфарином [45]
Инсульт/ ТЭ
ИИ/не уточнённый
Геморрагический инсульт
Большие кровотечения
ЖКТ кровотечения
ССС
Смерть от всех причин
Дабигатран 150
↓ на 34%
↓ на 24%
↓ на 74%
одинаково
↑ ОР на 50%
↓ ОР на 15%
↓ на 12% р=0,051
Дабигатран 110
одинаково
одинаково
↓ на 69%
↓ на 20%
одинаково
одинаково
одинаково
Ривароксабан
одинаково
одинаково
↓ на 40%
одинаково
↑ ОР в 3 раза
одинаково
одинаково, р=0,09
Апиксабан
↓ на 21%
одинаково
↓ на 49%
↓ на 31%
одинаково
одинаково
↓ на 11%
ваний: 2 проспективных [14; 23] и 7 ретроспективных [3; 24; 13; 25; 26; 27; 28], включающих 1730 пациентов с ЛАГ. Прием оральных антикоагулятнов (варфарина) был связан со снижением риска смертности на 31% (HR 0,69; 95% CI: 0,57-0,82; I2=28%). Анализ чувствительности показал подобные результаты и никакой значимой разнородности. Таким образом, авторы пришли к выводу, что нет никаких рандомизированных доказательств в поддержку приема оральных антикоагулянтов у больных ИЛГ. Объединенные результаты когортных исследований склоняются в пользу оральных антикоанулянтов, в связи с улучшением выживаемости. Однако всё равно существует необходимость прагматичных рандомизированных доказательств с четким ответом на этот важный клинический вопрос [29].
ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ ЛАГ, АССОЦИИРОВАННОЙ С ЗАБОЛЕВАНИЯМИ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Известно, что системная склеродермия представляет собой аутоиммунный коллагеноз, характеризующийся васкулопатией и фиброзом и встречающийся у более чем 2 миллионов человек во всем мире [30]. Достоверно установлено, что ЛАГ является одной из главных причин смерти при системной склеродермии, что составляет 30-40% от всех летальных исходов при данном заболевании [31; 32; 33]. Нелеченная ЛАГ, ассоциированная с системной склеродермией, быстро приводит к фатальному течению со смертельным исходом от правожелудочковой сердечной недостаточности и аритмий [34].
Тромбоз in situ является частью ЛАГ, ассоциированной с системной склеродермией, проявляющийся венозными и артериальным тромбозами периферических легочных сосудов мелкого калибра и имеющий общие гистологические признаки с ИЛГ [35]. В то время как несколько наблюдательных исследований, включая австралийское когортное исследование по склеродермии, продемонстрировали положительное влияние антикоагулянтной терапии на выживаемость пациентов с ЛАГ, другие наблюдательные исследования не поддержали этого мнения [36; 37; 38; 3; 29]. Необходимо отметить, что многие пациенты, включенные в эти исследования, не находились на достаточной ЛАГ-специфической терапии, и большинство из них страдало ИЛГ [29; 36]. Напротив, данные австралийского когортного исследования по склеродермии продемонстрировали положительное влияние на выживание у пациентов, получающих антикоагулянты и адекватную ЛАГ-специфическую терапию. В группе ЛАГ, ассоциированной с заболеваниями соединительной ткани (95%, которых были пациенты с ЛАГ, ассоциированной с системной склеродермией), медиана выживания составила только 5 лет, наблюдалось предполагаемое 5-кратное сокращение смертности при терапии варфарином, назначенной по усмотрению врача, в среднем на 2,6±1,8 лет [23].
-
A. Calderone и соавт. представили объяснение и методологию фазы III рандомизированного контролируемого исследования по оценке эффективности, безопасности и рентабельности приема антикоагулянтов при ЛАГ, ассоциированной с системной склеродермией. В данном исследовании сравнивается терапия 2,5 мг апиксабана с плацебо в параллельных группах, рандомизированных в соотношении 1:1, в обеих группах препарат принимают дважды в день в течение 3 лет как дополнение к постоянной пероральной ЛАГ-специфической терапии. Первичными конечными точками будет время до смерти или клиническое ухудшение ЛАГ.
Вторичные результаты будут включать функциональную способность, связанную с качеством жизни и развитием неблагоприятных событий. Также будет оцениваться рентабельность терапии антикоагулянтами против плацебо. Необходимо отметить, что это первое клиническое исследование, целью которого оценить эффективность, безопасность и рентабельность антикоагулянтной терапии как компонента лечения ЛАГ, ассоциированной с системной склеродермией. С целью минимизирования предвзятости данное исследование является слепым рандомизированным плацебо-контролируемым. Выбор апиксабана в дозе 2,5 мг два раза в сутки в качестве антикоагулянтной терапии основан на соображении соотношения риска-пользы при ЛАГ, ассоциированной с системной склеродермией [39].
ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ ПРИ ЛАГ, АССОЦИИРОВАННОЙ С ВРОЖДЁННЫМИ ПОРОКАМИ СЕРДЦА (ЛАГ-ВПС)
Пороки сердца и связанных с ним крупных сосудов являются самыми частыми среди врожденных аномалий. Вследствие улучшенной диагностики данных заболеваний приблизительно 90% пациентов с врожденными пороками сердца (ВПС) достигают взрослой жизни. В 10% случаев быстро или со временем развивается ЛАГ, которая снижает толерантность к физическим нагрузкам и ухудшает прогноз. Данные по ситуации с такими пациентами ограничены. Продолжающийся проспективный регистр недавно инициированных методов лечения для легочной гипертензии COMPERA включает взрослых пациентов со всеми формами легочной гипертензии, которые получают ЛАГ-специфическую терапию. Так, с 16 ноября 2012 в базе данных 8% составили 3642 пациента с ЛАГ-ВПС. Средний возраст этих пациентов составил 39 лет, мужчины в 39%, средняя дистанция по тесту 6-минутной ходьбы составила 370±102 метра, функциональном классе по NYHA I/II – в 39%, III – в 59% и IV – в 3% случаев. Среднее качество жизни в визуальной аналоговой шкале из 100 пунктов (EQ-5 D) равнялось 51. Пациенты с ЛАГ-ВПС в 80% случаев получали монотерапию и 9% комбинированную ЛАГ-специфическую терапию и в 11% – лекарства, не относящиеся к терапии ЛАГ. Только в 20% случаев пациенты принимали оральные антикоагулянты. Предполагается, что 4-летняя выживаемость пациентов с ЛАГ-ВПС составила 79%, по сравнению с 72% у больных с идиопатической ЛАГ. Согласно данным регистра, пациенты с ЛАГ-ВПС снизили толерантность к физическим нагрузкам и существенно снизили качество жизни. Они получают комбинированную терапию и оральные антикоагулянты реже, чем пациенты с ИЛГ, однако их выживаемость выше [40].
ВЫВОДЫ
Таким образом, проблема антикоагулянтной терапии при ЛАГ остается актуальной и не решённой по настоящее время. Учитывая наличие доказанных патогенетических механизмов повышенного тромбообразования у таких пациентов, большинство исследователей склоняется в пользу антикоагулянтной терапии. Принимая во внимание результаты, полученные на животных моделях, а также предварительные результаты рандомизированного плацебо-контролируемого исследования с апиксабаном, не исключается положительная роль на прогноз и снижение риска тромбообразования у пациентов, принимающих новые пероральные антикоагулянты, однако это требует проведения дальнейших клинических испытаний.
Список литературы Проблемные аспекты применения оральных антикоагулянтов у пациентов с легочной артериальной гипертензией различного генеза
- Galie' N., Humbert M., Vachiery J.-L. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension//Eur Heart J. -2016. -Vol. 37. -P. 67 -124.
- Чазова И.Е., Мартынюк Т.В., Наконечников С.Н. Итоги Европейского конгресса кардиологов 2015 года: новая версия рекомендаций по диагностике и лечению легочной гипертензии//Евразийский кардиологический журнал. -2015. -Vol. 4. -P. 3-10.
- Olsson K.M., Delcroix M., Ghofrani H.A. et al. Anticoagulation and Survival in Pulmonary Arterial Hypertension Results From the Comparative, Prospective Registry of Newly Initiated Therapies for Pulmonary Hypertension (COMPERA)//Circulation. -2014. -Vol. 129. -P. 57-65.
- Johnson S.R., Granton J.T., Mehta S. Thrombotic arteriopathy and anticoagulation in pulmonary hypertension//Chest. -2006. Vol. 130. -P. 545-552.
- Opitz C.F., Kirch W, Mueller E.A. et al. Bleeding events in pulmonary arterial hypertension//Eur J Clin Invest. -2009. -Vol. 39. -Suppl 2. -P. 68-73.
- Sandoval J., Santos L.E., Cordova J. et al. Does anticoagulation in Eisenmenger syndrome impact long-term survival?//Congenit Heart Dis. -2012. -Vol. 7. -P. 268-276.
- Wagenvoort C.A., Wagenvoort N. Primary pulmonary hypertension: A pathologic study of the lung vessels in 156 clinically diagnosed cases//Circulation. -1970. -Vol. 42. -P. 1163-1184.
- Wagenvoort C.A. Vasoconstrictive primary pulmonary hypertension and pulmonary veno-occlusive disease//Cardiovasc Clin. -1972. -Vol. 4. -P. 97-113.
- Wagenvoort C.A., Wagenvoort N. Pathology of the Eisenmenger syndrome and primary pulmonary hypertension//Adv Cardiol. -1974. -Vol. 11. -P.123-130.
- Huber K., Beckmann R., Frank H. et al. Fibrinogen, t-PA, and PAI-1 plasma levels in patients with pulmonary hypertension//Am J Respir Crit Care Med. -1994. -Vol. 150. -P. 929-933.
- Hoeper M.M., Sosada M., Fabel H. Plasma coagulation profiles in patients with severe primary pulmonary hypertension//Eur Respir J. -1998. -Vol.12. -P. 1446-1449.
- Bonderman D., Turecek P.L., Jakowitsch J. et al. High prevalence of elevated clotting factor VIII in chronic thromboembolic pulmonary hypertension//Thromb Haemost. -2003. -Vol. 90. -P. 372-376.
- Fuster V., Steele P.M., Edwards W.D. et al. Primary pulmonary hypertension: natural history and the importance of thrombosis//Circulation. -1984. -Vol. 70. -P. 580-587.
- Rich S., Kaufmann E., Levy P.S. The effect of high doses of calcium-channel blockers on survival in primary pulmonary hypertension//N Engl J Med. -1992. -Vol. 327. -P. 76-81.
- Johnson S.R., Mehta S., Granton J.T. Anticoagulation in pulmonary arterial hypertension: a qualitative systematic review//Eur Respir J. -2006. -Vol. 28. -P. 999-1004.
- Galie N., Manes A, Negro L. et al. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension//Eur Heart J. -2009. -Vol. 30. -P. 394-403.
- Humbert M., Sitbon O., Chaouat A. et al. Survival in patients with idiopathic, familial, and anorexigen-associated pulmonary arterial hypertension in the modern management era//Circulation. -2010. -Vol. 122. -P. 156-163.
- Frost A.E., Badesch D.B., Barst R.J. et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US Contemporary Registries//Chest. -2011. -Vol. 139. -P. 128-137.
- Badesch D.B., Raskob G.E., Elliott C.G. et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry//Chest. -2010. -Vol. 137. -P. 376-387.
- Hoeper M.M., Huscher D., Ghofrani H.A. et al. Elderly patients diagnosed with idiopathic pulmonary arterial hypertension: Results from the COMPERA registry//Int J Cardiol. -2013. -Vol. 168. -P. 871-880.
- Ling Y., Johnson M.K., Kiely D.G. et al. Changing demographics, epidemiology, and survival of incident pulmonary arterial hypertension: results from the pulmonary hypertension registry of the United Kingdom and Ireland//Am J Respir Crit Care Med. -2012. -Vol. 186. -P. 790-796.
- Henkens I.R., Hazenoot T., Boonstra A. et al. Major bleeding with vitamin K antagonist anticoagulants in pulmonary hypertension//Eur Respir J. -2013. -Vol. 41. -P. 872-878.
- Ngian G.S., Stevens W, Prior D., et al. Predictors of mortality in connective tissue disease-associated pulmonary arterial hypertension: a cohort study//Arthritis Res Ther. -2012. -Vol. 14. -P. 213.
- Storstein O., Efskind L., Müller C. et al. Primary pulmonary hypertension with emphasis on its etiology and treatment//Acta Med Scand. -1966. -Vol. 179. -P. 197-212.
- Ogata M., Ohe M., Shirato K. et al. Effects of a combination therapy of anticoagulant and vasodilator on the long-term prognosis of primary pulmonary hypertension//Jpn Circ J. -1993. -Vol. 57. -P. 63-9.
- Frank H., Mlczoch J., Huber K. et al. The effect of anticoagulant therapy in primary and anorectic drug-induced pulmonary hypertension//Chest. -1997. -Vol. 112. -P. 714-21.
- Kawut S.M., Horn E.M., Berekashvili K.K. et al. New predictors of outcome in idiopathic pulmonary arterial hypertension//Am J Cardiol. -2005. -Vol. 95. -P.199-203.
- Saeed W, Tiawari N., Sardar M.R. et al. Effect of Warfarin on Long Term Pulmonary Arterial Hypertension (PAH) Mortality: Change of facts?//Circulation. -2011. -Vol. 124. -P. A16034.
- Caldeira D., Loureiro M.J., Costa J. et al. Oral anticoagulation for pulmonary arterial hypertension: systematic review and meta-analysis//Can J Cardiol. -2014. -Vol. 30. -P. 879-87.
- Geyer M., Müller-Ladner U. The pathogenesis of systemic sclerosis revisited//Clin Rev Allergy Immunol. -2011. -Vol. 40. -P. 92-103.
- Nikpour M., Baron M. Mortality in systemic sclerosis: lessons learned from population-based and observational cohort studies//Curr Opin Rheumatol. -2014. -Vol. 26. -P. 131-7.
- Komöcsi A., Vorobcsuk A., Faludi R. et al. The impact of cardiopulmonary manifestations on the mortality of SSc: a systematic review and meta-analysis of observational studies//Rheumatology (Oxford). -2012. -Vol. 51. -P.1027-36.
- Elhai M., Meune C., Avouac J. et al. Trends in mortality in patients with systemic sclerosis over 40 years: a systematic review and meta-analysis of cohort studies//Rheumatology (Oxford). -2012. -Vol. 51. -P. 1017-26.
- Tyndall A.J., Bannert B., Vonk M., et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database//Ann Rheum Dis. -2010. -Vol. 69. -P. 1809-15.
- Berger G., Azzam Z.S., Hoffman R., et al. Coagulation and anticoagulation in pulmonary arterial hypertension//Isr Med Assoc J. -2009. -Vol.11. -P. 376-9.
- Johnson S.R., Granton J.T., Tomlinson G.A. et al. Warfarin in systemic sclerosis-associated and idiopathic pulmonary arterial hypertension. A Bayesian approach to evaluating treatment for uncommon disease//J Rheumatol. -2012. -Vol. 39. -P. 276-85.
- Nikpour M., Stevens W., Proudman S.M., et al. Should patients with systemic sclerosis-related pulmonary arterial hypertension be anticoagulated?//Intern Med J. -2013. -Vol. 43. -P. 599-603.
- Preston I.R., Roberts K.E., Miller D.P., et al. Effect of warfarin treatment on survival of patients with pulmonary arterial hypertension (PAH) in the Registry to Evaluate Early and LongTerm PAH Disease Management (REVEAL)//Circulation. -2015. -Vol. 132. -P. 2403-11.
- Calderone A., Stevens W., Prior D., et al. Multicentre randomised placebo-controlled trial of oral anticoagulation with apixaban in systemic sclerosis-related pulmonary arterial hypertension: the SPHInX study protocol//BmJ Open. -2016. -Vol. 6. -e011028.
- Kaemmerer H., Gorenflo M., Hoeper M. et al. Pulmonary arterial hypertension in patients with congenital heart disease: current issues and health care situation//Dtsch Med Wochenschr. -2013. -Vol. 138. -P. 1247-52.
- Delbeck M., Nickel K.F., Perzborn E. et al. A role for coagulation factor Xa in experimental pulmonary arterial hypertension//Cardiovascular Research. -2011. -Vol. 92. -P. 159-168
- Kim N.H., Delcroix M., Jenkins D.P. et al. Chronic Thromboembolic Pulmonary Hypertension//J Am Coll Cardiol. -2013. -Vol. 62(Suppl). -P. 92-99
- Мартынюк Т.В., Дадачева З.Х., Чазова И.Е. Возможности медикаментозного лечения хронической тромбоэмболической легочной гипертензии//Атеротромбоз. -2015. -№ 1. -С. 87-98
- Дьяков И. Новые оральные антикоагулянты -место на отечественном фармацевтическом рынке//Ремедиум. -2015
- Панченко Е.П. Новые пероральные антикоагулянты у больных неклапанной фибрилляцией предсердий и хронической болезнью почек//Атеротромбоз. -2015. -№ 2. С. 51-57


