Проблемы и перспективы использования наноразмерных терапевтических молекулярных композиций в онкологии
Автор: Ольховский И.А., Зуков Р.А., Столяр М.А., Li S.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Актуальность. Развитие технологий конструирования наноразмерных частиц позволило разработать множество экспериментальных молекулярных композиций, демонстрирующих высокий потенциал для улучшения традиционных подходов в лечении злокачественных новообразований. Вместе с тем, лишь единичные препараты успешно проходят третью фазу клинических исследований и получают одобрение для использования в практической деятельности. Анализ преимуществ и недостатков отдельных наноконструкций, проблемы их широкого медицинского применения, а также тенденции дальнейшего развития этого перспективного направления представляют несомненный интерес как для экспериментальной, так и для клинической онкологии. Материал и методы. Проанализированы результаты поиска по научным базам данных PubMed, Medline, по научной электронной библиотеке eLibrary.ru, а также в базе данных регистрации клинических исследований https://clinicaltrials.gov по следующим ключевым словам: nanoparticles, nanomaterials, nanomedicines и cancer (наночастицы, наноматериалы и нанолекарства при раке). Для данного обзора литературы подобраны 62 актуальные статьи зарубежных и отечественных авторов, опубликованные за период с 2015 по 2025 г. Результаты. Преимущества наноразмерных молекулярных композиций во многом обусловлены их способностью к избирательному накоплению в области опухолевого роста, что позволяет обеспечивать целенаправленную доставку противоопухолевых средств и ведет к повышению терапевтической эффективности. Существующие проблемы практического применения данной группы препаратов связаны с обеспечением их стабильности и безопасности, а также с высокой вариабельностью локальных условий микроокружения опухолевых клеток. Заключение. Перспективные направления разработки наноразмерных препаратов сосредоточены на интеграции различных химических компонентов и адресных молекул-лигандов для контролируемой целевой доставки как таргетных противоопухолевых, так и иммуномодулирующих средств.
Наноматериалы, наночастицы, наноразмерные композиции, злокачественные новообразования
Короткий адрес: https://sciup.org/140312771
IDR: 140312771 | УДК: 616-006-08:620.3 | DOI: 10.21294/1814-4861-2025-24-5-140-162
Текст научной статьи Проблемы и перспективы использования наноразмерных терапевтических молекулярных композиций в онкологии
Актуальность. Развитие технологий конструирования наноразмерных частиц позволило разработать множество экспериментальных молекулярных композиций, демонстрирующих высокий потенциал для улучшения традиционных подходов в лечении злокачественных новообразований. Вместе с тем, лишь единичные препараты успешно проходят третью фазу клинических исследований и получают одобрение для использования в практической деятельности. Анализ преимуществ и недостатков отдельных наноконструкций, проблемы их широкого медицинского применения, а также тенденции дальнейшего развития этого перспективного направления представляют несомненный интерес как для экспериментальной, так и для клинической онкологии. Материал и методы. Проанализированы результаты поиска по научным базам данных PubMed, Medline, по научной электронной библиотеке , а также в базе данных регистрации клинических исследований по следующим ключевым словам: nanoparticles, nanomaterials, nanomedicines и cancer (наночастицы, наноматериалы и нанолекарства при раке). Для данного обзора литературы подобраны 62 актуальные статьи зарубежных и отечественных авторов, опубликованные за период с 2015 по 2025 г. Результаты. Преимущества наноразмерных молекулярных композиций во многом обусловлены их способностью к избирательному накоплению в области опухолевого роста, что позволяет обеспечивать целенаправленную доставку противоопухолевых средств и ведет к повышению терапевтической эффективности. Существующие проблемы практического применения данной группы препаратов связаны с обеспечением их стабильности и безопасности, а также с высокой вариабельностью локальных условий микроокружения опухолевых клеток. Заключение. Перспективные направления разработки нанораз-мерных препаратов сосредоточены на интеграции различных химических компонентов и адресных молекул-лигандов для контролируемой целевой доставки как таргетных противоопухолевых, так и иммуномодулирующих средств.
Background. Advances in nanoparticle design technologies have enabled the development of numerous experimental molecular compositions that demonstrate high potential for improving traditional approaches to cancer treatment. However, only a few drugs successfully complete phase III clinical trials and receive approval for clinical use. Analysis of the advantages and disadvantages of nanomedicines, the challenges of their widespread medical application, and further development of this promising field are of undoubted interest to both experimental and clinical oncology. Material and Methods. The results of a search in the scientific databases PubMed, Medline, in the scientific electronic library , as well as in the clinical trials registration database were analyzed for the following queries – keywords: nanoparticles, nanomaterials, nanomedicines and cancer (nanoparticles, nanomaterials and nanomedicines for cancer). For this literature review, 60 relevant articles by internastional and domestic authors published between 2015 and 2025 were selected. Results. Nanosized molecular compositions offer advantages in cancer therapy primarily through selective tumor accumulation, which enables targeted delivery of antitumor agents and leads to increased therapeutic efficacy. The existing challenges in practical application of this group of drugs are associated with ensuring their stability and safety, as well as with the high variability of the tumor cell microenvironment. Conclusion. The prospects of nanodrug development focus on integrating various nanomaterials with targeted ligands to deliver antitumor and immunomodulatory agents directly to tumors, with a focus on personalized strategies that consider individual tumor characteristics.
Одним из наиболее перспективных направлений повышения эффективности терапии злокачественных новообразований (ЗНО) признается развитие технологий, основанных на использовании на-норазмерных (10–200 нм) систем, состоящих из комплекса молекул действующего лекарственного средства, связанных с «транспортными» нано-размерными частицами (nanocarriers), а также с молекулами лиганда, обладающего специфическим сродством к определенным мишеням в случае систем активной адресной доставки. Такие нано-размерные системы обозначаются англоязычными терминами nanoparticles, nanomaterials или Drug Delivery System, а также более конкретными для целей диагностики – nanosensors и для лечебного воздействия – nanomedicines. В русскоязычном варианте более приемлем термин наноразмерные композиции или конструкции (НК). Преимущества терапевтических НК обеспечиваются целенаправленной доставкой лекарственных средств в опухолевую ткань, что ведет к повышению терапевтической эффективности и снижению токсичности по отношению к нормальным тканям. Ряд недавно опубликованных обзорных статей охватывает широкий спектр вопросов разработки, экспериментального тестирования и клинического использования НК для улучшения противоопухолевой терапии [1–7]. Об уровне интереса к этой проблеме свидетельствует нарастающий объем публикаций, индексированных в международных базах данных: за последние 7 лет их количество превысило 50 тыс., в том числе в 2024–25 гг. (за 1,5 года) опубликовано 10,5 тыс. статей.
История разработки средств адресной доставки лекарств насчитывает несколько десятилетий. Первым из одобренных FDA для клинического применения препаратом НК была липосомальная форма доксорубицина. За прошедшие годы были описаны многочисленные молекулярноинженерные варианты НК с различными лекарственными веществами и адресными лигандами в комплексе с наноразмерными транспортерами: белками плазмы крови, полимерными молекулами, сложными углеводами, синтетическими пептидами, мицеллярными и липосомальными струк- турами, модифицированными биологическими мембранами клеток, нуклеиновыми кислотами, а также с различными неорганическими наночастицами (табл. 1). Особый интерес представляют НК, чувствительные к стимулам («умные» НК) [4], физические или химические свойства которых могут значительно измененяться в ответ на изменения в окружающей среде или под действием внешних стимулов, что может обеспечить максимально безопасную направленную доставку лекарств к клеткам-мишеням ЗНО и даже в отдельные внутриклеточные органеллы [7].
Вместе с тем, имеются существенные барьеры трансляции экспериментальных результатов, и в реальной клинической практике до сих пор используются лишь единичные НК. В настоящее время в мире для лечения ЗНО получено одобрение только для 15 НК, при этом около 80 новых противоопухолевых НК проходят оценку в более чем 250 клинических испытаниях [4, 5]. В данном обзоре обобщены современные достижения и проблемные вопросы разработки и клинического использования НК для лечения ЗНО.
Особенности микроокружения опухолевых клеток
Микросреда злокачественного новообразования (МСЗНО) (англ.: tumor microenvironment (TME)) представляет собой сложную экологическую сеть, в которой клоны опухолевых клеток взаимодействуют с окружающими их немалигнизированными клетками и межклеточными структурными элементами. Поскольку именно в этой локальной зоне происходят основные патогенетические процессы канцерогенеза, изучение уникальных особенностей МСЗНО является важной отправной точкой для разработки эффективных противоопухолевых препаратов.
В МСЗНО вовлечены многочисленные клетки: фибробласты, адипоциты, тромбоциты, эндотелиальные клетки сосудов и различные клетки иммунной системы (табл. 2) [8–10]. Благодаря сложному взаимодействию эти компоненты образуют само-поддерживающуюся сеть, которая способствует пролиферации, инвазии и метастазированию опухоли. В этой динамичной системе злокачественные клетки перепрограммируют («обучают») свое микроокружение, реконструируя сосудистую архитектуру и внеклеточный матрикс, чтобы оптимизировать условия выживания опухоли. МСЗНО характеризуется тремя основными патофизиологическими процессами: гипоксией, хроническим воспалением и подавлением противоопухолевых иммунологических реакций.
Атипичная пролиферации опухолевых клеток в МСЗНО приводит к локальному нарушению кровообращения. Гипоксическая среда вызывает экспрессию индуцированных гипоксией транс-криптационных факторов (HIF1а, HIF2а) и фак- тора роста эндотелия сосудов (VEGF) [11, 12], что приводит к образованию многочисленных кровеносных сосудов, неспособных, однако, обеспечить равномерную перфузию и предотвратить дальнейшее формирование локальных гипоксических локусов. Фактор HIF участвует во множестве иммуносупрессивных сигнальных путей, способствуя поляризации макрофагов в проонкогенный фенотип M2, подавляя активность NK-клеток и одновременно увеличивая в злокачественных клетках экспрессию PD-1 и систем активного выброса лекарств из цитоплазмы. Повышенная экспрессия HIF часто ассоциируется с более высокой смертностью пациентов при ЗНО [11]. В связи с этим закономерен интерес исследователей к разработке селективных ингибиторов HIF. В обзоре [13] представлено более 30 различных НК, содержащих малую интерферирующую или антисмысловую РНК для селективного подавления экспрессии HIF.
Ассоциированные с МСЗНО клетки секретируют цитокины, хемокины и факторы роста, формируют хронический провоспалительный потенциал, который действует как катализатор прогрессирования ЗНО, способствуя ремоделированию внеклеточного матрикса, ангиогенезу и подавлению иммунитета [8, 9, 11]. Соответственно, цель применения НК, кроме прямого цитотоксического действия на опухолевые клетки, включает также подавление индуцируемых гипоксией патологических процессов в МСЗНО и восстановление иммунного контроля.
Механизмы проникновения НК в зону МСЗНО
Из-за атипичного ангиогенеза сосудистая структура в МСЗНО отличается от структуры нормальных сосудов. Опухолевые кровеносные сосуды имеют большие межэндотелиальные промежутки с размерами пор от 100 до 2 000 нм, уменьшенный гладкомышечный слой и низкую функциональность рецепторов сосудистого напряжения, что облегчает проникновение НК через стенки сосудов в МСЗНО. Кроме того, в солидных опухолях лимфатические сосуды часто слабо развиты и разрежены, что приводит к нарушению лимфодренажа и нарушению оттока НК. Данный феномен повышенной проницаемости и задержки (ППЗ) (англ. – enhanced permeability and retention effect – EPR) служит основной причиной пассивного накопления НК в МСЗНО [1–6, 8, 14]. В то же время малые молекулы с коротким временем циркуляции не имеют таких преимуществ.
Упомянутый выше липосомальный препарат доксорубицина Doxil® является классическим примером использования эффекта ППЗ. В Doxil® используются липосомы, покрытые полиэтиленгликолем, что увеличивает время их циркуляции в кровотоке, при этом повышается накопленная концентрация препарата в МСЗНО.
Таблица 1/table 1
Варианты структурных компонентов наноразмерных молекулярных конструкций целевой доставки и стимулы высвобождения действующих веществ
Variants of structural components of nanoscale molecular target delivery constructs and stimuli for the release of active substances
|
Химическая основа транспортной системы/ Chemical basis of nanocarriers |
Полисахаридные полимеры – дендримеры, хитозан, мицеллы; Липидные (липосомы, SLNs); биологические мембраны клеток (эритроциты, тромбоциты, химерные мембраны), микровезикулы; Белки (альбумин, трансферрин); Синтетические пептидные конструкции; ДНК-оригами; Неорганические наночастицы углерода (графен, наноалмазы, нанотрубки), кремния (мезопористые материалы), металлов (золота, серебра, железа, меди и др.), магнитные оксиды железа; черный фосфор; металлорганические соединения; Гибридные и топологически гетерогенные наночастицы/ Polysaccharide polymers – dendrimers, chitosan, micelles; Lipids (liposomes, SLNs); biological cell membranes (erythrocytes, platelets, chimeric membranes), microvesicles; Proteins (albumin, transferrin); Synthetic peptide structures; DNA origami; Inorganic nanoparticles of carbon (graphene, nanodiamonds, nanotubes), silicon (mesoporous materials), metals (gold, silver, iron, copper, etc.), magnetic iron oxides; black phosphorus; organometallic compounds; Hybrid and topologically heterogeneous nanoparticles |
|
Действующие вещества (полезная нагрузка)/ Active ingredients (payload) |
Хемотерапевтические препараты (доксорубицин, цисплатин); Таргетные препараты (навитоклакс, трастузумаб, паклитаксель, гемцитабин и др.); Ингибиторы иммунных точек; агонисты IL-2 и рецептора TGF-β; Пептидные и ДНК вакцины; матричные РНК; Антисмысловые, микроРНК и кольцевые circРНК/ Chemotherapeutic drugs (doxorubicin, cisplatin); Targeted drugs (navitoclax, trastuzumab, paclitaxel, gemcitabine, etc.); Immune point inhibitors; IL-2 and TGF-β receptor agonists; Peptide and DNA vaccines; mRNA; Antisense, microRNA and circRNA. Антитела (к EGFR, VEGF, HER2, FGFR3, к P-гликопротеину (P-gp) и др.); Аптамеры (к PSMA, к муцину MUC1, аптамер AS1411, аптамер протеинтирозинкиназы PTK 7, AptHER2, AraHH001 и др.); |
|
Адресные молекулы (лиганды к клеточным мишеням)/ Targeted molecules (ligands to cellular targets) |
Пептидные лиганды (RGD, C16Y, Angiopep-2, RHAMM-таргет-пептиды и др.); Модификации фолиевой кислоты; модификации трансферина; Бактериальные мембраны/ Antibodies (to EGFR, VEGF, HER2, FGFR3, to P-glycoprotein (P-gp), etc.); Aptamers (to PSMA, to mucin MUC1, aptamer AS1411, aptamer of protein tyrosine kinase PTK 7, AptHER2, AraHH001, etc.); Peptide ligands (RGD, C16Y, Angiopep-2, RHAMM-target peptides, etc.); Folic acid modifications; transferrin modifications; Bacterial membranes. |
|
Чувствительность к стимулам освобождения действующих веществ/ Sensitivity to stimuli for the release of active substances |
Эндогенные условия микроокружения: рН; окислительно-восстановительный потенциал; специфически повышенная ферментативная активность (металлопероксидазы, катепсин В, урокиназа, фосфолипаза и др.); повышенная локальная температура Экзогенные стимулы: лазерное световое, ультрафиолетовое, инфракрасное или ионизирующее облучение; ультразвук; электромагнитные поля/ Endogenous conditions of the microenvironment: pH; oxidation-reduction potential; specifically increased enzymatic activity (metal peroxidase, cathepsin B, urokinase, phospholipase, etc.); increased local temperature. Exogenous stimuli: laser light, ultraviolet, infrared or ionizing radiation; ultrasound; electromagnetic fields. |
Примечание: таблица составлена авторами.
Note: created by the authors.
|
Таблица 2/table 2 Компоненты межклеточной среды злокачественной опухоли (МСЗНО) Components of the tumor microenvironment (tMe) |
||
|
Компонент/ Component |
Гетерогенность в МСЗНО/ Heterogeneity in TME |
Роль в канцерогенезе/ Role in carcinogenesis |
|
Опухолевые клетки/ Tumor cells |
Стволовые опухолевые клетки/ Tumor stem cells Активно пролиферирующие/ Actively proliferating Сенильные опухолевые клетки/ Senile tumor cells |
Генетическая нестабильность; Атипичная пролиферативная активность; Секреция провоспалительных цитокинов; Активация ангиогенеза; Перепрограммирование (обучение) функций окружающих клеток; Метаболический «симбиоз»/ Genetic instability; Atypical proliferative activity; Secretion of proinflammatory cytokines; Activation of angiogenesis; Reprogramming (training) of functions of surrounding cells; Metabolic «symbiosis» |
|
Опухолеассоциированные фибробласты/ Cancer-associated fibroblasts – CAFs |
CAF, сдерживающие прогрессию опухоли; CAF, способствующие прогрессии опухоли; CAF, активно секретирующие цитокины; CAF, ремоделирующие внеклеточный матрикс/ CAFs inhibiting tumor progression; CAFs promoting tumor progression; CAFs actively secreting cytokines; CAFs remodeling the extracellular matrix |
Бимодальное влияние. Поддержание пролиферативной сигнализации; Активация ангиогенеза и метастазирования; Воспаление; Избегание иммунного повреждения; Перепрограммирование клеточного метаболизма и формирование метаболического симбиоза/ Bimodal influence. Maintenance of proliferative signaling; Activation of angiogenesis and metastasis; inflammation; avoidance of immune damage; reprogramming of cellular metabolism and formation of metabolic symbiosis |
|
Опухолеассоциированные макрофаги/ Tumor-associated macrophages – TAMs |
Стимулирующий рост опухоли (M2 CD163+CD86+); Ингибирующий рост опухоли (M1 CD64+CD80+)/ Stimulating tumor growth (M2 CD163+CD86+); Inhibiting tumor growth (M1 CD64+CD80+) |
Бимодальное влияние. Фагоцитируют дебрис разрушенных клеток; Продуцируют цитолитические ферменты; Способствуют деградации внеклеточного матрикса; Секретируют провоспалительные цитокины; Усиливают ангиогенез; М2 – основной проопухолевый компонент в МСЗНО/ Bimodal effect. Phagocytose debris of destroyed cells; Produce cytolytic enzymes; Promotes degradation of the extracellular matrix; Secrete proinflammatory cytokines; Enhances angiogenesis; M2 is the main protumor component in TME |
|
Дендритные клетки (ДК), ассоциированные с опухолью/ Tumor-associated dendritic cells (DCs) |
Плазмацитоидные ДК Обычные ДК Воспалительные ДК/ Plasmacytoid DCs Conventional DCs Infammatory DCs |
Опосредуют развитие иммуносупрессии в опухоли; Индуцируют активность клеток Th2, способствующих атителообразованию; Ингибируют функцию CD8+ T клеток киллеров/ Mediate the development of immunosuppression in the tumor; Induce Th2 cell activity that promotes antibody formation; Inhibit the function of CD8+ T-cell killers |
Нейтрофилы/Neutrophils Стимулирующий рост опухоли (N2);
Ингибирующий рост опухоли (N1); Незрелые нейтрофилы (NI);
Нейтрофилы,активно продуцирующие интерфероны (NISG)/
Stimulating tumor growth (N2);
Inhibiting tumor growth (N1);
Immature neutrophils (NI);
Neutrophils actively producing interferons (NISG)
Бимодальное влияние. Секреция интерферонов;
Усиление ангиогенеза;
Воспалительная активация и продукция АФК; Неспецифическое иммуносупрессивное действие; Поддержка метастазирования/ Bimodal effect.
Secretion of interferons;
Enhancement of angiogenesis Inflammatory activation and ROS production;
Non-specific immunosuppressive effect;
Support of metastasis
Продолжение таблицы 2/Сontinuation of table 2
Цитотоксические лимфоциты/ Cytotoxic Lymphocytes
Т-лимфоциты/
T lymphocytes CD8+ CTL
Основной противоопухолевый компонент в МСЗНО. Вызывают апоптоз, некроз и остановку роста, высвобождая INF-γ и другие цитотоксические цитокины; создавая противоопухолевую среду/
The main antitumor component in TME, induce apoptosis, necrosis and growth arrest by releasing INF-γ and other cytotoxic cytokines; creating an antitumor environment
Регуляторные лимфоциты/ Regulatory Lymphocytes
Т-лимфоциты: nTregs, iTregs, T2-MZP/
T-Lymphocytes: nTregs, iTregs, T2-MZP
Тромбоциты/ Platelets
Костномозговой или легочной генерации; Функциональные субпопуляции (прокоагулянтные, агрегационные, иммунокомпетентные)/ Platelets of bone marrow or lung generation;
Functional subpopulations (procoagulant, aggregation, immunocompetent)
Стимулирование роста опухоли.
Подавляют противоопухолевое иммунное действие эффекторных Т-клеток, NK-клеток и DCs;
Секретируют ингибирующие цитокины IL-10, TGF-β;
Создают иммуносупрессивную среду/ Stimulation of tumor growth.
Suppress the antitumor immune action of effector T cells, NK cells and DCs; Secrete inhibitory cytokines IL-10, TGF-β; create an immunosuppressive environment Бимодальное действие.
Участие в презентации неоантигенов; Инициация тромбоза сосудов опухоли;
Образование гетероагрегатов с опухолевыми клетками, защита от иммунной атаки;
Способствуют метастазированию/ Bimodal action.
Participation in the presentation of neoantigens; Initiation of tumor vessel thrombosis; Formation of hetero aggregates with tumor cells, protection from immune attack; Promote metastasis
Миелоидные супрессорные клетки/ Myeloid-derived suppressor cells -MDSCs
M-MDSCs, PMN-MDSCs, eMDSCs
Индуцируют неспецифическую супрессию иммунитета;
Подавляют активность Т-киллеров и NK-клетки;
Индуцируют антигенспецифическую толерантность Т-клеток; Вырабатывают цитокины, которые
Стволовые мезенхимальные клетки/ Mesenchymal stem cells
Дифференцируется в мезенхимальные ткани, такие как костная, хрящевая и жировая ткани, васкулогенная мимикрия/
Differentiates into mesenchymal tissues such as bone, cartilage and adipose tissue, vasculogenic mimicry
Эндотелиальные клетки/ Endothelial cells
поддерживают ангиогенез опухоли; дифференцируется в ТАМ в условиях гипоксии; Способствуют развитию резистентности к терапии/ Induce non-specific suppression of immunity; suppresses the activity of T-killers and NK cells; induce antigen-specific tolerance of T-cells; produce cytokines that support tumor angiogenesis; differentiate into TAM under hypoxic conditions, promote the development of resistance to therapy
Основной компонент стромальных клеток в TME. Формируют преметастатическую нишу;
Способствуют злокачественности процесса/ The main component of stromal cells in the TME and form a premetastatic niche; contribute to the malignancy of the process.
Cодействие поддержанию опухоли. Секретирует ангиокринные факторы, молекулы адгезии; Взаимодействует с опухолевыми клетками посредством секреции микровезикул/
Promote tumor maintenance. Secretes angiocrine factors, adhesion molecules; interacts with tumor cells through secretion of microvesicles.
Адипоциты/ Adipocytes
Обеспечение энергетического резерва;
Секреция экзосом, цитокинов, хемокинов и гормонов, способствующих иммуносупрессии и прогрессированию рака/
Providing energy reserves; secreting exosomes, cytokines, chemokines and hormones that promote immunosuppression and cancer progression.
Окончание таблицы 2/end of table 2
Нейроэндокринные – Стимулирование пролиферативной сигнализации;
клетки/ Секреция нейротрансмиттеров, включая CgA, хромо-
Neuroendocrine cells фильный и вазоактивный полипептид;
Регулирование миграции и активности NK-клеток/
Stimulation of proliferative signaling; secretion of neurotransmitters including CgA, chromophilic and vasoactive polypeptide; regulation of NK cell migration and activity.
Внеклеточные везикулы/ Экзосомы, Бимодальное влияние на опухоль; Межклеточный пере-
Extracellular vesicles микровезикулы, апоптотические нос биологически активных молекул; Участие в регу-тельца/ ляции сигнальных путей, пролиферации, устойчивости
Exosomes, microvesicles, apoptotic к лекарственным препаратам; Перепрограммирование bodies стромальных клеток для создания ниши для выживания/
Bimodal effect on tumor Intercellular transfer of biologically active molecules. Involved in regulation of signaling pathways, proliferation, drug resistance; reprogramming of stromal cells to create a niche for survival.
Межклеточный матрикс/ Неклеточная трехмерная сеть, включа- Участие в передаче межклеточных сигналов роста и Extracellular matrix ющая коллаген, эластин, фибронектин, пролиферации, ингибирование апоптоза. Может способ- протеогликаны, ламинины и гликопротеины/
A noncellular three-dimensional network that includes collagen, elastin, fibronectin, proteoglycans, laminins, and glycoproteins ствовать развитию опухоли, улучшая рост и метастазирование/
Participation in the transmission of intercellular growth and proliferation signals, inhibition of apoptosis. May promote tumor development, improving growth and metastasis.
Примечание: таблица составлена авторами.
Note: created by the authors.
Отдельные НК могут высвобождать лекарственные средства в зависимости от рН среды, оставаясь стабильными в нейтральной среде кровотока, но «разгружать» свою терапевтическую нагрузку в умеренно кислых условиях МСЗНО [4, 15]. Некоторые НК используют включенные в их состав протеолитические ферменты для воздействия на внеклеточный матрикс опухоли и его ремодулирование, способствуя более выраженному накоплению лекарственных средств в опухолевых тканях и повышению их терапевтической эффективности [4, 16].
Вместе с тем, известно, что проявление феномена ППЗ весьма гетерогенно. Он существенно различается между разными пациентами, типами опухолей и даже между первичными опухолями и их метастазами у одного и того же пациента. Соответственно, пассивное накопление и терапевтическая эффективность НК также сильно различаются от опухоли к опухоли и от пациента к пациенту. Зачастую несовпадающие результаты экспериментальной терапии рака, полученные на моделях животных, могут объясняться существенными различиями в строении и размерах тела, а также гемодинамическими и морфологическими особенностями солидных опухолей у человека [8, 14, 17].
Новые подходы к использованию НК для терапии ЗНО заключаются в учете локальных особенностей проявления ППЗ для выбора препарата с оптимальным химическим транспортером, его размером и геометрической формой [17], равно как и возможности параллельной визуализации распределения НК в МСЗНО. Перспективные направления связаны с использованием дополнительных механизмов проникновения НК к опухолевым клеткам посредством трансэндотелиального переноса, использованием в качестве транспортеров модифицированных эндогенных клеток или неиммуногенных бактерий [14, 18].
В отличие от механизмов пассивного накопления НК, активные способы нацеливания сопряжены с модификацией их поверхности специфическими молекулами-лигандами, которые могут адресно связываться с рецепторами-мишенями на клетках, что еще больше снижает токсичность для нормальных тканей и повышает терапевтическую эффективность [1–6]. Например, присоединение к поверхности НК модифицированных молекул фолиевой кислоты, преимущественно связывающихся с фолатными рецепторами FR-beta, сверх-экспрессируемыми примерно в 40 % солидных опухолей человека, позволяет увеличить эффективность доставки НК с цитостатиком в МСЗНО [6]. B. Dutta et al. аналогично использовали НК с модифицированными антителами к HER2 для нацеливания на HER2-позитивные опухолевые клетки [19]. В качестве специфичных к различным опухолевым клеткам лигандов хорошие перспективы продемонстрировали RHAMM-таргет-пептиды, которые одновременно обладают и отчетливым противоопухолевым действием [20]. Наиболее перспективные стратегии предполагают разработку гибридных НК, сочетающих разные химические основы транспортных частиц и комбинацию лиган- дов для активного нацеливания для максимального использования различных механизмов накопления в МСЗНО [4, 6].
Классификация НК в зависимости от химической основы (табл. 1) Полимерные НК
Полимерные НК – наноразмерные структуры, состоящие из природных полимеров или синтетических материалов, таких как полимолочная кислота и полиэтиленгликоль [21]. Такие НК могут принимать разные формы: полимерные мицеллы, дендримеры, конъюгаты полимер-лекарственных средств и полимерные везикулы, каждая из которых имеет свои особенности и область применения. Полимерные мицеллы имеют гидрофобную сердцевину, которая инкапсулирует гидрофобные лекарственные средства, и гидрофильную оболочку, которая улучшает растворимость в воде. Дендримеры обладают разветвленной древовидной структурой, начинающейся с основной молекулы или мономера. Их поверхностные функциональные группы могут быть химически модифицированы для присоединения лекарственных средств, лигандов-мишеней или флуоресцентных зондов. В процессе синтеза дендримеров обеспечивается точный контроль над такими свойствами, как масса, размер, форма и характеристики поверхности. Конъюгаты полимер-лекарственного НК включают химическое присоединение лекарственных средств к полимерным носителям через сложноэфирные, пептидные или амидные связи. Эти связи спроектированы таким образом, чтобы разрушаться при определенных физиологических условиях для контролируемого высвобождения молекул лекарственного средства. Полимерные НК обладают хорошей биосовместимостью и низкой токсичностью. Примером может служить НК-препарат южнокорейской компании Genexol-PM ® - первый полимерно-мицеллярный препарат паклитаксела, одобренный для лечения немелкоклеточного рака легкого (НМРЛ), рака молочной железы, яичников и поджелудочной железы [21].
Несмотря на существующие достижения, полимерные НК сталкиваются с проблемами, которые препятствуют их клиническому применению, включая плохой фармакокинетический контроль, расхождение между доклиническими и клиническими результатами и трудности в их крупномасштабном производстве, что требует дальнейших исследований.
Липидные НК
Липидные НК, такие как упомянутый выше Doxil®, состоят из молекул фосфолипидов с гидрофильными головками и гидрофобными хвостами. Когда эти молекулы образуют липосомы, гидрофильные головки выстраиваются вдоль внутренней и внешней поверхностей бислоя, в то время как гидрофобные «хвостики» группируются в центре бислоя. Размер таких НК обычно составляет от десятков до сотен нанометров. Водное ядро липидных НК обеспечивает защитную среду для инкапсуляции гидрофильных лекарственных средств. Липофильные лекарственные средства встраиваются в гидрофобные «хвосты» бислоя, оптимизируя кинетику высвобождения за счет регулирования липидного состава.
S.A. Dilliard et al. [22] сообщают о разработке липидных НК, селективно воздействующих на отдельные органы и ткани. Они использовали различные составы и соотношения липидных компонентов НК, чтобы обеспечить их взаимодействие со специфическими белками в крови, предотвращая накопление в печени и достигая целевой доставки модифицированной РНК в такие органы, как селезенка и легкие. Вместе с тем, к недостаткам липосом относятся недостаточная загрузка лекарственным веществом, его быстрое высвобождение, а также недостаточная стабильность в кровотоке [5].
В отличие от традиционных липосом, ионизируемые липидные НК построены на основе липидов с уникальной структурой мицеллярного ядра и, как правило, состоят из четырех ключевых компонентов: ионизируемые катионные липиды (а) для образования комплекса с отрицательно заряженными нуклеиновыми кислотами (б), фосфолипиды (в) как структурная основа НК и холестерин (г) для стабильности и более эффективного слияния НК с мембранами клеток. Характер и степень ионизации липосомальной оболочки позволяют более селективно направлять действующее вещество [23].
Липидные НК активно используются для экспериментальной терапии, основанной на малых интерферирующих РНК (миРНК). Описан препарат НК (siFAK + CRISPR-LNPs), созданный на основе мультиплексных дендримерных липидных структур для совместной доставки миРНК киназы фокальной адгезии, мРНК Cas9 и sgRNA для редактирования генома в опухолевых клетках [24].
В целом, липидные НК применимы в широком спектре терапевтических средств – от традиционных цитостатиков до передовых модификаций нуклеиновых кислот и инструментов для редактирования генов, что определяет перспективность их дальнейшей разработки.
НК на основе нативных клеточных мембран
Система доставки лекарств c использованием НК на основе биологических мембран стала объектом исследований благодаря своей хорошей биосовместимости, низкой иммуногенности. В отличие от искусственных липосом, мембраны клеток исходно имеют полезные для дальнейшего инжиниринга рецепторные белки. Опухолевые клетки, которые экспрессируют CD47 на поверхности своей мем- браны, опосредуют сигналы иммунным клеткам «не ешь меня» за счет взаимодействия с «белком регуляции сигнала α» «(SIRPα) на макрофагах, не давая им распознавать опухолевые клетки. Основываясь на этом, L. Rао et al. [25] разработали генно-инженерные везикулы мембранных клеток макрофагов (gCM), содержащих большое количество молекул SIRPα CV1, способных конкурентно связываться с CD47 опухолевых клеток, тем самым снижать их подавляющее действие на макрофаги, обращая вспять иммунное уклонение. Кроме того, авторы дополнительно инкапсулировали в эти везикулы магнитные наночастицы. Полученный в итоге препарат НК «gCM-MN» под влиянием внешнего магнитного поля концентрируется в зоне МСЗНО, где ионы железа генерируют активные формы кислорода (АФК), вызывая обратную поляризацию макрофагов M2 к фенотипу M1, тем самым усиливая противоопухолевые терапевтические эффекты.
Поскольку стабильность эритроцитов в циркуляции также во многом обусловлена наличием на их мембранах ингибирующих фагоцитоз молекул, НК с эритроцитарными мембранами также обладают значительно увеличенным периодом полураспада в крови. D. Wang et al. [26] разработали гибридные НК с сульфидом меди и химерным мембранным покрытием (DCU@[RBC-B16]), в котором были объединены мембраны эритроцитов и клеток меланомы B16 для создания гибридной мембраны. Наночастицы DCU@[RBC- B16] затем были нагружены доксорубицином, что, как и в случае с Doxil ® , привело к усилению его воздействия на опухоль.
Тромбоциты, которые играют ключевую роль не только в гемостазе, но и в регуляции воспаления и иммунных реакций, обладают идеально подходящими способностями проникать в МСЗНО, контактировать и образовывать гетероагрегаты с эндотелиальными клетками сосудов, иммунными и опухолевыми клетками [27]. Первый описанный препарат, покрытый мембраной тромбоцитов TRAIL-Dox-PM-NV с поверхностным лигандом к индуцирующему апоптоз фактору некроза опухоли (TRAIL) и загруженный доксорубицином, поражал опухолевые клетки как в первичных очагах, так и циркулирующие в крови [28]. Недавно описано очередное успешное использование НК на основе модифицированных тромбоцитов: препарат DASA + + ATO@PLT доставляет дазатиниб и атовакуон в МСЗНО опухоли печени. Одновременно продемонстрирована способность DASA + ATO@PLT ремоделировать МСЗНО и уменьшать степень гипоксии в опухоли [29]. Другой препарат модифицированных тромбоцитов nano-Erda@PLT показал возможность избирательно вызывать пироптоз клеток рака мочевого пузыря за счет таргетного воздействия на рецептор FGFR [30].
Микровезикулярные мембраны также рассматриваются в качестве потенциальных платформ для 148
НК. К таким везикулам, окруженным мембраной родительской клетки, относятся также экзосомы, секретируемые разными клетками в нормальных условиях, и апоптотические тельца, образующиеся во время клеточного апоптоза. Согласно экспериментальным и доклиническим данным, применение микровезикул как универсальных транспортеров для НК может заменить синтетические липосомы, благодаря их естественной роли в физиологии тканей, увеличенному периоду полураспада и низкому иммунному воздействию [31, 32].
Разработана система доставки химиотерапевтических препаратов с использованием экзосом, полученных из опухолевых клеток путем экзоцитоза и инкапсуляции пористых кремниевых наночастиц (E-PSiNPs) для целенаправленной химиотерапии. E-PSiNPs обладают высокой способностью воздействовать на опухолевые клетки и стволовые опухолевые клетки. НК препарат DOX@E-PSiNPs, содержащий доксорубицин, усиливает проникновение препарата в сосудистую сеть опухоли и его концентрацию в опухолевых тканях, тем самым повышая эффективность химиотерапии [33].
В целом, НК на основе мембранных систем продемонстрировали хорошую эффективность в терапевтических целях в экспериментах как in vitro , так и in vivo , однако их разработка сталкивается с рядом проблем. На текущий момент база данных клинических испытаний (clinicaltrial.gov) содержит чуть более 80 записей для диагностических и терапевтических целей при раке на основе биомембран по сравнению с более чем 200 активными клиническими испытаниями прочих НК. Внедрение биомембранных препаратов сдерживается вариабельностью источников биомембран, недостаточной стандартизацией и сложностью масштабирования производства, при этом гидрофильные молекулы в отличие от гидрофобных должны быть перенесены в биомембранные носители с помощью механических или химических воздействий, влияющих на нативность биологических мембран. В настоящее время для оптимизации нацеливания и повышения эффективности применяются мостиковые молекулы, РНК-аптамеры и химерные мембраны, при этом наиболее значимым подходом остается специфическая инженерия поверхности мембранных частиц [цит. по 32].
НК на основе альбумина и синтетических пептидов
Человеческий сывороточный альбумин, являясь белком плазмы крови с длительным периодом полураспада in vivo, обладает хорошей биосовместимостью и гидрофильностью, оптимальной для доставки лекарственных средств в составе НК. Модификация поверхности или инкапсуляция лекарственного средства в альбуминовые НК предотвращает быстрое выведение препарата из цир- куляции и способствует его накоплению в МСЗНО за счет феномена ППЗ. Более того, кислотная среда быстро пролиферирующих опухолевых клеток может способствовать лучшему распределению и стабильности наночастиц альбумина. Альбумин за счет своих природных эпитопов, рецепторы для которых высоко экспрессируются во многих опухолевых клетках, позволяет использовать естественный механизм транспорта лекарственного средства в цитоплазму путем его интернализации вместе с альбумином. Альбумин также может быть конъюгирован в НК с другими молекулами-мишенями (например, антителами, пептидами) для дальнейшего повышения специфичности в адресной доставке к опухолевым клеткам.
Еще в 2005 г. НК препарат Abraxane ® , содержащий паклитаксел, связанный с альбумином, был одобрен FDA для лечения рака молочной железы. Позднее его применение было распространено на НМРЛ и рак поджелудочной железы. В ноябре 2019 г. для клинического применения также одобрен Fyarro ® , препарат сиролимуса, связанный с альбумином, для лечения запущенных злокачественных периваскулярных эпителиоидноклеточных опухолей [34]. Опыт клинического применения этих препаратов демонстрирует преимущества альбумина в качестве носителя НК для доставки лекарств. Благодаря достижениям в области биотехнологий системы доставки на основе альбумина будут играть все более важную роль в медицине, о чем свидетельствует большая доля альбуминовых НК среди всех НК, включенных в клинические испытания.
Изменяя аминокислотную последовательность и пространственное расположение пептидных цепочек, можно разрабатывать различные молекулярные конструкции. При определенных условиях пептиды могут самостоятельно собираться в упорядоченные наноструктуры, такие как нановолокна, нанотрубки и наносферы. Это свойство самосборки может быть использовано для создания носителей лекарств, которые инкапсулируют низкомолекулярные лекарственные средства, повышая их стабильность и обеспечивая контролируемое высвобождение. Многочисленные экспериментальные примеры противоопухолевой эффективности различных пептидных НК представлены в обзоре [35].
Вместе с тем, выполнение сложных химических модификаций пептидных цепей в результате изменения размера и поверхностных зарядов может повлиять на биосовместимость НК, вызывая образование антител, воспаление, а также отложение плохо деградируемых молекул в тканях. Для того чтобы самоорганизующиеся пептидные НК были клинически приемлемыми, необходимо дополнительно улучшать технологии производства, профиля их безопасности и эффективности in vivo .
НК на основе молекул нуклеиновых кислот
Основной принцип ДНК-оригами заключается в самосборке множества нитей ДНК. Высокая управляемость, хорошая биосовместимость и функциональная универсальность молекул ДНК делают их перспективными носителями для доставки лекарственных средств. С помощью программируемых методов гибридизации ДНК этим молекулам можно легко придать заданные формы (палочковидная, треугольная, пятиугольная, тетраэдрическая, октаэдрическая и икосаэдрическая), а также модифицировать их функциональными элементами, включая аптамеры, связывающиеся с белками и противоопухолевыми препаратами. Это подчеркивает значительный потенциал НК на основе ДНК как эффективных средств для адресной доставки [36].
Тетраэдрические формы ДНК представляют собой типичную многогранную наноструктуру, позволяя ее модифицировать четырьмя способами: прикреплением к вершинам, закреплением на ребрах, заключением в капсулу внутри каркасообразной структуры или интегрированием в структуру двойной спирали посредством комплементарного сопряжения. Q. Fan et al. изготовили вдыхаемую рН-чувствительную ДНК-тетраэдрическую НК (CP@TDN) для доставки иммуномодулирующих CpG-олигонуклеотидов и нацеленных на PD-L1 ДНК-аптамеров. В кислой среде МСЗНО богатый C-основаниями pH-чувствительный участок ДНК изменяет свою пространственную структуру, и это конформационное изменение освобождает apt-PD-L1 (антагонистический ДНК-аптамер, нацеленный на PD-L1). Свободный apt-PD-L1 затем связывается с PD-L1 на поверхности опухолевых клеток, запуская иммунную активацию, что в итоге способствует лечению метастатического рака легких [37]. Такие молекулы могут также высвобождаться через взаимодействие с комплементарными нуклеиновыми кислотами или под действием ферментов, селективно разрезающих ДНК в определенной последовательности цепочки нуклеотидов [38]. НК на основе ДНК-оригами обладают такими преимуществами, как простая самосборка, стабильные механические свойства, хорошая биосовместимость и устойчивость к нуклеазам. Такие НК перспективны не только в адресной доставке лекарств, но и для применения в биосенсорах, разделении и анализе клеток, технологиях биоизображения. Однако риски того, что тетраэдрические ДНК могут вызывать побочные эффекты in vivo , требуют дальнейшего изучения.
НК на основе неорганических наночастиц
Неорганические наночастицы подразделяются на несколько типов в зависимости от химической структуры: металлические наночастицы, оксидные наночастицы и магнитные наноматериалы [1–6, 40]. Эти наночастицы обладают уникальными физико-химическими свойствами, такими как настраиваемый размер, форма и характеристики поверхности, а также исключительными оптическими и электромагнитными параметрами. В настоящее время несколько препаратов НК на основе металлических наночастиц проходят доклинические и клинические испытания [39]. В качестве компонентов НК наиболее часто используют золото, серебро, железо и медь.
Среди неорганических наночастиц наночастицы золота широко изучаются из-за их универсальности в синтезе, которая включает такие формы, как наносферы, нанооболочки и наностержни. НК на основе золота могут быть функционализированы присоединением на поверхности определенных соединений, чтобы специфически воздействовать на опухолевые клетки и доставлять лекарственные препараты, а их свойства фототермической активации позволяют при близком контакте уничтожать опухолевые клетки.
Наночастицы диоксида кремния характеризуются регулируемой пористой структурой и высокой удельной поверхностью, что также широко используется для доставки лекарственных средств. Эти наночастицы применяются для создания НК с депонированными терапевтическими средствами, включая цисплатин, доксорубицин, пептидные препараты, белковые препараты и нуклеиновые кислоты [39].
Одними из наиболее пригодных для медицинских целей считают НК на основе оксидов железа (superparamagnetic iron oxide nanoparticles (SPIONs)) – магнетита и маггемита [4, 40]. Оксиды железа малотоксичны, широко распространены в живых системах и могут метаболизироваться клетками. Однако главная особенность магнитных наночастиц – их восприимчивость к внешним электромагнитным полям, что может обеспечить управление движением магнитных НК и их направленную доставку. Кроме того, электромагнитное воздействие способно нагреть (в методе гипертермии) или активировать фотохимические процессы (в методе фототермии). Одним из примеров успешного использования оксидов железа служит препарат NanoTherm® для магнитной гипертермии глиобластомы [].
Также описаны противоопухолевые pH-чувствительные магнитные «наногранаты» (PMN), состоящие из самоорганизующихся наночастиц оксида железа и pH-чувствительных полимерных лигандов [40]. Они использовались для визуализации небольших опухолей (<3 мм) с помощью pH-чувствительной T1 МРТ и флуоресцентной визуализации. При этом была отмечена хорошая фотодинамическая терапевтическая эффективность в гетерогенных опухолях с высокой лекарственной устойчивостью.
Хотя применение магнитных НК в медицине пока не соответствует начальным ожиданиям, тем не менее уже доказана практическая возможность реализации направленной магнитной доставки лекарств и методов магнитной гипертермии. Важным преимуществом оксидных наночастиц является их способность детектироваться методами МРТ. Сочетание диагностического и терапевтического потенциала таких НК отвечает современному запросу в медицине [40].
Черный фосфор является наиболее стабильным аллотропом фосфора, его атомы находятся в состоянии гибридизации sp3, что приводит к образованию сморщенных слоев, которые укладываются вертикально и притягиваются друг к другу слабыми ван-дер-ваальсовыми взаимодействиями. Благодаря этому он обладает сильными фототермическими свойствами при воздействии ближнего инфракрасного излучения, что открывает широкий спектр применения в качестве компонента наночастиц для фотоакустической визуализации и терапии злокачественных новообразований (ЗНО) [4].
Квантовые точки обычно представляют собой трехслойную наноразмерную конструкцию из полупроводникового ядра, оболочки и покрывающего вещества. Характеризуются широким спектром поглощения, узкими полосами излучения и высокой фотостабильностью, что позволяет широко использовать их в биологической визуализации. В экспериментальной терапии ЗНО наиболее часто используются квантовые точки с графеновым покрытием из-за их хорошей биосовместимости. Различные лиганды, в том числе пептиды, фолиевая кислота и крупные белки, могут быть присоединены к поверхности квантовых точек для активного нацеливания к клеткам-мишеням. Благодаря своей естественной флуоресценции такие НК особенно хорошо подходят для визуализации клеток. С использованием CISe в качестве ядра, ZnS в качестве оболочки, лигирования марганцем и фолиевой кислотой недавно получена многофункциональная НК – CuInSe2@ZnS:Mn, которая обладает высокой эффективностью флуоресценции в ближнем инфракрасном диапазоне (до 31,2 %) и высокой контрастностью при МРТ, позволяя выявлять минимальные метастатические очаги [41]. Вместе с тем, основным препятствием разработки таких НК является отсутствие оптимизированного процесса производства квантовых точек. Кроме того, в случае потери защитной оболочки освободившиеся металлические ядра таких НК могут вызывать серьезные токсические последствия.
Металлорганические конструкции (англ.: metal-organic framework (MOF)) состоят из органических молекул, создающих оболочку вокруг ионов щелочноземельных или редкоземельных металлов. Поскольку в клетках рака толстой кишки наблюдается накопление H2S за счет гиперэкспрессии цистатионин-β-синтазы, что действует как аутокринный и паракринный фактор, стимулирующий дальнейшее размножение раковых клеток, разработан комплексный препарат НК Cu-MOF (HKUST-1), активируемый H2S, для синергичного воздействия фототермической терапии инфракрасного диапазона и химиотерапии. Эта «включающая» стратегия, основанная на эндогенных биомаркерах, для освобождения терапевтических средств на месте может значительно упростить создание эффективных НК [42]. К сожалению, многие подобные НК при системном введении оказались недостаточно стабильными в организме, кроме того, токсичность ионов металлов ограничила их применение для доставки лекарств.
Современные тенденции в конструировании НК предполагают создание топологически неоднородных композиций, например, таких как биметаллические «частицы Януса», НК с функционально дифференцированным ядром и оболочкой, а также гибридные НК, состоящие из разных химических носителей. Преимущества топологически неоднородных НК заключаются в сочетании сильных сторон разных платформ и обеспечении лучшего контроля загрузки и высвобождения отдельных лекарственных препаратов, а также в улучшении способности преодолевать биологические барьеры [4].
Примеры использования НК для улучшения лучевой терапии ЗНО
НК активно разрабатываются для улучшения эффективности лучевой терапии, с этой целью в основном используют металлические сенсибилизаторы с высоким атомным номером, такие как золото, гадолиний, титан, гафний и тантал. В последнее время появилось много сообщений о различных новых радиочувствительных подходах с помощью наноматериалов, усиливающих генерацию АФК, усиленное потребление внутриклеточного восстановленного глутатиона (GSH), преодоление гипоксии опухоли и различных синергических способах радиотерапии. Наиболее перспективным направлением признается разработка НК, реагирующих на стимулы, в том числе их комбинацию pH/ROS/GSH или X-ray/ROS/GSH [43].
Ярким примером лучевой сенсибилизации является использование НК-препарата NBTXR3, на основе наночастиц диоксида гафния, который одобрен для лечения местнораспространенной саркомы мягких тканей. Внутриопухолевое введение NBTXR3 и последующее облучение вызывают обширную гибель опухолевых клеток и инициируют адаптивные иммунные реакции на высвобождающиеся при разрушении опухолевых клеток антигены [44]. Еще одной многообещающей разработкой является AVPt@HP@M, pH-чувствительный НК препарат. Полимер дофамина, интегрированный с наночастицами Pt (Pt@HP), обладает каталазной активностью, которую можно использовать для преобразования эндогенного H 2 O 2 в O 2 , устраняя гипоксию в МСЗНО. Благодаря мезопористым оболочкам Pt@HP эффективно поглощает апоптин
(AP) и вертепорфин (VP). В сочетании с лучевой терапией он оказывает радиосенсибилизирующий эффект с помощью нескольких стратегий, включая устранение гипоксии, усиление апоптоза опухоли, а также индуцированного радиацией фотодинамического эффекта. Препарат значительно повышает уровень внутриклеточных АФК и, изменяя метаболизм пуринов, нарушает механизмы восстановления ДНК, не вызывая заметной системной токсичности [45].
Фотодинамическая терапия является эффективной неинвазивной терапевтической стратегией, которая может преобразовывать кислород в высокоцитотоксичный синглетный кислород посредством возбуждающего неионизирующего облучения и фотосенсибилизаторов. Фотодинамические свойства ряда содержащих металлы НК были описаны выше. Однако выраженный фотодинамический эффект существенно увеличивает локальное потребление кислорода, что ведет к гипоксии и активации HIF. Чтобы преодолеть опухоль-ассоциированную гипоксию и далее достичь нацеленного на опухоль синергетичного воздействия, была сконструирована биоразлагаемая кислород-производящая НК (Ini@PM-HP), которая состоит из пористого металлоорганического каркаса (PCN-224(Mn)), ингибитора полимеразы (PARP) (Инипариб) (поли АДФ-рибоза) и модифицированной полидофамином гиалуроновой кислоты (HA-PDA). Поскольку гиалуроновая кислота специфически связывается с переэкспрессирован-ными рецепторами (CD44) на опухолевой клетке, Ini@PM-HP предпочитает накапливаться после внутривенной инъекции в МСЗНО, где инипариб может высвобождаться, нарушая восстановление повреждений ДНК и способствуя апоптозу. В то же время хелатирование Mn и производного порфирина (Mn-TCPP) может генерировать O 2 in situ путем реакции с эндогенным H 2 O 2 [46].
Отдельным направлением разработки НК является их использование с целью повышения эффективности хирургических пособий за счет визуализации злокачественных клеток в операционном поле для лучшего контрастирования края резекции [47].
Использование НК в криохирургии
Криохирургия в онкологии – хирургическая методика, основанная на замораживании опухолевой ткани. Она является минимально инвазивной и имеет меньше побочных эффектов, чем традиционная резекция. Однако недостаточное замораживание опухоли и неизбежное повреждение окружающих тканей ограничивают ее эффективность. Нанокриохирургия – сочетание криогенной биомедицины и нанотехнологий. Ее принцип заключается в предварительном введении раствора наночастиц, регулирующих процесс замораживания, для максимальной теплоотдачи, быстрого снижения темпе- ратуры с целью увеличения образования ледяных кристаллов, повреждающих опухолевые клетки. Кроме того, с помощью НК потенциально можно регулировать направление и интенсивность роста повреждающего «ледяного шара».
Для защиты прилегающей здоровой ткани во время криохирургии используются НК на основе липосом со свойствами изменения фазы перехода физического состояния жидкость/кристалл. Такие НК обладают большой латентной теплоемкостью и низкой теплопроводностью, что делает их идеальными при криохирургии [цит. по 5].
Применение НК для повышения эффективности иммунотерапии
Фундаментальным принципом иммунотерапии опухолей является активация иммунной системы за счет повышения ее способности распознавать опухолеспецифические антигены и формирования достаточного пула эффекторных иммунокомпетентных клеток, способных уничтожать злокачественные клетки. Иммунологический противоопухолевый надзор обеспечивается адекватным локальным кровоснабжением тканей и оптимальным взаимодействием иммунокомпетентных клеток, участвующих в контакте с генетически перерожденными клетками. Иммуносупрессивный характер МСЗНО определяется нарушенной васкуляризацией, гипоксией, ацидозом, провоспали-тельным цитокиновым профилем и высокой долей иммунных клеток, толерантных к злокачественным клеткам [1, 2, 4, 5, 9, 10].
Существует несколько подходов в иммунотерапии, направленных на активацию иммунной системы против опухолевых клеток с помощью ингибиторов иммунных контрольных точек (ИКТ), противоопухолевых вакцин, генетически модифицированных лимфоцитов с химерными антигенными рецепторами (CAR-T-клетки) и модуляторами иммунокомпетентных клеток.
Ингибиторы иммунных контрольных точек являются одними из наиболее эффективных и широко используемых стратегий противоопухолевой иммунотерапии, демонстрируя значительную эффективность при различных видах ЗНО. Ингибиторы иммунных контрольных точек блокируют иммуносупрессивные сигнальные пути, тем самым восстанавливая способность иммунной системы распознавать опухолевые клетки. Несмотря на эти преимущества, терапевтическая эффективность традиционных ИКТ часто ограничена из-за неоптимальной целевой доставки, аутоиммунных осложнений и возникновения резистентности. Доставка ИКТ с помощью НК предлагает решение этих проблем. Разработаны НК, которые обеспечивают доставку комплементарных агентов, таких как малые интерферирующие РНК (миРНК), для прямого подавления синтеза белков внутриклеточных сигнальных путей «контрольных точек»
и для перепрограммирования клеток иммунного микроокружения в МСЗНО [48].
Y. Liu et al. [49] разработали наночастицы Ru@ ICG-BLZ, способные реполяризовать макрофаги в направлении фенотипа M1, тем самым восстанавливая их противоопухолевую активность. Эти наночастицы обладают хорошей способностью к загрузке лекарственного средства, и при попадании в МСЗНО высвобожденный препарат BLZ-945 специфически ингибирует сигнальный путь CSF-1/ CSF-1R, что приводит к фенотипическому сдвигу макрофагов от M2 типа к противоопухолевому типу M1. НК Ru@ICG–BLZ также увеличивают секрецию макрофагами оксида азота и IL-12, усиливая противоопухолевый иммунный ответ. Кроме того, эти НК индуцируют фототермическую абляцию солидных опухолей с минимальным повреждением окружающих тканей.
Аналогичным образом действует иммунотерапия, направленная на лимфоциты Treg, которые ограничивают активность эффекторных Т-клеток киллеров и NK-клеток в МСЗНО. Sato et al. использовали фотоиммунотерапию в ближнем инфракрасном диапазоне для избирательного снижения уровня Treg посредством нацеливания на их мембранный белок CD25. Эта стратегия устраняла функциональные ограничения со стороны Treg и приводила к активации CD8+ Т-киллеров и NK-клеток, восстанавливая локализованный противоопухолевый иммунитет в МСЗНО [50].
Разработка противоопухолевых вакцин представляет собой одно из самых перспективных направлений в иммунотерапии рака, НК при этом могут быть полезны для целевой доставки антигенов в презентирующие их клетки. Противоопухолевые вакцины включают клеточно-опосредованные (дендритные) вакцины, пептидные вакцины, а также вакцины, основанные на внедрении в клетки специфических последовательностей нуклеиновых кислот ДНК или мРНК для эндогенного синтеза антигенов-мишеней [51]. Несмотря на многообещающие ранние результаты, применение дендритных вакцин сталкивается со значительными проблемами. Их производство является трудоемким и дорогостоящим, а их эффективность при опухолях на поздних стадиях остается ограниченной.
Несколько противоопухолевых дендритноклеточных вакцин одобрены для клинического применения. Известные примеры включают Hybricell для лечения меланомы (2004), DCVax-Brain для лечения глиобластомы (2007) и Sipuleucel-T для лечения рака предстательной железы (2010) [5]. Десятки дендритных вакцин проходят клинические испытания I–II фазы [52].
Исследование ATALANTE-1 является рандомизированным контролируемым клиническим исследованием III фазы, включающим для HLA-A2-позитивных пациентов с прогрессирующим НМРЛ, резистентных к ИКТ. В нем оценивали эффективность пептидной вакцины OSE2101 в сравнении со стандартной химиотерапией. Было показано, что OSE2101 значительно увеличивает медиану общей выживаемости при вторичной резистентности к ИКТ, при удовлетворительном профиле токсичности [53].
Достижения в области технологий секвенирования нуклеиновых кислот позволяют прогнозировать характеристики опухолеспецифических неоантигенов путем идентификации мутаций в опухолевых экзонах и аномальных процессов транскрипции и трансляции мРМК, что позволяет разрабатывать поливалентные персонализированные вакцины. Опубликованы результаты пилотного клинического исследования NCT02956551, в котором после предварительного полногеномного секвенирования ДНК и РНК в образцах опухоли легких пациентов с помощью биоинформаци-онного анализа были рассчитаны оптимальные аминокислотные последовательности различных опухолеспецифических неоантигенов. Синтезированные на этом основании пептиды ex vivo внедряли в антиген-презентирующие клетки для получения персональной Neo-DCVac вакцины. Продемонстрировано, что Neo-DCVac значительно улучшает результаты лечения распространенного рака легких [54].
Для производства персонализированных вакцин также используют технологии непосредственного внедрения в клетки специально синтезированной РНК для инициации синтеза эндогенных белков, содержащих эпитопы антигенов, специфичных для конкретной опухоли [55–57]. Эти белки в дальнейшем перерабатываются в пептиды через лизосомальные пути и представляются молекулами HLA для распознавания CD4+ и CD8+ Т-клеткам и В-клеткам. Различные липидные НК могут использоваться для внедрения РНК в клетки-мишени [55, 57]. мРНК-противоопухолевые вакцины обладают рядом преимуществ перед другими типами вакцин. Во-первых, не проникшие в клетки-мишени мРМК быстро гидролизуются РНКазами, предотвращая их накопление в организме и сводя к минимуму возможные побочные эффекты. Искусственные мРНК могут одновременно кодировать несколько опухолевых антигенов, формируя комплексный ответ. В отличие от ДНК-вакцин, которые для эффективности должны проникать в ядро клетки, мРНК-вакцины функционируют в цитоплазме и не интегрируются в геном хозяина. Это устраняет риск мутаций, связанных с интеграцией генома, что теоретически делает вакцины на основе мРНК более безопасными, чем вакцины на основе ДНК.
C.D. Palmer et al. [58] исследовали (NCT03639714) персонализированную гетерологичную неоан-тигенную вакцину, сочетающую аденовирус шимпанзе (ChAd68) и самоамплифицирующуюся мРМК (samRNA), в сочетании с ИКТ для пациентов с запущенными метастатическими солидными опухолями. Показано, что комбинированная терапия безопасна и способна вызывать устойчивый иммунный ответ.
Для более длительной циркуляции и лучшей эффективности были предложены варианты использования кольцевых молекул РНК (circRNA) и двухцепочечных РНК (dsRNA), которые повышают стабильность молекул и эффективность экспрессии белковых продуктов [59, 60].
В 2023 г. опубликованы результаты I фазы клинических испытаний персонализированной мРНК-вакцины Цевумеран (Autogene cevumeran) в комплексной терапии рака поджелудочной железы. Это тип индивидуальной неоантигенспецифиче-ской иммунотерапии на основе липоплексной НК, содержащий модифицированную мРНК, с транскриптами, которые кодируют до 20 неоантигенов, идентифицированных в удаленной опухоли. Исследование показало, что у 50 % пациентов развились специфические Т-клеточные иммунные реакции. Примечательно, что ни у одного из этих пациентов не было рецидива опухоли в течение 18 мес [61]. Компания BioNTech в сотрудничестве с Genentech анонсировала старт II фазы клинических испытаний и расширение показаний к использованию вакцины (NCT05968326; NCT04486378; NCT03815058; NCT03289962).
Значительным прорывом в терапии меланомы признана недавно одобренная FDA комбинация ингибитора ИКТ пембролизумаба и липидной НК mRNA-4157/V940, включающей 34 последовательности мРНК неоантигенов опухоли [62]. В 2024 г. фармацевтические компании инициировали третью фазу клинических испытаний данной комбинации для терапии НМРЛ. Успех мРНК-вакцин в этих испытаниях подчеркивает их высокий терапевтический потенциал, устраняющий ограничения традиционных низкомолекулярных препаратов
Проблемные вопросы и перспективы клинического использования НК
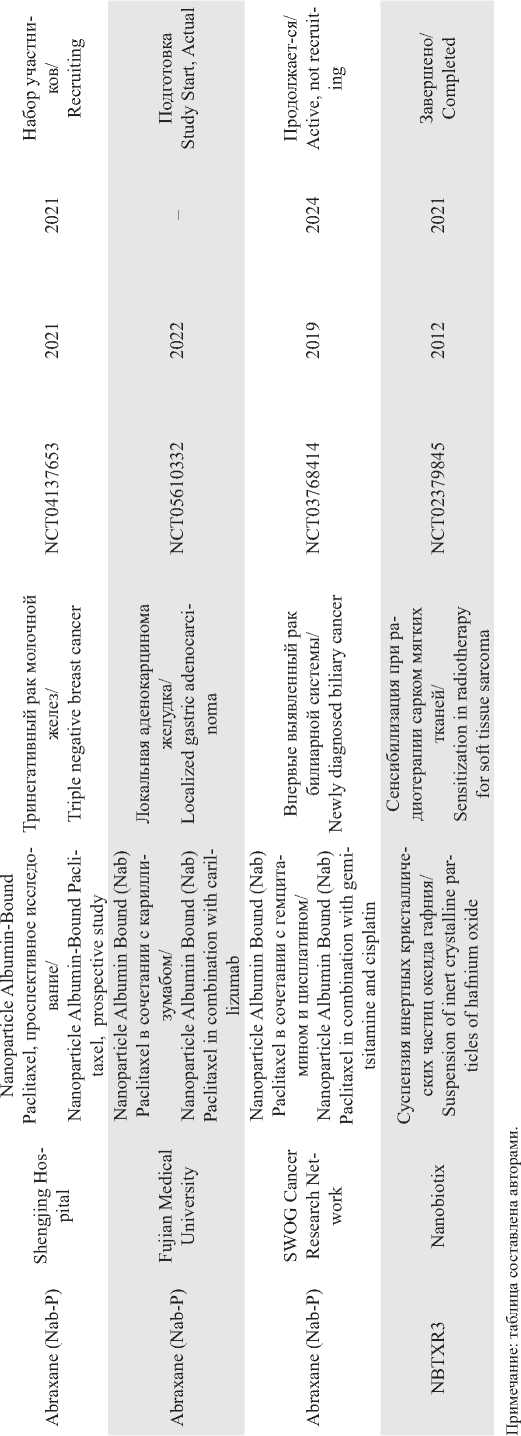
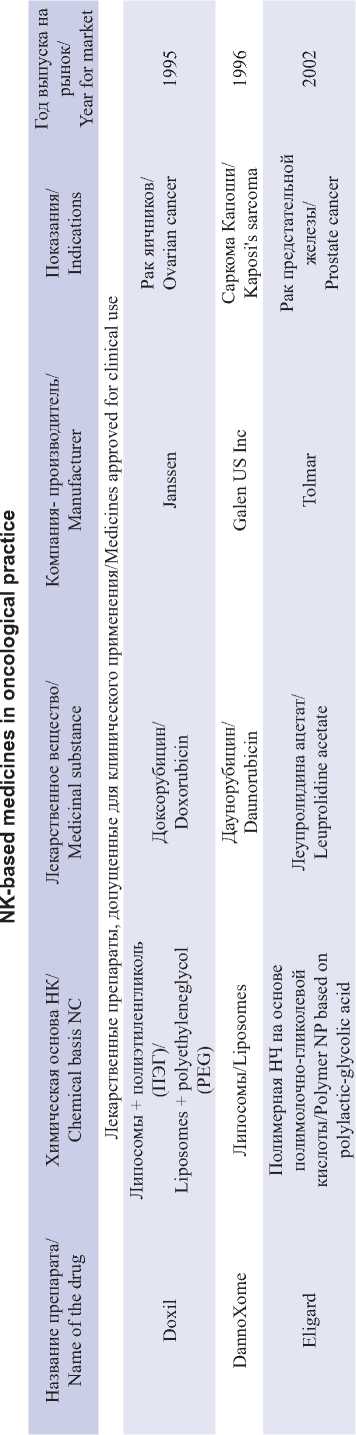
В связи с бурным развитием нанотехнологий ежегодно возрастает и объем исследований, направленных на разработку противоопухолевых НК. Однако лишь небольшая часть новых НК доходит до клинических испытаний. Согласно данным официальной регистрации (https://clinicaltrials. gov), только 24 терапевтических НК находятся на III фазе клинических испытаний (табл. 3) и лишь несколько препаратов одобрено к клиническому применению (табл. 4). Каждая отдельная НК имеет особые проблемы в своей клинической практике, но большинство сталкиваются с похожими проблемами, которые можно разделить на биологические, технологические и связанные с дизайном исследования [4, 5].
Биологические проблемы включают торможение биораспределения препарата из-за образования морфологических барьеров для проникновения в
Таблица 3/table 3
a
со о Р О ^ о
й
и
га й
s
ьо й 1
о и га
i
Z
| ё
я
и
о
Z га
й о
о ю га к
й
о
Z
Z
Z
Z й Z эй й
У
Z
га
эй z й О
2 и га Р эй
Z X Й
Й Й
й и *
й
о
И м о
п
И СО р 2
р
га
Ph и
5Й Й
m
га и га
S
й р й й g
с
Эй
И
га
га
о о
I и
-р
Эй
И й
ч
2 и га
В
га р £
S
Эй z
“
О 2 и га
ffl
■ Е
Е р
И й
В
р
ш
X
Эй
И й
ч
2 и га
Эй 3 й
га
z
I
Й о
й й
га
о
й и *
га
га ад и й
га
§
Z
Z
§ о
эй jS
О -
га z й z
Й
о
U
О
о
В
й
Е -2 р ад р о
Й
Ч и
й
.ад
"га
о
и га
z га й
га
га й й
Z 2
й га И
2 о й
£
Е
я
S
§
й й й га
га й о
й
га й
й
о
° ^
W .о
2 44
2 Он
й
В й
= о
2 Z й
С
а
о
га со О
га
га
й о
о
И га к
й
га й
и га
К
я о Н й 2 р га !—7 Р ^
"га & Р
UQ ад ■ Е -
Q
й о
я
2 §
га т
й
о
й ^ й га к
рад2
О га
в о я га ЕЕ га
О
га й-i й й о га
га
■5
о
В
й
й о а
й й £ й Е р
о р
5 Он
Й
Р й
га га О
га
й б
Н й
2 р га ср ^
ffl
"га о §Э Е
QQ ад .а
х й1
I
й о
га
о
°?
.а а й
га
Р
О
§
Й
га й
й
л
X
5 й
р
~га
га
Эн й о га ■
^ й га
2 о и S ю га
S
§
S й й га
й о
га
га
В и О в
1 .2
в а о о
й га
га
о
°?
.а а й
2 О z й -Й О
га
О га
о
га
га
pH
о
Ри Й
га
z z z га
5 й о в й
а
В о °? й а й
о е о
й
S й й га
2 о ч я
га
о °? .а
о
о
£ й
В о °?
й а й
га й z и о
й
га
я .2
га
р
§
й о
1
о о
й о
< .а
а
Z Z
Z га
й о
О z z
о
га ,
5 й
р
§
о
а й
га ,
ГН
р о
- га
га
р
га
В
га
га
га ей
й
о °? .а
га X О
£ й
й .§
ей га < .В
•р о
О^
й
га
§
Продолжение таблицы 3/Сontinuation of table 3
|
s ~o 45 £ ед ОЙ CL М О то ой £ L ^ ^ L ' го X ед ед |
й \ $ ® ой « * *3^1 ед ед ^ ед ед ед ед ед , ед ед ед ед |
|
ед о ед ед ед чо ед ед 04 ТГ 40 ед ед оо ед |
ед ед о ед ед ед ед ед ед ед ед 04 ед ед м ^ ед ед ед ^ ед ед ед ед 04 ОО 40 ед ОО о ед М О 71- 40 Н ИНИН и и и и £ z £ z £ |
genes
|
Из1 я й |
1 Jh - w -йО 2 d |
Окончание таблицы 3/end of table 3
Продолжение таблицы 4/Сontinuation of table 4
й
£
Эй О z
О й О 2 и га
X
^
Эй О И й о й о
2 и га
га р
(ffl
~га
О
й ад
я о
ад га
й
га S о □ га и о
О
§
й га й й п й
О
й
И й й 2 и и га
о
О
га
Е
a
й о
2 й о
ffl
-О
§ Эй и й о
О га
эй
О И й
О
2 в в
эВ
О
га
й о
2 га
Z
2 га с
га
га
й га
с
га
га ^ и S
й
о
га й w
S В 2 В
Ё
Й
га г
й га
X
га р. о § Z
■ S Е я
о й о о га й ffl к w га й
й § й g й и й й
га
га _ п й \ га
га
о
ад
и
й
2 й й о X
й й о й й
р
п я
й й о и
я
■Д
о
Е
о
х о
<£ S
о X га о « Е о й I га о S 2 о о о Й й ■ В о и О га г о й га й й й й га Эй О И й й О eq X га й о й о р о Й й й .g я ^ Эй § й о й о ю о о ок й ад га га о £ 2 о о о Й й ■ В о и О 5 й Е о га га й' ^ о и га й га § Эй и й й и Z 2 Эй О й О й ад-S 5 £ S S р —* Й га эй й й га со О й и в д § О .3 Л 'й га И О И й X 2 о о о и и • В о и О О S X й и га га Z S й ■ о Й га о s U S о о о Й й ■ В о и О О и га й га й и га Е 1 S р я X га О га о га В р и га о s яя га й й й й § й й X й й га § X Й о is О X о ,о р о й о й • S га М X й о й о о и й о а й X й й й о й о га 2 й й С га Й Й й га о S й z г z е й о Z и S Й га й ^ р о S в я га a О Й й й й й й е и □ о й и S п га й И О о S й й га о й о ад р о I о S га .X й X к X й z га о и X z й Й О й О га Й й Й S й 2 • й и ад о Z й Й Z я й Й га о и X й 2 • о и й 2 о z га й и Z 1 тЗ й га Е о § й й й й га И й га s' X ад й о ■'й £ ■я ■д к й й о й о S и й й I й о 2 о Й со И й р S й й га .3 ffl Q if й й о S в я й й • ад о о ; й га га Окончание таблицы 4/end of table 4 МСЗНО, а также весьма вариабельные механизмы деградации НК в организме. В случае внутривенного введения могут наблюдаться существенные вариации в удержании НК лекарственного средства и, соответственно, уровне его проникновения к целевым клеткам. Вероятно, магнитные НК могут быть использованы для преодоления этой проблемы при использовании трехмерных магнитных полей для управления их движением в организме. Несмотря на то, что НК состоят из исходно биобезопасных материалов, конструкция в целом может приобретать плохо прогнозируемую токсичность из-за таких факторов, как размер и форма частиц, общая площадь поверхности, растворимость и агломерация. Известно, что НК могут оседать в нормальных тканях с воспалительными, окислительными и цитотоксическими последствиями. Здоровые клетки часто страдают от свободных радикалов, генерируемых НК, содержавшими металл. Варианты НК с более биосовместимыми веществами, такими как хитозан, и материалами, которые распадаются после облучения инфракрасным светом, могут стать потенциальным решением. Еще одна проблема биораспределения НК – это их поглощение фагоцитирующими макрофагами. Попытки покрытия НК материалами, которые предотвращают образование «короны» за счет собственных белков крови, не показали существенных результатов. В настоящее время для влияния на функцию макрофагов и перепрограммирование в МСЗНО в качестве стратегии защиты от неспецифического фагоцитоза выбраны воздействия НК на сигнальные пути «не ешь меня: CD47-SIRPα» . Технологические проблемы относятся к возможностям масштабирования производства. Большинство НК, которые используются в исследованиях in vivo и in vitro, обычно производятся небольшими партиями, а масштабирование довольно часто технологически сложно осуществимо либо очень затратно. Прогнозирование клинической эффективности на этапе конструирования НК с учетом технологических возможностей производства является наиболее сложной задачей. Использование математического моделирования на основе экспериментальных результатов при имитации биологических параметров МСЗНО, = например в модели «органы-на-чипах», а также Q- потенциала систем искусственного интеллекта в i анализе накопленной базы знаний могут улучшить и прогнозы эффективности и производительности s НК уже на начальном уровне разработки. о Проблемы дизайна клинических исследований, * 2 такие как размер популяции, цель и время воздействия, могут в значительной степени нивелировать потенциально позитивный эффект препаратов. Сея a рьезной проблемой является то, что до сих пор НК практически никогда не используются в качестве 1 терапии первой линии, где могли бы максималь-S' s но проявиться их терапевтические эффекты, а в случае применения принципов персонализированной медицины должны исполняться требования к особому формату клинического исследования единственного случая (n=1). При этом для индивидуального прогнозирования альтернативных вариантов терапии необходимо учитывать множество факторов, таких как коморбидность, генетические особенности пациента и его опухоли, анализ прошлых медицинских историй и т.д. Заключение Разработка и внедрение в клиническую практику НК определяют перспективные тренды развития лечения ЗНО, дополняя и улучшая традиционные подходы хирургических методов, химиотерапии, лучевой терапии и иммунотерапии. Использование НК повышает стабильность противоопухолевых средств в циркуляции, обеспечивает их контролируемое высвобождение в зоне МСЗНО и позволяет воздействовать на противоопухолевый иммунный ответ. Вместе с тем, по сравнению с огромным количеством экспериментальных исследований в клинической практике используется только несколько препаратов на основе НК. Существующие


