Проблемы и перспективы совершенствования молекулярно-генетической диагностики для назначения таргетных препаратов в онкологии
Автор: Гервас П.А., Литвяков Н.В., Попова Н.О., Добродеев А.Ю., Тарасова А.С., Юмов Е.Л., Иванова Ф.Г., Черемисина О.В., Афанасьев С.Г., Гольдберг В.Е., Чердынцева Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 (62), 2014 года.
Бесплатный доступ
Последнее десятилетие молекулярно-нацеленная, или таргетная, терапия заняла доминирующее место в онкологии. В качестве основных мишеней могут выступать многочисленные элементы сигнальных путей, связанные с регуляцией клеточного цикла и апоптоза, нарушение которых ассоциировано со злокачественным ростом. Одной из мишеней выступает рецептор эпидермального фактора роста (EGFR), активация которого происходит при раке лёгкого, колоректальном раке, плоскоклеточном раке головы и шеи, раке молочной железы, меланоме и др. Для блокирования EGFR-опосредованного онкогенного сигнального пути созданы низкомолекулярные тирозинкиназные ингибиторы, пептид-ассоциированные цитотоксины и моноклональные антиEGFR антитела. Однако в ряде исследований (FLEX, SATURN, INTEREST, IPASS) было показано, что клиническая эффективность применения таргетных препаратов оказалась ниже ожидаемой, в первую очередь, не произошло увеличения такого показателя, как время до прогрессирования опухоли. Причиной этого несоответствия может быть отсутствие селекции больных с учетом дополнительных молекулярных маркеров чувствительности и/или резистентности в результате мутаций или генетического полиморфизма. Ведущая роль в несовпадения реального и ожидаемого эффекта таргетных препаратов отводится феномену внутриопухолевой гетерогенности, т.е. сосуществованию в пределах одной опухоли клеток с различными биологическими свойствами, которые обусловлены генетическими, эпигенетическими, фенотипическими особенностями опухолевых клонов. Для повышения эффективности таргетной терапии необходим поиск новых драйверных мишеней и создание препаратов, направленных против них, а также разработка мультитаргетного подхода. Кроме того, чрезвычайно важным является вопрос об использовании генетического тестирования для мониторинга эффективности проводимого лечения, поскольку терапия сама по себе служит мощным фактором клональной эволюции, приводящей к появлению резистентных клонов опухолевых клеток
Рецептор эпидермального фактора роста (egfr), молекулярное тестирование, таргетная терапия, внутриопухолевая гетерогенность
Короткий адрес: https://sciup.org/14056420
IDR: 14056420 | УДК: 616-006-07-08:576.3:577.21:615.277.3
Текст обзорной статьи Проблемы и перспективы совершенствования молекулярно-генетической диагностики для назначения таргетных препаратов в онкологии
В последнее десятилетие молекулярно-нацеленная, или таргетная, терапия занимает доминирующее место в мировых исследованиях в области онкологии [5, 18, 25, 26, 34, 40]. Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США FDA (Food and Drug Administration, USA) одобрено более 40 таргетных препаратов . Новые препараты ежегодно изучаются в сотнях доклинических и клинических программ. Апробируются различные схемы, в которых таргетные препараты назначаются в монорежиме, в комбинациях друг с другом, в сочетании с химиопрепаратами. Таргет-ная терапия, по сравнению с конвенциональной химиотерапией, имеет ряд преимуществ: индивидуализация назначения, более низкая токсичность, таблетированные формы большинства препаратов исключают необходимость госпитализации и позволяют больным радикально не менять образ жизни. Использование таргетных препаратов позволяет улучшить клиническую эффективность лечения в целевых группах, а также снизить его себестоимость за счет отказа от заведомо неэффективных вмешательств [23, 24, 27, 29].
В настоящее время на территории РФ под патронажем общества химиотерапевтов RUSSCO осуществляется программа «Совершенствование молекулярно-генетической диагностики в РФ» для назначения таргетных препаратов, которая предусматривает создание и развитие сети лабораторий молекулярной диагностики по всей территории России. Любой врач-онколог, желающий выполнить тест на мутацию EGFR/RAS/ALK, должен заполнить анкету и зарегистрировать заявку на сайте или по телефону «горячей» линии. Отправка материала, тест на мутацию и доставка ответа осуществляются бесплатно. Благодаря действующей программе при наличии соответствующей мутации врач может персонализированно назначить пациенту лечение таргетным препаратом.
Сигнальный путь эпидермального фактора роста EGFR как мишень для таргетной терапии
В качестве основных мишеней целенаправленной терапии могут выступать многочисленные элементы сигнальных путей, связанные с регуляцией клеточного цикла и апоптоза, нарушение которых ассоциировано со злокачественным ростом. Рецептор эпидермального фактора роста (EGFR), или HER1, – трансмембранный гликопротеин с молекулярной массой 170 kD, обладающий тирозинкиназной активностью, является наиболее хорошо изученной мишенью. EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции клеточного роста и дифференцировки. EGFR состоит из трех участков: внеклеточного лиганд-связывающего домена, трансмембранного гидрофобного участка и внутриклеточного тирозинкиназного домена. В роли лигандов выступают экскретируемые нормальными и/или опухолевыми клетками ростовые факторы EGF (epidermal growth factor) и TGF-a (transforming growth factor-a), которые аутокринным и/или паракринным путем регулируют активность рецептора. Активация
EGFR происходит после связывания одного из специфичных лигандов с внеклеточным доменом, последовательных конформационных изменений в виде гомо- или гетеродимеризации рецептора и реакции фосфорилирования тирозиновых остатков внутриклеточного домена, что приводит к значительному усилению внутриклеточных сигнальных импульсов. В результате всех этих взаимодействий активированная тирозинкиназа через специальные белки запускает целый каскад внутриклеточных процессов, передающих импульс к ядру клетки, тем самым инициируя клеточную пролиферацию и ряд других биологических эффектов, ответственных за опухолевую прогрессию: адгезию и инвазию трансформированных клеток, включение антиапоп-тотических механизмов. Более того, лиганды EGFR – TGF-a и EGF могут индуцировать процессы опухолевого ангиогенеза за счет гиперэкспрессии васкулярного эндотелиального фактора роста (VEGF, vascular endothelium growth factor) [11, 16]. Основные механизмы активации EGFR-зависимых сигнальных путей в опухолевых клетках обеспечиваются: 1) мутацией тирозинкиназного домена гена EGFR и, как следствие этого, его аутоактивацией при отсутствии факторов роста, приводящей к неконтролируемой пролиферации; 2) гиперэкспрессией EGFR; 3) избыточной продукцией факторов роста – лигандов EGFR (TGF-a, EGF) [7].
EGFR активирован во многих опухолях человека: раке лёгкого, колоректальном раке, плоскоклеточном раке головы и шеи, раке молочной железы, меланомах и др. Существует несколько вариантов блокирования онкогенного эффекта, реализуемого через активированный EGFR: 1) использование низкомолекулярных ингибиторов, способных воздействовать на внутриклеточный, несущий мутацию домен EGFR, и прерывать процесс тирозинкиназного фосфорилирования; 2) применение рекомбинантных пептидных лигандов EGF и/ или TGF-a, конъюгированных с проникающими внутрь клетки цитотоксинами; 3) использование моноклональных антител, связывающих экстрацеллюлярный участок рецептора или образующих неактивный комплекс с его лигандами EGF и TGF-a. В настоящее время к клиническому применению разрешены 9 ингибиторов передачи сигнала в клетки (иматиниб, сунитиниб, сорафениб, лапатиниб, гефитиниб, эрлотиниб, дазатиниб, нилотиниб, пазопаниб) и 5 моноклональных антител (тра- стузумаб, ритуксимаб, бевацизумаб, цетуксимаб, панитумумаб) [10].
Ингибиторы тирозинкиназ в лечении немелкоклеточного рака легкого (НМРЛ): возможные причины резистентности
Низкомолекулярный тирозинкиназный ингибитор гефитиниб (Иресса) одобрен в 2003 г. FDA для лечения химиорезистентного диссеминированного НМРЛ. Доказана эффективность назначения этого препарата при наличии у пациентов мутаций в 18– 21 экзонах гена EGFR [12, 28]. Следует отметить, что частота активирующих мутаций EGFR , которые обусловливают чувствительность к ингибиторам тирозинкиназ (ИТК), существенно варьирует в разных популяциях. Так, активирующие EGFR мутации в европейской популяции встречаются примерно у 5–15 % пациентов с аденокарциномами, в Азии – у 40–50 % пациентов, в России этот показатель достигает 20 % [4]. Ответ на терапию гефитинибом в популяции пациентов НМРЛ с мутацией гена EGFR выявил невиданную ранее, практически 100 %, частоту объективных ответов, а медиана времени до прогрессирования опухоли почти вдвое превышала исторический контроль [6, 33, 35].
Большинство таргетных препаратов, применяемых в том числе при местнораспространенном и метастатическом НМРЛ, зарегистрированы на основании результатов больших рандомизированных клинических исследований III фазы. Однако существует ряд исследований (FLEX, SATURN, INTEREST, IPASS), где ожидаемые и наблюдаемые клинические показатели эффективности лечения таргетными препаратами не совпадают, включая первичную цель – увеличение времени до прогрессирования опухоли [6]. Причинами для столь различных результатов эффективности препаратов, обладающих одинаковым механизмом действия, могут быть ошибки дизайна исследований, различия в дозах назначаемых препаратов, потенциальный антагонизм с цитостатическими препаратами, также может иметь значение отсутствие селекции больных с учетом дополнительных молекулярных маркеров чувствительности в результате мутаций или генетического полиморфизма. Очевидно, сегодня найдены далеко не все биомаркеры, которые могли бы предсказать эффект от таких препаратов, и не известно, есть ли для всех (или большинства) пациентов относительно небольшая польза или
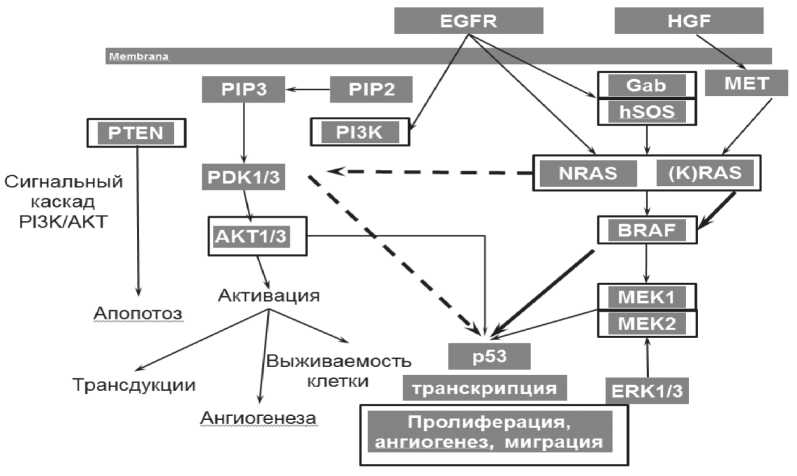
Рис. 1. Сигнальные пути гена EGFR (адаптировано из [34])
существенный эффект наблюдается у какой-то незначительной части больных, но он «растворяется» в общей группе.
С другой стороны, уже на начальных клинических этапах тестирования ИТК многими исследователями было отмечено, что развитие выраженного эффекта при НМРЛ наиболее вероятно у женщин, лиц азиатской расы, больных с опухолью железистого и, в частности, бронхиолоальвеолярного строения, а также никогда не куривших пациентов [2]. Следовательно, на основании более чем 10-летнего изучения особенностей НМРЛ с мутацией EGFR в настоящее время можно говорить о необходимости изучения клинической эффективности назначения таргетных препаратов с учетом дополнительных маркеров чувствительности (резистентности), расовой принадлежности пациентов, включенных в исследование. Отсутствие эффекта ИТК при наличии целевой мутации рецептора EGFR может быть обусловлено тем, что клеточные сигнальные пути могут быть активированы не только вследствие мутации в тирозинкиназном домене соответствующего рецептора, но и включения сигнальных путей в результате повреждения других участников внутриклеточного каскада. Чаще всего это происходит в результате мутаций онкогенов, кодирующих или регулирующих соответствующие элементы киназных каскадов: фосфатидилинозит-3-киназу (PI3K), ras-белок, raf-киназу, митогенактивированную протеинкиназу (MAPK), PTEN (рис. 1). Вполне логично, что сигнальные пути, стимулированные таким образом, не поддаются коррекции с помощью ингибиторов тирозинкиназ EGFR. В этих случаях для остановки или ослабления митогенного сигнала должны быть использованы ингибиторы перечисленных выше сигнальных белков. Встречаются единичные сообщения об одновременном выявлении мутации в генах EGFR и KRAS, которые ассоциируются со снижением чувствительности к ИТК EGFR, так как мутации гена KRAS запускают EGFR-опосредованный путь через Ras/MAPK каскад вне зависимости от наличия мутации EGFR, обеспечивая неконтролируемое клеточное деление (рис. 1) [11].
Амплификация гена MET, кодирующего рецептор фактора роста гепатоцитов (HGFR, hepatocyte growth factor receptor), ассоциируется со вторичной резистентностью к ингибиторам тирозинкиназ EGFR. Амплификация МЕТ обнаружена в 20 % образцов опухолей легкого, резистентных к таргетной химиотерапии ИТК, причем данные по частоте ее выявления широко варьируют – от 1,4 до 21 %, в зависимости от метода определения и пороговых значений, выбранных исследователями. Амплификация МЕТ выявляется при плоскоклеточном раке и аденокарциноме легкого, независимо от наличия мутаций KRAS и EGFR [2, 31]. Также могут возникать генетические нарушения, отменяющие ответ на ИТК. Например, в ходе лечения НМРЛ гефитинибом более чем у половины пациентов регистрируется селекция клеток, содержащих вторую мутацию гена EGFR 20 экзона – Т790М, эта замена ассоциирована с конформационными изменениями рецептора и приводит к резистентности к терапии ИТК. Установлено, что новый необратимый ингибитор мутированного EGFR – Афатиниб (afatinib, Gilotrif, Tomtovok, Tovok) может проявлять активность по отношению к опухолям с мутацией Т790М [9].
Таким образом, для повышения эффективности лечения пациентов с НМРЛ необходимы поиск новых мишеней и создание направленных против них препаратов. Кроме того, чрезвычайно важным является вопрос о возможности использования генетического тестирования для мониторинга эффективности проводимой терапии, которая сама по себе служит мощным фактором клональной эволюции, приводящей к появлению резистентных клонов опухолевых клеток (новых драйверных мутаций), что может сделать необходимым назначение другого препарата [15].
Перспективы мультитаргетного подхода к терапии злокачественных новообразований
Необходимо помнить, что механизм внутриклеточной передачи сигнала – это сложный комплексный процесс, а НМРЛ является гетерогенным заболеванием со множеством молекулярных нарушений на различных уровнях сигнального пути. Все это обосновывает целесообразность клинического использования «мультитаргетного» подхода, подразумевающего одновременное назначение нескольких таргетных препаратов или применение одного препарата, действующего сразу на несколько мишеней. Так, с учетом имеющихся на данный момент знаний о патогенетически значимых нарушениях в сигнальном каскаде EGFR на 14-й Всемирной конференции по вопросам лечения рака легкого (ASCO, 2012) испанская группа по изучению рака легкого представила алгоритм лечения больных с НМРЛ, который может появиться в клинической практике в ближайшем будущем [22]. На первом этапе у пациента оценивается мутация гена EGFR, при положительном результате рекомендуются ингибиторы EGFR (гефитиниб или эрлотиниб), в случае отсутствия мутации EGFR проводится поиск транслокации ALK и/или мутации KRAS. При положительном тесте на ALK назначается кризо- тиниб, при отрицательном – оценивается мутация HER2 и при ее наличии рассматривается лечение афатинибом. При выявлении мутации KRAS можно рассмотреть возможность лечения ингибиторами MEK, а при отсутствии мутации KRAS оценивается мутация в гене BRAF с последующими рекомендациями назначения ингибиторов RAF.
ALK-мутация – это внутрихромосомная перестройка (транслокация) короткого плеча 2-й хромосомы, ведущая к образованию химерного онкогена EML4/ALK. Понимание роли ALK-мутации в развитии немелкоклеточного рака легкого стало одним из важнейших шагов в дальнейшей расшифровке генома этого заболевания и расширении возможностей персонализации его лечения. В ходе «Программы совершенствования молекулярно-генетической диагностики в РФ» RUSSCO предоставляется возможность выявления ALK-транслокации методом FISH-тестирования как единственным методом, одобренным FDA, Международной ассоциацией по изучению рака легкого (IASLC) и Ассоциацией молекулярных патологов (США) [39, 44].
Raf-киназа – серин-треониновая киназа, представленная тремя изоформами (ARAF, BRAF, CRAF), участвует в передаче сигнала от рецептора к ядру клетки по тому же сигнальному пути ras/raf/ MEK/MAPK (рис. 1). Ген BRAF кодирует серинтреониновую киназу, участвующую в передаче сигналов пролиферативного каскада. В норме активация белков семейства RAF происходит только при поступлении к клетке сигнала к делению. Активация данного сигнального пути в трансформированных клетках наблюдается в результате мутации вышележащего ras-белка (K-Ras) либо вследствие мутации непосредственно самой raf-киназы (BRAF), которые отмечаются в небольшой подгруппе больных НМРЛ. Как правило, мутации EGFR и KRAS – взаимоисключающие события. Появление первого специфического ингибитора мутированного BRAF – препарата «Вемурафениб» – пробудило интерес к систематическому выявлению мутации 1799T > A, приводящей к замене валина на глутаминовую кислоту в позиции 600 (V600E) гена BRAF. В дальнейшем было установлено, что до 15–20 % активирующих событий гена BRAF составляют точковые замены V600K, V600R, V600D и V600M [23, 30].
Таким образом, может быть выделена дополнительная популяция больных НМРЛ, в которой целесообразно проведение терапии ингибиторами raf-киназы, а не ингибиторами EGFR. Это обстоятельство требует отдельных исследований для прояснения вопроса об эффективности назначения вемурафениба при вышеупомянутых нуклеотидных заменах.
Моноклональные антитела против EGFR в таргетной терапии
Другой путь активации EGFR-зависимых сигнальных путей в опухолевых клетках обусловлен гиперэкспрессией гена EGFR за счет амплификации его локуса. Подобная амплификация локуса EGFR отмечается при колоректальном раке (КРР) и плоскоклеточных опухолях головы и шеи. Гиперэкспрессия EGFR опухолевыми клетками, как правило, ассоциируется с поздними стадиями и метастатическим фенотипом заболевания и, соответственно, коррелирует с плохим прогнозом [1, 37]. Моноклональные антитела (Mab) к рецепторам EGFR-семейства блокируют рецептор, прикрепляясь к его внеклеточному домену, и конкурируют при этом с естественными лигандами – факторами роста EGF, TGF-a и др. В этих условиях стимуляции рецептора и инициации дальнейшей передачи сигнала внутрь клетки не происходит, а рецептор подвергается деградации. Цетуксимаб (Эрбитукс) – химерное моноклональное антитело, специфичное к EGFR, уже одобрено к клиническому использованию у больных метастатическим колоректальным раком (мКРР), резистентным к химиотерапии иринотеканом, а также у пациентов с опухолями головы и шеи в комбинации с лучевой терапией [4, 13]. При мКРР происходит активация EGFR-RAS/MAPK сигнального пути. В Ras-зависимом сигнальном пути ключевую роль играют белки семейства Ras.
Суперсемейство Ras включает H-Ras, K-Ras, N-Ras гомологичные белки. Прикрепленные к внутренней стороне клеточной мембраны белки Ras являются первыми членами каскада киназ, которые приводят к активации тирозинкиназных сигнальных путей с последующей транскрипцией генов. Доказано, что активация генов семейства Ras, за счет мутаций сводит на нет эффект ингибирования EGFR моноклональными антителами при терапии мКРР (рис. 1) [4, 17, 36, 43]. Мутации в гене KRAS в опухолях толстой кишки встречаются в 30–60 % случаев. Наиболее часто мутации KRAS определяются в экзоне 2, кодонах 12 и 13. Однако описаны мутации в экзоне 3, кодоне 61 и в экзоне 4, кодонах
117 и 146. Мутации в гене NRAS (в идентичных экзонах и кодонах) при КРР составляют до 5 %. Мутации в гене HRAS при аденокарциноме толстой кишки не описаны. Самым изученным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS . Наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому моноклональные антитела назначают только больным мКРР с диким типом гена KRAS [19, 20].
Предиктивное значение мутаций в разных генах семейства RAS неодинаково, и отсутствие результатов крупных проспективных рандомизированных исследований пока не позволяет применять дифференцированный подход при обнаружении разных видов мутаций. Так, опубликованы данные о зависимости эффективности лечения метастатического колоректального рака от статуса мутации KRAS. У пациентов с G13D мутацией цетуксимаб в сочетании с химиотерапией достоверно улучшал, по сравнению с химиотерапией, частоту ответов и выживаемость без прогрессирования. У пациентов с G12V и другими типами мутаций подобных отличий не выявлено [41, 42]. Влияние мутаций гена NRAS и BRAF на эффективность таргетной терапии анти-EGFR моноклональными антителами (пани-тумумаб) изучалось у пациентов с мКРР, и было показано их негативное влияние на результаты лечения [32, 36]. Активация мутированного пути Ras проявляется в том, что активированный K-Ras приводит к гиперпролиферации, а активированный NRAS подавляет апоптоз, что полностью нивелирует терапевтический эффект антител [32, 38].
Внутриопухолевая гетерогенность как фактор ограничения эффективности таргетной терапии
При внедрении в клиническую практику таргет-ной терапии считалось, что для любого таргетного агента можно будет определить мишень на опухолевых клетках конкретного больного, а наличие или отсутствие такой мишени будет четко коррелировать с клинической эффективностью, что оказалось не совсем верным. Одной из причин несовпадения реального и ожидаемого эффекта таргетных препаратов является феномен внутриопухолевой гетерогенности – сосуществование в пределах одной опухоли клеток с различными биологическими свойствами, которые обусловлены генетическими, эпигенетическими, фенотипическими особенностями опухолевых клонов [3, 8, 15].
Внутриопухолевая гетерогенность является одной из важнейших причин, ограничивающих эффективность таргетной терапии, и оказывается главным препятствием на путях ее развития. Вну-триопухолевая гетерогенность предполагает наличие клеток с уникальными геномами и разными свойствами, обеспечивающими разные потенции к прогрессированию и резистентности к терапии, в пределах одной опухоли, а также предполагает различия между клетками первичных и вторичных опухолей и обеспечивает их разную чувствительность к терапии. Отсутствие мутаций в клетках первичной опухоли не гарантирует, что их не будет в клетках метастазов. Внутриопухолевая гетерогенность является существенным фактором снижения эффективности диагностики (ввиду невозможности иметь образцы со всех участков опухоли при постановке диагноза), поэтому могут быть получены некорректные результаты молекулярного тестирования об отсутствии мутации или о наличии мутации при низкой представленности мутантных клонов в опухоли и на этом основании приняты ошибочные решения о назначении таргетной терапии [8, 14, 15]. Одной из современных методологий изучения внутриопухолевой гетерогенности является лазерная микродиссекция, позволяющая прицельно выделять из тканей морфологически различающиеся клеточные варианты, что позволяет характеризовать свойства отдельных клонов опухоли как основу внутриопухолевой гетерогенности. Сотрудники НИИ онкологии имеют многолетний опыт работы на оборудовании фирмы Carl Zeiss, Germany (лазерный микродиссектр (PALM MicroBeam), микроскопы Axio Scope A1 и Axio Star plus), что позволило получить оригинальные результаты о функционально-генетических особенностях морфологической гетерогенности опухолей, которые являются основой для разработки персонифицированных подходов к диагностике и лечению [3].
Представления о феномене внутриопухолевой гетерогенности указывают на существование различных механизмов чувствительности к таргетным препаратам в различных участках опухоли, которые могут быть и не связаны с известными мутациями генов-мишеней таргетных препаратов [14, 21]. Следует особо отметить, что лекарственная терапия является одним из мощных факторов клональной эволюции опухолей, приводящей к изменению ее популяционного состава и, соответственно, изменению чувствительности (резистентности) к назначенному таргетному препарату в процессе терапии [21, 25]. При появлении рецидивов и отдаленных метастазов молекулярное тестирование позволяет прояснить, какие мишени могут быть объектом воздействия на этапах лечения.
Поскольку развитие фундаментальных представлений о разнообразии молекулярных механизмов опухолевой прогрессии идет практически вровень с последними достижениями молекулярногенетических технологий, для многих вновь выявленных мишеней нет стандартных методов и тест-систем детекции, поэтому необходима постоянная оптимизация технических условий и организационных алгоритмов молекулярного тестирования. В этих условиях чрезвычайно важным является контроль качества исследований лабораторий, вовлеченных в программу совершенствования молекулярной диагностики в России, который систематически проводит RUSSCO в тесном сотрудничестве с известными зарубежными специалистами.
Таким образом, очевидна потребность клинического внедрения и расширения возможностей технологии молекулярного тестирования для эффективного принятия решений о назначении молекулярно-направленной терапии онкологических больных. При этом необходима оптимизация подходов на основе учета популяционной специфики, объективных условий, связанных с наличием внутриопухолевой гетерогенности, а также организационно-технических возможностей. Все это внесет значимый вклад в совершенствование молекулярно-генетической диагностики в онкологии.
Работа поддержана грантом компании ОПТЭК № 9/2013.


