Продолжительность жизни больных метастатическим почечно-клеточным раком в Российской Федерации: результаты многоцентрового регистрового исследования Rensur3
Автор: Тимофеев И.В., Варламов И.С., Петкау В.В., Сафина С.З., Зуков Р.А., Мажбич М.С., Стаценко Г.Б., Варламов С.А., Зайцев И.В., Новикова О.Ю., Красный С.А., Нургалиев Н.С., Попова И.Л., Владимирова Л.Ю.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.9, 2019 года.
Бесплатный доступ
Введение. Данные по общей выживаемости (ОВ) пациентов с метастатическим почечно-клеточным раком (мПКР) в реальной жизни публикуются редко. Задача регистрового исследования RENSUR3 заключалась в сборе сведений по применению разных вариантов терапии при мПКР в условиях реальной клинической практики и оценке ОВ в популяции российских пациентов. Методы. Пациентов ретроспективно идентифицировали в 8 онкологических центрах в разных регионах России и включали в исследование, если диагноз мПКР был установлен в период с января 2015 г. по декабрь 2016 г. Анонимные сведения собирали онлайн, регистр охватывал демографические характеристики, а также данные по терапии и исходам. Результаты. В исследование для анализа было включено 573 больных, 65,6 % из них составили мужчины. Средний возраст пациентов на момент постановки диагноза мПКР составил 63,1 года, при этом 14,5 % были в возрасте ≥75 лет. 72 % прошли хирургическое лечение по поводу первичной опухоли; светлоклеточный и несветлоклеточный рак был выявлен у 84 % и 16 % пациентов, соответственно...
Метастатический почечно-клеточный рак, лекарственное лечение, таргетная терапия, иммуноонкология, регистр, продолжительность жизни
Короткий адрес: https://sciup.org/140243821
IDR: 140243821 | DOI: 10.18027/2224-5057-2019-9-2-45-52
Текст научной статьи Продолжительность жизни больных метастатическим почечно-клеточным раком в Российской Федерации: результаты многоцентрового регистрового исследования Rensur3
В 2015 году в Российской Федерации было диагностировано 22 846 новых случаев почечно-клеточного рака (ПКР) [1]. На ПКР приходится приблизительно 4,6% от всех злокачественных новообразований. Медиана возраста на момент постановки диагноза данного заболевания у пациентов с различными стадиями составляла 62,1 года. Европейский стандартизованный по возрасту показатель заболеваемости ПКР был 9,77 на 100 000 населения в 2015 году в сравнении с 7,64 в 2005 году [2]. За эти 10 лет абсолютное количество пациентов, у которых был выявлен ПКР, выросло на 42,73%.
В России в 2015 году было зарегистрировано, в совокупности, 5302 случая смерти, связанных с раком почки. Несмотря на стабильность показателей смертности, стандартизованных по возрасту, которые составляли от 3,58 в 2005 году и 3,27 в 2015 году, в 2015 году было выявлено на 410 случаев смерти больше, чем десять лет назад.
Данные по общей выживаемости (ОВ) пациентов с метастатическим ПКР публикуются редко [3,4]. До настоящего времени нет сведений о продолжительности жизни больных метастатическим ПКР, диагноз которого впервые был установлен в 2015 году. В практических рекомендациях по лечению метастатического ПКР обобщены данные клинических исследований [3,5]. Однако популяции отдельных исследований могут не отражать результаты лечения в реальной жизни — они могут быть лучше, чем у пациентов в повседневной практике. Во всем мире регистры являются источником информации о реальной продолжительности жизни, а также методах лечения, влияющих на нее [6].
Задача регистрового исследования RENSUR3 заключалась в сборе сведений по применению разных вариантов терапии при метастатическом ПКР в условиях реальной клинической практики и оценке ОВ в популяции российских пациентов, у которых метастатический ПКР был впервые выявлен в 2015 году.
Методы
Пациенты
Пациентов ретроспективно идентифицировали в 8 онкологических центрах (8,2% от общего количества онкологических учреждений в России в 2015 году [7]) в разных регионах (Астрахань, Барнаул, Екатеринбург, Казань, Красноярск, Омск, Ростов-на-Дону, Хабаровск). Врачи собирали и представляли обезличенные сведения пациентов онлайн с помощью регистра, охватывающего демографические характеристики, а также данные по лечению и его исходам. Пациентов включали в исследование, если у них был впервые диагностирован метастатический ПКР в интервале с января 2015 года по январь 2016 года. Для включения в исследование пациенты должны были соответствовать следующим критериям: наличие гистологически подтвержденного ПКР и возраст ≥18 лет на момент постановки диагноза. Если нефрэктомия пациенту не выполнялась, то для подтверждения диагноза ПКР до начала системной терапии проводилась биопсия первичной опухоли. Пациентов, получавших терапию в рамках клинических исследований, в это исследование не включали. В исследование включались все пациенты, соответствующие критериям, в данном регионе за указанный период.
Исследование RENSUR3 соответствовало правилам Хельсинкской декларации. Протокол исследования был одобрен главными исследователями и этическими комитетами каждого из исследовательских центров.
Критерии оценки
Первичной конечной точкой этого исследования являлась 3-летняя ОВ. Другие результаты, представляющие интерес, включали медиану ОВ, характеристики пациентов и схемы лечения (применявшиеся методы хирургического лечения и системной терапии).
Прогрессирование заболевания оценивали на основании радиологических и клинических данных, а маркерами прогрессирования заболевания были смена терапии и смерть. Также были изучены схемы перехода от терапии первой линии к терапии четвертой линии. Переход к следующей линии терапии определялся как смена лечения в результате прогрессирования заболевания или из-за токсичности. В медицинской документации некоторых пациентов не было данных по всем параметрам; в надлежащих случаях использовали доступные данные по этим пациентам.
Статистический анализ
Это исследование является ретроспективным когортным. Для описания исходных характеристик пациентов и схем терапии применялась сводная статистика (средние показатели, медианы и доли). Время выживаемости вычисляли со дня начала терапии до дня смерти (ОВ). Оценку кривых выживаемости проводили по методу Каплана-Мейера. Для оценки связей между исходами, демографическими факторами и схемами терапии использовали анализы по Каплану-Майеру и логранговые сравнения. Все статистические анализы проводили с помощью программы IBM SPSS StatisticsBase v. 22.0 (производства компании SPSS, Inc., Чикаго, Иллинойс, США).
Таблица 1. Характеристики пациентов
|
N (%) |
|
|
Возраст, лет (разброс) |
63,1 (24-95) |
|
Пол |
|
|
Мужской |
376 (65,6) |
|
Женский |
197 (34,4) |
|
Хирургическое вмешательство в анамнезе |
|
|
Нефрэктомия |
413 (72) |
|
Подтип ПКР |
|
|
Подтип определен |
311 (54) |
|
Светлоклеточный ПКР |
262 (84)1 |
|
Папиллярный ПКР |
22 (7)1 |
|
Хромофобный ПКР |
17 (6)1 |
|
Другие |
10 (3)1 |
|
Подтип не определен |
262 (46) |
|
Группа прогноза в соответствии со шкалой MSKCC |
|
|
Благоприятный |
79 (26)2 |
|
Промежуточный |
167 (56)2 |
|
Плохой |
53 (18)2 |
|
Не определен |
256 (45) |
|
Нет данных |
18 (3) |
1 Частота гистологического варианта среди пациентов с установленным подтипом ПКР.
2 Частота встречаемости каждой группы риска оценивалась среди пациентов, у которых прогноз был определен по шкале MSKCC (Мемориальный онкологический центр имени Слоуна и Кеттеринга).
Результаты
Характеристики пациентов
В это исследование для анализа было включено, в совокупности, 573 взрослых пациента с метастатическим ПКР. Случаев исключения больных из этого исследования не было. Среднее количество пациентов в одном регионе составило 72 (от 11 до 119). У всех пациентов был подтвержден метастатический процесс. Средний возраст на момент постановки диагноза заболевания составлял 63,1 года (разброс от 24 до 95 лет). 55% пациентов были моложе 65 лет; 14,5% пациентов — в возрасте 75 лет и старше. Большинство пациентов было мужского пола (65,6%).
У 72 % больных для лечения локализованного местнораспространенного ПКР или в качестве циторедуктивного подхода при метастатическом ПКР была выполнена нефрэктомия или резекция почки. У 160 (28%) пациентов первичная опухоль не была удалена. Случаи резекции метастазов или локальной терапии не встречались. У всех пациентов до начала лекарственной терапии ПКР был подтвержден гистологически или цитологически, тем не менее, подтип опухоли в соответствии с классификацией
Таблица 2. Структура системной терапии у пациентов с распространенным ПКР в исследовании RENSUR3.
Число случаев и частота назначения препарата в одной или нескольких линиях терапии
|
Препарат |
Число случаев и частота назначения препарата от общего количества назначений (n=399), N (%) |
|
Интерферон альфа |
161 (40,4) |
|
Сорафениб |
75 (19) |
|
Бевацизумаб + интерферон |
66 (16,5) |
|
Сунитиниб |
42 (10,5) |
|
Эверолимус |
14 (3,5) |
|
Акситиниб |
12 (3) |
|
Пазопаниб |
11 (2,8) |
|
Темсиролимус |
10 (2,5) |
|
Ниволумаб |
1 (<1) |
|
Другие препараты (химиотерапия, тамоксифен) |
7 (1,8) |
ВОЗ (светлоклеточный рак или другой вариант) описывался только у 311 (54 %) пациентов. Светлоклеточные и несветлоклеточные опухоли определялись у 262 (84%) и 34 (16%) больных из числа пациентов с установленным подтипом, соответственно. Прогноз по критериям MSKCC оценивался в 55% случаев. Характеристики пациентов представлены в табл. 1.
Лекарственное лечение. Ответ на терапию
Триста семь (54%) пациентов получили системную терапию, основанную на назначении препаратов в разных линиях, в 399 случаях, по поводу метастатического заболевания. Лекарственное лечение не проводилось 266 (46%) больным. Пожилые пациенты (65 лет и старше) реже получали какую-либо терапию, чем более молодые. Так, среди пожилых терапию получили только 44% больных, что ниже показателя во всей популяции. В группе более молодых пациентов терапия проводилась в 61% случаев, что выше среднего показателя в общей группе (P=0,033). Значительных различий по частоте системной терапии у пациентов разного пола выявлено не было (P>0,1).
Из тех больных, кто получил системное лечение, только одна линия терапии проводилась 220 (71,7%) пациентам. 87 (28,3%) пациентов получили две и более линии (75 (24,4%) — 2 линии, 9 (2,9%) — 3 линии, 3 (1 %) — 4 линии). Таргетная терапия была назначена 160 (52,1 %) больным. Другие виды лекарственного лечения применялись у 147 (47,9%) пациентов. Самым частым вариантом лекарственного лечения был интерферон (n=161). Число случаев и частота назначения препаратов в одной или нескольких линиях терапии представлены в табл. 2. Медиана продолжительности всех линий терапии составила 10 месяцев (95 % ДИ 7,6–12,4).
Основной причиной прекращения лечения было прогрессирование заболевания (86%). В результате нежелательных явлений терапия была отменена у 9% пациентов. Случаев смерти, связанных с проводимой терапией, в этом исследовании не отмечено.
Информация об оценке объективного ответа на проводимое лечение оказалась доступна у 262 больных. Частота полных ответов составила 6,5%, которые были зарегистрированы только у пациентов, получающих таргетную терапию.
Общая выживаемость
При медиане времени наблюдения 40,3 месяца 3-летняя выживаемость больных метастатическим ПКР составила 21%, однолетняя ОВ — 52%, а медиана ОВ — 12 месяцев (95% ДИ 11,1–12,9). При оценке связи выживаемости с назначением и линиями терапии, а также индивидуальными демографическими факторами продолжительность жизни пациентов, получивших терапию, была достоверно лучше, чем пациентов без лечения (медиана 15,1 месяца по сравнению с 6,9 месяца, Р<0,0001), равно как и у пациентов, получивших вторую линию терапии (медиана 18,4 месяца) по сравнению с пациентами, прошедшими только первую линию терапии (10,9 месяца, Р<0,001). Из 102 больных, которые были живы на момент последней оценки, 52 (61%) пациента получили 2 линии таргетной терапии. В качестве терапии первой линии преобладало назначение сунитини-ба или комбинации бевацизумаба с интерфероном. Аналогичная картина наблюдалась при рассмотрении перехода на третью и четвертую линии терапии, хотя при этом и не было достигнуто статистической значимости, вероятнее всего, из-за ограниченного количества пациентов в этой группе. Больные младше 65 лет имели достоверно лучшую ОВ, чем пациенты в возрасте старше 65 лет (P=0,013). Кривые Каплана-Майера представлены на рис. 1.
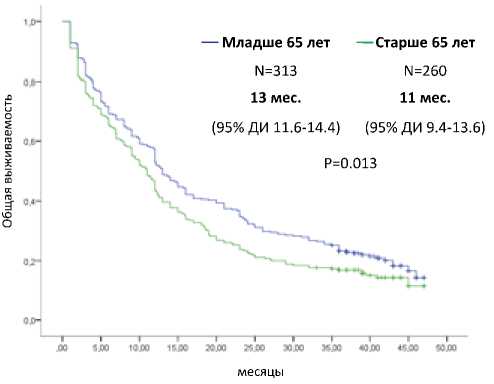
Рисунок 1. ОВ больных метастатическим ПКР младше и старше 65 лет в исследовании RENSUR3 (кривые Каплана-Майера).
Обсуждение
В исследовании RENSUR3 оценена продолжительность жизни пациентов с метастатическим ПКР в 8 репрезентативных регионах РФ, а также определены факторы, влияющие на ОВ.
Медиана ОВ, рассчитанная по методу Каплана-Майера в общей в популяции RENSUR3, составила 12 месяцев, а 3-летняя выживаемость — 21 %. Такие результаты сопоставимы с данными регистров развивающихся стран, однако уступают развитым. Так, в странах БРИКС — Индии [8] и Бразилии [9] — медиана ОВ больных метастатическим ПКР составила 12,87 и 14,1 месяцев соответственно. В Казахстане в 2015 году данный показатель также был 12 месяцев [10]. Анализ многоцентрового корейского регистра продемонстрировал медиану ОВ в 31 месяц у больных светлоклеточным метастатическим ПКР и в 24 месяца у пациентов с несветлоклеточным [11]. В Чехии, согласно данным национального регистра таргетной терапии и, в частности, сунитиниба, медиана ОВ, проанализированная у 1.315 пациентов, составила минимум 26,3 месяца [12]. Надо отметить, что таргетная терапия назначается вне зависимости от возраста в этой стране, что отличается от подходов в РФ, когда пациенты старше 65 лет имели меньший шанс получить лекарственное лечение, что, по-види-мому, привело к снижению ОВ в этой группе. Позитивное влияние таргетной терапии на ОВ у пожилых пациентов также было показано и прокомментировано в американском ретроспективном когортном исследовании [26,27].
Скромные показатели ОВ в исследовании RENSUR3 также объясняются назначением лекарственного лечения только у половины больных (54%), низкой частотой применения таргетных препаратов (52,1%), редким назначением терапии второй и последующих линий при прогрессировании болезни (28,3%), отсутствием регистрации новых препаратов (ниволумаба, ниволумаба в комбинации с ипи-лимумабом, кабозантиниба, ленватиниба в комбинации с эверолимусом) в РФ на тот момент. Назначение терапии у половины пациентов, особенно таргетных препаратов, скорее всего, было обусловлено недостаточным финансированием в 2015 году, что повлияло на лекарственное обеспечение. Те же проблемы отмечаются в других странах БРИКС [8,13], в которых только 20% больных получают вторую линию терапии. В немецком проспективном регистровом исследовании STAR-TOR [14] в группе, получившей последовательную терапию сунитинибом/темсироли-мусом и затем акситинибом, медиана ОВ составила 38,1 месяца, а в группе, в которой назначалась только одна линия терапии, — 13,7 месяца (P<0,0001). В чешском регистре RENIS назначение двух линий терапии приводило к медиане ОВ 29 месяцев, тогда как получение пациентами трех линий — к 50,9 месяца [15].
В исследовании 2 фазы [16] эффективности акситини-ба в лечении цитокин-рефрактерного метастатического ПКР, что характерно для половины российских пациентов,
5-летняя ОВ составила 20,6%, и это уже превосходит результаты RENSUR3. В этом исследовании впервые проводилась оценка больных метастатическим ПКР, получавших таргетный препарат более 5 лет, при этом анализ результатов показал, что некоторым таким пациентам акситиниб приносит клиническую пользу при хорошей переносимости в течение длительного времени. По данным российского исследования FavorAx, у пациентов, получавших акситиниб во второй линии терапии, медиана ОВ достигнута не была (при наблюдении 25 месяцев), при этом 18-месячная ОВ составила 85,7% [17].
Внедрение новейших вариантов лекарственного лечения во второй линии, в том числе ингибиторов контрольных точек, будет способствовать улучшению продолжительности жизни больных. Согласно данным длительного наблюдения из клинических исследований 1 и 2 фазы, приблизительно одна треть пациентов с метастатическим ПКР, получавших ниволумаб в рамках терапии второй и последующих линий, были живы через 4 или 5 лет [18]. 3-летняя общая выживаемость составила 35%. В проспективном исследовании NIVOREN GETUG-AFU 26, в котором 729 пациентов, максимально приближенных к реальной практике (2 и более предшествующих линий терапии, метастазы в головной мозг, плохой прогноз, нарушение функции почек и т.п.), получили ниволумаб, медиана ОВ на ниволумабе составила 24,5 месяца, а 1-летняя выживаемость — 69% [19]. Похожие цифры приводят авторы исследования расширенного доступа, в котором 1-летняя ОВ была 63% [20]. Результаты эффективности ниволумаба в реальной жизни совпадают с данными регистрационного исследования Checkmate 025, в котором медиана ОВ была 25,8 месяцев, а 3-летняя ОВ — 39% [21,22].
Анализ базы данных SEER с включением 14 976 пациентов показывает, что в США продолжительность жизни при распространенном раке почки с началом эпохи таргетной терапии (2007–2013 гг.) стала лучше на 13% (P<0.0001) [23]. К сожалению, выраженной позитивной динамики в российской популяции не наблюдается. Медиана ОВ в исследовании RENSUR3 является абсолютно сопоставимой с той, которая была в исследовании RENSUR5, изучавшем исходы пациентов с метастатическим ПКР, впервые выяв-
Список литературы Продолжительность жизни больных метастатическим почечно-клеточным раком в Российской Федерации: результаты многоцентрового регистрового исследования Rensur3
- Kaprin A, Starinskiy V, Petrova G. Malignant tumors in Russia in 2015 (morbidity and mortality). Moscow. 2017. p.250. ISBN 978-5-85502-227-8
- Tsimafeyeu I, Aksel E. Renal Cell Carcinoma in the Russian Federation in 2008. Malign Tumours 1 (2010): 1-4.
- NCCN Clinical Practice Guidelines in Oncology: Kidney Cancer, version 1.2015.
- Tsimafeyeu I, Zart JS, Chung B. Cytoreductive radiofrequency ablation in patients with metastatic renal cell carcinoma (RCC) with small primary tumours treated with sunitinib or interferon-α. BJU International 112 (1), 32-38.
- Носов Д.А., Воробьев Н.А., Гладков О.А., с соавт. Практические рекомендации по лекарственному лечению почечно-клеточного рака. Злокачественные опухоли. 2015. -№ 4, спецвыпуск. -С.281-285.doi: 10/18027/2224-5057-2015-4s281-285
- Минаков С.Н., Левина Ю.В., Простов М.Ю. Популяционный раковый регистр. Функциональные возможности, задачи и существующие проблемы. Злокачественные опухоли. 2019;9 (1):6-9. 10.18027/2224-5057-2019-9-1-6-9
- DOI: :10.18027/2224-5057-2019-9-1-6-9
- Состояние онкологической помощи населению России в 2017 году (под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой) -М.: МНИОИ им. П.А. Герцена -филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018.-илл. -236 с. ISBN 978-5-85502-237-7
- Ramaswamy A, Joshi A, Noronha V, et al. Patterns of Care and Clinical Outcomes in Patients With Metastatic Renal Cell Carcinoma-Results From a Tertiary Cancer Center in India. ClinGenitourin Cancer. 2017 Jun;15 (3):e345-e355.
- Coelho RC, Reinert T, Campos F, et al. Sunitinib treatment in patients with advanced renal cell cancer: the Brazilian National Cancer Institute (INCA) experience. IntBraz J Urol. 2016 Jul-Aug;42 (4):694-703.
- Nurgaliev N, Kaidarova D, Shatkovskaya O, et al. Real-world outcomes in patients with metastatic renal cell carcinoma in Kazakhstan. Presented at the Fourteenth Annual European International Kidney Cancer Symposium, 2019.
- Kim JK, Kim SH, Song MK, et al. Application of the International Metastatic Renal Cell Carcinoma Database Consortium and Memorial Sloan Kettering Cancer Center Risk Models in Patients with Metastatic Non-Clear Cell Renal Cell Carcinoma: A Multi-Institutional Retrospective Study Using the Korean Metastatic Renal Cell Carcinoma Registry. Cancer Res Treat.2018 Sep 7. 10.4143/crt.2018.421
- DOI: :10.4143/crt.2018.421
- Poprach A, Lakomy R, Bortlicek Z, et al. Efficacy of Sunitinib in Elderly Patients with Metastatic Renal Cell Carcinoma: Data from Real-World Clinical Practice. Drugs Aging. 2016 Sep;33 (9):655-63.
- Bergerot PG, Bergerot CD, Dizman N, et al. Assessment of Treatment Patterns for Metastatic Renal Cell Carcinoma in Brazil. J Glob Oncol. 2018 Sep;4:1-8.
- Boegemann M, Hubbe M, Thomaidou D, et al. Sunitinib Treatment Modification in First-Line Metastatic Renal Cell Carcinoma: Analysis of the STAR-TOR Registry. Anticancer Res. 2018 Nov;38 (11):6413-6422.
- Finek J, Demlova R, Kopeckova K, et al. Treatment sequences in metastatic renal cell carcinoma: Efficacy results from the Czech registry (RENIS). Annals of Oncology, Volume 29, Issue suppl_8, October 2018, mdy283.101, https://doi.org/10.1093/annonc/mdy283.101
- Rini BI, de La Motte Rouge T, Harzstark AL, et al. Five-year survival in patients with cytokine-refractory metastatic renal cell carcinoma treated with axitinib. ClinGenitourin Cancer. 2013 Jun;11 (2):107-14.
- Tsimafeyeu I, Borisov P, Abdelgafur A, et al. Phase 2 Multicenter Single-Arm Study of Second-Line Axitinib in Favorable Risk Patients with Metastatic Renal Cell Carcinoma: FavorAx. Target Oncol. 2019 Feb;14 (1):33-38.
- McDermott DF, Motzer RJ, Atkins MB, et al. Long-term overall survival (OS) with nivolumab in previously treated patients with advanced renal cell carcinoma (aRCC) from phase I and II studies. J ClinOncol 34, 2016 (suppl; abstr 4507).
- Albiges L, Negrier S, Dalban C, et al. Safety and efficacy of nivolumab in metastatic renal cell carcinoma (mRCC): Final analysis from the NIVOREN GETUG AFU 26 study. J ClinOncol 37, 2019 (suppl 7S; abstr 542).
- De Giorgi U, Cartenì G, Giannarelli D, et al. Safety and efficacy of nivolumab for metastatic renal cell carcinoma: real-world results from an expanded access programme. BJU Int. 2019 Jan;123 (1):98-105.
- Motzer RJ, Escudier B, McDermott DF, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015 Nov 5;373 (19):1803-13.
- Sharma P. et al. 16th International Kidney Cancer Symposium; November 3-4, 2017; Miami, FL, USA.
- Rao A, Wiggins C, Lauer RC. Survival outcomes for advanced kidney cancer patients in the era of targeted therapies. Ann Transl Med. 2018 May;6 (9):165.
- Tsimafeyeu I, Zolotareva T, Varlamov S, et al. Five-year overall survival among patients with metastatic renal cell carcinoma: Results of Russian population-based study RENSUR5. J ClinOncol 35, 2017 (suppl 5S; abstr 20).
- Tsimafeyeu I, Zolotareva T, Varlamov S, et al. Five-year Survival of Patients With Metastatic Renal Cell Carcinoma in the Russian Federation: Results From the RENSUR5 Registry. ClinGenitourinCancer. 2017 Dec;15 (6):e1069-e1072.
- Li P, Jahnke J, Pettit AR, Wong YN, Doshi JA. Comparative Survival Associated With Use of Targeted vs Nontargeted Therapy in Medicare Patients With Metastatic Renal Cell Carcinoma. JAMA Netw Open. 2019 Jun 5;2 (6):e195806.
- Shteynshlyuger A. Many Elderly Patients With Stage IV Metastatic Renal Cell Carcinoma May Benefit From MoreAggressive Treatment. JAMA Netw Open. 2019 Jun 5;2 (6):e195815.


