Продуктивность бобово-ризобиального комплекса под влиянием ростстимулирующих штаммов микроорганизмов
Автор: Миннебаев Л.Ф., Кузина Е.В., Рафикова Г.Ф., Чанышев И.О., Логинов О.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Растительно-микробные взаимодействия
Статья в выпуске: 3 т.54, 2019 года.
Бесплатный доступ
Причина отсутствия повсеместного перехода к экологически ориентированному земледелию заключается в первую очередь в нестабильном эффекте при использовании биологических препаратов. Малоизученным остается вопрос о влиянии интродуцируемых микроорганизмов на аборигенную почвенную микробиоту, в частности о том, как использование биологических препаратов сказывается на естественных (природных) микробно-растительных связях. В настоящем исследовании нами впервые дана комплексная сравнительная оценка воздействия, которое оказывает интродукция штаммов ризобактерий, различающихся сочетанием ростстимулирующих свойств, на однолетние и многолетние бобовые культуры. Целью работы было изучение влияния ростстимулирующих штаммов бактерий Paenibacillus ehimensis IB 739, Pseudomonas koreensis ИБ-4 и Ps. chlor-oraphis ИБ-51 на экосистему бобовое растение-аборигенное микробное сообщество. Объектами исследования в условиях вегетационного опыта служили растения гороха посевного ( Pisum sati-vum L.) сорта Чишминский 95, люпина белого ( Lupinus albus L.) сорта Дега, нута ( Cicer arietinum L.) сорта Заволжский, люцерны изменчивой ( Medicago ½ varia Martyn) сорта Галия, донника белого ( Melilotus albus Мedik.) сорта Чермасан...
Бобовые растения, ростстимулирующая активность, образование клубеньков, азотфиксация, взаимодействие растение, взаимодействие растение-микроорганизм
Короткий адрес: https://sciup.org/142220121
IDR: 142220121 | УДК: 633.31/.37:631.8:631.461.5:581.1 | DOI: 10.15389/agrobiology.2019.3.481rus
Текст научной статьи Продуктивность бобово-ризобиального комплекса под влиянием ростстимулирующих штаммов микроорганизмов
К настоящему времени известен ряд механизмов прямого (1-3) и опосредованного (4, 5) положительного влияния бактерий на растения. Установлено, что одна и та же ростстимулирующая бактерия (plant growth
В работе использовалось оборудование Центра коллективного пользования «БиоАналит» УИБ УФИЦ РАН.
promoting bacteria, PGPB) может быть наделена фитоположительными свойствами различной природы (6, 7). К сожалению, малоизученным остается вопрос о влиянии интродуцируемых микроорганизмов на аборигенную почвенную микробиоту, в частности о том, как использование биологических препаратов сказывается на естественных (природных) микробно-растительных связях (8). Доказано, что эффективность биологического препарата зависит не только от его полифункциональности, но и от того, насколько успешно агентам биологического контроля удается занять экологическую нишу в уже существующем сообществе (9-11).
Бобово-ризобиальное сообщество — один из наиболее известных примеров сбалансированного фитомикробиома. Клубеньковые бактерии, будучи естественными симбионтами бобовых растений, обеспечивают последних дополнительным азотом. Только некоторые штаммы ризобий обладают такими свойствами PGPB, как увеличение продуктивности сельскохозяйственных культур посредством синтеза фитогормонов (12, 13) и биоконтроля фитопатогенов (14, 15). С этой точки зрения представляется интересным изучить возможности повышения потенциала экосистемы бобовых растений через интродукцию микроорганизмов, наделенных комплексом полезных свойств.
Установлено, что биологическая активность ростстимулирующих бактерий Paenibacillus ehimensis IB 739 (ВКМ B-2680D), Pseudomonas koreen-sis ИБ-4 (ВКМ В-2830D) и Ps. chlororaphis ИБ-51 имеет комплексную природу: все три штамма являются антагонистами фитопатогенов, а также могут продуцировать фитогормоны и способствовать улучшению азотного питания растений. При этом способность к фиксации атмосферного азота у штаммов P. ehimensis IB 739 и Ps. koreensis ИБ-4 сопоставима с нитрогеназной активностью бактерий рода Azotobacter (16). Фитогормоны цитокинины, пусть и в незначительном количестве, продуцируют все указанные штаммы, ауксины — только штамм Ps. chlororaphis ИБ-51. Необходимо отметить также, что P. ehimensis IB 739 и Ps. koreensis ИБ-4 служат продуцентами экзополисахаридов (ЭПС) (17, 18). Это свойство может играть положительную роль при инокуляции растений, поскольку наличие в бактериальном препарате ЭПС способствует увеличению периода жизнеспособности клеток микроорганизмов на поверхности семян.
Как отмечалось выше, возможность применения на практике комплекса полезных свойств, которыми наделены те или иные микроорганизмы, напрямую зависит от того, способны ли внесенные извне бактерии прижиться в ризосфере растения-хозяина (19, 20). На примере яровой пшеницы и огурца было установлено, что штаммы P. ehimensis IB 739, Ps. ko-reensis ИБ-4 и Ps. chlororaphis ИБ-51 успешно колонизируют ризосферу и сохраняют высокую численность микробной популяции на протяжении всего периода вегетации (21, 22).
В представленной работе впервые дана комплексная сравнительная оценка воздействия, которое оказывает интродукция штаммов ризобакте-рий, различающихся сочетанием ростстимулирующих свойств, на однолетние и многолетние бобовые культуры, и показано, что наличие у штамма способности стимулировать рост бобовых растений само по себе не гарантирует благоприятного влияния на их продуктивность .
Цель работы — изучение влияния ростстимулирующих штаммов бактерий Paenibacillus ehimensis IB 739, Pseudomonas koreensis ИБ-4 и Ps. chlo-roraphis ИБ-51 на экосистему бобовое растение—аборигенное микробное сообщество.
Методика. В модельном эксперименте (2017 год) использовали чер- нозем глинисто-иллювиальный (содержание общего гумуса 4,2 %, общего азота — 0,5 %, подвижного фосфора — 5,6 мг/100 г почвы; рНвод. 6,3). Для оптимизации водно-воздушного режима в вегетационные сосуды помещали дренаж (высота слоя 2 см), вносили воздушно-сухую нестерильную почву (1300 г) и увлажняли до 60 % от полной влагоемкости. Количество фосфора в почве определяли по методу Кирсанова, кислотность — потенциометрическим методом (23).
Семена растений гороха посевного ( Pisum sativum L.) сорта Чиш-минский 95, люпина белого ( Lupinus albus L.) сорта Дега, нута ( Cicer arietinum L.) сорта Заволжский, люцерны изменчивой ( Medicago ½ varia Martyn) сорта Галия и донника белого ( Melilotus albus Мedik.) сорта Черма-сан стерилизовали замачиванием в 1 % растворе перманганата калия в течение 30 мин. Затем их 5-кратно промывали большим количеством стерильной водопроводной воды и на 1 сут полностью погружали в воду для набухания, после чего помещали на увлажненную фильтровальную бумагу для проращивания в течение 1 сут при комнатной температуре и оценивали лабораторную всхожесть.
Для обработки семян использовали жидкую культуру штаммов бактерий с известным титром микроорганизмов (108-109 КОЕ/мл). P. ehimensis IB 739 выращивали на среде I (24), Ps. koreensis ИБ-4 и Ps. chlororaphis ИБ-51 — на среде Кинг В (25). Семена инокулировали из расчета 105 кл/семя для крупных семян (горох, люпин, нут) и 103 кл/семя для мелкосеменных растений (люцерна, донник). В вегетационные сосуды высаживали по 5 проростков гороха, люпина, нута и по 10 проростков люцерны и донника. Глубина заделки — от 1 до 3 см. Для растений, которые не выносят семядоли на поверхность (горох, нут), применялась более глубокая заделка. В контрольном варианте для обработки семян использовали стерильную водопроводную воду. В качестве дополнительного контроля, необходимого для наблюдения за изменением содержания азота в почве, были взяты сосуды с почвой без растений. Эталоном служило известное микробиологическое удобрение Азотовит® на основе штамма бактерий Azotobacter chroococcum B-9029 (регистрант ООО «Промышленные инновации», Россия, . Азотовит рекомендуется производителями как универсальное удобрение комплексного действия: он обеспечивает растения азотным питанием, подавляет фитопатогенную микрофлору, способствует развитию вегетативной системы растений (лист, стебель, соцветие), повышает урожайность.
Эксперимент проводили при комнатной температуре и естественной освещенности. Продолжительность опыта составила 45 сут. Образцы растений отбирали на 18-е и 45-е сут, почвенные образцы для анализа численности некоторых групп микроорганизмов — на 18-е и 45-е сут, для определения количества азота — на 45-е сут. Растения извлекали вместе с монолитом почвы, осторожно отмывали корневую систему, затем оценивали размерные показатели и число образовавшихся клубеньков. В высушенном растительном материале устанавливали содержание общего азота по Кьельдалю. Поражение корневыми гнилями учитывали в соответствии с методическими указаниями (26). Численность микроорганизмов в ризосфере определяли методом высева серийных разведений почвенной суспензии на агаризованные питательные среды — МПА (микроорганизмы, использующие органический азот), Эшби (аэробные свободноживущие азотфиксаторы и олигонитрофилы), Чапека-Докса с добавлением молочной кислоты (микромицеты) (27).
Статистическую обработку данных проводили в программе Microsoft
Excel. Рассчитывали средние значения ( M ) и стандартные ошибки средних (±SEM). Достоверность различий оценивали по t -критерию Стьюдента ( t -тест) и считали статистически значимыми при p ≤ 0,05.
Результаты . Согласно проведенным почвенным анализам, степень обеспеченности легкорастворимыми фосфатами для зернобобовых культур в опыте была средней при нейтральном показателе pH. Такие характеристики почвы можно считать благоприятными для активных форм спонтанных штаммов клубеньковых бактерий.
В таблице 1 обобщены данные, дающие представление о некоторых механизмах положительного влияния бактерий P. ehimensis IB 739, Ps. ko-reensis ИБ-4, Ps. chlororaphis ИБ-51 на растения (16, 17, 21, 22). Выбранные нами представители семейства бобовых различались по ареалам возделывания. Очевидно, что если штаммы Rhizobium leguminosarum (микросимбионт гороха) распространены практически повсеместно, то в случае с культурами нута и люпина в почве, где эти растения ранее не выращивались, подходящие микросимбионты могут отсутствовать.
Для культур зернобобовых однолетников (горох, люпин, нут) лабораторная всхожесть семян составила 92,5-98,0 %. Всхожесть семян кормовых трав (люцерна и донник) была ниже — соответственно 77,0 и 82,0 %. В условиях вегетационного опыта культуры Ps. koreensis ИБ-4 и P. ehimen-sis IB 739, а также биопрепарат Азотовит® оказывали положительное влияние на всхожесть семян бобовых растений. Интересно, что наибольшую отзывчивость на действие биопрепаратов проявила люцерна.
Показатель всхожести достигал максимальных значений при обработке семян жидкой культурой Ps. koreensis ИБ-4, при этом количество взошедших растений увеличивалось на 15-20 % по сравнению с контролем. Штамм Ps. chlororaphis ИБ-51 не оказывал (в случае гороха и нута) или оказывал незначительное стимулирующее воздействие на этот показатель. Полученные экспериментальные материалы не согласуются с данными по фи-тогормональной активности штаммов (см. табл. 1). Так, Ps. chlororaphis ИБ-51 значительно превосходит Ps. koreensis ИБ-4 в продукции регуляторов роста растений, но при этом не проявлял благоприятного влияния на всхожесть семян.
Известно, что повышенная концентрация индолил-3-уксусной кислоты (ИУК) может приводить к ингибирующим эффектам (28), при этом наиболее простой способ регуляции концентрации фитогормонов в ризосфере растения — варьирование числа бактерий-продуцентов при инокуляции (29-31). Ранее в работе О.Н. Логинова было установлено, что высокий титр штамма Ps. chlororaphis ИБ-51 отрицательно сказывается на всхожести семян ряда овощных культур (18). По-видимому, подобный эффект наблюдался и в условиях нашего эксперимента. Кроме того, существует гипотеза, что когда фитогормоны, синтезируемые штаммами, находятся в комплексе с экзополисахаридами, как в случае культур P. ehimensis IB 739 и Ps. koreensis ИБ-4, то за счет постепенной диссоциации комплекса действие фитогормонов на растение носит более мягкий и пролонгированный характер (32).
Принято считать, что ауксины в основном способствуют росту корней (увеличению длины и ветвления) (31), а также положительно влияют на рост листьев. Цитокинины, в свою очередь, активизируют рост побегов в большей степени, чем корней, даже угнетая рост последних (33). В нашем эксперименте в вариантах с обработкой семян штаммом Ps. chlororaphis ИБ-51 (продуцент ауксинов и цитокининов) чаще отмечалось увеличение длины корней (рис. 1, А), а также числа листьев. Стимулирование развития 484
-
1. Известные проявления положительного воздействия изучаемых штаммов ростстимулирующих бактерий на растение (M±SEM) (16, 17, 21, 22)
Штамм
Синтез фитогормонов, нг/мл КЖ
Способность к фиксации атмосферного азота
Антагонистические механизмы воздействия на фитопатогены
цитокинины 1 ИУК
рост на среде Эшби нитрогеназная активность, мкг N2•мл - 1•ч - 1
антибиотики1 протеазы1 хитиназы
-
2. Морфофизиологические показатели бобовых растений при обработке семян ростстимулирующими штаммами бактерий в разные сроки после инокуляции (M±SEM, вегетационный опыт, 2017 год)
Вариант
18-е сут
45-е сут
длина надземной части, см
длина главного корня, см
число
листьев, шт.
число клубеньков, шт/растение
длина надземной части, см
длина главного корня, см
число
листьев, шт.
число клубеньков, шт/растение
Контроль (вода)
32,3±1,7
Горох по 11,0±0,8
с е в н о й ( Pisum sativum L., сорт Чишминский 95)
6,3±0,7 2,1±0,9 73,7±5,8
16,2±0,9
12,7±1,3
9,0±2,5
Paenibacillus ehimensis IB 739
38,5±2,1*
11,3±0,8
7,0±0,5
3,7±1,2
77,6±4,1
15,7±1,5
14,5±2,1
12,7±4,4
Pseudomonas koreensis ИБ-4
38,0±2,2*
10,8±0,6
6,7±0,6
1,8±0,3
85,5±4,7*
18,2±0,9*
15,4±1,1*
20,4±3,8*
Ps. chlororaphis ИБ-51
36,3±2,8
12,7±0,7*
5,7±0,5
14,0±2,4*
76,3±6,3
18,4±0,8*
15,0±0,8*
20,3±5,1*
Азотовит®
38,7±2,5*
7,6±0,6*
5,5±0,3
6,8±3,9
84,0±4,2*
14,0±1,1*
14,0±2,5
10,4±1,7
Контроль (вода)
14,7±0,9
Люп
8,3±0,6
ин белый 4,0±0,5
( Lupinus albus L., сорт 0,3±0,1
Дега)
29,1±2,5
14,5±2,1
10,5±1,4
10,2±2,0
P. ehimensis IB 739
16,2±1,4
8,8±0,5
4,0±0,2
6,3±0,5*
30,0±3,2
18,3±1,5*
11,3±2,9
10,7±1,8
Ps. koreensis ИБ-4
18,5±1,1*
8,8±0,5
5,0±0,6
-
34,3±2,6*
14,6±1,8
11,7±2,5
8,3±1,7
Ps. chlororaphis ИБ-51
16,8±1,3
10,0±0,8*
5,0±0,5
0,5±0,1
36,0±3,8*
18,7±1,5*
13,3±1,2*
17,0±2,5*
Азотовит®
17,7±1,1*
8,3±0,6
4,0±0,4
-
35,7±3,9*
15,3±2,8
11,3±1,9
16,0±1,9*
Контроль (вода)
28,5±1,9
Н у т ( Cicer arietinum L., сорт Заволжский) 12,7±1,1 9,4±0,6 - 38,1±3,0
17,0±1,8
16,0±2,8
-
P. ehimensis IB 739
31,0±2,1
17,5±1,0*
10,3±0,7
-
40,0±3,7
20,3±2,5
15,3±2,1
-
Ps. koreensis ИБ-4
27,0±1,5
15,3±0,8*
9,7±0,6
-
44,0±2,5*
22,5±3,1*
14,7±1,9
-
Ps. chlororaphis ИБ-51
31,3±1,8
13,8±0,8
10,7±0,9
-
44,0±2,7*
21,7±2,7*
17,0±2,9
-
Азотовит®
30,3±2,3
11,2±0,6
9,0±0,5
-
45,7±3,1*
16,3±2,5
16,0±2,9
-
Контроль (вода)
9,3±0,8
Люцерна изменчивая
5,2±0,7 3,1±0,3
( Medicago ½ varia Martyn, сорт Галия)
1,9±0,5 18,9±2,2
15,0±1,9
7,2±1,3
7,2±2,1
P. ehimensis IB 739
9,8±0,7
4,1±0,5
3,0±0,3
1,8±0,3
23,1±1,7*
15,1±2,1
10,7±1,9*
18,4±4,9*
Продолжение таблицы 2
Ps. koreensis ИБ-4
9,5±1,0
5,9±0,5
3,3±0,3
3,8±1,5
17,8±2,7
14,2±2,5
8,1±1,8
11,1±3,0
Ps. chlororaphis ИБ-51
8,8±0,7
4,7±0,4
2,8±0,4
1,8±0,2
18,1±2,1
14,8±2,5
8,0±1,9
10,6±1,9
Азотовит®
10,4±0,9
6,0±0,5
Донник
3,1±0,3 2,4±0,5 19,1±2,9
б ел ый ( Melilotus albus Мedik., сорт Чермасан)
14,9±2,7
9,3±0,6*
25,2±6,7*
Контроль (вода)
7,2±0,6
5,0±0,4
2,9±0,3
1,5±0,6
14,0±0,9
14,3±1,1
5,6±0,7
12,5±2,6
P. ehimensis IB 739
8,5±0,5*
5,5±0,4
3,3±0,3
1,3±0,3
15,6±1,8
15,4±2,5
6,4±1,1
23,9±3,8*
Ps. koreensis ИБ-4
8,3±0,6
5,6±0,5
2,7±0,2
3,0±1,0
14,0±1,3
12,3±2,0
6,0±1,0
13,6±1,8
Ps. chlororaphis ИБ-51
6,7±0,5
4,6±0,4
3,1±0,4
2,1±0,5
16,2±1,9
15,1±1,9
7,0±0,5*
16,6±2,9
Азотовит®
6,6±0,6
6,4±0,3*
2,8±0,3
0,6±0,3
20,6±3,1*
16,3±0,7*
7,7±0,9*
37,1±7,8*
П р и м еч а ни е. Прочерк означает, что клубеньки не образовались. * Различия с контролем статистически значимы при p ≤ 0,05.
-
3. Численность различных групп микроорганизмов (КОЕ/г абс. сух. почвы) в ризосфере бобовых растений при обработке семян ростстимули-рующими штаммами бактерий в разные сроки после инокуляции (M±SEM, вегетационный опыт, 2017 год)
|
Paenibacillus ehimensis IB 739 |
190,3±25,3 |
- |
Умеренный |
0,67±0,021 |
+ |
+ |
+ |
|
Pseudomonas koreensis ИБ-4 |
119,0±17,3 |
40,4±4,7 |
Обильный |
0,68±0,030 |
+ |
+ |
- |
|
Ps. chlororaphis ИБ-51 |
205,4±42,1 |
878,1±93,2 |
Умеренный |
0,08±0,002 |
+ |
+ |
- |
П р и м е ч а н и е. КЖ — культуральная жидкость, ИУК — индолил-3-уксусная кислота. Прочерк означает, что ферменты и метаболиты не были обнаружены.
|
Вариант |
Горох посевной ( Pisum sativum L.) |
Люпин белый ( Lupinus albus L.) |
Нут ( Cicer arietinum L.) |
Люцерна изменчивая ( Medicago ½ varia Martyn) |
Донник белый ( Melilotus albus Мedik.) |
||||
|
18-е сут 1 |
45-е сут |
18-е сут |
п 45-е сут |
18-е сут 45-е сут |
18-е сут |
45-е сут |
18-е сут |
45-е сут |
|
|
Контроль (вода) |
5,4±0,7 |
Микроо 4,4±0,8 |
рганизмы 3,5±0,6 |
, и сп оль зующи е орг аниче ский аз от, ½107 5,8±0,5 5,3±0,9 3,9±0,3 2,7±0,8 |
0,9±0,5 |
1,0±0,3 |
1,9±0,5 |
||
|
Paenibacillus ehimensis IB 739 |
6,3±0,8 |
1,0±0,1* |
2,4±0,6 |
0,8±0,2* |
6,4±0,7 1,2±0,2* |
1,4±0,6 |
2,0±0,8 |
0,3±0,1* |
2,5±0,5 |
|
Pseudomonas koreensis ИБ-4 |
4,3±0,6 |
1,7±0,2* |
4,3±0,4 |
3,1±0,3* |
3,3±1,3 1,3±0,2* |
0,6±0,1* |
2,0±0,7 |
0,5±0,2 |
3,1±0,9 |
|
Ps. chlororaphis ИБ-51 |
5,4±0,3 |
6,4±1,3 |
3,2±0,4 |
1,9±0,2* |
4,2±0,7 0,7±0,1* |
0,7±0,2* |
2,0±0,6 |
1,0±0,2 |
2,9±0,6 |
|
Азотовит® |
4,1±0,7 |
2,3±0,3* |
3,2±0,5 |
1,5±0,2* |
6,7±0,9 1,4±0,3* |
1,1±0,4* |
1,9±0,6 |
1,2±0,3 |
1,6±0,3 |
|
Контроль (вода) |
1,2±0,3 |
Аэробные св 2,0±0,4 1,6±0,2 |
ободноживущие азотфиксаторы 1,2±0,4 2,8±0,6 1,1±0,2 |
и олигонитрофилы, 1,2±0,5 1,7±0,3 |
½107 0,8±0,2 |
1,3±0,5 |
|||
|
P. ehimensis IB 739 |
2,1±0,6 |
2,4±0,2 |
1,6±0,2 |
1,3±0,3 |
3,6±0,5 1,1±0,1 |
1,5±0,3 |
1,5±0,3 |
0,9±0,2 |
2,1±0,5 |
|
Ps. koreensis ИБ-4 |
1,6±0,3 |
1,5±0,3 |
2,0±0,3 |
0,8±0,2 |
3,0±0,4 1,2±0,1 |
0,5±0,2 |
1,7±0,5 |
0,9±0,2 |
2,5±0,8 |
|
Ps. chlororaphis ИБ-51 |
1,1±0,3 |
1,5±0,4 |
1,7±0,3 |
2,1±0,6 |
1,6±0,8 0,8±0,2 |
0,9±0,2 |
1,8±0,3 |
0,8±0,1 |
1,5±0,4 |
|
Азотовит® |
0,8±0,2 |
1,1±0,6 |
1,9±0,3 |
1,2±0,3 |
2,2±0,4 1,2±0,2 |
1,4±0,3 |
1,8±0,2 |
0,5±0,1 |
1,9±0,5 |
|
Контроль (вода) |
8,6±0,8 |
4,2±0,3 |
35,0±3,6 |
3,4±0,4 |
Микромицеты, ½104 13,3±1,1 1,4±0,4 |
11,3±1,0 |
2,5±0,5 |
9,8±0,9 |
2,9±0,5 |
|
P. ehimensis IB 739 |
4,1±0,5* |
1,8±0,2* |
4,5±0,4* |
3,0±0,3 |
3,3±0,3* 2,2±0,5 |
4,9±0,5* |
3,9±1,0 |
1,6±0,3* |
3,2±0,6 |
|
Ps. koreensis ИБ-4 |
3,2±0,4* |
1,5±0,1* |
2,0±0,2* |
2,6±0,5 |
2,1±0,2* 1,8±0,3 |
0,8±0,1* |
2,3±0,5 |
0,5±0,1* |
3,9±0,6 |
|
Ps. chlororaphis ИБ-51 |
4,7±0,6* |
5,0±0,5 |
2,8±0,3* |
1,1±0,2* |
4,9±0,5* 1,4±0,2 |
2,3±0,3* |
3,6±0,7 |
1,6±0,2* |
2,2±0,4 |
|
Азотовит® |
8,1±0,5 |
1,5±0,2* |
3,4±0,4* |
3,1±0,3 |
7,3±0,6* 2,3±0,5 |
1,7±0,2* |
1,3±0,8 |
4,7±0,5* |
2,6±0,4 |
* Различия с контролем статистически значимы при p ≤ 0,05.
надземной части в большинстве случаев наблюдалось при инокуляции семян Ps. koreensis ИБ-4 (продуцент цитокининов) и препаратом Азотовит® (см. рис. 1, Б). Однако неправомочно говорить о специализации штаммов по воздействию на определенные органы растения-макросимбионта. Так, в случае использования P. ehimensis IB 739 (продуцент цитокининов) на горохе, люцерне и доннике у растений активизировался рост побегов, а на люпине и нуте — корневой системы.
А
Б

Рис. 1. Развитие корневой системы и побегов бобовых растений при инокуляции штаммами ростстимулирующих бактерий: А — горох посевной ( Pisum sativum L.), слева — контроль, справа — обработка штаммом бактерий Pseudomonas chlororaphis ИБ-51; Б — люпин белый ( Lupinus albus L.), слева направо — контроль, обработка препаратом Азотовит®, обработка штаммом Ps. koreensis ИБ-4.
Штаммы Ps. koreensis ИБ-4 и Ps. chlororaphis ИБ-51 оказались активнее на горохе, люпине и нуте; на люцерне и доннике положительный эффект либо был менее заметен, либо отсутствовал. Возможно, это объясняется тем, что оболочка семян люцерны и донника содержит токсичные вещества, в частности алкалоиды (34), и исследуемые штаммы псевдомонад оказались менее устойчивы к действию бактерицидных веществ, чем культуры Paenibacillus и Azotobacter .
Образование первых клубеньков в условиях опыта наблюдалось приблизительно на 10-е сут после появления всходов. При этом на корнях нута клубеньки не обнаруживались на протяжении всего эксперимента, что было вполне логично. Нут не относится к числу приоритетных культур в Республике Башкортостан, поэтому в почве могли отсутствовать специфичные для этого вида клубеньковые бактерии. На первоначальном этапе наибольшее количество клубеньков обнаружили на корнях гороха, что, по-видимому, связано с быстрым ростом этой культуры (табл. 2). К концу опыта по числу клубеньков (в пересчете на одно растение) лидировал донник белый. Формирование клубеньков происходило как на главном корне, так и на придаточных и боковых корнях (часто было привязано к зоне корневых волосков), а также на стебле. При обработке жидкой культурой P. ehimensis IB 739, Ps. chlororaphis ИБ-51 и биопрепаратом Азотовит® характерным было образование более крупных розовых клубеньков, сосредоточенных вокруг главного корня в виде муфты.
Инокуляция бактериями в целом положительно влияла на процесс клубенькообразования, но растения разных родов неодинаково откликались на интродукцию PGPB в микробное сообщество ризосферы. На горохе, обработанном штаммом Ps. chlororaphis ИБ-51, и на люпине в варианте с P. ehimensis IB 739 уже на 3-й нед эксперимента число клубеньков в несколько раз превышало контрольные значения (p ≤ 0,05). На люцерне и доннике через 2 нед после начала опыта между контрольным и опытными вариантами еще не было достоверной разницы в образовании клубеньков, к концу эксперимента в вариантах с внесением P. ehimensis IB
739 и Азотовита® отмечали увеличение числа клубеньков в 1,9-3,5 раза (p ≤ 0,05). В случае штаммов псевдомонад статистически достоверных различий по сравнению с контролем на кормовых культурах мы не выявили. В целом, P. ehimensis IB 739 и биопрепарат Азотовит® стимулировали клу-бенькообразование на люпине, люцерне и доннике, Ps. chlororaphis ИБ-51 был активен в ризосфере люпина и гороха, а Ps. koreensis ИБ-4 — только в ризосфере гороха.
Мы не установили связи между числом клубеньков и развитием корневой системы растения. Так, на люпине наибольшую длину корней зафиксировали при обработке P. ehimensis IB 739 и Ps. chlororaphis ИБ-51, штамм Ps. koreensis ИБ-4 и биопрепарат Азотовит® не оказали существенного влияния на анализируемые показатели (см. табл. 2). При этом на развитой корневой системе растений люпина, обработанных штаммом P. ehimensis IB 739, сформировалось меньше клубеньков, чем в варианте с Азотовитом®.
При анализе азотфиксирующей активности в ризосфере бобовых культур необходимо принимать во внимание, что описанный эксперимент продолжался до фазы цветения растений, поэтому представленные результаты могут служить только для предварительной оценки.
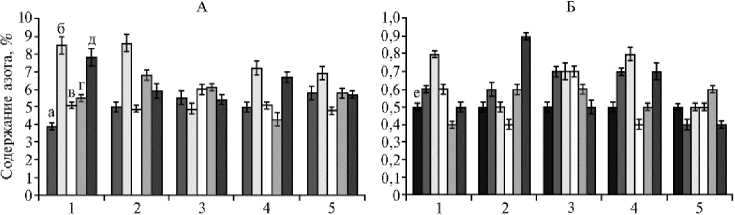
Культура
Рис. 2. Содержание азота в растениях гороха посевного ( Pisum sativum L.) сорта Чишминский 95 (1) , люпина белого ( Lupinus albus L.) сорта Дега (2) , нута ( Cicer arietinum L.) сорта Заволжский (3) , люцерны изменчивой ( Medicago ½ varia Martyn) сорта Галия (4) , донника белого ( Mel-ilotus albus Мedik.) сорта Чермасан (5) (А) и в почве после выращивания растений (Б) при обработке семян ростстимулирующими штаммами бактерий: а — контроль, б — Paenibacillus ehimensis IB 739, в — Pseudomonas koreensis ИБ-4, г — Ps. chlororaphis ИБ-51, д — Азотовит®, е — почва без растений (вегетационный опыт, 2017 год) .
Максимальное количество азота в корнях и биомассе обнаружили при инокуляции растений P. ehimensis IB 739 и обработке биопрепаратом Азотовит® (рис. 2, А). На горохе этот показатель составил 7,8-8,5 % против 3,9 % в контроле, на люцерне — 6,7-7,2 % против 5,0 % (p ≤ 0,05). После уборки растений значительное увеличение содержания азота в почве по сравнению с исходным количеством (0,5 %) отмечали при использовании штамма P. ehimensis IB 739 на горохе, нуте, люцерне, в варианте с обработкой люпина Азотовитом®, а также в почве, на которой выращивали нут, в вариантах с Ps. koreensis ИБ-4 и без инокуляции (p ≤ 0,05) (см. рис 2, Б). Очевидно, что штамм P. ehimensis IB 739 наиболее активно стимулировал процесс азотфиксации.
Следует подчеркнуть, что эти данные не согласуются с количеством клубеньков, образовавшихся на растениях. Например, в случае нута клубеньки не образовывались вовсе. Следовательно, фиксация азота нутом происходила только за счет присутствия в ризосфере растения-хозяина азотфиксирующих бактерий, не относящихся к ризобиям.
В вариантах опыта со штаммом P. ehimensis IB 739 запасы азота в почве не истощались при его одновременном накоплении в растениях. В то же время на люпине при использовании биологического препарата Азотовит® происходило значительное накопление азота в почве, тогда как его усвоение растениями мы не зафиксировали.
Анализ полученных данных не выявил зависимости между нитрогеназной и нодулирующей активностью исследуемых штаммов и интенсивностью азотфиксации. Несмотря на то, что P. ehimensis IB 739 и Ps. ko-reensis ИБ-4 обладали одинаковой способностью к фиксации атмосферного азота (см. табл. 1), увеличение количества азота в почве и растениях гороха отмечалось только для штамма P. ehimensis IB 739. Обработка семян жидкой культурой штамма Ps. chlororaphis ИБ-51 значительно стимулировала клу-бенькообразование на горохе и люпине за счет выработки ауксинов, при этом накопления азота ни в растениях, ни в почве не зафиксировали.
Микробиологический анализ ризосферы бобовых культур показал, что максимальная численность микроорганизмов у крупносеменных растений приходилась на начальный период развития, а затем она снижалась. У кормовых трав, наоборот, к концу опыта отмечали увеличение количества ризосферных микроорганизмов (табл. 3). По-видимому, это объясняется различиями в жизненных циклах и стратегиях накопления элементов питания у однолетних и многолетних бобовых культур. На момент окончания опыта у зернобобовых растений наступала фаза завершения активного роста, что было напрямую связано с оттоком азота и других нутриентов из вегетативных органов в репродуктивные. При этом многолетние культуры еще продолжали активно развиваться и запасать питательные вещества в корневой системе, обеспечивая питание микробному сообществу.
Отметим также, что в конце опыта численность гетеротрофов в ризосфере у неинокулированных зернобобовых растений оказалась достоверно выше, чем у инокулированных (p ≤ 0,05). Этот факт можно расценивать как косвенное доказательство регулирующего воздействия на аборигенное бактериальное сообщество со стороны интродуцированных штаммов. Численность азотфиксирующих микроорганизмов в ризосфере как в контроле, так и в опытных вариантах на протяжении всего эксперимента составляла 107 КОЕ/г почвы. При этом в случае многолетних культур можно говорить о тенденции к увеличению численности азотфиксаторов к концу опыта.
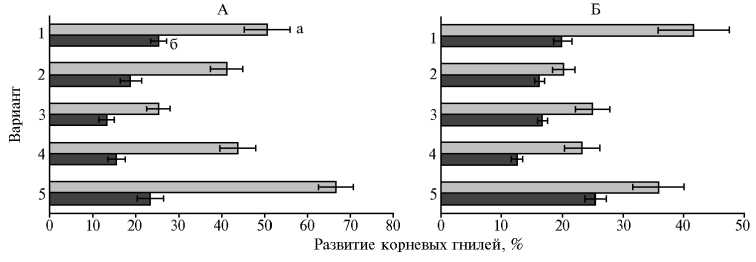
Рис. 3. Поражение гороха посевного ( Pisum sativum L.) сорта Чишминский 95 (А) и люпина белого ( Lupinus albus L.) сорта Дега (Б) корневыми гнилями на 18-е (а) и 45-е сут (б) после инокуляции семян ростстимулирующими штаммами бактерий: 1 — Азотовит®, 2 — Pseudomonas chlororaphis ИБ-51, 3 — Ps. koreensis ИБ-4, 4 — Paenibacillus ehimensis IB 739, 5 — контроль (вегетационный опыт, 2017 год) .
Инокуляция семян штаммами бактерий, а также обработка биопрепаратом Азотовит® способствовала подавлению развития микроскопических грибов в ризосфере 2-недельных растений. К концу эксперимента разница в численности микромицетов в контрольном и опытных вариантах была статистически недостоверной. При этом эффективность исследуемых штаммов против корневых гнилей сохранялась на протяжении всего вегетационного опыта и составила в среднем на горохе 33,7-62,1 %, на люпине — 30,4-50,9 % (рис. 3). В варианте с биопрепаратом Азотовит отмечали наибольшее количество растений, пораженных корневыми гнилями.
Таким образом, мы установили, что внесение PGPB не обязательно оказывает на растение благоприятное воздействие. Другие авторы сообщали, что эффективность бактериальных обработок может различаться даже на разных сортах одного вида сельскохозяйственной культуры (35, 36). Эти данные согласуются с результатами работы В.Н. Ефимова с соавт. (37), в которой указывается на то, что бобовые культуры очень избирательны в отношении интродуцируемых штаммов бактерий и по-разному откликаются на применение тех или иных биологических препаратов.
Известно, что ауксинподобные вещества относятся к нодулирую-щим агентам, то есть стимулируют процесс клубенькообразования (38). При этом низкая концентрация ИУК увеличивает клубенькообразование, а высокая ингибирует нодуляцию (39). Нами не установлена зависимость интенсивности клубенькообразования от ростстимулирующей активности бактерий, в том числе от ее природы (цитокинины, ауксины). Тем не менее, поскольку инокуляция исследуемыми штаммами не тормозила клубенько-образование, можно констатировать отсутствие конкурентного или подавляющего действия со стороны испытуемых штаммов в отношении аборигенных ризобий почвы.
Если рассматривать роль, которую свободноживущие азотфиксато-ры играют в обеспечении растений азотом, то наш эксперимент подтвердил, что увеличение содержания биологического азота в почве не всегда приводит к его накоплению в корнях и биомассе растений (40). Одно из объяснений состоит в том, что фиксированный диазотрофами азот атмосферы может оставаться недоступным для растений вследствие его локализации в почве в составе микробной биомассы (41).
Итак, инокуляция семян бобовых культур штаммами бактерий родов Paenibacillus и Pseudomonas , обладающих комплексом положительных свойств (продукция фитогормонов, нитрогеназная активность, синтез антибиотических веществ), способствует увеличению всхожести семян, росту побегов и корней, улучшению азотного питания растений, стимулирует образование клубеньков, а также приводит к снижению поражения корневыми гнилями. При этом разные виды бобовых культур демонстрируют неодинаковую отзывчивость на интродукцию PGPB (plant growth promoting bacteria). В целом, полученные данные свидетельствуют о перспективности применения Paenibacillus ehimensis IB 739 на люцерне изменчивой и доннике белом, Pseudomonas koreensis ИБ-4, Pseudomonas chlororaphis ИБ-51 — на горохе посевном, люпине белом.
Список литературы Продуктивность бобово-ризобиального комплекса под влиянием ростстимулирующих штаммов микроорганизмов
- Sziderics A.H., Rasche F., Trognitz F., Sessitsch A., Wilhelm E. Bacterial endophytes contribute to abiotic stress adaptation in pepper plants (Capsicum annuum L.). Canadian Journal of Microbiology, 2007, 53(11): 1195-1202 ( ) DOI: 10.1139/W07-082
- Joo G.J., Kim Y.M., Kim J.T., Rhee I.K., Kim J.H., Lee I.J. Gibberellins-producing rhizobacteria increase endogenous gibberellins content and promote growth of red peppers. Journal of Microbiology, 2005, 43(6): 510-515.
- Yang J., Kloepper J.W., Ryu C.M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends in Plant Science, 2009, 14(1): 1-4 ( ) DOI: 10.1016/j.tplants.2008.10.004
- Forchetti G., Masciarelli O., Alemano S., Alvares D., Abdala G. Endophytic bacteria in sunflower (Helianthus annuus L.): isolation, characterization, and production of jasmonates and abscisic acid in culture medium. Applied Microbiology and Biotechnology, 2007, 76(5): 1145-1152 ( ) DOI: 10.1007/s00253-007-1077-7
- Francis I., Holsters M., Vereecke D. The Gram-positive side of plant-microbe interactions. Environmental Microbiology, 2010, 12(1): 1-12 ( ) DOI: 10.1111/j.1462-2920.2009.01989.x
- van Loon L.C. Plant responses to plant growth-promoting rhizobacteria. European Journal of Plant Pathology, 2007, 119(3): 243-254 ( )
- DOI: 10.1007/s10658-007-9165-1
- Berg G. Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture. Applied Microbiology and Biotechnology, 2009, 84(1): 11-18 ( )
- DOI: 10.1007/s00253-009-2092-7
- Raaijmakers J.M., Paulitz T.C., Steinberg C., Alabouvette C., Möenne-Loccoz Y. The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms. Plant and Soil, 2009, 321(1-2): 341-361 ( )
- DOI: 10.1007/s11104-008-9568-6
- Chandrashekhara, Niranjanranj S., Deepak S.A., Amrutesh K.N., Shetty N.P., Shetty H.S. Endophytic bacteria from different plant origin enhance growth and induce downy mildew resistance in pearl millet. Asian Journal of Plant Pathology, 2007, 1(1): 1-11 ( )
- DOI: 10.3923/ajppaj.2007.1.11
- Walters D.R., Fountaine J.M. Practical application of induced resistance to plant diseases: an appraisal of effectiveness under field conditions. The Journal of Agricultural Science, 2009, 147(5): 523-535 ( )
- DOI: 10.1017/S0021859609008806
- Spaepen S., Vanderleyden J., Remans R. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Microbiology Reviews, 2007, 31(4): 425-448 ( )
- DOI: 10.1111/j.1574-6976.2007.00072.x
- Gouws L.M., Botes E., Wiese A.J., Trenkamp S., Torres-Jerez I., Tang Y., Hills P.N., Usadel B., Lloyd J.R., Fernie A.R., Kossmann J., van der Merwe M. The plant growth promoting substance, lumichrome, mimics starch, and ethylene-associated symbiotic responses in lotus and tomato roots. Front. Plant Sci., 2012, 3: 120 ( )
- DOI: 10.3389/fpls.2012.00120
- Khan W., Prithiviraj B., Smith D.L. Nod factor and lumichrome enhance photosynthesis and growth of corn and soybean. Journal of Plant Physiology, 2008, 165(13): 1342-1351 ( )
- DOI: 10.1016/j.jplph.2007.11.001
- Hemissi I., Mabrouk Y., Abdi N., Bouraoui M., Saidi M., Sifi B. Effects of some Rhizobium strains on chickpea growth and biological control of Rhizoctonia solani. African Journal of Microbiology Research, 2011, 24(5): 4080-4090 ( )
- DOI: 10.5897/AJMR10.903
- Akhtar M.S., Shakeel U., Siddiqui Z.A. Biocontrol of Fusarium wilt by Bacillus pumilis, Pseudomonas alcaligenes and Rhizobium sp. on lentil. Turk. J. Biol., 2010, 34: 1-7 ( )
- DOI: 10.3906/biy-0809-12
- Логинов О.Н., Четвериков С.П., Давлетшин Т.К., Кузина Е.В. Штамм азотфиксирующих бактерий Pseudomonas sp. для получения биопрепарата против заболеваний пшеницы, вызываемых фитопатогенными грибами, и повышения урожайности. Патент РФ № 2529958. Заявл. 20.08.2013. Опубл. 10.10.2014. Бюл. № 28.
- Рафикова Г.Ф., Коршунова Т.Ю., Миннебаев Л.Ф., Четвериков С.П., Логинов О.Н. Новый штамм бактерий Pseudomonas koreensis ИБ-4 как перспективный агент биологического контроля фитопатогенов. Микробиология, 2016, 85(3): 317-326 ( )
- DOI: 10.7868/S0026365616030137
- Худайгулов Г.Г., Логинов О.Н., Мелентьев А.И. Экзополисахарид альгинатного типа Paenibacillus ehimensis 739. Известия Самарского научного центра Российской академии наук, 2011, 5: 214-217.
- Боронин А.М. Ризосферные бактерии рода Pseudomonas, способствующие росту и развитию растений. Соросовский образовательный журнал, 1998, 10: 25-31.
- Иванчина Н.В., Гарипова С.Р. Влияние ростстимулирующих бактерий (PGPB) на продуктивность и устойчивость растений. Агрохимия, 2012, 7: 87-95.
- Мелентьев А.И. Аэробные спорообразующие бактерии Bacillus Cohn в агроэкосистемах. М., 2007.
- Логинов О.Н. Бактерии Pseudomonas и Azotobacter как объекты сельскохозяйственной биотехнологии. М., 2005.
- Спирина В.З., Соловьева Т.П. Агрохимические методы исследования почв, растений и удобрений. Томск, 2014.
- Кузьмина Л.Ю. Исследование взаимодействий бактерий-антагонистов с растениями и фитопатогенными грибами. Автореф. канд. дис. Казань, 1998.
- Смирнов В.В., Киприанова Е.А. Бактерии рода Pseudomonas. Киев, 1990.
- Методические указания по государственным испытаниям фунгицидов, антибиотиков и протравителей семян сельскохозяйственных культур. М., 1985.
- Дзержинская И.С. Питательные среды для выделения и культивирования микроорганизмов. Астрахань, 2008.
- Long H.H., Furuya N., Kurose D., Takeshita M., Takanami Y. Isolation of endophytic bacteria from Solanum sp. and their antibacterial activity against plant pathogenic bacteria. Journal of the Faculty of Agriculture, Kyushu University, 2003, 48(1-2): 21-28.
- Persello-Cartieaux F., David P., Sarrobert C., Thibaud M.C., Achouak W., Robaglia C., Nussaume L. Utilization of mutants to analyze the interaction between Arabidopsis thaliana and its naturally root-associated Pseudomonas. Planta, 2001, 212(2): 190-198 ( )
- DOI: 10.1007/s004250000384
- Compant S., Reiter B., Sessitch A., Nowak J., Clement C., Barka E.A. Endophytic colonization of Vitis vinifera L. by a plant growth-promoting bacterium Burkholderia sp. strain PsJN. Applied Microbiology and Biotechnology, 2005, 71(4): 1685-1693 ( )
- DOI: 10.1128/AEM.71.4.1685-1693.2005
- Idris E.E.S., Iglesias D.J., Talon M., Borriss R. Tryptophan-dependent production of indole-3-acetic acid (IAA) affects level of plant growth promotion by Bacillus amyloliquefaciens FZB42. Mol. Plant-Microbe Interact., 2007, 20(6): 619-626 ( )
- DOI: 10.1094/MPMI-20-6-0619
- Веселов С.Ю., Иванова Т.Н., Симонян М.В., Мелентьев А.И. Исследование цитокининов, продуцируемых ризосферными микроорганизмами. Прикладная биохимия и микробиология, 1998, 34(2): 175-179.
- Кудоярова Г.Р., Курдиш И.К., Мелентьев А.И. Образование фитогормонов почвенными и ризосферными бактериями как фактор стимуляции роста растений. Известия УНЦ РАН, 2011, 3-4: 5-16.
- Joy S.G., George P. Phytochemical analysis of alfalfa (Medicago sativa) seed extract by soxhlet extraction using different solvents. American Journal of Advanced Drug Delivery, 2014, 2(2): 145-152.
- Гарипова С.Р., Гарифуллина Д.В., Маркова О.В., Иванчина Н.В., Хайруллин Р.М. Изучение бактериальных ассоциаций эндофитов клубеньков, способствующих увеличению продуктивности бобовых растений. Агрохимия, 2010, 11: 50-58.
- Kumari S., Khanna V. Effect of antagonistic rhizobacteria inoculated with Mesorhizobium ciceri on control of fusarium wilt in chickpea (Cicer arietinum L.). African Journal of Microbiology Research, 2014, 8(12): 1255-1265 ( )
- DOI: 10.5897/AJMR2013.6481
- Ефимов В.Н., Воробейков Г.А., Патил А.Б., Мирюгина Т.А., Бредихин В.Н., Хотянович А.В. Азотное питание и продуктивность гороха и кормовых бобов при обработке семян комплексом бактериальных препаратов. Агрохимия, 1996, 1: 10-15.
- Ferguson B.J., Mathesius U. Phytohormone regulation of legume-rhizobia interactions. Journal of Chemical Ecology, 2014, 40(7): 770-790 ( )
- DOI: 10.1007/s10886-014-0472-7
- van Noorden G.E., Ross J.J., Reid J.B., Rolfe B.G., Mathesius U. Defective long-distance auxin transport regulation in the Medicago truncatula super numeric nodules mutant. Plant Physiology, 2006, 140(4): 1494-1506 ( )
- DOI: 10.1104/pp.105.075879
- Spehn E.M., Scherer-Lorenzen M., Schmid B., Hector A., Caldeira M.C., Dimitrakopoulos P.G., Finn J.A., Jumpponen A., O'Donnovan G., Pereira J.S., Schulze E.D., Troumbis A.Y., Körner C. The role of legumes as a component of biodiversity in a cross-European study of grassland biomass nitrogen. Oikos, 2002, 98: 205-218 ( )
- DOI: 10.1034/j.1600-0706.2002.980203.x


