Продуктивность и оптические характеристики трех сортов пшеницы (Triticum aestivum L.) при известковании и внесении азотных удобрений
Автор: Канаш Е.В., Литвинович А.В., Ковлева А.О., Осипов Ю.А., Сальников Э.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агробиология зерновых культур
Статья в выпуске: 1 т.53, 2018 года.
Бесплатный доступ
Известкование кислых почв, занимающих в Российской Федерации 73 млн га сельскохозяйственных угодий, - традиционный прием, который обеспечивает оптимизацию почвенных условий и способствует получению высоких и устойчивых урожаев. При интенсивных технологиях возделывание сельскохозяйственных культур сопровождается выносом кальция с урожаем, вымыванием атмосферными осадками и пр., поэтому требуется его восполнение, что экономически затратно. Знание оптимальных для каждого сорта доз мелиоранта необходимо для корректировки его количества, обеспечивающего максимальный эффект от применения. В представленной работе впервые влияние разных доз мелиоранта (доломитовая мука) оценено in situ по оптическим характеристикам листьев яровой пшеницы ( Triticum aestivum L.) сортов Ленинградская 97, Красноуфимская 100 и Тризо, различающихся по продуктивности и отзывчивости на внесение азотных удобрений. Растения выращивали в 5-литровых сосудах, заполненных дерново-подзолистой почвой, при естественном освещении. Доза мелиоранта была равна 0 (контроль), 0,25, 0,50, 0,75 и 1,00 ммоль-экв/100 г почвы (гидролитическая кислотность Нг). Предпосевное удобрение аммиачной селитрой обеспечивало два варианта азотного питания - оптимальный (1 г азота на 5 кг почвы) и дефицитный (0,15 г азота на 5 кг почвы). Содержание в почве других элементов минерального питания во всех вариантах опыта было одинаковым. Спектры отражения от поверхности листьев в диапазоне 300-1000 нм измеряли с помощью спектрометра HR2000 («Ocean Optics», США). После записи спектров отражения рассчитывали индексы отражения, тесно связанные с содержанием хлорофилла, отношением суммы каротиноидов к сумме хлорофиллов, рассеянием радиации, обусловленным изменением внутренней структуры листа, активностью фотохимических процессов фотосинтеза, а также содержанием антоцианов и флавонолов. Результаты свидетельствуют, что сорта пшеницы реагируют на внесение мелиоранта по-разному. Установлено, что благоприятное влияние мелиоранта на продуктивность больше выражено в условиях дефицита азотного питания. При оптимальном содержании азота продуктивность сорта Ленинградская 97 в ответ на внесение мелиоранта не менялась. Продуктивность сорта Тризо в вариантах 0,50 и 1,00 Hг была выше на 55-60 % и 5-27 % при содержании азота соответственно 1 и 0,15 г/кг почвы. У сорта Красноуфимская 100 диапазон, в котором отмечали положительную реакцию на внесение мелиоранта, оказался уже, чем у сорта Тризо, и был сдвинут в сторону низких доз. Максимальную прибавку урожая зерна отмечали при 0,50 Нг и высоком содержании азота в почве - 30 %. Обнаружена тесная корреляционная связь между массой зерна, сформированного при внесении различных доз мелиоранта, и содержанием хлорофилла в листьях (индекс хлорофилла) у сортов Красноуфимская 100 ( R 2 = 0,87) и Тризо ( R 2 = 0,88). Изменение индексов, характеризующих эффективность превращения энергии света в фотохимических процессах фотосинтеза, позволяет предположить, что внесение мелиоранта не только способствует поглощению азота, но также влияет на эффективность усвоения световой энергии в процессе фотосинтеза.
Пшеница, продуктивность, азотное удобрение, мелиорант, оптические и морфофизиологические свойства
Короткий адрес: https://sciup.org/142214123
IDR: 142214123 | DOI: 10.15389/agrobiology.2018.1.61rus
Текст научной статьи Продуктивность и оптические характеристики трех сортов пшеницы (Triticum aestivum L.) при известковании и внесении азотных удобрений
Кислые почвы в Российской Федерации занимают 73 млн га сельскохозяйственных угодий (1), а их известкование — традиционный прием оптимизации почвенных условий для получения высоких и устойчивых урожаев (2-5). В настоящее время площадь мелиорируемых земель в РФ сократилась с 6 млн до 266 тыс. га (6). На сельскохозяйственных угодьях с повышенной кислотностью в России ежегодно не добирается около 20 млн т продукции в пересчете на зерно, а окупаемость азотных удобрений на сильнокислых почвах в 1,4-2,7 раза ниже, чем на слабокислых и нейтральных (3, 6). Интенсивное возделывание сельскохозяйственных культур сопровождается выносом кальция с урожаем. По обобщенным данным, ежегодный вынос кальция для разных видов колеблется от 20 до 500 кг/га (7). В почвах Нечерноземной зоны на баланс кальция отрицательно влияет его вымывание атмосферными осадками. По данным многолетних исследований, среднегодовые потери кальция в результате вымывания из дерновоподзолистых почв составляют 300-400 кг/га (8). Удорожание мелиорации привело к тому, что количество вносимого с известковыми материалами кальция компенсирует только 6-8 % его естественных потерь. Практически полный отказ от известкования стал причиной перехода значительной части нейтральных почв в категорию слабокислых, а слабокислых — в категорию средне- и сильнокислых (9).
Разная отзывчивость сортов пшеницы на известкование, их генетическая неоднородность по этому признаку — один из доступных ресурсов, которые могут обеспечить уменьшение потерь урожая из-за кислотности почвы. Показано, что некоторые сорта пшеницы могут переносить значительную степень кислотности почвы, в то время как другие очень чувствительны к таким условиям (10-12). Скрининг 116 генотипов пшеницы, включая коммерческие сорта и селекционные линии из Западной Австралии, по толерантности к кислотности почвы позволил идентифицировать формы, существенно превосходящих по этому признаку известные возделываемые сорта (12). Улучшение ситуации за счет генетического улучшения растений по толерантности к закислению почв может рассматриваться не в качестве альтернативы применению извести или других почвенномелиоративных мероприятий, а как необходимое дополнение к ним. Установление отзывчивости на известкование конкретного сорта необходимо для максимально эффективного применения мелиоранта (13). Такой подход позволит существенно снизить затраты на известкование кислых почв.
Общепризнано, что фенотипирование хозяйственно ценных признаков, таких как продуктивность и толерантность к действию абиотических стрессоров, наиболее трудоемко и технически сложно, поскольку требует испытания во многих условиях среды в течение нескольких сезонов. Некоторые из существующих методов основаны на разрушающем отборе образцов растений в разные периоды развития, требуют больших затрат времени и материальных средств. В связи с этим в последнее десятилетие развиваются новые приемы фенотипирования с высокой пропускной способностью — неинвазивная визуализация, спектроскопия, анализ изображений и высокопроизводительные вычисления (14, 15).
Ранее, использовав методы контактной и дистанционной диагностики физиологического состояния растений in situ , мы испытали ряд оптических критериев (индексов отражения) для определения толерантности ячменя и пшеницы к действию разных стрессоров, включая УФ-радиацию, дефицит воды и азота (16-18), и количественной оценки потребности растений в азотных удобрениях (19). Полученные результаты показали, что такой подход позволяет обнаружить у растений нарушения на самых ранних этапах возникновения и может использоваться для совершенствования технологий сельскохозяйственного производства и прогноза урожая.
В представленной работе впервые влияние разных доз мелиоранта (доломитовая мука) оценено in situ по оптическим характеристикам листьев у сортов пшеницы, различающихся по продуктивности и отзывчивости на внесение азотных удобрений. Знание оптимальных для каждого сорта доз мелиоранта необходимо для корректировки его количества, обеспечивающего максимальный эффект от применения.
Цель работы заключалась в подборе оптических критериев при оценке отзывчивости сортов яровой пшеницы, рекомендованных к возделыванию на северо-западе Нечерноземной зоны России, на известкование для изучения особенностей ответной реакции растений на применение 62
мелиоранта в широком диапазоне доз и установление дозы, оптимальной для каждого сорта в зависимости от фона азотного питания.
Методика . Исследование выполняли на трех сортах яровой пшеницы ( Triticum aestivum L.) с разной продуктивностью и отзывчивостьюи на внесение азотных удобрений — Красноуфимская 100, Ленинградская 97 и Тризо. Почва в опыте кислая (рН 4,1) дерново-подзолистая легкосуглинистая с высоким содержанием обменного алюминия и низким содержанием гумуса: гумус — 1,9 %; гидролитическая кислотность (Нг) — 4,7 ммоль-экв/100 г почвы, Ca2+ — 1,75, Al3+ — 0,6 ммоль/100 г; доля частиц размером < 0,01 мм — 24,7 %.
Растения выращивали в вегетационных сосудах (5 кг почвы/сосуд) в вегетационном домике, накрытом полиэтиленовой пленкой, при естественном освещении. Опыт проводился в вегетационный сезон 2012 года, среднемесячная температура которого в мае и июле превышала норму на 1,4 и 0,7 ° С, в августе — была ниже на 0,4 ° С. Полив проводился ежедневно, влажность почвы поддерживали равной 75±5 % от полной полевой вла-гоемкости (ППВ). Схема опыта включала 21 вариант, которые различались по содержанию азота в почве и ее гидролитической кислотности. Для создания неодинакового фона азотного питания перед посевом в каждый сосуд вносили аммиачную селитру из расчета 1 г азота (оптимальное азотное питание — ОАП) или 0,15 г азота (дефицитное азотное питание — ДАП). Дозы мелиоранта (доломитовая мука с нейтрализующей способностью 85 %) равнялись 0 (контроль), 0,25; 0,50; 0,75 и 1,0 Hг. На фоне ОАП у всех трех сортов испытывали четыре режима известкования (пятый вариант — контроль). При ДАП испытывали 3 режима гидролитической кислотности — 0 (контроль), 0,50 и 1,0 Hг на сортах Красноуфимская 100 и Тризо, которые по предварительным данным были более отзывчивы на внесение мелиоранта, чем сорт Ленинградская 97. В каждый сосуд высевали по 20 семян. После появления всходов число растений в сосудах выравнивали, оставляя в каждом по 12 шт. Продуктивность оценивали после достижения фазы полной спелости зерна. Повторность опыта — 4-кратная.
Спектры отраженной от поверхности листьев регистрировали в период выхода в трубку и в начале колошения в средней части закончивших рост соответственно 4-го и 6-го листьев с помощью оптоволоконной спектрорадиометрической системы («Ocean Optics», США). Для каждого варианта опыта записывали не менее 18 спектров. По спектрам отраженной радиации определяли меру рассеяния света листом R800 (6) и рассчитывали индексы отражения (содержание хлорофилла ChlRI, соотношение количества каротиноидов и хлорофилла SIPI, фотохимическая активность фотосинтетического аппарата PRI, содержание антоцианов ARI и флавонолов FRI), характеризующие активность фотосинтетического аппарата:
ChRI = (R 750 - R 705 )/(R 750 + R 705 - 2R 445 ) (20),
SIPI = (R 800 - R 445 )/(R 800 - R 680 ) (21), PRI = (R 570 - R 531 ) (R 570 + R 531 ) (21), ARI = R 750 (1/R 550 - 1/R 700 ) (22), FRI = [(1/R 410 ) - (1/R 460 )] x R 800 (23), где R — величина отражения, цифры — длина волны, отраженной от поверхности листа.
Для удобства интерпретации полученных данных и получения положительных значений индексов отражения по всех вариантах опыта в расчетные формулы PRI, ARI и FRI была введена константная величина С, из которой вычитались значения перечисленных индексов. Получали модифицированные индексы отражения: PRI mod = C 1 - PRI, ARI mod = C2 - ARI, 63
FRImod = C3 - FRI. Величину С1-С3 подбирали экспериментально. Обычно для растений пшеницы, выращиваемой при естественном освещении, С1 была равна 0,5; С2 и С3 — 0,7 (16, 17).
Статистическую обработку полученных данных проводили c применением программ Excel 2010 и Statistica 8 («StatSoft, Inc.» США). Определяли средние значения изучаемых показателей ( M ), стандартные ошибки среднего (±SEM) и доверительный интервал при 95 % доверительном уровне ( t 0,05 ½ SEM). Достоверность различий между вариантами оценивали методами параметрической ( t -критерий Стьюдента) и непараметрической (критерий парных сравнений Вилкоксона) статистики. Различия между вариантами считали достоверными при p ≤ 0,05.
Результаты . Примененные оптические индексы позволяют оценить емкость (интенсивность) фотосинтетической системы (ChlRI — индекс отражения хлорофилла, величина которого определяется содержанием хлорофилла в листе, наиболее тесно коррелирует с содержанием хлорофилла, приходящегося на единицу листовой поверхности), а также эффективность превращения энергии света в фотохимических процессах фотосинтеза (SIPI — отношение суммы каротиноидов к сумме хлорофиллов, PRI — эффективность использования фотосинтетически активной радиации, ARI — содержание антоцианов; R800 — критерий рассеяния света, зависящий от поверхностных характеристик и структуры листа).
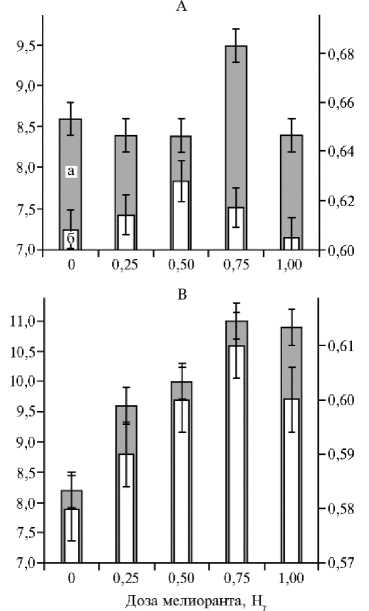
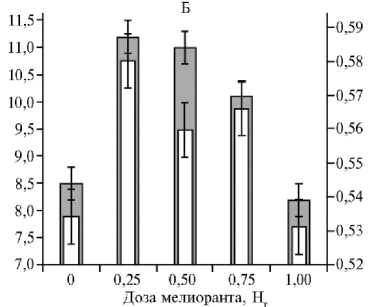
Рис. 1. Масса зерна с одного растения, г (а, левая ордината) и содержание хлорофилла ChlRI, отн. ед. (б, правая ордината) в листьях верхнего яруса у растений пшеницы ( Triticum aestivum L.) в период колошения в зависимости от дозы внесенного мелиоранта при оптимальном азотном питании: А — сорт Ленинградская 97, Б — сорт Красноуфимская 100, В — сорт Тризо (вегетационный опыт, повторность 4-кратная). На рисунке представлены средние значения и доверительные интервалы, M± ( t 0 , 05 ½ SEM).
Растения сортов Ленинградская 97, Красноуфимская 100 и Тризо по-разному реагировали на внесение мелиоранта (рис. 1). Прибавку урожая зерна (12±3 %, p ≤ 0,039) у пшеницы сорта Ленинградская 97 после внесе- ния мелиоранта отмечали только при 0,75 Hг, меньшая и большая дозы не приводили к достоверному изменению урожайности. Наиболее отзывчивым на внесение мелиоранта был сорт Красноуфимская 100, продуктивность которого возрастала более чем на 30±3 % (p ≤ 0,024) после внесения самой малой дозы — 0,25 Hг. Мелиорант в дозе 0,50 Hг тоже увеличивал урожайность этого сорта на 30±2 % (p ≤ 0,009). Более высокая доза (1,00 Hг) оказала существенное, но меньшее влияние: урожай зерна стал выше на 20±3 % (p ≤ 0,041). Максимальная прибавка урожая у сорта Тризо, равная примерно 30 %, наблюдалась после внесения мелиоранта в дозах 0,75 и 1,00 Hг. Этот сорт положительно реагировал на значительно меньшие дозы (0,25 и 0,50 Hг), увеличивая урожай зерна соответственно на 17±2,4 % (p ≤ 0,033) и 24±2,1 % (p ≤ 0,021). Таким образом, растения сорта Ленинградская 97 положительно реагировали на внесение мелиоранта в сравнительно высокой дозе — 0,75 Hг. Другие дозы были неэффективны. Сорт Красноуфимская 100 увеличивал урожайность зерна при всех примененных дозах, но наиболее значительно — при минимальной (0,25 Hг), тогда как у сорта Тризо продуктивность, напротив, возрастала с ростом дозы мелиоранта. Можно предположить, что столь разная реакция на внесение мелиоранта определяется происхождением сортов и свойствами почв, на которых вы- ращивали растения в процессе создания сортов.
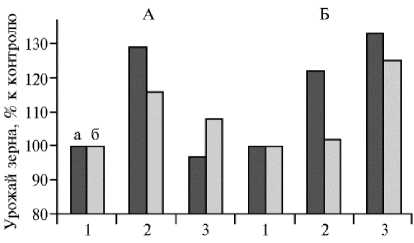
Рис. 2. Изменение массы зерна с растения у сортов пшеницы ( Triticum aestivum L.) Красноуфимская 100 (А) и Тризо (Б) в зависимости от дозы мелиоранта, внесенного перед посевом, и азота: а — оптимальное азотное питание (ОАП), б — дефицитное азотное питание; 1 (контроль) — без мелиоранта, 2 и 3 — внесение мелиоранта (соответственно 0,50 и 1,00 Hг) (вегетационный опыт, повторность 4-кратная). Приведены средние величины, за 100 % принят урожай зерна в варианте без внесения мелиоранта (1). Доверительные интервалы M± ( 1 0,05 x sEm) не превышают ±5 % (р < 0,05).
Изменения продуктивности растений пшеницы в зависимости от дозы мелиоранта и азотного питания представлены на рисунке 2. При оптимальной обеспеченности азотом (вариант ОАП) и внесении 0,50 Нг мелиоранта масса зерна с одного растения у сортов Красноуфимская 100 и Тризо возросла соответственно на 30 и 22 % (р ≤ 0,040). При той же обеспеченности растений азотом увеличение дозы мелиоранта до 1,00 Нг не сопровождалось ростом продуктивности у сорта Красноуфимская 100, однако у сорта Три-зо масса зерна в этих условиях оказалась больше на 35 % (р ≤ 0,035). При недостаточной обеспеченности азотом (вариант ДАП) и сред- ней дозе мелиоранта (0,50 Нг) масса зерна с растения у сорта Красноуфимская 100 увеличилась на 15 % (р ≤ 0,041), у сорта Тризо — не изменилась. При внесении мелиоранта в дозе 1,00 Нг с растений сортов Красноуфимская 100 и Тризо получили зерна больше соответственно на 8±2 %
(р ≤ 0,032) и 25±3 % (р ≤ 0,021), чем в контроле (ОАП) (см. рис. 2). Можно сделать вывод, что при дефиците азотного питания внесение мелиоранта будет повышать эффективность усвоения азота, причем для получения максимального эффекта доза мелиоранта для сорта Красноуфимская 100 должна быть существенно меньшей, чем для сорта Тризо. Вне зависимости от уровня азотного питания растения сорта Красноуфимская 100 давали наибольшую прибавку урожая при внесении 0,50 Нг мелиоранта. Дальнейшее увеличение дозы мелиоранта не сопровождалось ростом продуктивности растений. У сорта Тризо независимо от обеспеченности азотом к максимальной прибавке приводила наиболее высокая доза мелиоранта — 1,00 Нг, однако и в дозе 0,50 Нг мелиорант способствовал значительному росту урожайности.
1. Морфофизиологические показатели у растений пшеницы ( Triticum aestivum L.) двух сортов в период колошения в зависимости от дозы мелиоранта и уровня азотного питания (вегетационный опыт, повторность 4-кратная)
|
Доза, Нг |
Азот, г/сосуд |
ЛАП |
Биомасса органов/растение |
||||||
|
листья |
стебли |
колосья |
|||||||
|
см2 |
1 % |
г 1 |
% |
г 1 |
% |
г 1 |
% |
||
|
Сорт Красноуфимская 100 |
|||||||||
|
0 (контроль) |
1 |
82,8 |
100,0 |
0,25 |
100,0 |
0,55 |
100,0 |
0,19 |
100,0 |
|
0,25 |
1 |
111,8 |
135,1 |
0,30 |
119,8 |
0,42 |
76,7 |
0,18 |
98,3 |
|
0,50 |
1 |
103,1 |
124,5 |
0,28 |
111,9 |
0,50 |
92,1 |
0,14 |
72,7 |
|
0,75 |
1 |
84,9 |
102,6 |
0,28 |
112,1 |
0,49 |
90,1 |
0,14 |
72,7 |
|
1,00 |
1 |
87,0 |
105,1 |
0,32 |
127,6 |
0,42 |
76,5 |
0,06 |
34,4 |
|
0 (контроль) |
0,15 |
76,0 |
100,0 |
0,22 |
100,0 |
0,47 |
100,0 |
0,18 |
100,0 |
|
0,50 |
0,15 |
91,4 |
120,3 |
0,28 |
126,5 |
0,45 |
95,4 |
0,13 |
75,6 |
|
1,00 |
0,15 |
72,9 |
96,0 |
0,27 |
120,9 |
0,45 |
94,8 |
0,13 |
72,5 |
|
Сорт |
Тризо |
||||||||
|
0 (контроль) |
1 |
92,6 |
100,0 |
0,29 |
100,0 |
0,39 |
100,0 |
0,16 |
100,0 |
|
0,25 |
1 |
107,1 |
115,6 |
0,35 |
117,9 |
0,47 |
118,9 |
0,14 |
87,3 |
|
0,50 |
1 |
108,5 |
117,2 |
0,35 |
118,1 |
0,39 |
100,1 |
0,10 |
63,6 |
|
0,75 |
1 |
111,8 |
120,8 |
0,37 |
127,8 |
0,39 |
100,6 |
0,11 |
64,8 |
|
1,00 |
1 |
118,5 |
128,0 |
0,36 |
123,3 |
0,40 |
100,7 |
0,13 |
77,2 |
|
0 (контроль) |
0,15 |
93,5 |
100,0 |
0,30 |
100,0 |
0,47 |
100,0 |
0,17 |
100,0 |
|
0,50 |
0,15 |
106,4 |
113,8 |
0,31 |
104,3 |
0,45 |
105,7 |
0,13 |
84,7 |
|
1,00 |
0,15 |
115,9 |
124,0 |
0,32 |
105,1 |
0,39 |
90,7 |
0,12 |
77,3 |
П р и м еч а ни е. ЛАП — листовая ассимилирующая поверхность. Для ЛАП и биомассы указан процент к контролю — варианту (для каждого из сортов и каждой из доз азота), в котором мелиорант не вносили. Доверительные интервалы М ±( t 0,05 ½ SEM) не превышают ±5 % (р ≤ 0,05).
Внесение мелиоранта приводило к формированию более активного фотосинтетического аппарата, стимулируя синтез хлорофилла (см. рис. 1), увеличивая площадь листовой ассимилирующей поверхности и долю листьев в общей биомассе растений (табл. 1). Независимо от обеспеченности растений азотом мелиорация почвы способствовала существенному увеличению содержания хлорофилла. При хорошей обеспеченности (вариант ОАП) максимальное увеличение количества хлорофилла у сорта Красноуфимская 100 происходило при дозе мелиоранта 0,50 Нг. Дальнейшее увеличение дозы мелиоранта (до 1,0 Нг) не приводило к росту содержания этого пигмента. Сорт Тризо положительно реагировал на внесение мелиоранта во всем диапазоне применяемых доз: количество хлорофилла возрастало с ростом дозы мелиоранта вне зависимости от уровня азотного питания (см. рис. 1).
Коэффициент детерминации ( R 2) для зависимости между массой зерна и индексом хлорофилла (ChlRI) составил у сорта Красноуфимская 100 — R 2 = 0,87 (p = 0,020), у Тризо — R 2 = 0,81 (p = 0,018). У сорта Ленинградская 97 связь между массой семян, полученных с одного растений, и содержанием хлорофилла не проявилась ( R 2 = 0,008; p = 0,88).
При оптимальном азотном питании у сортов Красноуфимская 100 и Тризо с возрастанием дозы мелиоранта увеличивалась биомасса листьев. Внесение мелиоранта при дефиците азота сопровождалось усилением накопления листовой биомассы у сорта Красноуфимская 100, при этом максимального значения этот показатель достигал при внесении 0,50 Нг мелиоранта (см. табл. 1). Достоверного влияния доз мелиоранта на биомассу листьев пшеницы сорта Тризо при дефиците азотного питания не выявили. Характерно, что у сортов Красноуфимская 100 и Тризо при оптимальном азотном питании дозы мелиоранта (соответственно 0,25 и 0,75-1,00 Нг), вызывающие максимальную прибавку площади листовой ассимилирующей поверхности, биомассы листьев, содержания хлорофилла (ChlRI) и максимальную прибавку урожая зерна совпадали.
Увеличение площади листьев вследствие внесения мелиоранта на фоне оптимального азотного питания сопровождалось уменьшением биомассы стеблей, наиболее выраженным у сорта Красноуфимская 100 (см. табл. 1). При дефицитном уровне азотного питания биомасса стеблей в ответ на внесение мелиоранта уменьшалась незначительно. Биомасса зеленых колосьев у растений сортов Красноуфимская 100 и Тризо к сроку отбора проб была ниже после внесения мелиоранта. Полученные результаты свидетельствуют, что мелиорант, оптимизируя азотное питание растений, способствует росту листьев и задерживает наступление их старения, что сопровождается торможением перехода к колошению и замедляет развитие колосьев. Аналогичные процессы можно наблюдать при высоком уровне азотного питания. Формирование мощного фотосинтетического аппарата, который сохраняет способность к фотосинтезу более длительное время, дает несомненные преимущества для реализации потенциальной продуктивности растений. Однако можно предположить, что отрицательными последствиями таких изменений, по-видимому, окажется некоторое удлинение вегетационного периода и склонность к полеганию растений из-за формирования более слабых стеблей.
2. Оптические характеристики листьев у пшеницы ( Triticum aestivum L.) двух сортов в зависимости от дозы мелиоранта и уровня азотного питания (вегетационный опыт, повторность 4-кратная)
|
Вариант |
Доза мелиоранта, Нг |
Уровень азота |
ChlRI |
SIPI |
R 800 |
PRI mod |
ARI mod |
FRI mod |
|
1 |
0 |
Сорт ОАП |
Красноу 0,530 |
ф и м с к а я 100 1,019 30,90 |
0,462 |
0,557 |
3,797 |
|
|
2 |
0,50 |
ОАП |
0,557* |
1,020 |
30,86 |
0,470 |
0,479* |
4,586* |
|
3 |
1,00 |
ОАП |
0,521 |
1,014* |
30,25 |
0,472 |
0,496 |
3,152 |
|
4 |
0 |
ДАП |
0,525 |
1,014 |
30,39 |
0,445 |
0,455 |
3,737 |
|
5 |
0,50 |
ДАП |
0,537 |
1,014 |
31,91* |
0,476* |
0,502 |
2,982 |
|
6 |
1,00 |
ДАП |
0,543 |
1,012 |
32,25* |
0,494* |
0,487 |
3,636 |
|
7 |
0 |
ОАП |
Сорт Тризо 0,590 1,009 |
31,84 |
0,445 |
0,428 |
3,561 |
|
|
8 |
0,50 |
ОАП |
0,590 |
1,008 |
32,26 |
0,448 |
0,443 |
2,855* |
|
9 |
1,00 |
ОАП |
0,604* |
1,011 |
33,67* |
0,448 |
0,532* |
2,551* |
|
10 |
0 |
ДАП |
0,582 |
1,009 |
31,85 |
0,435 |
0,385 |
3,992 |
|
11 |
0,50 |
ДАП |
0,596 |
1,012 |
31,74 |
0,423 |
0,425 |
3,937 |
|
12 |
1,00 |
ДАП |
0,606* |
1,011 |
32,89* |
0,448 |
0,474 |
3,658 |
|
П р и м е ч а н и е. ОАП и ДАП — оптимальное и дефицитное |
азотное питание. Индексы отражения: |
|||||||
СhlRI — содержание хлорофилл, SIPI — соотношение каротиноиды/хлорофилл, R800 — показатель рассеяния света внутри листа, PRImod — активность фотохимических процессов, характеризующий интенсивность тепловой диссипации, ARImod и FRImod — содержание антоцианов и флавонолов. Расчетные формулы индексов приведены в разделе «Методика». При статистической обработке применен непараметрический тест Вилкоксона (выполнено попарное сравнение вариантов 1 и 2, 1 и 3; 4 и 5, 4 и 6; 7 и 8, 7 и 9; 10 и 11, 10 и 12).
* Различия для соответствующих попарных сравнений статистически значимы при р ≤ 0,05.
Оптические характеристики листьев у сортов Красноуфимская 100 и Тризо различались и изменялись в зависимости от обеспеченности азотом и в ответ на разные дозы мелиоранта (табл. 2), но чувствительность индексов к изменению этих факторов оказалась неодинаковой. Максимальное содержание хлорофилла (ChlRI) у сортов отмечали при тех же дозах мелиоранта, которые были необходимы для наибольшей прибавки урожая зерна (для сорта Красноуфимская 100 — 0,25 Нг, для Тризо — 0,75-1,00 Нг).
Диагностика активности фотосинтетического аппарата, основанная на определении количества хлорофилла, не всегда позволяет объективно оценить физиологическое состояние растений. Например, при изучении реакции пшеницы и ячменя разных сортов на действие ультрафиолетовой радиации (λ = 280-380 нм), показано, что зависимость между индексом отражения хлорофилла и величиной нетто-продуктивности имеет место лишь при выраженном угнетении роста растений (16-18). Вероятнее всего, не- большая потеря хлорофилла направлена на создание условий для устранения последствий окислительного стресса, и это не всегда сопровождается торможением роста и снижением продуктивности (16-18). Полученные результаты позволяют заключить, что на ранних этапах дефицита минерального питания интенсивность фотосинтеза и, соответственно, продукционного процесса не лимитируется небольшим снижением емкости фотосинтетического аппарата. По-видимому, одной из основных причин замедления роста становится менее эффективное превращение световой энергии в химическую при фотосинтезе. Эффективность использования света и элементов питания в настоящее время представляет большой интерес для селекции, и неинвазивные оптические методы, позволяющие быстро и количественно оценить эти признаки, рассматриваются как наиболее перспективные для совершенствования технологий управления сельскохозяйственным производством и получения высоких урожаев (15, 24, 25).
Фотохимический индекс отражения PRI был разработан для оценки скорости изменения относительного содержания пигментов ксантофиллового цикла, которые служат активным регулятором светового потока в пигмент-белковых комплексах (20, 26, 27). При высокой интенсивности света или в стрессовых условиях благодаря превращению каротиноидов ксантофиллового цикла, протекающему с выделением тепла, избыточное поглощение световой энергии хлорофиллом антенного комплекса снижается. Тепловая диссипация излишней энергии — важнейшая фотопротек-торная функция каротиноидов по защите фотохимической системы хлоропластов от необратимого повреждения вследствие притока в реакционные центры большого количества энергии, которая не может использоваться. Изменение PRI во время вегетации растений может быть результатом сочетания работы ксантофиллового цикла и изменения общего пула хлорофиллов и каротиноидов, который формируется в ответ на долговременную акклиматизацию растений к условиям обитания (28, 29). Тенденция к увеличению тепловой диссипации (PRImod) в ответ на внесение мелиоранта была наиболее выражена у сорта Красноуфимская 100, особенно при пониженном уровне азота (см. табл. 2). Достоверных изменений фотохимического индекса отражения у сорта Тризо мы не обнаружили. При низкой обеспеченности азотом внесение мелиоранта способствовало превращению каротиноидов и усилению тепловой диссипации, что особенно проявилось у сорта Красноуфимская 100.
Содержание каротиноидов оценивали также по SIPI (см. табл. 2). Величина SIPI практически не менялась, достоверные (р ≤ 0,05) различия проявились лишь между вариантами 1 и 3. G.A. Blackburn (26) показал, что имеется нелинейная зависимость между величиной SIPI и соотношением каротиноиды:хлорофилл a, которая наилучшим образом описывается логарифмической моделью ( R 2 = 0,86). SIPI недостаточно чувствителен при низких значениях этого соотношения, но становится чувствительнее при их повышении. По-видимому, именно этим можно объяснить отсутствие достоверных изменений SIPI в ответ на внесение мелиоранта и снижение обеспеченности азотом, поскольку содержание хлорофилла во всех вариантах опыта было достаточно высоким.
Достоверные (р ≤ 0,05) уменьшение индексов ARImod и FRImod наблюдали только на высоком фоне азотного питания как у сорта Красноуфимская 100, так и у Тризо. Антоцианы и флавонолы в основном абсорбируют излучение в зеленой и ультрафиолетовой части спектра, незначительно — в красной и почти не поглощают в синей. Накопление антоцианов при стрессе уменьшает поток проникающей к хлоропластам фото-68
синтетически активной радиации, что способствует защите реакционных центров в пластидах при возникновении стресса (22, 30, 31). Имеются данные, что антоцианы и флавонолы выполняют также антиоксидантные функции, в частности флавоноиды, находящиеся в хлоропластах, удаляют синглетный кислород, образующийся в тканях растений при действии различных стрессовых факторов среды (32).
Величина индекса R800 обусловлена прежде всего объемом межклеточного воздушного пространства, отношением площади поверхности мезофилла к площади листа, а также особенностями внутренней структуры листа, протяженностью границы раздела воздух—вода, размерами клеток и органелл (20). Таким образом, увеличение R800 при дефиците минерального питания свидетельствует об изменении внутренней структуры листа, способствующем усилению рассеяния и уменьшению доли поглощенной солнечной радиации. Поскольку величина R800 возрастает при внесении мелиоранта, можно сделать вывод, что уменьшение кислотности почвы может сопровождаться изменением структуры листа. Такие изменения у сорта Красноуфимская 100 происходят при внесении мелиоранта на фоне дефицита азота, тогда как у Тризо — и при высоком, и при пониженном уровне азота в ответ на внесение 1,0 Нг мелиоранта (см. табл. 2).
Ранее было показано, что по изменению индексов отражения можно исследовать один из механизмов неспецифической ответной реакции растений на стрессовое воздействие среды — down regulation фотосистемы II (16, 17). В отличие от индекса хлорофилла, величина которого характеризует потенциальную способность растений поглощать фотосинтетически активную радиацию, все остальные индексы, представленные в таблице 2, позволяют оценить эффективность использования поглощенного света, небольшое снижение которой (с увеличением SIPI, R800, PRImod, ARImod и FRImod) отражает торможение синтетических процессов, во время которого происходит приспособление растений к меняющимся условиям среды.
Итак, при хорошей обеспеченности азотом (1 г д.в. на 5 кг почвы) у сорта Ленинградская 97 масса зерна не зависит от внесения мелиоранта. У сорта Красноуфимская 100 область положительной реакции на мелиорант сдвинута в сторону низких доз, у Тризо — обнаруживается во всем их диапазоне. У этих сортов прибавка массы зерна на фоне 0,25 Нг мелиоранта составила соответственно более 30 и 17 % (эффект проявлялся и для доз 0,50 и 0,75 Нг, но доза 1,0 Нг снижала урожай зерна у сорта Красноуфимская 100. У этих же сортов масса зерна при внесении разных доз мелиоранта и содержание хлорофилла в листьях тесно коррелировали ( R 2 = 0,87 и R 2 = 0,88). Стимулирующее влияние мелиоранта наиболее выражено при низкой дозе азота (0,15 г д.в. на 5 кг почвы). Увеличение индексов, характеризующих эффективность превращения энергии света в процессах фотосинтеза (SIPI, R800, PRImod, ARImod и FRImod) позволяет предположить, что мелиорант, улучшая питание растений, способствует изменению метаболизма в сторону приспособления к меняющимся условиям вегетации.
Список литературы Продуктивность и оптические характеристики трех сортов пшеницы (Triticum aestivum L.) при известковании и внесении азотных удобрений
- Добровольский Г.В., Шоба С.А., Балабко П.Н. Почвы и земельные ресурсы России. В кн.: Деградация и охрана почв/Под ред. Г.В. Добровольского. М., 2002: 5-32.
- Надежкин С.М., Надежкина Е.В. Влияние известкования на гумусное состояние почв лесостепи Поволжья. В сб.: Вопросы известкования почв/Под ред. И.А. Шильникова, Н.И. Акановой. М., 2002: 119-125.
- Шильников И.А., Сычёв В.Г., Аканова Н.И., Зеленов Н.А. Некоторые вопросы известкования почв в современных условиях. В сб.: Современные проблемы и перспективы известкования кислых почв. СПб, 2010: 19-24.
- Шильников И.А., Сычёв В.Г., Аканова Н.И. К вопросу о состоянии и эффективности химической мелиорации почв в земледелии Российской Федерации. Плодородие, 2013, 1(70): 9-14.
- Окорков В.В. Теоретические основы химической мелиорации кислых почв. Владимир, 2016.
- Якушев В. П., Осипов А. И., Миннулин Р. М., Воскресенский С. В. К вопросу об известковании кислых почв в России. Агрофизика, 2013, 2(10): 18-22.
- Небольсин А.Н., Небольсина З.П. Теоретические основы известкования почв. СПб, 2005.
- Зеленов Н.А., Шильников И.А., Аканова Н.И., Швырков Д.А. Резерв химических мелиорантов и их агроэкологическая эффективность. В сб.: Современные проблемы и перспективы известкования кислых почв. СПб, 2010: 30-34.
- Литвинович А.В., Ковлева А.О., Павлова О.Ю. Влияние известкования на накопление марганца и железа растениями яровой пшеницы. Агрохимия, 2015, 5: 61-68.
- Neenan M. Adaptability of wheat varieties to acid soils. Nature, 1955, 175: 1090-1091 ( ) DOI: 10.1038/1751090b0
- Ataur Rahman M., Barma N.C.D., Sarker M.H., Sarker M.M.R., Nazrul M.M.I. Adaptability of wheat varieties in strongly acidic soils of Sylhet. Bangladesh Journal of Agricultural Research, 2013, 38(1): 97-104 ( ) DOI: 10.3329/bjar.v38i1.15194
- Tang C., Nuruzzaman M., Rengel Z. Screening wheat genotypes for tolerance of soil acidity. Aust. J. Agr. Res., 2003, 54: 445-452 ( ) DOI: 10.1071/AR02116
- Литвинович А.В., Ковлева А.О., Павлова О.Ю. Отзывчивость различных сортов яровой пшеницы на известкование. Известия Санкт-Петербургского государственного аграрного университета, 2013, 30: 59-64.
- Humplík J.F., Lazár D., Husičková A., Spíchal L. Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses -a review. Plant Methods, 2015, 11(29): 1-10 ( ) DOI: 10.1186/s13007-015-0072-8
- Ruckelshausen A., Busemeyer L. Toward digital and image-based phenotyping. In: Phenomics in crop plants: trends, options and limitations/J. Kumar, A. Pratap, S. Kumar (eds.). Springer, New Delhi, India, 2015: 41-60 ( ) DOI: 10.1007/978-81-322-2226-2
- Kanash E.V., Panova G.G., Blokhina S.Yu. Optical criteria for assessment of efficiency and adaptogenic characteristics of biologically active preparations. Acta Horticulturae, 2013, 1009: 37-44 ( ) DOI: 10.17660/ActaHortic.2013.1009.2
- Kanash E.V., Osipov Yu.A. Optical signals of oxidative stress in crops physiological state diagnostics. Proc. 7th European Conference on Precision Agriculture (Wageningen, Netherlands, 2009)/E.J. van Henten, D. Goense, C. Lokhorst (eds.). Wageningen, 2009: 81-89 ( ) DOI: 10.3920/978-90-8686-664-9
- Yakushev V., Kanash E., Rusakov D., Blokhina S. Specific and non-specific changes in optical characteristics of spring wheat leaves under nitrogen and water deficiency. Advances in Animal Biosciences, 2017, 8(2), 229-232 ( ) DOI: 10.1017/S204047001700053X
- Yakushev V. P., Kanash E. V. Evaluation of wheat nitrogen status by colorimetric characteristics of crop canopy presented in digital images. Journal of Agricultural Informatics, 2016, 7 (1): 65-74 ( ) DOI: 10.17700/jai.2016.7.1.268
- Sims D.A., Gamon J.A. Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages. Remote Sens. Environ., 2002, 81(2-3): 337-354 ( ) DOI: 10.1016/S0034-4257(02)00010-X
- Peñuelas J., Barret F., Fitella I. Semi-empirical indices to assess carotenoids/chlorophyll a ratio from leaf spectral reflectance. Photosynthetica, 1995, 31(2): 221-230.
- Мерзляк М.Н., Гительсон А.А., Чивкунова О.Б., Соловченко А.Е., Погосян С.И. Использование спектроскопии отражения в анализе пигментов высших растений. Физиология растений, 2003, 50: 785-792 ( ) DOI: 10.1023/A:1025608728405
- Merzlyak M.N., Solovchenko A.E., Smagin A.I., Gitelson A.A. Apple flavonols during fruit adaptation to solar radiation: spectral features and techniques for non-destructive assessment. J. Plant Physiol., 2005, 162(2): 151-160 ( ) DOI: 10.1016/j.jplph.2004.07.002
- Gaju O., DeSilva J., Carvalho P., Hawkesford M.J., Griffiths S., Greenland A., Foulkes M.J. Leaf photosynthesis and associations with grain yield, biomass and nitrogen-use efficiency in landraces, synthetic-derived lines and cultivars in wheat. Field Crops Research, 2016, 193: 1-15 ( ) DOI: 10.1016/j.fcr.2016.04.018
- Araus J.L., Slafer G.A., Royo C., Serret D. Breeding for yield potential and stress adaptation in cereals. Crit. Rev. Plant Sci., 2008, 27: 377-412 ( ) DOI: 10.1080/07352680802467736
- Blackburn G.A. Spectral indices for estimating photosynthetic pigment concentrations: a test using senescent tree leaves. International Journal of Remote Sensing, 1998, 19: 657-675 ( ) DOI: 10.1080/014311698215919
- Gamon J.A., Serrano L., Surfus J.S. The photochemical reflectance index: an optical indicator of photosynthetic radiation use efficiency across species, functional types, and nutrient levels. Oecologia, 1997, 112: 492-501 ( ) DOI: 10.1007/s004420050337
- Gitelson A.A., Gamon J.A., Solovchenko A. Multiple drivers of seasonal change in PRI: Implications for photosynthesis 1. Leaf level. Remote Sens. Environ., 2017, 191: 110-116 ( ) DOI: 10.1016/j.rse.2016.12.014
- Gitelson A.A., Gamon J.A., Solovchenko A. Multiple drivers of seasonal change in PRI: Implications for photosynthesis 2. Stand level. Remote Sens. Environ., 2017, 190: 198-206 ( ) DOI: 10.1016/j.rse.2016.12.015
- Hatier J.-H.B, Gould K.S. Anthocyanin function in vegetative organs. In: Anthocyanins/C. Winefield, K. Davies, K. Gould (eds.). Springer, NY, 2008: 1-19 ( ) DOI: 10.1007/978-0-387-77335-3_1
- Steyn W.J., Wand S.J.E, Holcroft D.M., Jacobs G. Anthocyanins in vegetative tissues: a proposed united function in photoprotection. New Phytol., 2002, 155: 349-361 ( ) DOI: 10.1046/j.1469-8137.2002.00482.x
- Agati G., Matteini P., Goti A., Tattini M. Chloroplast-located flavonoids can scavenge singlet oxygen. New Phytologist, 2007, 174: 77-89 ( ) DOI: 10.1111/j.1469-8137.2007.01986.x


