Профиль пациентов с впервые установленной легочной артериальной гипертензией на фоне системных заболеваний соединительной ткани: взгляд кардиолога
Автор: Резухина Е. А., Зубова М. А., Родненков О. В., Мартынюк Т. В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Цель: провести комплексный анализ клинико-функционального и гемодинамического статуса пациентов с легочной артериальной гипертензией (ЛАГ), ассоциированной с системным заболеванием соединительной ткани (ЛАГ-СЗСТ).
Легочная артериальная гипертензия, ассоциированные формы, системные заболевания соединительной ткани, стратификация риска, лаг-специфическая терапия
Короткий адрес: https://sciup.org/143180188
IDR: 143180188 | УДК: 616.131 | DOI: 10.38109/2225-1685-2023-2-48-55
Текст научной статьи Профиль пациентов с впервые установленной легочной артериальной гипертензией на фоне системных заболеваний соединительной ткани: взгляд кардиолога
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Некоммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт:
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Легочная артериальная гипертензия (ЛАГ) является редким заболеванием сердечно-сосудистой системы с прогрессирующим течением и неблагоприятным прогнозом [1]. Дисбаланс между вазоконстрикторными и вазодилатирующими субстанциями с активацией свертывающей системы крови приводит к повышению легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА) с последующим ремоделированием сосудов малого круга кровообращения, правожелудочковой сердечной недостаточности и преждевременной смерти пациентов [2,3].
По данным зарубежных регистров, пациенты с ЛАГ, ассоциированной с системным заболеванием соединительной ткани (ЛАГ-СЗСТ), представляют наиболее частую из ассоциированных форм ЛАГ [1,4]. По материалам российского регистра, ЛАГ-СЗСТ занимает третье место по распространенности после ЛАГ, ассоциированной с врожденными пороками сердца (36,6%), составляя 19,3% [5].
Системные заболевания соединительной ткани (СЗСТ) представляют собой группу гетерогенных заболеваний, наиболее распространенным из которых является системная склеродермия (ССД). ЛАГ является одним из тяжелых осложнений СЗСТ.
Общая распространенность ЛАГ среди пациентов с ССД составляет 6,4% (95% ДИ 5–8,3%) [6]. Распространенность ЛАГ при других СЗСТ менее изучена, что обуславливается меньшей выявляемостью [7].
ССД – системное аутоиммунное заболевание, характеризующееся генерализованной микроангиопатией, иммунологическими нарушениями и активацией процессов фиброза, прогноз которого определяется поражением внутренних органов, в первую очередь сердца, легких и почек [8]. Проявлениями ССД, ассоциированными с ЛАГ, являются пожилой возраст, лимитированное поражение кожи и повышение расчетного систолического давления в легочной артерии (СДЛА) при эхокардиографии (ЭхоКГ) [7-9]. В рутинной клинической практике ЛАГ у больных ССД диагностируется поздно, что негативно сказывается на выживаемости [9]. Прогноз пациентов с ЛАГ-СЗСТ значительно хуже, как при естественном течении, так и при применении современных методов терапии. Годичная выживаемость при ЛАГ-СЗСТ составляет 82%, в то время как при идиопатической ЛАГ (ИЛГ) – 93% [6,7,10].
Верифицированный диагноз СЗСТ способствует осуществлению раннего скрининга на наличие ЛАГ у данной категории больных с последующим назначением ЛАГ-специфической те-
1,50%
■ ИБС ■ ХТЭЛГ
■ ГБ ■ ЛАГ-СЗСТ (неуточненная)
■ ЛГ ■ ЛАГ-СЗСТ (уточненная)
■ ЛАГ ■ Рестриктивная КМП
■ ИЛГ
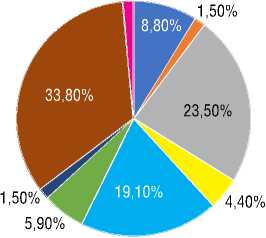
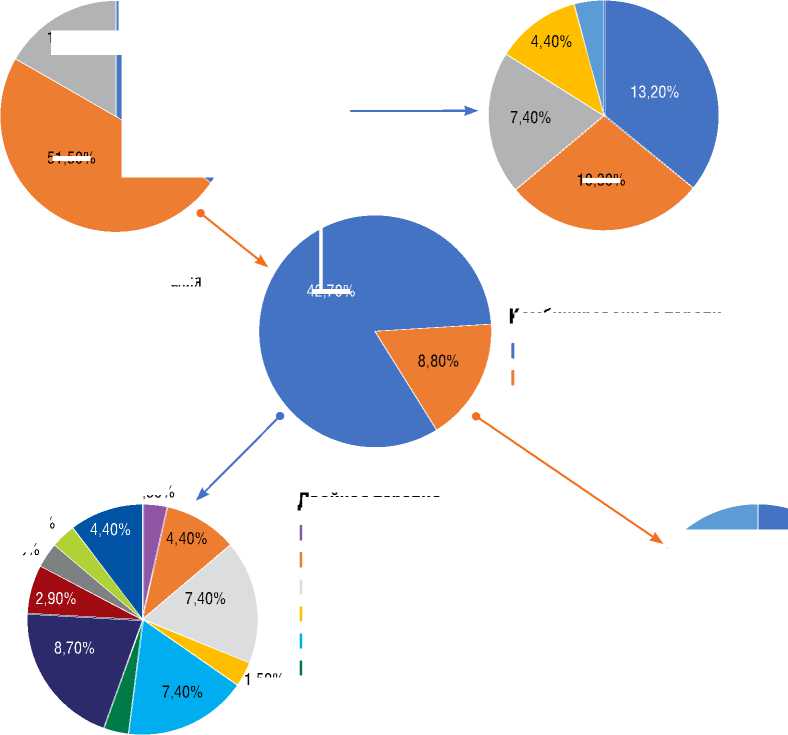
Рисунок 1. Диагнозы пациентов с ЛАГ-СЗСТ при поступленииFigure 1. Diagnosis of PAH-CTD patients admitted to the cardiology department
Примечание: ГБ – гипертоническая болезнь; ИБС – ишемическая болезнь сердца; ИЛГ – идиопатическая легочная гипертензия; ЛАГ-СЗСТ (неуточненная) – легочная артериальная гипертензия, ассоциированная с системны заболеванием соединительной ткани (неуточненная); ЛАГ-СЗСТ (уточненная) – легочная артериальная гипертензия, ассоциированная с системны заболеванием соединительной ткани (уточненная); ЛГ – легочная гипертензия; рестриктивная КПМ – рестриктивная кардиомиопатия; ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия
Notes: HBP – high blood pressure; CAD – coronary artery disease; IPAH – idiopathic pulmonary arterial hypertension; PAH-CTD (unidentified) – connective tissue disease-associated pulmonary arterial hypertension (unidentified); PAH-CTD (identified) – connective tissue disease-associated pulmonary arterial hypertension (identified); PH – pulmonary hypertension; RCM – restrictive cardiomyopathy; CTEPH – chronic thromboembolic pulmonary hypertension
4,40%
-
■ Системная склеродермия
-
■ Системная красная
волчанка
-
■ Системная склеродермия + синдром Шегрена
-
■ Синдром Шегрена
-
■ Ревматоидный артрит
-
■ Недифференцированное заболевание соединительной ткани
-
■ Анемия
-
■ Нарушение ритма сердца
-
■ Варикозное расширение
вен нижних конечностей
-
■ Антифосфолипиный синдром
-
■ Гипертоническая болезнь
-
■ Вирусный гепатит С
-
■ Заболевания щитовидной
железы
-
■ Сахарный диабет 2 типа
-
■ Атеросклероз коронарных артерий
-
■ Интерстициальное
поражение легких
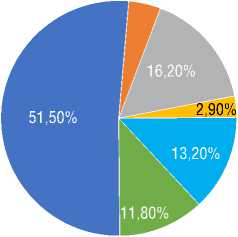
Рисунок 2. Спектр СЗСТFigure 2. CTD diagnoses
50 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 2, 2023
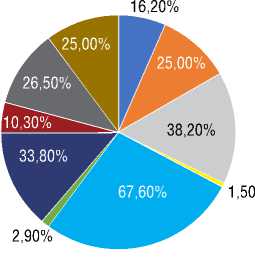
Рисунок 3. Сопутствующие заболевания у пациентов с ЛАГ-СЗСТ
-
Figure 3. Comorbidities in PAH-CTD patients
рапии при необходимости [6]. Несмотря на вышесказанное, согласно опыту работы НМИЦ кардиологии им. акад. Е.И. Чазова, как ведущего в нашей стране экспертного центра по легочной гипертензии (ЛГ), выявлены случаи как поздней диагностики ЛАГ-СЗСТ, так и ложной диагностики причины высокой ЛГ.
МАТЕРИАЛ И МЕТОДЫ
В рутинной работе экспертного центра на базе отдела легочной гипертензии и заболеваний сердца НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии им. ак. Е.И. Чазова» Минздрава России за период 2016-2022 гг. выявлено 68 пациентов с впервые установленным диагнозом ЛАГ-СЗСТ.
Диагноз ЛАГ-СЗСТ устанавливался в соответствии с алгоритмом, предложенным в евразийских (2019 г.) [2], и российских рекомендациях по лечению ЛГ (2020 г.) [3].
Проведен анализ клинико-демографической картины в зависимости от этиологии СЗСТ, показателей функционального и гемодинамического статуса с определением профиля риска летальности.
Оценка риска летальности в течение одного года производилась согласно шкалам стратификации риска, предложенным в европейских рекомендациях ESC/ERS 2015г, евразийских (2019 г.) и российских рекомендациях по лечению ЛГ (2020 г.) [1-3], а также по данным регистра REVEAL 2.0 [12] и упрощенного калькулятора оценки риска REVEAL Lite 2 [13]. Категории риска определялись как низкого, промежуточного и высокого в соответствии с имеющимися факторами риска у каждого пациента при включении в исследование [1-3,12,13].
Полученные данные представлены в виде среднего значения и стандартного отклонения, медианы, 25% и 75% перцентилей и являются описательными.
РЕЗУЛЬТАТЫ
По результатам оценки данных при поступлении у 23,5% пациентов лишь предполагался диагноз ЛГ, у 19,1% пациентов – ИЛГ, у 5,9% – хронической тромбоэмболической ЛГ, а у 11,8% пациентов предполагалось наличие иного заболевания сердечно-сосудистой системы (рис. 1).
Среди всей палитры СЗСТ у половины пациентов (51,5%) выставлялся диагноз ССД, также часто встречалась комбинация ССД и синдрома Шегрена (16,2%) (рис. 2).
Следует обратить внимание и на профиль сопутствующей патологии, среди которой у 67,6% пациентов превалировало наличие гипертонической болезни, варикозного расширения вен нижних конечностей (38,2%) и заболеваний щитовидной железы (33,8%), что отражено на рисунке 3.
При оценке клинического статуса медиана возраста пациентов составила 59,5 (53,0-69,0) лет, 94,1% больных были женщины. Медиана индекса массы тела (ИМТ) составила 27,0 кг/м 2 . У большинства больных выявлены признаки сердечной недостаточности (СН): у половины пациентов – отечный синдром (55,9%), а при проведении эхокардиографии (ЭхоКГ) – выпот в полости перикарда (51,5%), у пятой части пациентов – гепатомегалия (17,6%).
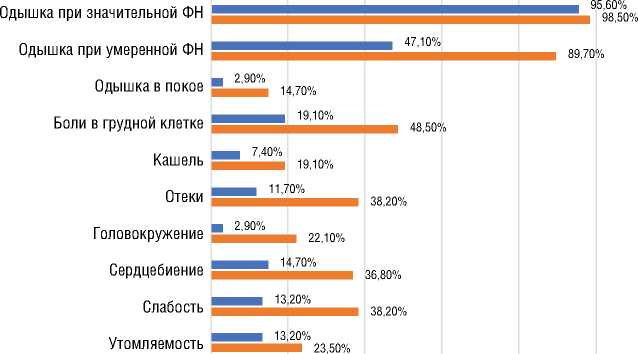
Во время сбора анамнеза обращало на себя внимание быстрое прогрессирование симптомов ЛАГ и СН от их манифестации до постановки диагноза, что показано на рисунке 4. Примечательно, что медиана времени от появления первого симптома до первого обращения к врачу составила 4 месяца (0-13,5), а от первого обращения до постановки диагноза 7,5 месяцев (1,75-20,0).
По результатам оценки функционального статуса медиана дистанции в тесте 6-минутной ходьбы (Т6МХ) составила 345,0 м (259,25-400,0), что соответствовало функциональному классу III ФК (ВОЗ) с медианой одышки по Боргу 5 (3,0-6,0) баллов. В связи с тяжестью состояния 12 (17,7%) пациентам Т6МХ не проводился. Таким образом, у подавляющего большинства больных (66,2%) по результатам обследования установлен III ФК (ВОЗ), у 19,1% – IV ФК (ВОЗ), а I и II ФК (ВОЗ) – лишь у 2,9% и 11,8% пациентов соответственно.
Для оценки тяжести и стратификации риска ЛАГ по имеющимся известным шкалам оценки риска проводился ряд лабораторных и инструментальных исследований. Медиана уровня мозгового натрийуретического пептида (NT-proBNP) составила 1953 (367,2-3472,0) нг/л.
Синкопе 8,80%16,20%
Предобморочные состояния 4,40% 11,80%
Осиплость голоса 2 2 , , 9 9 0 0 % %
Потеря массы тела 1 2 ,5 ,9 0 0 % %
при манифестации заболевания при постановке диагноза
Рисунок 4. Динамика симптоматики у пациентов с ЛАГ-СЗСТ
-
Figure 4. Symptoms progression in PAH-CTD patients
По результатам ЭхоКГ медиана площади правого предсердия (S ПП) составила 23 (19,0-26,75) см 2 . При катетеризации правых отделов сердца (КПОС) получены следующие данные: медиана среднего ДЛА 51,0 (35,5-62,0) мм рт. ст., медиана среднего давления в ПП 7,0 (5,0-12,75) мм рт. ст., медиана сатурации смешанной венозной крови 62,0 (56,0-66,0)%, медиана сердечного индекса 2,1 (1,7-2,5) л/мин/м2, медиана ЛСС 11,48 (5,99-15,71) ед. Вуда.
Клинико-демографические характеристики пациентов представлены в таблице 1.
В соответствии с критериями диагностики ЛАГ-ассоциированного фенотипа ССД, выявленных в работе Юд-киной Н.Н. соавт. (2017) [9], проанализированы данные всех пациентов с ЛАГ-СЗСТ, включенных в исследование (табл. 2).
У пациентов с ССД мочевая кислота (МК) идентифицирована как маркер повреждения микрососудов и демонстрирует хорошую корреляцию с уровнем креатинина в сыворотке и показателями гемодинамики [14,15]. Гиперурикемия – частое проявление гипоксии тканей: повышение уровня МК, побоч- ного продукта окисления пуринов, возникает при нарушении окислительного метаболизма и обнаруживается у пациентов с ЛАГ различной этиологии с доказанной корреляцией с ФК, смертностью и дистанцией Т6МХ [14]. Всем пациентам в НМИЦК рутинно выполняется биохимический анализ крови, но при отсутствии суставных симптомов не оценивается уровень МК, в связи с чем нет результатов уровня МК в данном исследовании.
С учетом полученных в результате обследования данных проведена оценка риска летальности с помощью шкалы определения риска, предложенной в европейских рекомендациях ESC/ ERS 2015 и евразийских рекомендациях 2019 г. [1-3], а также согласно регистру REVEAL 2.0 и упрощенному калькулятору REVEAL Lite 2 [12,13]. По результатам оценки большинство пациентов имели высокий риск неблагоприятного прогноза с небольшим количеством параметров низкого риска (табл. 3), что послужило поводом к назначению ЛАГ-специфической терапии в режиме как моно-, так и комбинированных двойных и тройных схем (рис. 5).
Таблица 1. Клинико-демографические характеристики пациентов с ЛАГ-СЗСТ
Table 1. PAH-CTD patients demographic and disease characteristics
|
Показатель |
Значение |
|
Возраст, лет Женщины (n=64) ИМТ, кг/м2 Отеки н/к = ПЖ СН (n=38) Гепатомегалия (n=12) SpO2,% ЭхоКГ: S ПП, см2 (n=66) Выпот в полости перикарда (n=35) Функциональный статус: Д6МХ, м (n=56) ФК (ВОЗ) I (n=2) II (n=8) III (n=45) IV (n=13) Одышка по Боргу (n=54) NT-proBNP, нг/л (n=29) BNP, нг/л (n=9) КПОС (n=54): срДЛА, мм рт. ст. ДПП, мм рт. ст. СВ, л/мин СИ, л/мин/м2 SvO2, % ЛСС, ед. Вуда |
59,5 (53,0-69,0) 94,1 27,0 (24,0-29,0) 55,9% 17,6% 94,5 (90; 97) 23 (19-26,75) 51,5% 345,0 (259,25-400,0) 2,9% 11,8% 66,2% 19,1% 5,0 (3,0-6,0) 1953 (367,2-3472,0) 454,6 (38,7-531,8) 51,0 (35,5-62,0) 7,0 (5-12,75) 3,5 (2,93-4,47) 2,1 (1,7-2,5) 61,0 (56,0-66,0) 11,48 (5,99-15,71) |
Примечание: данные представлены в виде медианы, 25% и 75% перцентилей; ДПП – среднее давление в правом предсердии; Д6МХ – дистанция в тесте 6-минутной ходьбы; ИМТ – индекс массы тела; КПОС – катетеризация правых отделов сердца; ЛСС – легочное сосудистое сопротивление; ПЖ СН- правожелудочковая сердечная недостаточность; СВ – сердечный выброс; СИ – сердечный индекс; срДЛА – среднее давление в легочной артерии; ФК (ВОЗ) – функциональный класс по классификации Всемирной организации здравоохранения; ЭхоКГ – эхокардиография; BNP – мозговой натрийуретический пептид; NT-proBNP – N-концевой фрагмент мозгового натрийуретического пептида; S ПП – площадь правого предсердия; SvO2 – сатурация венозной крови Notes: Continuous data are summarized using median, interquartile range (IQR) and categorical data counts, and percentage of patients;
RAP – right atrial pressure; 6MWD – six-minute walking distance; BMI – body mass index; RHC – right heart catheterization; PVR – pulmonary vascular resistance; RHF – right heart failure; CO – cardiac output; CI – cardiac index; mean RAP – mean right atrial pressure; FC (WHO) – functional class (World Health Organization); echocardiography; BNP – brain natriuretic peptide; NT-proBNP – N-terminal pro-brain natriuretic peptide; RAA – right atrial area; SvO2 – mixed venous oxygen saturation
Стоит отметить, что более половины пациентов (57,4%) также принимали терапию СЗСТ, назначенную ревматологом. Охват пациентов специфической терапией СЗСТ связан с поздней диагностикой основного заболевания как причины ЛАГ. Учитывая наличие явлений сердечной недостаточности, 69,1% пациентов назначена диуретическая терапия петлевыми диуретиками, 75% пациентов – антагонистами альдостерона (табл. 4 и 5).
ОБСУЖДЕНИЕ
По результатам исследования, несмотря на улучшение вы-являемости СЗСТ ревматологами (за 2020-2022 гг. 60,3% пациентов, поступивших в НМИЦК, имели верифицированный диагноз СЗСТ против 39,7% пациентов, госпитализированных в 2016-2019 гг.), суммарно лишь 35,3% пациентов за период 2016-2022 гг. имели установленный ревматологом диагноз ЛАГ-СЗСТ на момент госпитализации в НМИЦК. Этому отчасти
1,50%
36,80%
1,50%
1,50%
51,50%
10,30%
42,70%
Монотерапия
1,50%
Силденафил Риоцигуат Бозентан Мацитентан Илопрост
1,50%
1,50%
1,50%
17,70%
■ ■ ■ ■ ■
■ ■ ■
Монотерапия
Комбинированная терапия
Не назначена
Комбинированная терапия
-
■ Двойная терапия
-
■ Тройная терапия
1,50%
Двойная терапия
-
■ Силденафил+Бозентан
-
■ Силденафил+Мацитентан ■ Силденафил+Селексипаг ■ Силденафил+Илопрост
-
■ Риоцигуат+Бозентан
1 50% ■ Риоцигуат+Мацитентан ■ Риоцигуат+Селексипаг ■ Риоцигуат+Илопрост ■ Бозентан+Селексипаг
1,50%
2,80%

Тройная терапия
-
■ Силденафил+
Мацитентан+Селексипаг
-
■ Силденафил+
Мацитентан+Илопрост
-
■ Силденафил+
Амбризентан+Илопрост
-
■ Силденафил+
Бозентан+Илопрост
-
■ Риоцигуат+
Бозентан+Илопрост
■ Бозентан+Илопрост
■ Мацитентан+Селексипаг
Рисунок 5. Схемы ЛАГ-специфической терапии
-
Figure 5. PAH-specific therapy schemes
Таблица 2. Диагностические критерии ЛАГ-ассоциированного фенотипа ССД
Table 2. PAH-SSc phenotype criteria
|
Показатель |
Данные |
|
Суммарная длительность СЗСТ, мес |
78 (1-588) |
|
Телеангиоэктазии (n=53) |
77,9% |
|
Антицентромерные антитела (n=15) |
22% |
|
DLCO,% (n=8) |
38,75 (31,15-47,6) |
|
Поражение ЖКТ (n=27) |
39,7% |
|
Антитела к топоизомеразе (n=1) |
1,5% |
Примечание: данные представлены в виде медианы, 25% и 75% перцентилей; ЖКТ – желудочно-кишечный тракт; СЗСТ – системное заболевание соединительной ткани; DLCO – диффузионная способность легких
Notes: Continuous data are summarized using median, interquartile range (IQR) and categorical data counts, and percentage of patients;
GIT – gastrointestinal tract; CTD – connective tissue disease; DLCO – diffusing capacity of the lungs for carbon monoxide способствовал длительный промежуток времени между началом клинических проявлений и обращению к кардиологу или ревматологу с последующей постановкой диагноза.
Быстрое прогрессирование симптоматики с утяжелением состояния больных от манифестации заболевания до первого обращения к специалисту вместе с увеличением времени до постановки диагноза привело к повышению риска годичной летальности, что подтверждается при стратификации риска пациентов с помощью различных шкал (REVEAL 2.0 и REVEAL Lite 2, ESC/ERS 2015).
Оценка риска неблагоприятного прогноза с помощью калькулятора REVEAL Lite 2 [13], использующей только неинвазивные критерии, показала, что большинство пациентов (60,3%), включенных в исследование, находятся в группе высокого риска неблагоприятного прогноза с медианой суммарного числа параметров низкого риска равной 3 (3,0-4,0).
Определение риска неблагоприятного прогноза с применением регистра REVEAL 2.0 [12], учитывающего этиологию заболевания и содержащего в том числе инвазивные критерии стратификации риска (полная оценка риска была возможной лишь у 8 человек в связи с отсутствием данных DLCO), также свидетельствовало о исходной высокой тяжести состояния больных с ЛАГ-СЗСТ, включенных в исследование.
Использование как неинвазивных, так и инвазивных критериев для определения клинико-функционального статуса, оценки функционирования сердечно-легочной системы, па-
Таблица 3. Стратификация риска пациентов с ЛАГ-СЗСТ с применением различных моделей
Table 3. Risk stratification of PAH-CTD patients using different models Стратификация риска
|
ESC/ERS 2015 |
|
|
Низкий риск (n=1) |
1,5% |
|
Промежуточный риск (n=13) |
19,1% |
|
Высокий риск (n=54) |
79,4% |
|
Число параметров низкого риска |
3 (2-5) |
|
REVEAL 2.0 (только при наличии данных DLCO) (n=8) |
|
|
Низкий риск (n=1) |
12,5% |
|
Промежуточный риск (n=1) |
12,5% |
|
Высокий риск (n=6) |
75,0% |
|
Число параметров низкого риска |
7,5 (5,75-8,0) |
|
REVEAL Lite |
|
|
Низкий риск (n=14) |
20,6% |
|
Промежуточный риск (n=13) |
19,1% |
|
Высокий риск (n=41) |
60,3% |
|
Число параметров низкого риска |
3 (3-4) |
Примечание: данные представлены в виде медианы, 25% и 75% перцентилей; DLCO – диффузионная способность легких; ERS – Европейское респираторное общество (European Respiratory Society); ESC – Европейское кардиологическое общество (European society of cardiology); REVEAL – регистр больных ЛАГ (США) (the Registry to EValuate Early And Long-term PAH disease management)
Notes: Continuous data are summarized using median, interquartile range (IQR) and categorical data counts, and percentage of patients; DLCO – diffusing capacity of the lungs for carbon monoxide; ERS – European Respiratory Society; ESC – European society of cardiology; REVEAL –the Registry to EValuate Early And Long-term PAH disease management
|
Таблица 4. Специфическая терапия СЗСТ Table 4. Specific treatment of CTD |
|
|
Специфическая терапия СЗСТ 57,35% (n=39) |
|
|
Гидроксихлорохин |
7,4% (n=5) |
|
Метилпреднизолон |
36,8% (n=25) |
|
Преднизолон |
7,4% (n=5) |
|
Пентоксифиллин |
2,9% (n=2) |
|
Микофенолата мофетил |
5,9% (n=4) |
|
Пенициламин |
2,9% (n=2) |
|
Метотрексат |
7,4% (n=5) |
|
Лефлуномид |
2,9% (n=2) |
|
Циклофосфамид |
1,5% (n=1) |
Таблица 5. Профиль сопутствующей терапии Table 5. Non-PAH-Specific medications
Для раннего выявления ЛАГ у пациентов с ССД (как наиболее часто встречающейся нозологии среди СЗСТ, а также с учетом низкой выживаемости данной категории больных) и оценки необходимости в инвазивных методах исследования проводится разработка различных алгоритмов, одним из которых является DETECT [11]. Диагностика основывается на оценке наличия телеангиоэктазий, антицентромерных антител, уровня МК и NT-proBNP, отклонения электрической оси сердца вправо на электрокардиограмме, площади правого предсердия и скорости трикуспидальной регургитации по данным ЭхоКГ, отношения форсированной жизненной емкости легких к DLCO у пациентов с лимитированной формой ССД в течение не менее 3 лет. Однако в связи со значительными финансовыми затратами, недоступностью некоторых методов (DLCO), а также снижением DLCO не только при ЛАГ-СЗСТ, но и на старте интерстициальных заболеваний легких, прогностическая ценность вышеописанного алгоритма уступает диагностической [9,11].
Анализ группы пациентов с ЛАГ-СЗСТ, включенных в рандомизированное клиническое исследование GRIPHON – наиболее масштабное среди пациентов с ЛАГ, что ухудшение прогноза этой группы пациентов связано как с наличием СЗСТ-обусловленных коморбидностей, исходно более низким клинико-функциональным статусом (пациенты с СЗСТ обычно более старшего возраста часто имеют скелетно-мышечные проблемы, что ограничивает выполнение и интерпретацию нагрузочных проб), так и с несвоевременной диагностикой [4].
Таким образом, проведение инвазивной диагностики в дополнение к оценке клинико-функционального статуса, а также данных ЭхоКГ у пациентов с ЛАГ-СЗСТ на старте диагностического поиска является важной составляющей с точки зрения как постановки диагноза, так и стратификации риска с последующим решением вопроса о необходимости назначения ЛАГ-специфической терапии, что подтверждается результатами клинических исследований и закреплено в протоколах клинических рекомендаций [1-3].
-
3.
-
4.
-
5.
-
6.
-
7.
-
8.
-
9.
ЗАКЛЮЧЕНИЕ
Большинство пациентов с ЛАГ-СЗСТ находятся в группе высокого риска летальности не только по критериям инвазивной, но и неинвазивной диагностики. Значительный временной интервал от появления симптомов до обращения к врачу и постановки диагноза ЛАГ способствует более позднему назначению лечения и ухудшению прогноза пациентов с ЛАГ-СЗСТ.
Ранний скрининг больных с СЗСТ на наличие ЛАГ, регулярная оценка риска всех пациентов с ЛАГ-СЗСТ даже при субъективной стабильности состояния – ключ к улучшению качества жизни и прогноза выживаемости данной категории больных.
Список литературы Профиль пациентов с впервые установленной легочной артериальной гипертензией на фоне системных заболеваний соединительной ткани: взгляд кардиолога
- Galie N., Humbert M., Vachiery J.L, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016; 37:67–119. https://doi.org/10.1183/13993003.01032- 2015
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., соавт. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский кардиологический журнал 2020; 1:78-122. [Chazova I.E., Martynyuk T.V., Valieva Z.S., et al. Eurasian Guidelines for the diagnosis and treatment of pulmonary hypertension. Eurasian Нeart Journal 2020; 1:78-122. (In Russ.)] https://doi.org/10.38109/2225-1685-2020-1-78-122
- Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации. https://scardio.ru/content/Guidelines/2020/Clinic_rekom_LG.pdf
- Gaine S, Chin K, Coghlan G, et al. Selexipag for the treatment of connective tissue disease-associated pulmonary arterial hypertension. Eur Respir J. 2017;50(2):1602493. Published 2017 Aug 17. https://doi.org/10.1183/13993003.02493-2016
- Chazova IY, Martynyuk TV, Valieva ZS, et al. Clinical and Instrumental Characteristics of Newly Diagnosed Patients with Various Forms of Pulmonary Hypertension according to the Russian National Registry. Biomed Res Int. 2020;2020:6836973. Published 2020 Jun 14. v10.1155/2020/6836973
- Weatherald J, Montani D, Jevnikar M, Jaïs X, Savale L, Humbert M. Screening for pulmonary arterial hypertension in systemic sclerosis. Eur Respir Rev. 2019;28(153):190023. Published 2019 Jul 31. https://doi.org/10.1183/16000617.0023-2019
- Humbert M, Yaici A, de Groote P, et al. Screening for pulmonary arterial hypertension in patients with systemic sclerosis: clinical characteristics at diagnosis and long-term survival. Arthritis Rheum. 2011;63(11):3522-3530. https://doi.org/10.1002/art.30541
- van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/ European league against rheumatism collaborative initiative. Ann Rheum Dis. 2013;72(11):1747-1755. https://doi.org/10.1136/annrheumdis-2013-204424
- Юдкина НН, Николаева ЕВ, Мартынюк ТВ, Волков АВ. Клинический субтип системной склеродермии, ассоциированный с легочной артериальной гипертензией. Кардиологический вестник. 2017;(4):66-75 [Yudkina NN, Nikolaeva EV, Martynyuk TV, Volkov AV. The clinical subtype of systemic sclero-derma associated with pulmonary arterial hypertension. Kardiologicheskiy Vestnik. 2017;(4):66-75 (In Russ.)].
- Morrisroe K, Huq M, Stevens W, et al. Risk factors for development of pulmonary arterial hypertension in Australian systemic sclerosis patients: results from a large multicenter cohort study. BMC Pulm Med. 2016;16(1):134. Published 2016 Sep 27. https://doi.org/10.1186/s12890-016-0296-z
- Coghlan JG, Denton CP, Grünig E, et al. Evidence-based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study. Ann Rheum Dis. 2014;73(7):1340-1349. https://doi.org/10.1136/annrheumdis-2013-203301
- Benza RL, Gomberg-Maitland M, Elliott CG, et al. Predicting Survival in Patients With Pulmonary Arterial Hypertension: The REVEAL Risk Score Calculator 2.0 and Comparison With ESC/ERS-Based Risk Assessment Strategies. Chest. 2019;156(2):323-337. https://doi.org/10.1016/j.chest.2019.02.004
- Benza RL, Kanwar MK, Raina A, et al. Development and Validation of an Abridged Version of the REVEAL 2.0 Risk Score Calculator, REVEAL Lite 2, for Use in Patients With Pulmonary Arterial Hypertension. Chest. 2021;159(1):337-346. https://doi.org/10.1016/j.chest.2020.08.2069
- Bendayan D, Shitrit D, Ygla M, et al. Hyperuricemia as a prognostic factor in pulmonary arterial hypertension. Respir Med. 2003 Feb;97(2):130-3. https://doi.org/10.1053/rmed.2003.1440
- Simpson CE, Damico RL, Hummers L, et al. Serum uric acid as a marker of disease risk, severity, and survival in systemic sclerosis-related pulmonary arterial hypertension. Pulm Circ. 2019 Jul 29;9(3):2045894019859477. https://doi.org/10.1177/2045894019859477


