Профилактика катетер-ассоциированных инфекций в онкопедиатрии
Автор: Рыков Максим Юрьевич, Гьокова Елена Витальевна, Сусулева Наталья Александровна, Поляков Владимир Георгиевич
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 2 (6), 2013 года.
Бесплатный доступ
Выраженный успех в лечении онкологических заболеваний у детей, достигнутый в последнее десятилетие, объясняется внедрением мультимодальных программ лечения, в которых ведущее место отводится химиотерапии. Ее эффективность связана не только с развитием фармакологии, но и с интенсификацией протоколов лечения - увеличением дозировок химиопрепаратов, количества курсов и сокращением интервалов между ними. Это, в свою очередь, требует сложной сопроводительной терапии для профилактики и коррекции осложнений и побочных эффектов. Поскольку основной способ введения как химиопрепаратов, так и сопроводительных - внутривенный, это накладывает жесткие требованиям на системы центрального венозного доступа. Они должны быть надежными, простыми в использовании, устанавливаться однократно на весь период лечения, иметь минимальный процент осложнений при установке и эксплуатации, а также не снижать качества жизни пациентов. Такие условия особенно важны в онкопедиатрии, поскольку любая катетеризация центральных вен у детей - инвазивное вмешательство, требующее общей анестезии. В настоящее время всем перечисленным требованиям отвечают имплантируемые венозные порт-системы.
Детская онкология, катетер-ассоциированные инфекции, имплантируемые венозные порт- системы, химиотерапия
Короткий адрес: https://sciup.org/14045457
IDR: 14045457
Текст научной статьи Профилактика катетер-ассоциированных инфекций в онкопедиатрии
-
1. НИИ ДОГ ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН
-
2. ГБОУ ДПО РМАПО Минздрава РФ
Актуальность темы
За последние десятилетия отмечается выраженный успех в лечении онкологических заболеваний у детей. Выживаемость свыше 5 лет при целом ряде нозологических форм достигает 80 и более процентов. Это стало возможным в результате разработки эффективных программ комплексного лечения, в которых ХТ отводится ведущее место.
Развитие лекарственного лечения злокачественных опухолей началось в середине ХХ века. По мере разработки основных его принципов и их усовершенствования, перехода от моно- к полихимиотерапии в сочетании с хирургическим и лучевым лечением росла и выживаемость пациентов. Развитие диагностики, в том числе иммунологической и молекулярно-генетической, внедрение высоко-дозной ХТ, трансплантации гемопоэтических стволовых клеток и персонализированной, таргетной, терапии привело к новому прорыву в онкологии.
Современная ХТ онкологических заболеваний у детей — это цикловое лечение комбинацией ХП, применяемых в определенной последовательности в отношении друг к другу, вводимых в виде инфузий разной продолжительности (от 15 минутной до 24-72 часовой и более).
ХТ проводится циклами с интервалами между ними, позволяющими сочетать стационарное и амбулаторное ведение пациентов. Продолжительность ее зависит от вида опухоли, стадии процесса, наличия неблагоприятных прогностических факторов и может достигать многих месяцев. Учитывая, что среди первичных больных детей с онкопатологией случаи распространенного заболевания составляют до 65-70%, лечение, как правило, длительное и интенсивное. Повышение эффективности лекарственного лечения связано как с развитием фармакологии, так и с увеличением доз препа- ратов, многократности курсов ХТ и строгим соблюдением интервалов между ними.
В/в способ введения ХП является основным при большинстве онкологических заболеваний у детей, сопряжен с раздражением сосудистой стенки, флеботромбозами, некрозом тканей при экстравазации лекарственных средств. Кроме того, при проведении ПХТ требуются многократные диагностические заборы венозной крови для контроля токсичности лечения и отслеживания динамики заболевания, а также в/в инфузии поддерживающей терапии.
Использование периферических вен в силу их малого диаметра, низкой скорости кровотока, короткого пути для бактерий с контаминированной поверхности кожи до просвета сосуда, высокой вероятности химических тромбофлебитов и экстравазаций, недопустимо для длительных инфузий и неоднократных введений химиотерапевтических препаратов [4, 7, 8].
Применение центрального венозного доступа позволяет избежать большинства указанных выше проблем. Однако катетеризации ЦВ связана с риском развития тяжелых осложнений, как во время катетеризаций, так и при эксплуатации катетеров. Наиболее грозными из них являются катетерная инфекция, сепсис, воздушная эмболия. Кроме того, при наличии внешнего ЦВК неизбежны дискомфорт и трудности при выполнении гигиенических процедур. При продолжительной многомесячной ХТ требуются повторные катетеризации ЦВ, которые приводят к росту связанных с этим осложнений [2, 3, 4, 8, 24].
ИВПС обладают значительными преимуществами по сравнению с вышеописанными венозными доступами, так как не подвержены каким-либо внешним воздействиям, не вызывают дискомфорта у больных и не ограничивают их двигательную активность, что имеет особое значение в педиатрии. Порт — это небольшая емкость — камера, имеющая в верхней части силиконовую мембрану, через которую специальной иглой выполняются пункции для проведения инфузий. В боковую часть камеры подсоединен катетер, другой конец которого размещен в ВПВ. Камера же ушивается в мягкие ткани подключичной области [7, 21, 24].
ИВПС была изобретена в 1988 г. в США доктором R. T. Woodburn и запатентована им
29 августа 1989 г. [12]. Для пункции камеры порта может использоваться только специальная, не режущая, игла Губера, исключающая повреждение силиконовой мембраны [7, 11, 24]. Также крайне нежелательно использование при работе с портом шприцев объемом менее 10 см3 для предотвращения создания избыточного давления и отрыва катетера от камеры порта [24].
Игла Губера была изобретена дантистом из США Ральфом Губером и запатентована им 14 марта 1946 г. [11]. Благодаря острию специальной формы, она не режет, а «раздвигает» силиконовую мембрану камеры порта, сохраняя ее герметичность. После извлечения из камеры такая игла не оставляет туннелей в толще мембраны. Поскольку ИВПС были изобретены лишь в 1989 г., изначально Р. Губер предлагал использовать ее для снижения болевых ощущений при пункции сосудов. Кроме того, длинный срез иглы помогает задать нужное направление проводнику в сосудистом русле [11].
Материалы и методы
В работе анализируется клинический материал, касающийся 228 пациентов с онкологическими заболеваниями в возрасте от 3 мес. до 17 лет, которым в НИИ ДОГ ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН в период с 2010 по 2012 гг. были установлены различные системы центрального венозного доступа: 110 детям (48,2%) — ПК и 118 (51,8%) — ИВПС (таблица 1).
Диагноз ЗНО у всех пациентов был подтвержден гистологическим исследованием опухоли с применением, по показаниям, дополнительных методов иммуногистохимии в отделе патологической анатомии опухолей человека НИИ КО ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН. Пациентам проводился полный комплекс диагностического обследования соответственно нозологической форме заболевания, уточняющий распространенность опухолевого процесса и факторы риска, с дальнейшим отнесением больных к определенной группе риска и проведением рискдифференцированных программ лечения.
Среди обеих групп преобладали пациенты с саркомами различных форм и локализаций:
Профилактика катетер-ассоциированных инфекций в онкопедиатрии
Таблица 1 — Общая характеристика материала.
|
ПОКАЗАТЕЛИ |
ВЕНОЗНЫЕ ДОСТУПЫ |
|
|
ПК |
ИВПС |
|
|
Годы |
2010-2012 |
2010-2012 |
|
Количество пациентов |
110 (48,2%) |
118 (51,8%) |
|
Пол пациентов |
Мальчики 68 (61,8%) Девочки 42 (38,2%) |
Мальчики 71 (60,2%) Девочки 47 (39,8%) |
|
Возраст |
3 мес. — 17 лет |
6 мес. — 17 лет |
|
Средний возраст |
8,1 года |
11,5 лет |
|
Дети в возрасте до 1 года |
12 (10,9%) |
7 (5,9%) |
|
Умерло от прогрессирования основного заболевания |
3 (2,7%) |
5 (4,2%) |
|
Умерло от осложнений специального лечения |
1 (0,9%) |
0 |
|
Общее количество установленных систем венозного доступа |
605 |
118 |
|
Фирмы-производители систем венозного доступа |
B. Braun Melsungen AG — 79 шт. (13%) Arrow International Inc. — 526 шт. (87%) |
B. Braun Melsungen AG— 102 шт. (86,4%) Bard Inc. — 16 шт. (13,6%) |
195 детей (85,5%), из них 84 (43,0%) — с остеосаркомами, 79 (40,5%) — с мелкокруглоклеточными опухолями костей (включая саркомы Юинга, внескелетные саркомы Юинга, опухоли Аскина, примитивные нейроэктодермальные опухоли), 25 (12,8%) — с рабдомиосаркомами, 7 (3,6%) — с прочими видами сарком. Такой состав больных был обусловлен особой интенсивностью курсовой ПХТ, соответственно принятых в отделении опухолей опорно-двигательного аппарата НИИ ДОГ ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН протоколов лечения, и требующей наличия длительного центрального венозного доступа. Обе группы были идентичны по возрастному составу, распределению нозологических форм и распространенности болезни, требовавших аналогичных программ лечения, проводимых в один и тот же период времени.
Всем больным были установлены ПК и ИВПС ведущих мировых производителей ( B. Braun Melsungen AG (Германия); Bard Inc. (США); Arrow International Inc. (США)), соответствующих возрасту и весу больного: ПК диаметром 14-18 G (2,1 мм — 1,3 мм); ИВПС ультранизкого профиля, низкого профиля и стандартные.
В качестве растворов для заполнения систем центрального венозного доступа, в перерывах между их использованием, применялись: раствор гепарина с концентрацией 100 МЕ/мл и специализированный раствор Taurolock (Тауролок) фирмы TauroPharm GmbH (Таурофарм, Германия), содержащий тауролидин в количестве 3 мл. При возникновении внутрикатетерного тромбоза в установленных системах центрального венозного доступа использовался препарат Urokinase (Урокиназа) фирмы TauroPharm GmbH в концентрации 500 МЕ/мл 3 мл и экспозицией 15 минут.
Имплантации венозных порт-систем были выполнены 82 пациентам (69,5%) в операционном блоке отдела общей онкологии НИИ ДОГ ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН с использованием ЭОП марки Siemens Siremobil Compact (Германия) у 73 (89%) пациентов и с использованием ЭКГ-контроля у 9 пациентов (11%), с помощью делителя Certodyn фирмы B. Braun (Германия) и электрокардиомониторов Nihon Kohden BSM-4103K (Япония). Также часть имплантаций венозных порт-систем (36 пациентов, 30,5%) была выполнена в условиях рентген-операционной лаборатории интервенционной радиологии отдела лучевой диагностики НИИ КО ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН, с использованием рентгеновских аппаратов Siemens Axiom Artis и Polystar (Германия). Таким образом, с помощью ЭКГ-контроля было имплантировано 9 порт-систем (7,6%), с помощью интраоперационной рентгеноскопии — 109 (92,4%). Местная анестезия использовалась у 10 пациентов (8,5%) 16 лет и старше с их согласия. Общая анестезия применялась у 108 пациентов (91,5%). УЗ-навигация ВЯВ всегда предшествовала имплантациям и выполнялась с помощью ультразвуковых аппаратов Bard Site Rite Vascular Access 5 (США) и General Electric Logiq 400 PRO Series (США).
Установка ПК осуществлялась в перевязочных и манипуляционных кабинетах врачами отделения анестезиологии и реанимации НИИ ДОГ ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН.
Пациенты обеих групп получали цикловую ПХТ по принятым протоколам, состоящим, в основном, из комбинаций в/в вводимых следующих препаратов: Цисплатин, Доксорубицин, Метотрексат, Ифосфамид, Этопозид, Винкристин, Циклофосфамид, Дактиномицин, Карбоплатин.
Лечение проводилось на фоне инфузионной сопроводительной терапии с объемом до 5,5 л/сутки. Непрерывные в/в введения препаратов продолжались от 5 до 18 дней: короткие — при проведении курсов, содержащих Вепезид и Ифосфамид, более продолжительные — при проведении курсов, включающих высокодозный Метотрексат.
Больным проводили до 10 курсов неоадъювантной и адъювантной ПХТ с интервалом в 2-3 недели. При развитии побочных эффектов и осложнений проводимого лечения (панцитопения, инфекции, геморрагические циститы и др.), данный интервал увеличивался до 34 дней. При этом требовались в/в введения препаратов крови, курсы антибактериальных, противогрибковых и других препаратов, относящихся к корригирующей и симптоматической терапии, а также заборы венозной крови для выполнения различных анализов.
Статистическая обработка данных проводилась с помощью программы STATISTICA 7.0 ( StatSoft , США). Для проверки значимости различий признаков в группах использовались тесты χ 2 и точный критерий Фишера. За величину статистической значимости принимали значение величины-p < 0,05.
Результаты
При установке 605 ПК у 110 пациентов отмечались следующие осложнения и технические сложности:
-
1. Многократные попытки пункции ПВ (204 случая, 33,7%);
-
2. Пневмоторакс (12 случаев, 1,98%);
-
3. Травмы грудного лимфатического протока и правого лимфатического протока с развитием лимфореи из области стояния подключичного катетера (7 случаев, 1,1%);
-
4. Непреднамеренная пункция прилежащей подключичной артерии (62 случая, 10,2%);
-
5. Затруднения при проведении в ПВ проводника (183 случая, 30,2%);
-
6. Попадание дистального конца катетера во ВЯВ против тока крови (119 случаев, 19,7%);
-
7. Попадание дистального конца катетера в ПВ на противоположной стороне (5 случаев, 0,82%);
-
8. Прохождение катетера сквозь ткань легкого: при этом развития пневмоторакса отмечено не было и дистальный конец катетера находился в ВПВ (1 случай, 0,17%);
-
9. Непреднамеренная установка катетера через подключичную артерию в аорту (2 случая, 0,49%).
При эксплуатации 605 ПК нами отмечались следующие осложнения:
-
1. Самостоятельное удаление катетеров пациентами (175 случаев, 28,9%);
-
2. Тромбирование катетера (214 случаев, 35,4%);
-
3. Инфицирование катетера (42 случая, 6,9%);
-
4. Инфицирование пункционной ранки (264 случая, 43,6%);
-
5. Развитие КАИ (31 случай, 5,1%);
-
6. Разрушение внешнего конца катетера (14 случаев, 2,3%);
-
7. Выход катетера из ВПВ (13 случаев, 2,1%).
При установке 118 ИВПС у 118 пациентов нами отмечались следующие осложнения и технические сложности:
-
1. Непреднамеренная пункция ОСА при пун-ктировании ВЯВ (5 случаев, 4,2%);
-
2. Попадание дистального конца проводника во ВЯВ против тока крови (17 случаев, 14,4%);
-
3. Попадание дистального конца проводника в ПВ на стороне пункции (9 случаев, 7,6%);
-
4. Затруднения при попытке проведения проводника во ВЯВ после ее успешной пункции (11 случаев, 9,3%);
-
5. Попадание катетера порта во ВЯВ против тока крови во время выполнения имплантации с использованием ЭКГ-контроля (2 случая, 1,7%).
Профилактика катетер-ассоциированных инфекций в онкопедиатрии
При эксплуатации 118 ИВПС отмечались следующие осложнения:
-
1. Инфицирование порт-системы (3 случая, 2,5%);
-
2. Тромбирование порт-системы (6 случаев, 5%); 3. Перетирание катетера порта между I ребром и ключицей при проведении катетера в ВПВ через ПВ — 5 случаев среди пациентов, не относящиеся к 118 больным нашего исследования, у которых имплантации порт-систем была выполнена в других лечебных учреждениях;
-
4. Выход среза иглы Губера из камеры порта в толщу силиконовой мембраны, что отмечалось только при использовании игл Губера длиной 10 мм (16 пациентов, 13,6%);
-
5. Истончение подкожно-жировой клетчатки в области камеры порта (2 пациента, 1,7%).
Основные результаты установки и эксплуатации систем венозного доступа приведены в таблице 2.
Мы уделяли повышенное внимание технике эксплуатации порт-систем — правильной установке игл Губера, соблюдению допустимых сроков их эксплуатации, тщательному промыванию систем после использования и заполнения их препаратом Taurolock, содержащим тауролидин, в промежутках между курсами лечения. При эксплуатации ПК данный препарат не применялся и случаи развития КАИ были нередки (73 случая, 12%), тогда как эксплуатация ИВПС такими осложнениями не сопровождалась. Очаги инфекции у больных с опухолями костей имеют особое значение, поскольку могут привести к инфицированию установленных эндопротезов, что потребует длительного дорогостоящего лечения и может закончиться реэндопротезированиями или даже калечащими операциями — ампутациями конечностей.
При возникновении тромбоза ИВПС применение препарата Урокиназа позволило во всех случаях восстановить проходимость системы и не приводило к ее инвазивной коррекции.
Наиболее частыми трудностями и осложнениями в ходе установки ПК являлись: сложность пунктирования и катетеризации ПВ, непреднамеренная пункция ПА, попадание дистального конца катетера не в ВПВ, а в ее притоки, пневмоторакс. По сравнению с наиболее часто используемым в Европе яремным доступом (53,6%) [51, 106], в России преобладает катетеризация ПВ, а в большинстве регионов и вовсе используется периферический катетер для введения химиопрепаратов. В большинстве же зарубежных исследований выявлен более высокий риск осложнений при пункции и катетеризации ПВ, чем при аналогичном вмешательстве на ВЯВ [51, 112]. Так, в Европе частота развития пневмоторакса при катетеризации центральных вен достигает 15% [101, 106], в то время, как в нашем исследовании такого осложнения зафиксировано не было.
Возникавшие при имплантации порт-систем осложнения и технические трудности (37,3%) устранялись интраоперационно и не приводили к нарушению программ лечения, в отличие от установки ПК, где данный процент составил 98,3 и в 2,15% случаев привел к нарушению протоколов лечения. Эксплуатация ПК также сопровождалась более высокой частотой осложнений (97,3%) в сравнении с ИВПС (22,9%), и в (43,8%) случаях привела к нарушению протоколов лечения. Суммируя этот показатель с осложнениями при установке, общий процент нарушений протоколов лечения пациентов с ПК составил 45,9. Основными поздними осложнениями в группе больных с ПК были тромботические (35,4%) и инфекционные (55,7%), в то время, как при эксплуатации ИВПС они были отмечены в 5 и 2,5%, соответственно. По данным исследований, отражающих ситуацию в странах Европы и США, частота возникновения КАИ и тромбозов варьируется 5-15% от всех ЦВК [, 24].
Таким образом, преимущество той или иной системы венозного доступа определяется ее безопасностью и надежностью, что отражается в характере осложнений, их частоте и возможности коррекции, влиянии на выполнение программного лечения. Представленные в таблице сравнительные характеристики исследуемых систем венозного доступа отчетливо выявляют преимущества ИВПС. Интраоперационные осложнения и технические
Таблица 2 — Сравнительная характеристика осложнений установки и эксплуатации ПК и ИВПС.
|
ПОКАЗАТЕЛИ |
ВЕНОЗНЫЙ ДОСТУП |
|
|
ПК |
ИВПС |
|
|
ЧИСЛО |
605 |
118 |
|
Интраоперационные осложнения/из них скорректировано во время операции |
98,3%/33,7% |
37,3%/88,6% |
|
Осложнения при эксплуатации |
97,3% |
22,9% |
|
Тромбозов систем венозного доступа/из них проходимость восстановлена |
35,4%/63,5% |
5%/100% |
|
Инфекционные осложнения |
55,7% |
2,5% |
|
Самостоятельное удаление пациентами |
28,9% |
0 |
|
Осложнения, повлекших нарушение протоколов лечения |
45,9% |
1,7% |
сложности при установке ИВПС встречались достоверно ниже (37,3%), чем при ПК (98,3%) (р<0,01) и поддавались корректировке во время операции значительно чаще — в 88,6% против 33,7% (р<0,01). Еще более выражена разница в частоте осложнений при эксплуатации систем: 22,9% — при ИВПС и 97,3% — при ПК (р<0,01). Частота тромбозов и инфицирования систем отмечались лишь в 5 и 2,5% у ИВПС против 35,4 и 55,7% у ПК (р<0,001). Восстановление проходимости систем было отмечено во всех случаях у ИВПС, тогда как в 36,4% случаев потребовалась замена ПК. Общая частота осложнений при установке и эксплуатации ИВПС и ПК нарушила программное лечение лишь в 1,7% случаях при использовании ИВПС, в то время как при использовании ПК составила 45,9% (р<0,01).
Заключение
Интенсификация химиотерапии сопровождается повышенным риском осложнений и предъявляет строгие требования к условиям проведения такого лечения. В первую очередь, это постоянный мониторинг токсичности, проведение сопроводительной дезинтоксика-ционной инфузионной терапии, купирование осложнений путем заместительной терапии (трансфузии препаратов крови), противови- русной, противомикробной, противогрибковой терапии, применение в ряде случаев парентерального питания.
Все это определяет потребность в центральном венозном доступе, который в РФ преимущественно обеспечивается катетеризациями ПВ, причем нередки случаи нарушения ее техники. Это ведет к известным осложнениям (гемопневмотораксы, травмы легких, артериальных и лимфатических сосудов), что нарушает запланированное лечение и ухудшает эффективность противоопухолевой терапии [24]. Но даже после успешной установки ПК осложнения, связанные с их эксплуатацией, вплоть до развития КАИ, не позволяют достигнуть максимального эффекта в лечении. Было показано, что причиной развития сепсиса у детей со ЗНО, получающих интенсивные программы лечения, сопровождающиеся выраженным угнетением кроветворения и иммунодепрессивными состояниями, является использование ПК, причем имеется прямо пропорциональная зависимость с длительностью стояния ПК в вене [, 24]. Наличие внешнего ЦВК ухудшает возможности соблюдения правил гигиены, ограничивает двигательную активность, создает неудобства и дискомфорт. Дети раннего возраста нередко самостоятельно «вырывают» катетер и не хотят мириться с его наличием. Вероятность осложнений возрастает при повторных катетеризациях ПВ [24].
Профилактика катетер-ассоциированных инфекций в онкопедиатрии
Учитывая, что химиотерапия детей со ЗНО носит цикловой характер с периодами интенсивного лечения в условиях стационара и перерывами, когда больной выписывается из стационара, необходимо удалять ЦВК на время выписки и повторно устанавливать его при следующей госпитализации. Непрерывное же пребывание больного в отделении увеличивает риски развития внутрибольничных инфекций, удорожает лечение, неблагоприятно воздействует на психологический статус больного. Использование каждого ПК, даже изготовленного из современных бактерицидных и атромбогенных материалов, ограничено пребыванием в стационаре, но даже тогда не должно превышать 1 мес. [24]. Однако допустимые сроки эксплуатации ПК в РФ часто превышаются. Нередко один катетер может использоваться в течении нескольких месяцев в том числе в домашних условиях, что категорически недопустимо, поскольку для работы с ним требуется подготовленный медицинский персонал. ПК требуют выполнения строгих правил ухода, нарушения которых приводят к осложнениям.
Экстренные госпитализации детей с онкологическими заболеваниями, вызванные развитием тяжелых осложнений проводимого специального лечения, с целью их неотложной коррекции требуют наличия центрального венозного доступа. Низкие показатели периферической крови, характерные для межкурсовых промежутков, часто исключают катетеризацию ЦВ и вынуждают использовать периферические вены для проведения интенсивной терапии, что приводит к осложнениям, описанным выше.
Использование ИВПС лишено большинства перечисленных недостатков [, 24]. Порт устанавливается один раз на весь период лечения и позволяет получить доступ в центральную вену в любое необходимое время даже у пациентов с выраженной панцитопенией. Важно, что манипуляции с ИВПС легко доступны не только для врачей, но и для среднего медицинского персонала, поскольку чрезкожная установка иглы Губера в камеру порта быстрее и даже проще пункции периферической вены. Учитывая, что экстренные госпитализации могут осуществляться в отсутствии необходимых для установки ПК специалистов, ИВПС позво- ляют неотложно начать необходимую внутривенную терапию.
В США с каждым годом увеличивается число устанавливаемых порт-систем для проведения химиотерапевтического или паллиативного лечения. Активно внедряются порт-системы и у детей с онкологическими заболеваниями [24]. В нашей стране они только начинают использоваться у взрослых пациентов.
Наше исследование подтверждает преимущества ИВПС по сравнению ПК. Порты использовались как для проведения ХТ и сопроводительной терапии, так и для проведения общих анестезий во время хирургических этапов лечения, введения рентген контрастных препаратов и паллиативного лечения, устанавливались однократно на весь период лечения и последующего наблюдения. ПК, напротив, устанавливались больным неоднократно (605 катетеров на 110 пациентов), что было обусловлено как ограниченными сроками эксплуатации, так и большим количеством осложнений.
Разумеется, нет методов, абсолютно универсальных и применимых в любой ситуации. Так, ИВПС не стоит использовать для забора ПСКК на сепараторе, поскольку для этого требуется система венозного доступа, способная обеспечить чрезмерно большие объемы инфузий, не требующиеся во время других этапов лечения. Однако и в этом случае целесообразно установить пациенту два центральных венозных катетера — ПК и ИВПС. После завершения этапа по сбору ПСКК, ПК стоит удалить и продолжить использование ИПВС.
Показано, что применение ИВПС у детей с онкологическими заболеваниями значительно сокращает количество осложнений как во время их установки, так и во время эксплуатации по сравнению с другими возможными вариантами. Другое важнейшее преимущество — снижение количества общих анестезий и нагрузки на медицинский персонал. Разработанная техника имплантации таких устройств с применением УЗ и рентгенологического оборудования надежна и безопасна.
Эксплуатация систем венозного доступа с применением современных растворов для их заполнения в промежутках между использованием позволила существенно снизить количество инфекционных и тромботических
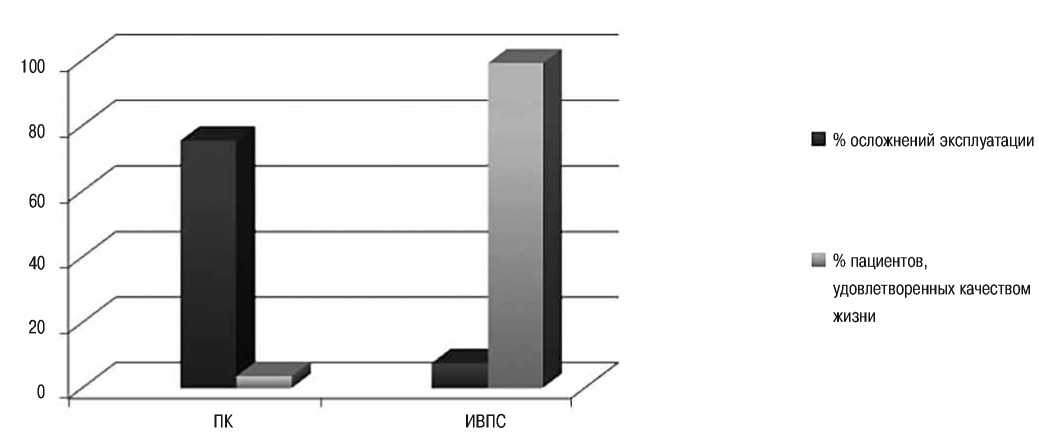
Рисунок 1 — Сравнительная оценка эффективности венозных доступов.
осложнений, некоторые из которых раньше приводили к срыву программ лечения, удалению систем и подвергали пациентов повторным рискам при их установке.
При средней продолжительности пребывания в стационаре 18,1 день только лишь отсутствие необходимости пункций периферических вен для диагностических заборов крови снизит нагрузку на средний медицинский персонал, поскольку за каждую госпитализацию данная манипуляция выполняется в среднем 10 раз [13]. Это особенно важно в свете дефицита кадров среднего медицинского персонала в онкологических клиниках РФ (23860 занятых штатных единиц из 25740 имеющихся по данным за 2012 г.) и их высокой загруженности (125,5 больных со ЗНО всех возрастов на 1 медицинскую сестру) [13].
Вероятно, широкое распространение ИВПС может сдерживаться недостаточной оснащенностью клиник РФ. По данным 2012 г. в России зарегистрировано 140 учреждений различной направленности, располагающих 147 рентген-хирургическими отделениями и 95 учреждений со 101 отделением рентген-эндоваскулярной диагностики и лечения [13]. Учитывая число онкологических отделений (кабинетов) — 2298 в 2090 лечебных учреждениях, количество операционных, позволяющих имплантировать венозные порт-системы, явно недостаточно, как и специалистов, обученных данной методике [13]. Однако по сравнению с 2011 г. отмечается положительная динамика, что позволяет надеется на постепенное решение данной проблемы.
Немаловажный аспект в условиях современных экономических реалий — стоимость лечения. Нами установлено, что, хотя цена ИВПС превышает цену ПК, широкое использование последних оказывается более чем в 2 раза затратнее, учитывая стоимость диагностики и лечения интраоперационных и эксплуатационных осложнений. Эта разница сохраняется даже с учетом затрат на установку ИВПС у детей с применением общей анестезии.
Приведенная выше диаграмма (рисунок 1) показывает, что применение ИВПС не только сопровождается минимальным процентом осложнений в сравнении в ПК, но и возможностью эксплуатации одной системы в течение всего лечения, что чрезвычайно важно для комфортной повседневной жизни. Об этом свидетельствует процент удовлетворенных качеством жизни пациентов, близкий к 100, тогда как при использовании ПК он не превышает 4% (данные получены при опросе пациентов и их родственников).
Таким образом, применение имплантируемых венозных порт-систем способно улучшить сложившуюся ситуацию и приблизить стандарты оказания помощи онкологическим больным к принятым в развитых странах.
Профилактика катетер-ассоциированных инфекций в онкопедиатрии
Список используемых сокращений в/в — внутривенный (но)
ВПВ — верхняя полая вена
ВЯВ — внутренняя яремная вена
ГБОУ — государственное бюджетное образовательное учреждение
ДОГ — детская онкология и гематология
ДПО — дополнительное последипломное образование
ЗНО — злокачественные новообразования
ИВПС — имплантируемая (ые)
венозная (ые) порт-система (ы)
КАИ — катетер-ассоциированные инфекции
КО — клиническая онкология
Минздрав — Министерство здравоохранения
МРТ — магнитно-резонансная томография
НИИ — научно-исследовательский институт
ПА — подключичная артерия
ПВ — подключичная вена
ПК — подключичный катетер
ПСКК — периферические стволовые клетки крови
ПХТ — полихимиотерапия
РАМН — Российская академия медицинских наук
РМАПО — Российская медицинская академия последипломного образования
РОНЦ — Российский онкологический научный центр
СА — сонная артерия
США — Соединенные Штаты Америки
УЗ-аппарат — ультразвуковой аппарат
УЗ-навигация — ультразвуковая навигация
ФГБУ — федеральное государственное бюджетное учреждение
ХП — химиопрепарат (ы)
ХТ — химиотерапия
ЦВ — центральная вена
ЦВК — центральный венозный катетер
ЭКГ-контроль — электрокардиографический контроль
ЭОП — электронно-оптический преобразователь
AG (Aktiengesellschaft) — акционерное общество
G (Gauge) — гейч
Inc. (Incorporated) — корпорация
Список литературы Профилактика катетер-ассоциированных инфекций в онкопедиатрии
- Аксенов, А. Н. Значение материала сосудистых катетеров в развитии тромбофлебитических осложнений кавакатетеризации/А. Н. Аксенов//Вестник хирургии. -2000. -Т.159, № 3. -с. 7-11
- Антонов, О. С. Катетеризация подключичных вен из надключичного и подключичного доступов, осложнения, связанные с пункцией вены и эксплуатацией катетера/О. С. Антонов, Н. И. Николаев, Ю. А. Казанцев//Анестезиология и реаниматология. -1984. -№ 4. -с. 64-67
- Белобородов, В. Б. Роль современных рекомендаций по профилактике инфекций, связанных с катетеризацией сосудов/В. Б. Белобородов//Инфекции и антимикробная терапия. -2002. -Т.6. -с. 177-180
- Бережанский, Б. В. Оптимизация фармакотерапии и профилактики инфекций, связанных с центральным венозным катетером в отделениях реанимации и интенсивной терапии. Автореф. дис. канд. мед. наук:14.00.25, 14.00.37/Б. В. Бережанский. -Смоленск, 2008. -22 с
- Быков, М. В. Ультразвуковые исследования в обеспечении инфузионной терапии в отделениях реанимации и интенсивной терапии/М. В. Быков -Тверь: ООО «Издательство «Триада», 2011. -36 с
- Детская онкология. Национальное руководство/Под ред. М. Д. Алиева, В. Г. Полякова, Г. Л. Менткевича, С. А. Маяковой. -М.: Практическая медицина, 2012. -684 с
- Имплантируемые инфузионные системы для длительного венозного доступа в онкологии/Ю. В. Буйденок, А. А. Мещеряков, В. В. Бредер и др.//Вестник Московского онкологического общества. Протоколы заседаний Московского онкологического общества. -2010. -с. 11-13
- Катетеризация подключичной вены: Ультразвуковой контроль позволяет менее опытным врачам добиться лучших результатов/И. Галтьери, И. Деппе, М. Сиперли, Д. Томсон//Вестник интенсивной терапии. -2006. -№ 4. -с. 24-30
- Козлов, В. И. Анатомия сердечно-сосудистой системы/В. И. Козлов. -М.: Практическая медицина, 2011. -192 с
- Особенности топографической анатомии у детей/А. В. Черных, В. Г. Витчинкин, В. А. Котюх и др. -Воронеж: ВГМА им. Н. Н. Бурденко, 2001. -39 с
- Пат. 2409979 США, НКИ 128/221. Hypodermic needle/Ralf R. Huber. -№ 654373; Заявлено 14.03.1946; Опубликовано 22.10.1946
- Пат. 4861341 США, МКИ4 А61М 5/00. Subcutaneous venous access device and needle system/Robert T. Woodburn. -№ 220609; Заявлено 18.07.1988; Опубликовано 29.08.1989-9 с
- Состояние онкологической помощи населению России в 2012 г./Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. -М.: ФГБУ «МНИОИ им. П. А. Герцена» Минздрава России, 2013. -232 с
- Anatomic basis of safe percutaneous subclavian venous catheterization/B. K. Tan, S. W. Hong, M. H. Huang et al.//J. trauma. -2000. -Vol. 48, № 1. -p. 82-86
- Bailey, E. Antimicrobial lock therapy for catheter-related bacteraemia among patients on maintance haemodialysis/E. Bailey, N. Berry, J. Cheesbrough//Antimicrob. Chemother. -2002. -Vol. 50. -617 p
- Crinch, C. The promise of novel technology for the prevention of intravascular device-related bloodstream infection/C. Crunch, D. Maki//Clin. Infect. Dis. -2002. -Vol. 34. -p. 1232-1242
- De Gaudio, A. Device-related infections in critically ill patients. Part 1 % prevention of catheter-related bloodstream infections/A. De Gaudo, A. Di Filippo//J. Chemother. -2003. -Vol. 15. -p. 419-427
- Humar, A. Prospective randomized trial of 10 % povidone-iodine versus 0,5 % tincture of chlorhexidine as cutaneous antisepsis for prevention of central venous catheter infection/A. Humar, A. Ostromecki, J. Dirnfeld//Clin. Infect. Dis. -2000. -Vol. 31. -p. 1001-1007
- Koldehoff, M. Taurolidine is effective in the treatment of central venous catheter-related bloodstream infections in cancer patient/M. Kolderhoff, J. Zakrzewski//Int. J. Antimicrob. Agent. -2004. -Vol.24. -p. 47-48
- Mermel, L. Prevention of intravascular catheter-related infections//Ann. Intern. Med. -2002. -Vol. 132. -p. 391-402
- Mickley, V. Central venous catheters: many questions, few answers/V. Mickley//Nephrol. Dial. Transplant. -2002. -Vol. 17. -p. 1368-1373
- Randomized, controlled clinical trial of point-of-care limited ultrasonography assistance of central venous cannulation/T. J. Milling, J. Rose, W. M. Briggs et al.//Critical Care Medicine. -2005. -Vol. 33. -p. 1764
- Walder, B. Prevention of bloodstream infections with central venous catheters treated with anti-infective agents depends on catheter type and insertion time: evidence from a meta-analysis/B. Walde, D. Pttet//Infect. Control Hosp. Epidemiol. -2002. -Vol. 23. -p. 748-756
- Wilson, S. E. Vascular access. Principles and practice/S. E. Wilson. -5th ed. -USA, Philadelphia: Lippincott Williams and Wilkins, 2010. -317 p


