Профилактика острой пострезекционной печеночной недостаточности у больных эхинококковом печени
Автор: Шабунин А.В., Бедин В.В., Тавобилов М.М., Карпов А.А., Лебедев С.С., Аладин М.Н.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 4 (78), 2021 года.
Бесплатный доступ
Введение. Развитие хирургических технологий в последние годы позволяет транслировать опыт лечения больных злокачественными новообразованиями печени на лечение пациентов с доброкачественным поражением печени.Материалы и методы. В хирургической клинике Боткинской больницы с 2020 года при эхинококкозе печени и необходимости выполнения обширных резекций печени стала применяться методика портоэмболизации для развития викарной гипертрофии остающейся доли печени. Проведен анализ результатов лечения 64 пациентов, перенесших резекционный метод лечения с 2007 по 2020 годы. В основную группу вошли 13 больных, 7 из которых за период с 2018 по 2020 год выполнено 8 процедур портоэмболизации. Вторая группа была представлена 51 пациентом, которые были оперированы без предварительной эмболизации правой ветви воротной вены. В исследовании оценены следующие показатели: длительность хирургического вмешательства, объем кровопотери, послеоперационный койко-день, осложнения по классификации Clavien-Dindo, специфические осложнения по ISGLS, рецидивы в течение первого года после хирургического вмешательства.Результаты. Непосредственные результаты хирургического лечения (количество общехирургических осложнений в послеоперационном периоде и его длительность) у больных после предоперационной эмболизации правой ветви воротной вены были значимо лучше, чем у больных оперированных без учета необходимости профилактики развития острой пострезекционной печеночной недостаточности. Результаты отдаленной выживаемости значимых различий не выявили.Выводы. Таким образом, современные хирургические технологии, позволяющие достигать увеличения объема функционирующей паренхимы печени, позволяют уменьшить количество и тяжесть послеоперационных осложнений и улучшить результаты лечения.
Эхинококкоз печени, портоэмболизация, резекция печени
Короткий адрес: https://sciup.org/142231717
IDR: 142231717 | УДК: 621.386.85: | DOI: 10.17238/2072-3180-2021-4-15-22
Текст научной статьи Профилактика острой пострезекционной печеночной недостаточности у больных эхинококковом печени
Несмотря на развитие малоинвазивных технологий в лечении эхинококкоза печени до сегодняшнего дня сохраняют свое место обширные резекции печени [1]. Основной проблемой после таких вмешательств является развитие послеоперационной острой печеночной недостаточности, приводящей к росту послеоперационных осложнений и послеоперационной летальности.
При планировании обширных резекционных вмешательств на печени у пациентов с эхинококкозом зачастую хирурги сталкиваются с проблемой малого функционального объема остающейся доли печени, что не позволяет выполнить радикальное хирургическое вмешательство. Острая пострезекционная печеночная недостаточность (ОППН) в настоящее время является одним из тех осложнений, на которые у хирургов есть возможность повлиять и предотвратить. Частота развития ОППН варьируется в пределах 0,7–35 % в зависимости от клиники и является основной причиной послеоперационной летальности после больших резекций печени [2].
На сегодняшний день известны ряд хирургических способов, позволяющих увеличить остаточный объем паренхимы печени, тем самым позволяя пациенту избежать пострезекционной печеночной недостаточности. Начиная с 1984 года при лечении воротной холангиокарциномы стала применяться предоперационная эмболизация правой ветви воротной вены (ЭПВВВ), и до сегодняшнего дня данная методика является основным способом увеличения остаточной доли печени (FRL) [3]. Незамедлительное перераспределение крови после проведения процедуры приводит к гипертрофии гепатоцитов с увеличением объема последних в неэмболизированных сегментах до 10 % в течение 4–6 недель [4].
Также одним из методов увеличения остающейся доли печени является лигирование ветвей воротной вены. По данным многих авторов ЭПВВВ и перевязка правой ветви воротной вены имеют схожее количество осложнений и послеоперационной летальности, однако прирост FLR по сравнению с ЭПВВВ несколько ниже [5].
Одним из наиболее радикальных способов предотвратить развитие ППН являются этапные резекции печени (типа ALPPS), однако данные методики сопряжены с большим количеством послеоперационных осложнений и летальностью [5, 6].
Наиболее современным способом профилактики ОППН является депривация венозного кровоснабжения печени, заключающаяся в эмболизации как портальной системы, так и эмболизации одной из печеночных вен. По данным ряда авторов данная методика позволяет значимо увеличить FLR, однако гистологически у данных пациентов наблюдалась выраженное повреждение гепатоцитов с синусоидальной дилатацией, также отмечается повышенный риск интраоперационных осложнений в виде развития кровотечения вследствие открытия вено-венозных интрапаренхиматозных шунтов [7].
В хирургической клинике Боткинской больницы предпочтение отдается методу портоэмболизации с контролем не только анатомического, но и функционального остающегося объема паренхимы печени по средством ОФЭКТ/КТ. На сегодняшний день данный способ является наиболее малотравматичным и безопасным, чем другие известные способы. Именно применению данной высокотехнологичной методики при эхинококкозе печени и посвящено наше исследование.
Материалы и методы
В хирургической клинике Боткинской больницы при планировании обширных резекций печени при её паразитарном поражении в качестве профилактики развития острой пострезекционной печеночной недостаточности с 2018 года проводилась процедура эмболизации правой ветви воротной вены (ЭПВВВ). В работе проанализированы 64 случая с многофокусным эхинококковым поражением печени за период с 2007 года. За указанный временной период проведено 64 правосторонних гемигепатэктомий. С целью оценки результатов применения данной методики проведено сравнение двух групп больных: первая группа включила в себя пациентов, перенесших ЭПВВВ, вторая – оперированных без предварительной профилактики ОППН. В основную (первую) группу вошли 13 больных, 7 из которых была проведена гибридная эндоваскулярная процедура, во вторую – 51 пациент, оперированный по традиционной схеме.
Достоверных различий по полу, возрасту, стадии эхинококкового процесса, а также показаниям к резекционному методу лечению в исследуемых группах не было.
В исследовании оценены следующие показатели: длительность хирургического вмешательства, объем кровопотери, необходимость интраоперационной гемотрансфузии, длительность нахождения в отделении реанимации, послеоперационные осложнения по классификации Clavien-Dindo, специфические осложнения по ISGLS, послеоперационный койко-день, рецидивы в течение первого года после хирургического вмешательства.
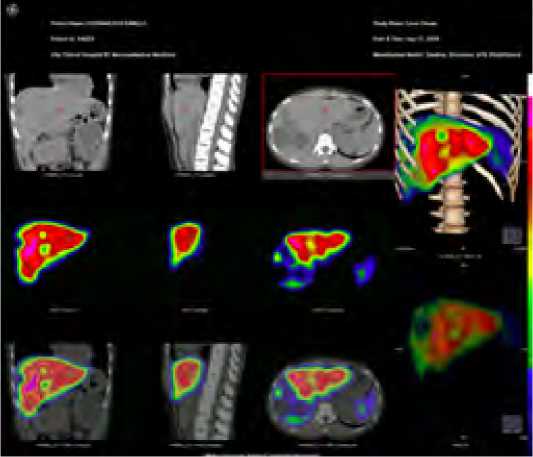
Рис. 1. ОФЭКТ/КТ после проведения ЭПВВВ у пациента с эхинококковым поражением правой доли печени. aFLR 34 % Fig. 1 . SPECT / CT scan after right PVE in a patient with echinococcal lesion of the right lobe of the liver. aFLR 34 %
Основными критериями при выполнении объемного резекционного вмешательства в обеих группах служили:
-
а) объем замещения паразитарными кистами паренхимы одной из долей печени,
-
б) малый объем паренхимы доли печени, остающийся после потенциальной резекции,
-
в) количество и размер кист, расположенных в одной доле.
Всем пациентам первой группы в предоперационном периоде исследование ОФЭКТ/КТ выполнялось на аппарате Discovery NM/СТ- 670 («Дженерал Электрик» США). При планировании обширной резекции при пограничных значениях анатомического размера остающейся доли печени (aFLR 25–30 % при нормальной функции печеночной паренхимы и 35–40 % при сниженной функции печеночной паренхимы) учитывали результаты ОФЭКТ/КТ печени (рис. 1). Показанием к проведению двухэтапного лечения был объем функционирующего FLR (fFLR) <30 %.
Противопоказаниями для проведения ЭПВВВ служило наличие аллергии на йодсодержащие контрастные препараты, однако в исследовании такие пациенты представлены не были.
Методика ЭПВ в модификации Боткинской больницы.
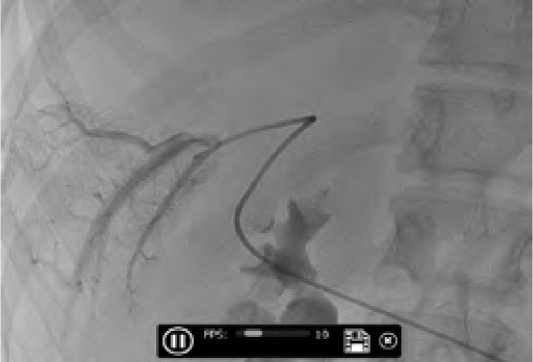
Рис. 2. Ангиограмма. Катетер в стволе правой ветви воротной вены. Введена гемостатическая губка до окклюзии
Fig. 2. Angiogram. Catheter in the trunk of the right branch of the portal vein. A hemostatic sponge was inserted before occlusion
Особенностью проведения ЭПВВВ у пациентов с эхинококковым поражением печени было отсутствие первичного ультразвукового доступа к правой ветви воротной вены. Это было связано с расположением эхинококковых кист, располагающихся на траектории пункции. Данная особенность встретилась у всех 8 пациентов, что потребовало скорректировать методику выполнения ЭПВВВ. Дренирование проводилось в VII межреберье по средней подмышечной линии, устанавливался порт 6Fr ниже зоны слияния правой и левой ветви воротной вены. Доступ к правой ветви воротной вены осуществлялся через контралатеральную вену, что обусловливало определенные технические трудности и удлинение времени процедуры. В последующем выполнялась прямая портография с эмболизацией гемостатической губкой до окклюзии (рис. 2).
Возраст больных первой группы составил 61,2±7,5 лет (от 18 до 78 лет). Соотношение мужчин и женщин: 30:21. Во второй группе возраст составил 54,5±7,3 лет (от 19 до 67 лет). Соотношение мужчин и женщин: 6:7.
Распределение больных по классификации ASA было следующим (рис. 3)
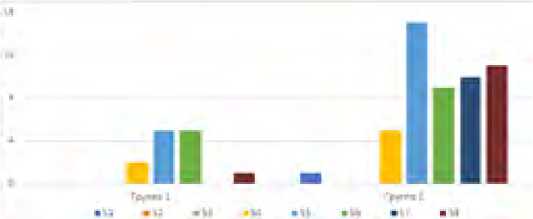
Рис. 5. Распределение больных по наличию пораженных сегментов печени
Fig. 5. Distribution of patients by the presence of affected liver segments
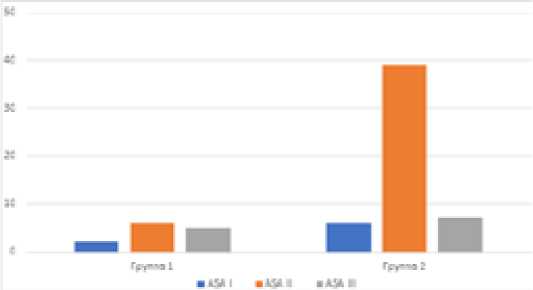
Рис. 3. Распределение больных по степени операционноанестезиологического риска по классификации ASA Fig. 3. Distribution of patients according to the degree of operational and anesthetic risk according to the ASA classification
Распределение больных первой группы по ультрасонографической классификации ВОЗ представлено на рисунке 4.
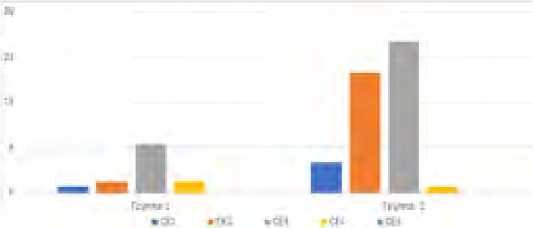
Рис. 4. Распределение больных по классификации ВОЗ
Fig. 4. Distribution of patients according to the WHO classification
Хотелось бы отметить, что во второй группе пациенты были представлены в основном категориями СЕ2 и СЕ3, что было обусловлено изменением концепции необходимости хирургического лечения как кист СЕ 1, так и «мертвых» паразитарных кист СЕ4 и СЕ5. Как видно из графика, большая часть пациентов имела стадию эхинококкового процесса СЕ2 и СЕ3.
Также было оценено распределение кист по сегментам печени (рис. 5)
Результаты
В исследовании оценены следующие показатели: объем паренхимы FLR до и после ЭПВВВ, технический и клинический успех, длительность хирургического вмешательства, объем кровопотери, необходимость интраоперационной гемотрансфузии, длительность нахождения в отделении реанимации, послеоперационные осложнения по классификации Clavien-Dindo, специфические осложнения по ISGLS, послеоперационный койко-день, рецидивы в течение первого года после хирургического вмешательства [8, 9].
Эффективность ЭПВВВ оценивалась по объему прироста aFLR и fFLR. Положительным результатом после портоэмболизации считалось увеличение fFLR до уровня 30 % и выше (табл. 1).
Таблица 1
Эффективность ЭПВВВ по показателю прироста fFLR
Table 1
Efficiency of right PVE in terms of growth rate fFLR
|
Пациент |
fFLR до ЭПВВВ, % |
fFLR после ЭПВВВ, % |
Прирост, % |
|
1 |
30,2 |
- |
|
|
2 |
23,6 |
31,2 |
7,6 |
|
3 |
25,3 |
41,4 |
16,1 |
|
4 |
32,7 |
- |
|
|
5 |
27,8 |
38,9 |
11,1 |
|
6 |
27,3 |
38,6 |
11,3 |
|
7 |
24,2 |
37,1 |
12,9 |
|
8 |
33,6 |
- |
|
|
9 |
27,8 |
43,4 |
15,6 |
|
10 |
31,7 |
- |
|
|
11 |
31,1 |
- |
|
|
12 |
19,1 |
26,4/ 32,3 |
7,3/ 13,2 |
|
13 |
31 |
- |
У 7/ 13 пациентов из группы 2 с fFLR менее 30 % выполнена ЭПВВВ, при этом у одного больного потребовалось проведение повторной процедуры эмболизации в связи с недостаточной эффективностью первичной операции. Средний показатель прироста fFLR составил 12,5 %. Технический успех составил 100%, клинический – 85,7 %.
Длительность хирургических вмешательств составила в первой группе 212 (182–307) минуты, во второй группе – 278,3 (185–421) минуты.
Предшествующая ЭПВВВ не приводила к увеличению объема интраоперационной кровопотери и составила: 213 (110– 1050) мл и 234 (121–1212) мл соответственно. Необходимость в интраоперационной гемотрансфузии в группе 1 выявлена у 6/13 пациентов, в группе 2 – у 31/51. В группе 1 средняя длительность послеоперационного койко-дня составила 13 (7–35) дней, в группе 2 – 17 (9–41).
В работе оценены как общие, так и специфические послеоперационные осложнения.
Таблица 2
Распределение больных по количеству осложнений по классификации Clavien-Dindo
Table 2
Distribution of patients by the number of complications according to the Clavien-Dindo classification
Как видно из таблицы 2, количество послеоперационных осложнений по Clavien-Dindo степени III и выше в первой группе составило 3, при этом во второй группе – 8. В группе 2 зафиксировано два летальных исхода, обусловленных развитием ОППН.
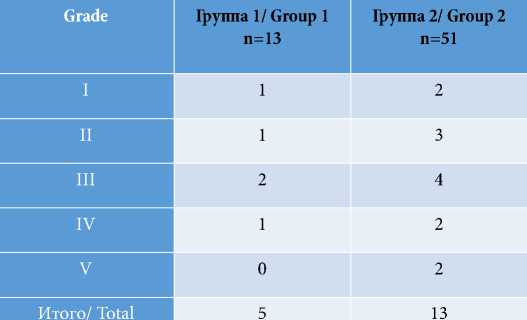
При анализе полученных результатов отмечено, что эпизодов развития ОППН у пациентов первой группы не отмечено. В группе 2 выявлено 20 случаев ОППН, при этом в трех случаях данное осложнение было представлено категорией «С» (табл. 3).
Таблица 3
Распределение больных по количеству случаев печеночной недостаточности по классификации ISGLS
Table 3
Distribution of patients by the number of cases of liver failure according to ISGLS classification
|
Grade |
Группа 1/ Group 1 n=13 |
Группа 2 /Group 2 n=51 |
|
А |
0 |
12 |
|
В |
0 |
5 |
|
С |
0 |
3 |
|
Итого/ Total |
0 |
20 |
Таблица 4
Распределение больных по количеству случаев послеоперационных геморрагических осложнений по классификации ISGLS
Table 4
Distribution of patients by the number of cases of postoperative hemorrhagic complications according to ISGLS classification
|
Grade |
Группа 1/ Group 1 n=13 |
Группа 2/Group 2 n=51 |
|
А |
3 |
2 |
|
В |
0 |
5 |
|
С |
0 |
1 |
|
Итого/ Total |
3 |
8 |
В первой группе выявлены три случая послеоперационных геморрагических осложнений, относящихся к классу А, не потребовавших проведения дополнительных вмешательств. Во второй группе зафиксированы 8 геморрагических осложнений (класс «А» двое пациентов, класс «В» – 5, класс «С» – один) (табл. 4).
В первой группе выявлен один случай желчного свища у пациента, перенесшего расширенную правостороннюю геми-гепатэктомию (класс «В»). В послеоперационном периоде у больного сформировалась билома, потребовавшая чрескожного дренирования жидкостного скопления. В течение 14 суток явления желчного свища купировались. Осложнений класса В и С не было.
Таблица 5
Распределение больных по количеству случаев билиарных осложнений по классификации ISGLS
Table 5
Distribution of patients by the number of cases of biliary complications according to ISGLS classification
|
Grade |
Группа 1/Group 1 n=13 |
Группа 2/Group 2 n=51 |
|
А |
0 |
3 |
|
В |
1 |
5 |
|
С |
0 |
0 |
|
Итого/ Total |
1 |
8 |
Во второй группе отмечено 8 случаев билиарных осложнений, все из них купированы консервативно либо малоинвазивными методами лечения (чрескожное дренирование билом, ретроградное стентирование желчных протоков) (табл. 5).
Таким образом, хотелось бы отметить, что применение ЭПВВВ у пациентов с паразитарным поражением печени не оказывало негативного влияния на течение послеоперационного периода при положительном влиянии на частоту и тяжесть развития пострезекционной печеночной недостаточности.
Обсуждение
Ежегодный рост количества резекций печени при различных нозологических формах и расширение показаний к их проведению обусловливает необходимость поиска методик профилактики ОППН. При значительном разнообразии современных методик, процедура ЭПВВВ, по-нашему мнению, обладает оптимальным соотношением таких качеств как безопасность и эффективность.
Известно, что ряд агрессивных хирургических способов профилактики ОППН (двухэтапные резекции, депривация кровотока) обладают несколько лучшими показателями в отношении прироста FLR, однако количество послеоперационных осложнений и летальность не позволяют широко внедрить их в повседневную практику особенно у пациентов с доброкачественным паразитарным процессом.
При эхинококковом поражении печени ЭПВВВ применена впервые в хирургической клинике Боткинской больницы. При выполнении процедуры эмболизации ветвей воротной вены нами была выявлена следующая особенность в отличие от известного способа у пациентов со злокачественным поражением печени: практически у 70 % больных сосудистый доступ осуществлялся через левую ветвь воротной вены, что определяло некоторые технические сложности при проведении вмешательства. При этом технический и клинический успех составил 100 % и 93 % соответственно.
При анализе полученных данных можно сделать вывод, что полученный первый опыт применения данной методики демонстрирует возможность профилактики тяжелых послеоперационных осложнений и улучшения непосредственных результатов хирургического лечения.
Выводы
Таким образом, современный подход к резекционным вмешательствам при эхинококкозе печени, включающий предоперационную эмболизацию правой ветви воротной вены с последующим достижением викарной гипертрофии контрлатеральной доли печени, позволяет уменьшить количество послеоперационных осложнений, а в особенности развитие острой пострезекционной печеночной недостаточности.
Аладин Марк Николаевич – ординатор кафедры хирургии Российской медицинской академии непрерывного профессионального образования (ФГБОУ ДПО РМАНПО МЗ РФ). Россия, 125284, Москва, 2-й Боткинский проезд, д. 5, e-mail: aladinmark97@ gmail.com ORCID: 0000-0002-5142-1302.
Information about authors:
Список литературы Профилактика острой пострезекционной печеночной недостаточности у больных эхинококковом печени
- Шабунин А.В., Тавобилов М.М., Карпов А.А. Эхинококкоз печени: эволюция хирургического лечения. Хирургия. Журнал им. Н.И. Пирогова, 2021. № 5. С. 5-103. DOI: 10.17116/hirurgia202105195
- Konishi T., Takamoto T., Hashimoto T., Makuuchi M. Is portal vein embolization safe and effective for patients with impaired liver function? J Surg Oncol., 2021, Mar № 3, 123, рр. 1742-1749. Epub ahead of print. DOI: 10.1002/jso.26447 PMID: 33657243
- Olthof, P. B., Aldrighetti, L., Alikhanov, R., Cescon, M., Koerkamp, B. G., Jarnagin, W. R., van Gulik, T. M. Portal Vein Embolization is Associated with Reduced Liver Failure and Mortality in High-Risk Resections for Perihilar Cholangiocarcinoma; Perihilar Cholangiocarcinoma Collaboration Group. Ann Surg Oncol., 2020, Dec; № 27(Suppl 3), рр. 968. DOI: 10.1245/s10434-020-08353-5
- Kim D., Cornman-Homonoff J., Madoff DC. Preparing for liver surgery with "Alphabet Soup": PVE, ALPPS, TAE-PVE, LVD and RL. Hepatobiliary Surg Nutr., 2020, Apr; № 9(2), рр. 136-151. 10.21037/hbsn.2019.09.10 ; PMCID: PMC7188547. DOI: 10.21037/hbsn.2019.09.10;PMCID PMID: 32355673
- Madoff D.C., Odisio B.C., Schadde E., Gaba R.C., Bennink R.J., van Gulik T.M., Guiu B. Improving the Safety of Major Resection for Hepatobiliary Malignancy: Portal Vein Embolization and Recent Innovations in Liver Regeneration Strategies. Curr Oncol Rep., 2020, May 16; № 22(6), рр. 59. DOI: 10.1007/s11912-020-00922-x PMID: 32415401
- Chan A., Zhang W.Y., Chok K., Dai J., Ji R., Kwan C., Man N., Poon R., Lo C.M. ALPPS Versus Portal Vein Embolization for Hepatitis-related Hepatocellular Carcinoma: A Changing Paradigm in Modulation of Future Liver Remnant Before Major Hepatectomy. Ann Surg., 2021, May 1; № 273(5), рр. 957-965. DOI: 10.1097/SLA.0000000000003433 PMID: 31305284
- Guiu B., Quenet F., Panaro F., Piron L., Cassinotto C., Herrerro A., Souche F.R., Hermida M., Pierredon-Foulongne M.A., Belgour A., Aho-Glele S., Deshayes E. Liver venous deprivation versus portal vein embolization before major hepatectomy: future liver remnant volumetric and functional changes. Hepatobiliary Surg Nutr., 2020, Oct; № 9(5), рр. 564-576. 10.21037/hbsn.2020.02.06 ; PMCID: PMC7603937. DOI: 10.21037/hbsn.2020.02.06;PMCID PMID: 33163507
- Clavien P. A. Barkun J., De Oliveira M. L., Vauthey J. N., Dindo D., Schulick R. D., Graf R. The Clavien-Dindo classification of surgical complications: five-year experience. Annals of surgery, 2009, Т. 250, № 2, рр. 187-196. DOI: 10.1097/SLA.0b013e3181b13ca2
- Rahbari N.N. Garden O.J., Padbury R., Brooke-Smith M., Crawford M., Adam R., Koch M., Makuuchi M., Dematteo R.P., Christophi C., Banting S., Usatoff V., Nagino M., Maddern G., Hugh T.J., Vauthey J.N., Greig P., Rees M., Yokoyama Y. Y., Fan S. T., Nimura Y., Figueras J., Capussotti L., Büchler M.W., Weitz J. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery, 2011, May; № 149(5), рр. 713-724. Epub 2011 Jan 14. DOI: 10.1016/j.surg.2010.10.001 PMID: 21236455


