Профили экспрессии микроРНК в лейкоцитах крови как маркеры тяжести расстройств аутистического спектра у детей
Автор: Алексеева А.С., Филиппова Ю.Ю., Бурмистрова А.Л.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
расстройства аутистического спектра (рас) - это гетерогенная группа нарушений нейроразвития с неизвестной этиологией. показано, что иммунная дисфункция может быть вовлечена в этиологию и патогенез аутизма. одними из регуляторов взаимодействий нервной и иммунной систем выступают микрорнк, которые могут рассматриваться как ключевые игроки в патогенезе и биомаркеры для диагностики заболевания. в данной работе был проведен поиск взаимосвязи уровней лейкоцитарной экспрессии микрорнк: микрорнк-155, микрорнк-146а, микрорнк-124, микрорнк-21 и микрорнк-9, с концентрацией цитокинов в плазме крови у детей с рас для выявления биологических маркеров заболевания и степени его тяжести. установлено, что у детей с легким течением аутизма уровни экспрессии изученных микрорнк в лейкоцитах крови не отличались от аналогичных значений детей с нормотипичным развитием. в лейкоцитах детей с тяжелым течением расстройств аутистического спектра снижена экспрессия микрорнк-124 и микрорнк-146а по сравнению с нормотипичными детьми, а также микрорнк-146а - по сравнению с детьми с легким течением аутизма. в группе детей с легким течением аутизма выявлены две значимые положительные корреляции между микрорнк-9/ifny и микрорнк-124/tnfa на фоне отрицательного взаимодействия между микрорнк-155 и tnfa. у детей с тяжелым течением расстройств аутистического спектра обнаружены четыре значимые отрицательные связи между микрорнк-9/ifny; микрорнк- 146а/ifnу; микрорнк-146а/il-6 и микрорнк-155/il-10. уровень экспрессии микрорнк-146а в лейкоцитах меньше 0.0035 у.е. с 86.7% чувствительностью и 89.6% специфичностью может свидетельствовать о тяжелом течении аутизма у детей. таким образом, у детей с тяжелым течением рас нами выявлены нарушения в уровнях экспрессии важных негативных регуляторов воспаления и участников нейроиммунных взаимодействий - микрорнк-146а и микрорнк-124.
Микрорнк, микрорнк-146а, лейкоциты, цитокины, расстройства аутистического спектра, дети, диагностика
Короткий адрес: https://sciup.org/147246124
IDR: 147246124 | УДК: 612.8, | DOI: 10.17072/1994-9952-2024-3-335-343
Текст научной статьи Профили экспрессии микроРНК в лейкоцитах крови как маркеры тяжести расстройств аутистического спектра у детей
Расстройства аутистического спектра (РАС) относятся к нарушениям нейроразвития, для которых характерна клиническая и генетическая гетерогенность. Базовые симптомы РАС: недостаточность многих социальных функций, стереотипия и ограниченные интересы, появляются в раннем детстве и прогрессируют в течение взрослой жизни [Eissa et al., 2020].
Этиология РАС неизвестна. Однако, по мнению ряда авторов, она является результатом комплексных взаимодействий и комбинаций генетических аберраций с влиянием факторов окружающей среды. Среди последних значимую роль играет активация иммунитета матери на ранних сроках беременности в результате инфекции [Liu X. et al., 2023]. В соответствии с этой теорией, иммунная система матери изменяет фетальное окружение плода на воспалительное, что вносит вклад в нарушение сетевых взаимодействий в мозге у потомства матерей с активацией иммунной системы. В дальнейшем это находит отражение в дезорганизации когнитивного развития, аберрациях в активности мозга у потомства и может приводить к психическим нарушениям, включая РАС и шизофрению [Белокоскова и др., 2023; Brown et al., 2014; Bilbo, 2009]. Вместе с тем, пре/перинатальное воспаление в центральной нервной системе (ЦНС) создает условия для формирования хронического воспаления на периферии, которое сохраняется при РАС в течение жизни [Hu et al., 2018]. На сегодня известно, что нейровоспаление опосредовано сложным взаимодействием между клетками ЦНС и периферическими клетками иммунной системы. Одними из ключевых регуляторов этих взаимодействий выступают микроРНК [Slota, Booth, 2019].
МикроРНК относятся к классу малых некодирующих РНК, основными функциями которых являются регулирование экспрессии матричных РНК (мРНК), дестабилизация и регулирование уровней протеинов [Powdrill et al., 2016]. Изменяя локальную генную экспрессию, микроРНК способны контролировать функции клеток, в том числе клеток мозга: нейрогенез, миграцию, нейронную поляризацию, развитие синапса и синаптическую пластичность. Показано, что микроРНК играют важную роль в этиологии и/или поддержании неврологических и иммунных нарушений, а также путей коммуникации иммунной и нервной систем [Foller, Cremer, Béclin, 2014]. На сегодняшний день наиболее важными и хорошо изученными микроРНК в контексте нейровоспаления являются микроРНК-155, микроРНК-146а, микроРНК124, микроРНК-21 и микроРНК-9. Все они демонстрируют совокупные модулирующие эффекты на иммунную и нервную системы через прямые и непрямые изменения сигналов воспалительных путей [Slota, Booth, 2019; Soreq, Wolf, 2011]. Однако экспрессия этих микроРНК в клетках крови (лейкоцитах) у лиц с РАС изучена недостаточно. Кроме того, остается вопрос, могут ли уровни экспрессии микроРНК в лейкоцитах периферической крови использоваться как персональные биомаркеры в диагностике РАС и степени их тяжести [Бурмистрова и др., 2022].
Цель данной работы – выявление взаимосвязи уровней лейкоцитарной экспрессии микроРНК: микроРНК-155, микроРНК-146а, микроРНК-124, микроРНК-21 и микроРНК-9, с концентрацией цитокинов в плазме крови у детей с РАС для поиска биологических маркеров заболевания и степени его тяжести.
Материал и методика
Дизайн исследования
Исследования выполнены на базе научной лаборатории Инновационных биотехнологий биологического факультета ФГБОУ ВО ЧелГУ. Отбор участников исследования проводился психотерапевтами в рамках Соглашения о сотрудничестве № 92 от 16.04.2016 г. с Комитетом социальной политики города Челябинска и МБУ СО Социально-реабилитационным центром Здоровье.
В исследование включено 126 детей, проживающих в г. Челябинске. Основная группа – 81 ребенок с диагностированными РАС различной степени тяжести: 51 ребенок – c легким течением РАС, 30 детей – с тяжелым течением РАС. Диагноз РАС поставлен психотерапевтами реабилитационного центра Здоровье на основании МКБ-10. Степень тяжести аутизма определяли с помощью рейтинговой шкалы детского аутизма (Childhood Autism Rating Scale, CARS). Группа сравнения («Нормотипичное развитие») – 45 детей, посещающих детские дошкольные учреждения и школы пос. Первомайский Челябинской обл.
Этическая экспертиза
В рамках работы было получено информированное согласие на проведение комплексного обследования и обработку персональных данных. Исследование одобрено этическим комитетом Челябинского государственного университета (протокол № 2 от 27.08.2019 г.) и выполнено с учетом положения Хельсинской декларации Всемирной медицинской ассоциации (2013) [Бурмистрова и др., 2022].
Методы
Материалом для исследования служили лейкоциты периферической крови. Фракцию клеток получали из венозной крови с К 3 ЭДТА центрифугированием в течение 10 мин. при 3000 об/мин, с последующим лизированием осадка эритроцитов раствором NH 4 Cl [Бурмистрова и др., 2022].
В лейкоцитах периферической крови была проведена оценка уровней экспрессии: микроРНК-9, микроРНК-21, микроРНК-124-3p, микроРНК-146а-5p и микроРНК-155. Общую РНК выделяли фенолхлороформным методом с помощью реагента TRIZol («TermoFisher Scientific», США). Концентрацию и чистоту выделения РНК анализировали на флуориметре Quantus («Promega», США). Реакцию обратной транскрипции (ОТ) микроРНК в кДНК и полимеразную цепную реакцию в реальном времени (ПЦР-РВ) проводили наборами реагентов: «ОТ-1» и «Набор реагентов для проведения ПЦР‑РВ с SYBR Green» НПК «Синтол» (Россия), согласно инструкциям производителей, на приборной базе ДТ-прайм («ДНК-технология», Россия) [Бурмистрова и др., 2022]. Экспрессию генов-мишеней нормализовали по «гену домашнего хозяйства» – гену малой ядерной РНК (U6). Первичные нуклеотидные последовательности праймеров по типу «стебель-петля» для ОТ и праймеров для ПЦР-РВ синтезированы НПК «Синтол» согласно данным: микроРНК-9 – Tavakolian S. с соавторами [Tavakolian et al., 2020]; микроРНК-21 – Xu с соавторами [Xu et al., 2012]; микроРНК-124-3p – Liu Y.X. с соавторами [Liu Y.X. et al., 2016]; микроРНК-146а-5p – Zhang R.X. с соавторами [Zhang et al., 2017]; микроРНК-155 и U6, а также параметры программ ОТ и ПЦР-РВ – Yang L.H. с соавторами [Yang et al., 2014]. Уровень мРНК рассчитывали в относительных единицах по методу 2(-ΔΔCT) с учетом эффективности реакции [Livak, Schmittgen, 2001].
Статистический анализ
Статистическая обработка данных выполнена в программах: PAST (v. 3.15) и MedCalc (v. 10.2.0), графические построения выполнены в пакете «corrplot» программно-статистической среды R (v. 3.6.1). Нормальность распределения величин в выборке оценивали по критерию Колмогорова–Смирнова. Данные имели непараметрическое распределение. Для приведения значений к нормальному распределению была проведена трансформация Бокса-Кокса. Такой подход дает возможность выявить более «тонкие» различия между группами, т.к. анализу подвергаются как непосредственные значения, так и относительные расстояния между показателями на линейной шкале, тогда как в рамках порядковой статистики рассматриваются не сами значения, а их ранги и нелинейная шкала не позволяет учесть разницу расстояний. После наивной ретрансформации для каждого показателя рассчитывали средние значения и 95% доверительный интервал (ДИ). Для сравнения выборок применяли однофакторный дисперсионный анализ (one way ANOVA) с апостериорными попарными сравнениями по методу Фримана-Тьюки [Филиппова, Алексеева, Бурмистрова, 2023]. Корреляции между уровнями экспрессии микроРНК в лейкоцитах периферической крови и концентрацией цитокинов в плазме оценивали с помощью коэффициента ранговой корреляции Спирмена отдельно для каждой исследуемой группы, и визуализировали в виде тепловой карты корреляций. Для оценки диагностической значимости микроРНК в качестве потенциальных маркеров аутизма и его тяжести использовали ROC-анализ, с вычислением площади под ROC-кривой и «точки отсечения». Во всех случаях эффекты считали статистически значимыми при P ≤0,05.
Результаты и обсуждение
Проведено клиническое и лабораторное обследование 45 детей с нормотипичным развитием и 81 ребенка с РАС. Группы детей были сопоставимы по полу (соотношение мальчики:девочки – 4:1). Возраст детей обеих групп варьировал в диапазоне от 3 до 13 лет, тем не менее, медианный возраст детей с нормотипичным развитием (9.0 лет) был значимо выше медианного возраста детей с РАС (6.0 лет). Значимых различий в уровнях экспрессии изученных микроРНК при делении детей согласно возрастной периодизации по ВОЗ (до 6 лет, 7–12 и 13 лет и старше) не обнаружено. Дети с РАС в зависимости от тяжести состояния (согласно CARS) были разделены психотерапевтами на группы с легким (баллы по CARS 29– 36) и тяжелым течением (баллы по CARS 36–60).
Экспрессию микроРНК: микроРНК-155, микроРНК-146а, микроРНК-124, микроРНК-21 и микроРНК9 оценивали в лейкоцитах периферической крови детей с легким/тяжелым течением РАС и нормотипичным развитием. Данные представлены в таблице.
Обнаружено: 1. Уровни экспрессии микроРНК в лейкоцитах крови детей с легким течением РАС не отличались от значений детей с нормотипичным развитием; 2. У детей с тяжелым течением РАС в лейкоцитах периферической крови была значимо снижена экспрессия микроРНК-124, по сравнению с аналогичным показателем группы «Нормотипичное развитие», и микроРНК-146а – как по отношению к значениям нормотипичных детей, так и детей группы «Легкое течение РАС» (таблица).
Уровни экспрессии микроРНК в лейкоцитах у детей с легким течением РАС, тяжелым течением РАС и нормотипичным развитием, M [95%ДИ]
[MicroRNA expression levels in leukocytes of children with a mild ASD, severe ASD and normotypical development, M [95% CI]]
|
Показатели, у.е. |
Нормотипичное развитие n = 45 |
Легкое течение РАС n = 51 |
Тяжелое течение РАС n = 30 |
|
Возраст, лет |
9.0 [4.0-13.0] |
6.0 [3.0-13.0] |
6.0 [3.0-13.0] |
|
Баллы по CARS |
- |
32.0 [29.0-36.0] |
40.0 [37.0-55.0] |
|
МикроРНК-9 |
0.54 [0.36; 0.77] |
0.55 [0.41; 0.73] |
0.49 [0.34; 0.71] |
|
МикроРНК-21 |
0.12 [0.08; 0.16] |
0.13 [0.10; 0.16] |
0.12 [0.08; 0.16] |
|
МикроРНК-124 |
0.13 [0.10; 0.18] |
0.13 [0.11; 0.17] |
0.09 [0.07; 0.13] P 3-1 =0.049 |
|
МикроРНК-146a |
0.008 [0.005; 0.012] |
0.006 [0.004; 0.008] |
0.004 [0.002; 0.006] P 3-1 <0.001 P 3-2 =0.002 |
|
МикроРНК-155 |
0.002 [0.002; 0.004] |
0.003 [0.001; 0.005] |
0.002 [0.001; 0.003] |
Примечание. Данные представлены в виде средних значений и 95% доверительных интервалов. P 3-1 - различия между показателями групп «Нормотипичное развитие» и «Тяжелое течение РАС». P 3-2 - различия между показателями групп «Легкое течение РАС» и «Тяжелое течение РАС». Статистически значимыми считались различия при Р ≤ 0.05.
Ранее нами было показано [Филиппова, Алексеева, Бурмистрова, 2023], что дети с РАС имеют различия в уровнях цитокинов в плазме крови в зависимости от тяжести состояния. Дети с легким течением РАС демонстрируют высокие уровни IL-4, что может носить компенсаторный характер. У детей с тяжелым течением РАС в плазме крови установлены значимо высокие уровни основного цитокина Tx1 – IFN γ , и IL-6, на фоне низких уровней важного противовоспалительного цитокина – IL-10 и провоспали-тельных «цитокинов тревоги»: TNF α и IL-1 β [Филиппова, Алексеева, Бурмистрова, 2023]. Как показано G. Oxenkrug, сдвиг гомеостатического баланса про- / противовоспалительных цитокинов Tx1/Tx2 в сторону Tx1 (прежде всего, повышения уровней IFN γ ), на фоне продолжительного действия стрессовых факторов различной природы, приводит к развитию системного хронического воспаления низкой степени тяжести [Oxenkrug, 2011]. На основании полученных результатов, для выявления ассоциации уровней экспрессии микроРНК в лейкоцитах периферической крови с наличием/отсутствием системного хронического воспаления и тяжестью РАС, нами был проведен корреляционный анализ. Результаты анализа представлены на рисунке.
В группе детей с нормотипичным развитием все корреляции между уровнями экспрессии микроРНК и цитокинами плазмы имели слабую силу, статистически значимых взаимодействий не обнаружено (рисунок, A).
При оценке межсистемных связей в группе детей с легким течением РАС установлены две значимые положительные корреляции между: микроРНК-9 и IFN γ (ρ = 0.28, Р = 0.048); микроРНК-124 и TNF α (ρ = 0.29, Р = 0.044); и одно отрицательное взаимодействие между микроРНК-155 и TNF α (ρ = -0.31, Р = 0.035) (рисунок, Б).
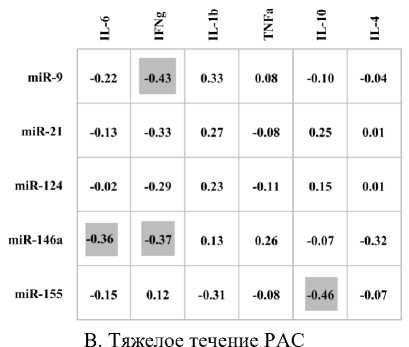
В группе детей с тяжелым течением аутизма выявлены четыре значимые корреляции средней силы, которые были отрицательными: между микроРНК-9 и IFNγ (ρ = -0.43, Р = 0.016); микроРНК-146а и IFNγ (ρ = -0.37, Р = 0.042); микроРНК-146а и IL-6 (ρ = -0.36, Р = 0.048); микроРНК-155 и IL-10 (ρ = -0.46,
Р = 0.011) (рисунок, В).
|
q |
胃 |
斤 |
||||
|
miR-9 |
-0.08 |
0.28 |
0.06 |
0.04 |
0.20 |
0.08 |
|
miR-21 |
-0.26 |
0.12 |
0.26 |
0.21 |
-OJO |
0.12 |
|
miR-124 |
-0.22 |
0.13 |
0.23 |
0.29 |
-0.01 |
0.13 |
|
miR-146a |
-0.06 |
-0.06 |
0.07 |
0.02 |
0.09 |
-0.20 |
|
miR-155 |
0.05 |
-0.17 |
-0.18 |
-0.31 |
-0.23 |
-0.15 |
Б. Легкое течение РАС
|
£ |
-* |
|||||
|
miR-9 |
0.24 |
0.20 |
-0.18 |
•0.22 |
0.15 |
0Л4 |
|
miR-21 |
0.01 |
0.09 |
-0.18 |
-0.22 |
0.08 |
-0.16 |
|
miR-124 |
0.01 |
0.16 |
-0.10 |
-0.12 |
0.02 |
-0.15 |
|
miR-146a |
-0.20 |
0.08 |
-0.04 |
0.08 |
•0,11 |
-0.23 |
|
miR-155 |
0.25 |
-0.05 |
-0.05 |
-0.09 |
-0.12 |
-0.08 |
А. Нормотипичное развитие
Структура корреляционных связей между уровнем экспрессии микроРНК в лейкоцитах и концентрацией цитокинов в плазме крови детей с легким/тяжелым течением РАС и нормотипичным развитием.
Цифрами показана сила связи ( ρ ), а также её направленность – отрицательная и положительная. Статистически значимые корреляционные взаимодействия ( Р ≤ 0.05) показаны серым цветом
[The correlations structure between microRNA expression levels in leukocytes and cytokine levels in blood plasma of children with a mild/severe ASD and normotypical development.
Note: The numbers in the figures show the strength of the association ( ρ ), as well as its direction – negative and positive. Statistically significant correlations (p ≤ 0.05) are shown in gray]
Таким образом, у детей с тяжелым течением аутизма микроРНК146а демонстрирует низкие уровни экспрессии в лейкоцитах периферической крови и высокую корреляционную активность с цитокинами плазмы, а именно наличие значимых отрицательных связей с IL-6 и IFN γ .
Для оценки диагностической значимости экспрессии микроРНК-146а в лейкоцитах периферической крови в качестве маркера тяжести течения РАС у детей был проведен ROC-анализ. Показано, что уровень экспрессии микроРНК-146а в лейкоцитах меньше 0.0035 у.е. (чувствительность: 86.7%, специфичность 89.6%, площадь под ROC-кривой: 0.836±0.0362, 95%ДИ: 0.760–0.896) может свидетельствовать о тяжелом течении аутизма у детей.
Результаты исследований последних лет свидетельствуют, что иммунная дисрегуляция, в частности дисбаланс про-/противовоспалительного фенотипов иммунных клеток, и хроническое нейровоспаление выступают значимыми характеристиками РАС [Moaaz et al., 2019]. Недавно продемонстрировано, что интенсивность воспаления на клеточном уровне, как в ЦНС, так и в клетках врожденной и адаптивной иммунной системы, регулируют микроРНК, прежде всего, микроРНК-9, микроРНК-21, микроРНК-124, микроРНК-146a и микроРНК-155. Авторы подчеркивают, что эти микроРНК имеют перекрестные мишени в нервной и иммунной системах и обеспечивают механизмы коммуникации этих систем в норме и при патологии [Slota, Booth, 2019; Li, Lei, Sun, 2023].
В нашей работе проведена оценка различий в уровнях экспрессии пяти микроРНК: микроРНК-146а, микроРНК-124, микроРНК-21, микроРНК-9 и микроРНК-155, в лейкоцитах периферической крови детей с РАС в зависимости от тяжести состояния и степени выраженности системного воспаления, а также изучен вопрос о возможности использования показателей микроРНК в качестве биологических маркеров для диагностики РАС. Лейкоциты рассматривались нами как итог комплексного взаимодействия микроРНК–мРНК в общей совокупности клеток иммунной системы периферической крови, в определенной точке времени в условиях гомеостаза – нормотипичного развития, и системного хронического воспаления низкой степени тяжести – тяжелое течение РАС (наличие его показано нами ранее [Филиппова и др., 2022]).
В результате работы в группе детей с легким течением РАС, на фоне отсутствия различий в уровнях экспрессии микроРНК с показателями детей с нормотипичным развитием, нами выявлено наличие трех значимых корреляций слабой силы между системами микроРНК лейкоцитов и цитокинов плазмы крови. Положительное взаимодействие микроРНК-9/IFN γ может отражать обнаруженный T. Amado с соавторами эффект усиления экспрессии микроРНК-9 в Tx1 после активации инфекционными и стрессовыми стимулами, который приводит к увеличению выработки IFNγ этими клетками [Amado et al., 2015]. Отрицательная корреляция между уровнями экспрессии микроРНК-155 в лейкоцитах и концентрацией про-воспалительного цитокина – TNF α в плазме крови может быть связана с ключевой ролью микроРНК-155 в негативной регуляции сигнальных путей воспалительных иммунных ответов [Saba, Sorensen, Booth, 2014]. Объяснение положительной связи между микроРНК-124 и TNF α носит дискуссионный характер, т.к. в норме микроРНК-124 является важнейшим модулятором воспаления и врожденного иммунитета, который поддерживает противовоспалительный М2 фенотип тканевых резидентных макрофагов и переключение баланса Тх1/Tx2 в сторону Тх2 [Qin et al., 2016; Moaaz et al., 2019]. У лиц с РАС изменение экспрессии микроРНК-124 рассматривается авторами в контексте регуляции функций клеток ЦНС, т.к. она экспрессируется во всех нервных клетках всех регионов мозга, за исключением гипофиза, и регулирует синаптическую пластичность и сигнальные молекулы памяти [Han et al., 2020]. Литературные данные о роли микроРНК-124 в иммунной дисфункции при РАС нами не обнаружены. Мы предполагаем, что у детей с легкой степенью тяжести РАС, показанные нами ранее высокие концентрации ИЛ-4 в плазме крови [Филиппова и др., 2022], поддерживают экспрессию микроРНК-9, микроРНК-124, и микроРНК-155 в лейкоцитах на уровне детей с нормотипичным развитием, что приводит к отсутствию в плазме детей с легким течением РАС воспалительного профиля.
В группе детей с тяжелым течением РАС наиболее важные данные, как мы считаем, были получены для микроРНК-146а. Так, в лейкоцитах детей с тяжелым течением РАС уровни экспрессии микроРНК-146а были значимо снижены, по отношению к показателям детей с нормотипичным развитием и лиц с легким течением РАС. Кроме того, микроРНК-146 была задействована в отрицательных корреляциях с основными провоспалительными цитокинами – IFN γ и IL-6, уровни которых в плазме крови были повышены, что отражало состояние системного хронического воспаления низкой степени тяжести у детей с тяжелым течением РАС. Авторами показано [Taganov et al., 2006; Saba et al., 2014], что микроРНК-146а негативно регулирует воспалительные процессы в нейронах, микроглии, астроцитах, таким образом ограничивая воспаление внутри ЦНС, в результате активации транскрипционного фактора NF-kB. Во врожденном иммунном ответе микроРНК-146а модулирует поляризацию макрофагов в направлении М2 фенотипа через Notch1 путь [Taganov et al., 2006; Saba, Sorensen, Booth, 2014]. Особый интерес представляет отрицательная взаимосвязь микроРНК-146а/IL-6. Во-первых, транскрипция микроРНК-146а и IL-6 проходит под контролем NF- κ B, даже если обе молекулы играют антагонистическую роль в воспалительном процессе. Высказаны предположения, что при физиологических условиях ось микроРНК-146/IL-6 поддерживает функциональный баланс, но в присутствии соответствующих провоспалительных стимулов уровни IL-6 «драматически» увеличиваются, а уровни микроРНК-146а – снижаются [Olivieri et al., 2021]. Более того, нами показано, что уровень экспрессии микроРНК-146а в лейкоцитах меньше 0,0035 у.е. с чувствительностью 86.7% и специфичностью 89.6%, позволяет выделить из общей когорты детей с РАС группу детей с тяжелым течением заболевания.
Заключение
Таким образом, у детей с тяжелым течением РАС нами выявлены нарушения в системе регуляции воспаления (на уровне экспрессии микроРНК): значимое снижение уровней экспрессии важных негативных регуляторов воспаления и участников нейро-иммунных взаимодействий – микроРНК-146а и микроРНК-124. Корреляционные связи между экспрессией микроРНК в лейкоцитах и концентрациями про/провоспалительных цитокинов в плазме крови (прежде всего, отрицательные взаимодействия: мик-роРНК-146а/IL-6 и микроРНК-146а/IFN γ ), вероятно, могут отражать возможные пути, посредством которых системное хроническое воспаление низкой степени тяжести может регулировать цитокиновый потенциал лейкоцитов у детей с тяжелым течением РАС. Наконец, нами продемонстрирована связь между низкими уровнями экспрессии микроРНК-146а в лейкоцитах и тяжестью РАС. При расширении исследований уровни экспрессии микроРНК-146а в лейкоцитах периферической крови могут быть предложены как дополнительные маркеры для диагностики тяжелого течения аутизма у детей. Тем не менее, конкретные механизмы участия изученных нами микроРНК в иммунной дисфункции при РАС требуют более детального изучения, т.к., согласно данным литературы, одна микроРНК может связывать сотни различных мРНК, а единственная мРНК может выступать мишенью многих микроРНК. В результате мик-роРНК–мРНК формируют комплексные генные сети, которые регулируют различные биологические функции [Plotnikova, Baranova, Skoblov, 2019].
Список литературы Профили экспрессии микроРНК в лейкоцитах крови как маркеры тяжести расстройств аутистического спектра у детей
- Белокоскова С.Г. и др. Содержание BDNF и активность каталазы в крови детей с расстройствами аутистического спектра // Медицинский академический журнал. 2023. Т. 23, № 2. C. 119-128. doi: 10.17816/MAJ112295.
- Бурмистрова А.Л. и др. Лейкоцитарная сигнатура микроРНК в контексте хронического системного воспаления при сосудистой деменции // Российский иммунологический журнал. 2022. Т. 25, № 4. C. 399404. doi: 10.46235/1028-7221-1187-MS0.
- Филиппова Ю.Ю., Алексеева А.С., Бурмистрова А.Л. Экспрессия цитокинов лейкоцитами в ассоциации с тяжестью аутизма у детей // Российский иммунологический журнал. 2023. Т. 26, № 4. C. 593-598. doi: 10.46235/1028-7221-13911-LCE.
- Филиппова Ю.Ю. и др. Цитокины и нейротрофические факторы в оценке степени тяжести аутизма у детей // Клиническая лабораторная диагностика. 2022. Т. 67, № 11. С. 647-651.
- Amado T. et al. Cross-regulation between cytokine and microRNA pathways in T cells // European journal of immunology. 2015. Vol. 45, № 6. P. 1584-1595. DOI: 10.1002/eji.201545487.
- Bilbo S.D. Early-life programming of later-life brain and behavior: a critical role for the immune system // Frontiers in behavioral neuroscience. 2009. Vol. 3. Art. 14. DOI: 10.3389/neuro.08.014.2009.
- Brown A.S. et al. Elevated maternal c-reactive protein and autism in a national birth cohort // Molecular psychiatry. 2014. Vol. 19. P. 259-264. DOI: 10.1038/mp.2012.19.
- Eissa N. et al. Role of Neuroinflammation in Autism Spectrum Disorder and the Emergence of Brain Hista-minergic System. Lessons Also for BPSD? // Frontiers in pharmacology. 2020. Vol. 11. Art. 886. DOI: 10.3389/fphar.2020.00886.
- Follert P., Cremer H., Beclin C. MicroRNAs in brain development and function: a matter of flexibility and stability // Frontiers in molecular neuroscience. 2014. Vol. 7. 7:5. DOI: 10.3389/fnmol.2014.00005.
- Han D. et al. MiR-124 and the Underlying Therapeutic Promise of Neurodegenerative Disorders // Frontiers in pharmacology. 2020. Vol. 10. Art. 1555. DOI: 10.3389/fphar.2019.01555.
- Hu C.C. et al. Alterations in plasma cytokine levels in Chinese children with autism spectrum disorder // Autism research. 2018. Vol. 11. P. 989-999. DOI: 10.1002/aur.1940.
- Li S., Lei Z., Sun T. The role of microRNAs in neurodegenerative diseases: a review // Cell biology and toxicology. 2023. Vol. 39, № 1. P. 53-83. DOI: 10.1007/s10565-022-09761-x.
- Liu X. et al. Preeclampsia promotes autism in offspring via maternal inflammation and fetal NFkB signaling // Life science alliance. 2023. Vol. 6, № 8. Art. e202301957. DOI: 10.26508/lsa.202301957.
- Liu Y.X. et al. MiR-124-3p/B4GALT1 axis plays an important role in SOCS3-regulated growth and chemo-sensitivity of CML // Journal of hematology & oncology. 2016. Vol. 9, № 1. Art. 69. DOI: 10.1186/s13045-016-0300-3.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ДДСТ method // Methods. 2001. Vol. 25, № 4. P. 402-408. DOI: 10.1006/meth.2001.1262.
- Moaaz M. et al. Th17/Treg cells imbalance and their related cytokines (IL-17, IL-10 and TGF-P) in children with autism spectrum disorder // Journal of neuroimmunology. 2019. Vol. 337. Art. 577071. DOI: 10.1016/j.jneuroim.2019.577071.
- Olivieri F. et al. MiR-21 and miR-146a: The microRNAs of inflammaging and age-related diseases // Ageing research reviews. 2021. Vol. 70. Art. 101374. DOI: 10.1016/j.arr.2021.101374.
- Oxenkrug G. Interferon-gamma - Inducible Inflammation: Contribution to Aging and Aging-Associated Psychiatric Disorders // Aging and disease. 2011. Vol. 2, № 6. P. 474-486. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3295064/ (дата обращения: 27.03.2024)
- Plotnikova O., Baranova A., Skoblov M. Comprehensive Analysis of Human microRNA-mRNA Interac-tome // Frontiers in genetics. 2019. Vol. 10. Art. 933. DOI: 10.3389/fgene.2019.00933.
- Powdrill M.H. et al. The role of microRNAs in metabolic interactions between viruses and their hosts // Current opinion in virology. 2016. Vol. 19. P. 71-76. DOI: 10.1016/j.coviro.2016.07.005.
- Qin Z. et al. MiRNA-124 in Immune System and Immune Disorders // Frontiers in immunology. 2016. Vol. 7. Art. 406. DOI: 10.3389/fimmu.2016.00406.
- Saba R., Sorensen D.L., Booth S.A. MicroRNA-146a: A Dominant, Negative Regulator of the Innate Immune Response // Frontiers in immunology. 2014. Vol. 5. Art. 578. DOI: 10.3389/fimmu.2014.00578.
- Slota J.A., Booth S.A. MicroRNAs in neuroinflammation: implications in disease pathogenesis, biomarker discovery and therapeutic applications // Noncoding RNA. 2019. Vol. 5, № 2. Art. 35. DOI: 10.3390/ncrna5020035.
- Soreq H., Wolf Y. NeurimmiRs: microRNAs in the neuroimmune interface // Trends in molecular medicine. 2011. Vol. 17, № 10. P. 548-555. DOI: 10.1016/j.molmed.2011.06.009.
- Taganov K.D. et al. NF-kB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses // Proceedings of the National Academy of Sciences of the United States of America. 2006. Vol. 103, № 33. P. 12481-12486. DOI: 10.1073/pnas.0605298103.
- Tavakolian S. et al. Evaluation of microRNA-9 and -192 expression levels as biomarkers in patients suffering from breast cancer // Biomedical reports. 2020. Vol. 12, № 1, P. 30-34. DOI: 10.3892/br.2019.1257.
- Xu X.M. et al. Expression of miR-21, miR-31, miR-96 and miR-135b is correlated with the clinical parameters of colorectal cancer // Oncology letters. 2012. Vol. 4, № 2. P. 339-345. DOI: 10.3892/ol.2012.714.
- Yang L.H. et al. Universal stem-loop primer method for screening and quantification of microRNA // PLoS One. 2014. Vol. 9, № 12. Art. e115293. DOI: 10.1371/journal.pone.0115293.
- Zhang R.X. et al. Both plasma and tumor tissue miR-146a high expression correlates with prolonged overall survival of surgical patients with intrahepatic cholangiocarcinoma // Medicine (Baltimore). 2017. Vol. 96, № 44. Art. e8267. DOI: 10.1097/MD.0000000000008267.


