Прогностическая и предиктивная значимость динамики изменения индекса пролиферации Ki67 в модели предоперационной гормонотерапии больных раком молочной железы
Автор: Родионова Мария Валерьевна, Воротников Игорь Константинович, Родионов Валерий Витальевич, Дудко Евгений Александрович, Чхиквадзе Нино Валерьяновна, Кометова Влада Владимировна, Рябчиков Денис Анатольевич, Ошкина Елена Викторовна, Ожерельев Александр Святославович, Богуш Татьяна Анатольевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
В современном здравоохранении прослеживается четкая тенденция в сторону улучшения ранней диагностики рака молочной железы, что позволяет выявлять пациентов с крайне низким риском рецидива заболевания, которым обоснованно можно не проводить адъювантную химиотерапию. В связи с этим возникла необходимость проведения исследований, направленных на поиск биологических маркеров неблагоприятного прогноза в группе больных гормонозависимым раком молочной железы. для широкого внедрения в клиническую практику данные маркеры должны быть валидированы в хорошо спланированных клинических исследованиях, предоставлять дополнительную предиктивную информацию и быть легко воспроизводимыми. В качестве таких маркеров могут выступать стандартные иммуногистохимические показатели: рецепторы эстрогенов и прогестерона, индекс пролиферации Ki67. Однако для индивидуализации гормонотерапии имеет большее значение не исходный уровень их экспрессии в опухоли, а динамика изменения в процессе тестовой гормонотерапии.
Рак молочной железы, гормонотерапия, гормоночувствительность
Короткий адрес: https://sciup.org/14056569
IDR: 14056569 | УДК: 618.19-006.66-08-07-037:615.357:577.2
Текст обзорной статьи Прогностическая и предиктивная значимость динамики изменения индекса пролиферации Ki67 в модели предоперационной гормонотерапии больных раком молочной железы
Внедрение в клиническую практику адъювантной терапии рака молочной железы (РМЖ) привело к существенному снижению смертности от этой опухоли [17]. Выбор метода адъювантной терапии, в соответствии с современными стандартами, основывается на знании молекулярно-биологического портрета опухоли. Эстрогеновые рецепторы альфа (ЭР), рецепторы прогестерона (ПР), рецептор эпидермального роста Her2 в настоящее время являются общепризнанными прогностическими факторами риска развития отрицательного события (рецидив заболевания, смерть) и маркерами, предсказывающими чувствительность или резистентность опухоли к конкретной терапии.
Одновременно ведется поиск новых прогностических и предиктивных маркеров. В частности, отличительной чертой опухолевых клеток является их способность к постоянному делению [13]. Наиболее распространенным способом измерения степени пролиферации является иммуногистохимическое определение негистонного нуклеопротеина Ki67. Его точная функция в настоящее время достоверно не определена, хотя считается, что он связан с синтезом рибосомальной РНК [2, 16]. Наблюдение, что Ki67 присутствует только в пролиферирующих клетках, привело к тому, что данный маркер был одобрен для оценки доли пролиферирующих клеток в опухоли. В 2013 г. панелью экспертов St Gallen International Breast Cancer Conference было рекомендовано использование в клинической практике порогового значения Ki67 – 20 % для разграничения опухолей с высокой и низкой пролиферативной активностью. Одновременно было предложено деление гормон-рецептор позитивных люминальных опухолей на два подтипа: подтип А (Ki67<20 %) и подтип В (Ki67≥20 %) [12].
Роль неоадъювантных клинических исследований в оценке чувствительности опухоли к системной терапии
Проведение неоадъювантной системной терапии не только делает возможным выполнение операции в случае местнораспространенного РМЖ и уменьшение объема хирургического вмешательства в случае первично-операбельного РМЖ, но и позволяет in vivo оценить чувствительность опухоли к проводимой системной терапии. Отсутствие опухолевых клеток в гистологических препаратах у пациенток, получивших неоадъювантную системную терапию, описывается как полный
лечебный патоморфоз и является независимым маркером более высоких отдаленных результатов лечения [10, 20]. Неоадъювантный дизайн клинических исследований по изучению эффективности лекарственных средств, основанный на анализе частоты полного лечебного патоморфоза, был одобрен как метод, требующий меньшего количества пациентов и более коротких сроков наблюдения по сравнению с адъювантным. Однако полный лечебный патоморфоз в результате проводимой неоадъювантной химиотерапии, особенно в группе опухолей с высокой экспрессией ЭР, достигается достаточно редко, что приводит к затруднению интерпретации полученных результатов. Полный лечебный патоморфоз является редким явлением и в случае неоадъювантной эндокринотерапии РМЖ, несмотря на доказанную прогностическую и предиктивную значимость высокого уровня экспрессии ЭР и ПР в опухоли. В литературе описаны редкие случаи полного лечебного патоморфоза ЭР-позитивного РМЖ на фоне предоперационной эндокринотерапии: 0–2 % случаев – после приема тамоксифена в течение 4 мес, 2 % – после 3-месячного приема летрозола, 3 % – после 3-месячного приема анастрозола и 5–7 % – после 3–6 мес терапии экземестаном [7, 8, 11, 18, 19]. Результаты рандомизированного исследования В.Ф. Семиглазова и др., включавшего 121 больную местнораспространенным ЭР-позитивным РМЖ в постменопаузе, показали сопоставимую частоту полного лечебного патоморфоза в группах неоадъювантной химиотерапии (4 курса АТ) и 3-месячной гормонотерапии (анастрозол или эксеземестан) – 7 и 5 % соответственно [19].
В настоящее время ведется активный поиск новых биологических маркеров в первичной и резидуальной опухолях, способных не только прогнозировать отдаленные результаты лечения, но и ускорить разработку и внедрение новых лекарственных средств в группе пациенток высокого риска.
Предиктивная и прогностическая роль динамического мониторинга молекулярных маркеров в оценке гормоночувствительности опухоли
Впервые попытка оценить чувствительность опухоли к неоадъювантной гормонотерапии с использованием индекса пролиферации Ki67 была предпринята М. Dowsett et al. в 1998 г. [15]. В пилотное исследование были включены пациентки (n=21) первично-операбельным РМЖ, у которых иммуноцитохимически в материале аспирационной биопсии определяли исходные показатели экспрессии ЭР, ПР и Ki67, а также методом проточной цитофлуориметрии – плоидность и фракцию клеток в S-фазе (SPF). Повторное аналогичное исследование проводилось через 14 дней и 8 нед после ежедневного приема тамоксифена в дозе 20 мг/ сут. Объективный ответ оценивался клинически с использованием критериев UICC. Двенадцать пациенток ответили на лечение (в 2 случаях был зарегистрирован полный ответ, в 10 – частичный), у 7 больных наблюдалось прогрессирование заболевания. Клинический ответ был зарегистрирован преимущественно у пациенток с положительным статусом ЭР (р=0,002), ПР (р=0,006) и низкой фракцией SPF (р=0,06). После 14 дней приема тамоксифена в группе пациенток, ответивших на терапию, показатель Ki67 (процент окрашенных клеток) снизился в среднем в 4,8 раза, а в группе не ответивших на терапию средний показатель остался практически без изменения (р=0,005). В то же время статистически достоверного изменения SPF зарегистрировано не было. Снижение уровня ЭР относительно исходного значения было отмечено у 3 из 15 пациенток, причем все они ответили на лечение. Повышение экспрессии ПР наблюдалось у 7 из 17 пациенток, у 6 из которых наблюдался объективный ответ. Похожие изменения уровней экспрессии ЭР и ПР были получены и через 8 нед приема тамоксифена, однако снижение Ki67 и SPF в этом временном интервале не коррелировало с клиническим ответом. Авторами был сделан вывод, что снижение Ki67 и уровня экспрессии ЭР, а также повышение экспрессии ПР на фоне краткосрочного приема тамоксифена могут прогнозировать терапевтический ответ на гормонотерапию.
В 2000 г. опубликованы результаты исследования аналогичного дизайна, в котором у 54 больных РМЖ изменение маркеров оценивалось на 14-й день, 60-й день или на 14-й и 60-й дни [4]. Результаты однофакторного анализа показали, что исходные уровни ЭР и ПР являются достоверными предиктивными факторами ответа на гормонотерапию (р<0,0001 и р<0,003 соответственно). Повышение уровня экспрессия ПР и снижение Ki67 через 2 нед приема тамоксифена достоверно свидетельствовали о чувствительности опухоли к гормонотерапии (р<0,03 и р<0,04 соответственно). Напротив, отсутствие эстрогеновых рецепторов, наличие метастатических лимфоузлов и отсутствие снижения Ki67 после 14 дней приёма тамоксифена достоверно коррелировали с повышенным риском рецидивирования (р<0,05). В данном исследовании хирургическое лечение пациенткам не проводилось из-за наличия сопутствующей патологии или преклонного возраста, а безрецидивный период оценивался от начала лечения до появления отдаленных метастазов.
Попытка оценить информативность динамики изменения Ki67 относительно исходного уровня в прогнозировании клинического ответа и в оценке эффективности гормонотерапии была предпринята в крупном мультицентровом двойном слепом рандомизированном исследовании IMPACT [7]. В исследование вошло 330 постменопаузальных пациенток с первично-операбельным или местнораспространенным условно-операбельным
ЭР-положительным РМЖ. Пациентки были рандомизированы в группы терапии тамоксифеном 20 мг/сут, аримидексом 1 мг/сут и комбинации этих препаратов в равной пропорции. Иммуногистохимическое определение ЭР, ПР, Her2 и Ki67 проводилось в материале кор-биопсии до начала лечения и через 2 нед, а также в операционном материале через 12 нед терапии. Окончательно в анализируемую группу были включены 259 пациенток. Во всех группах показано статистически достоверное снижение Ki67 после 2 и 12 нед лечения. Причем снижение было достоверно выше в группе анастразола в сравнении с группой тамоксифена (р=0,004, р=0,001 соответственно), в то время как между группами тамоксифена и комбинации тамоксифена и анастразола достоверных различий получено не было (р=0,6, р=0,912). Авторами была предпринята попытка оценить чувствительность опухолей различных люминальных подтипов к проводимой гормонотерапии. За исключением группы комбинированного приема препаратов снижение Ki67 на 2-й и 12-й нед наблюдения было достоверно бóльшим в случае ПР-положительного статуса опухоли.
В процессе гормонотерапии изменялся и рецепторный статус опухолей. На 12-й нед отмечалось снижение уровня экспрессии ЭР как в группе тамоксифена, так и в группе анастрозола (р<0,05). В группе анастрозола также было отмечено значимое снижение экспрессии ПР на 2-й и на 12-й нед наблюдения – в 41 и 82 % случаев соответственно. В то же время в группе тамоксифена уровень экспрессии ПР повышался в 48 % случаев на 2-й нед лечения, а к 12-й нед практически возвращался к исходным значениям.
Кроме того, в работе была выявлена статистически значимая корреляция между снижением уровня Ki67 и увеличением экспрессии ПР в группе тамоксифена, однако в группе анастрозола достоверной взаимосвязи получено не было. Отмеченное повышение уровня ПР в группе тамоксифена контрастирует со значительным подавлением экспрессии данных рецепторов в группе анастрозола. Однако разнонаправленное изменение уровня ПР в обеих группах прямо и статистически значимо коррелирует с подавлением пролиферативной активности опухоли. Снижение уровня экспрессии ПР на фоне приема анасторозла говорит об эффективности депривации эстрогенов вследствие зависимости ПР от эстрогенов. А повышение уровня ПР в группе тамоксифена является индикатором агонистического эффекта на его ген, что также является индикатором биологической чувствительности опухоли. Феномен раннего повышения уровня экспрессии ПР и повышенной чувствительности данных опухолевых клеток к гормонотерапии был описан А. Howel et al. еще в 1987 г. [14].
Снижение Ki67 относительно исходного уровня отмечено на 2-й (75,3 vs 61,7 %) и на 12-й нед
(73,2 vs 67,3 %) терапии в группах анастрозола и тамоксифена. Обращает на себя внимание тот факт, что эти изменения были более выражены в группе пациенток, у которых регистрировался объективный ответ. Вместе с тем только в группе тамоксифена снижение Ki67 в группе пациенток с объективным ответом было статистически значимым (р=0,013).
При сравнительном анализе результатов неоадъювантной гормональной терапии РМЖ в исследовании IMPACT с данными эффективности адъювантной гормональной терапии в исследовании АТАС выявляются следующие закономерности: в первом случае критерием эффективности терапии были объективный ответ и динамика изменения молекулярных маркеров, во втором – показатель безрецидивной выживаемости. При медиане наблюдения 100 мес в исследовании АТАС, включавшем 9 366 ЭР-позитивных пациенток в постменопаузе, показано увеличение безрецидивной выживаемости на 27 % в группе анастрозола по сравнению с группой тамоксифена [1]. Характер изменения уровня Ki67 в исследовании IMPACT как через 2 нед, так и через 12 нед приема препаратов гормонотерапии зеркально коррелировал с показателями безрецидивной выживаемости в исследовании АТАС. Таким образом, краткосрочные пилотные исследования с оценкой молекулярных опухолевых маркеров в динамике могут быть рекомендованы для обоснования проведения в дальнейшем крупномасштабных дорогостоящих исследований. Тем не менее невозможно полностью отказаться от рандомизированных исследований III фазы, так как только результаты исследования АТАС не выявили статистически достоверных различий в эффективности тамоксифена и анастразола по показателю общей выживаемости при сроке наблюдения 100 мес (р=0,7) [1].
Ki67 как маркер первичной и приобретенной резистентности
В отличие от стандартных адъювантных исследований, оценивающих отдаленные показатели выживаемости, неоадъювантная модель с оценкой молекулярных опухолевых маркеров в качестве предиктивных факторов позволяет выявить резистентность опухоли к гормонотерапии уже на ранних этапах лечения. В рассмотренном выше исследовании IMPACT в группе анастрозола у 52/56 пациенток с ЭР-положительным РМЖ после двухнедельного приема препарата отмечалось снижение пролиферации опухолевых клеток, что свидетельствовало о том, что терапия ингибиторами ароматазы в подавляющем числе случаев оказалась эффективной. Однако характер динамических изменений показателей Ki67 в период от 2 до 12 нед терапии существенно различался внутри этой группы пациенток (рис. 1А). У большинства из них (85 %) снижение показателя Ki67, отмечен- ное спустя 2 нед после начала терапии, нарастало вплоть до 12-й нед на фоне продолжившейся неоадъювантной терапии. У 15 % больных, напротив, к 12-й нед от начала лечения снижение Ki67 останавливалось, а в некоторых случаях был отмечен рост маркера, что может являться биологическим свидетельством ранней приобретенной резистентности к проводимой терапии. Это теоретическое предположение было подтверждено клиническими данными: безрецидивная выживаемость пациенток с приобретенной резистентностью не отличалась от таковой у пациенток с резистентностью de novo и была достоверно ниже по сравнению с группой больных, у которых наблюдалось длительное стойкое снижение Ki67 (рис. 1Б) [5]. Таким образом, динамическая оценка пролиферативной активности опухоли делает возможным использование биомаркеров в исследованиях таргетных препаратов по преодолению приобретенной опухолью гормонорезистентности.
Ki67 в составе прогностических моделей
Номограмма представляет собой прогностический алгоритм, позволяющий оценить вероятность определенного исхода индивидуально для каждого конкретного пациента, используя набор определенных «входных» данных (например, размер узла, гормональный статус опухоли и т. п.). Не вызывает сомнений тот факт, что прогнозирование на основе сочетания нескольких прогностических параметров дает более точный результат, нежели прогнозирование, использующее только 1 маркер [21].
Точное определение риска рецидивирования у пациенток, получающих гормонотерапию, позволяет обоснованно отказаться от проведения токсичной химиотерапии в группе пациенток низкого риска. Разработано несколько прогностических мультигенных сигнатур, показывающих преимущество дополнительного проведения химиотерапии у больных ЭР-позитивным раком молочной железы групп низкого и среднего риска (Oncotype DX, Mammaprint). Однако это дорогостоящие методики, применение которых не всегда обосновано. Традиционные иммуногистохимические маркеры часто обладают достаточной прогностической и предиктивной информативностью. Номограмма IHC4 объединила иммуногистохимические параметры (ЭР, ПР, Ki67 и Her2) и клиникоморфологические параметры (размер опухолевого узла, количество пораженных лимфоузлов, степень злокачественности, возраст пациентки) в математический индекс, позволяющий прогнозировать агрессивность заболевания у ЭР-позитивных пациенток, получающих эндокринотерапию. Данная номограмма была валидирована в исследовании TransАТАС в когорте 1 125 пациенток, и ее про-
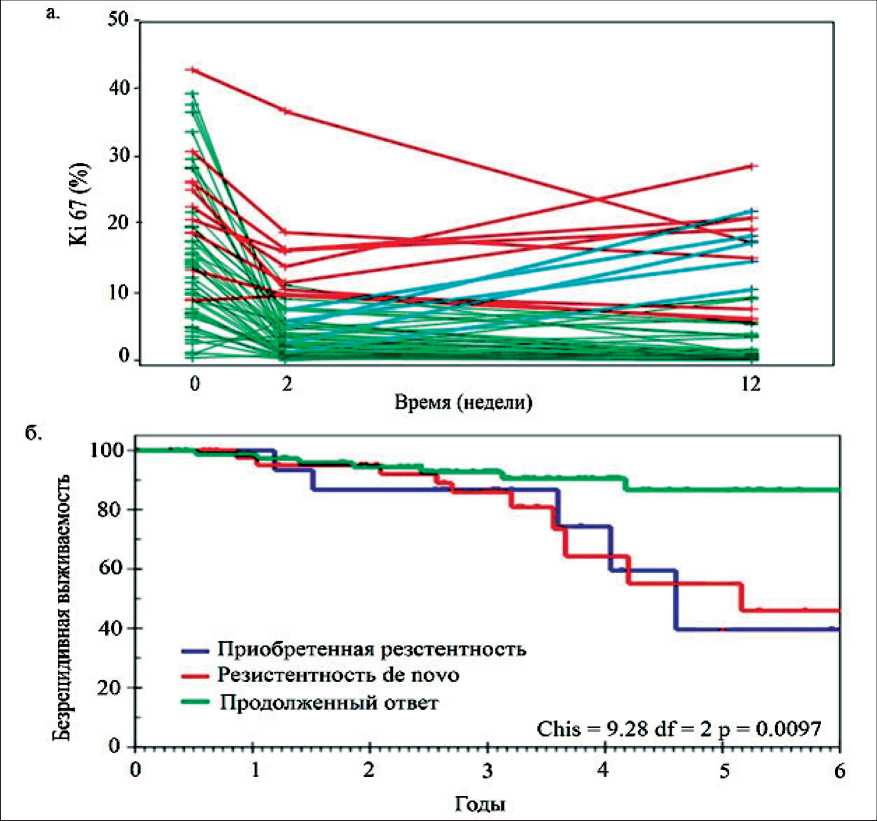
Рис. 1. А. Изменение маркера пролиферации Ki67 на фоне 12-недельной терапии анастрозолом; Б. Безрецидивная выживаемость пациенток ЭР-положительным раком молочной железы, получавших анастрозол, тамоксифен или их комбинацию в течение 12 нед (резистентность de novo – снижение Ki67<50 % за 2 нед терапии; приобретенная резистентность – снижение Ki67>50 % за 2 нед терапии, и ≤50 % снижение со 2-й по 12-ю нед терапии; продолженный ответ – снижение Ki67>50 % за 2 нед терапии и >50 % со 2-й по 12-ю нед терапии). Модифицировано из статьи M. Dowsett et al., 2011 [4]
гностическая информативность не отличалась от таковой для Oncotype DX [4].
Предоперационный прогностический индекс PEPI был предложен в качестве номограммы, позволяющей оценить отдаленные результаты лечения больных РМЖ, в рамках исследования IMPACT. Индекс PEPI включает морфологические и молекулярные характеристики опухоли: статус ЭР, размер опухолевого узла, статус регионарных лимфоузлов, уровень Ki67 [9]. Авторами было показано, что после проведения в течение 12 нед неоадъювантной эндокринотерапии можно выделить группу пациенток чрезвычайно низкого риска рецидива, для которой является достаточным проведение только гормонотерапии, а также группу пациенток с высоким индексом PEPI, в которой не- обходимо дополнительно провести адъювантную химиотерапию. Таким образом, показатели Ki67 и динамика их изменения в ходе неоадъювантной гормональной терапии являются важным ориентиром в выборе тактики дальнейшего лекарственного лечения РМЖ.
Список литературы Прогностическая и предиктивная значимость динамики изменения индекса пролиферации Ki67 в модели предоперационной гормонотерапии больных раком молочной железы
- Arimidex, Tamoxifen, Alone or in Combination (ATAC) Trialists’Group, Forbes J.F., Cuzick J., Buzdar A., Howell A., Tobias J.S., Baum M. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 100-month analysis of the ATAC trial//Lancet Oncol. 2008. Vol. 9 (1). P. 45-53
- Bullwinkel J., Baron-Lühr B., Lüdemann A., Wohlenberg C., Gerdes J., Scholzen T. Ki-67 protein is associated with ribosomal RNA transcription in quiescent and proliferating cells//J. Cell Physiol. 2006. Vol. 206 (3). P. 624-635
- Chang J., Powles T.J., Allred D.C., Ashley S.E., Makris A., Gregory R.K., Osborne C.K., Dowsett M. Prediction of clinical outcome from primary tamoxifen by expression of biologic markers in breast cancer patients//Clin. Cancer Res. 2000. Vol. 6 (2). P. 616-621
- Cuzick J., Dowsett M., Pineda S., Wale C., Salter J., Quinn E., Zabaglo L., Mallon E., Green A.R., Ellis I.O., Howell A., Buzdar A.U., Forbes J.F. Prognostic value of a combined estrogen receptor, progesterone receptor, Ki-67, and human epidermal growth factor receptor 2 immunohistochemical score and comparison with the Genomic Health recurrence score in early breast cancer//J. Clin. Oncol. 2011. Vol. 29 (32). P. 4273-4278 DOI: 10.1200/JCO.2010.31.2835
- Dowsett M., Smith I., Robertson J., Robison L., Pinhel I., Johnson L., Salter J., Dunbier A., Anderson H., Ghazoui Z., Skene T., Evans A., A’Hern R., Iskender A., Wilcox M., Bliss J. Endocrine Therapy, New Biologicals, and New Study Designs for Presurgical Studies in Breast Cancer//J. Natl. Cancer Inst. Monogr. 2011. Vol. 2011 (43). P. 120-123 DOI: 10.1093/jncimonographs/lgr034
- Dowsett M., Smith I.E., Ebbs S.R., Dixon J.M., Skene A., Griffith C., Boeddinghaus I., Salter J., Detre S., Hills M., Ashley S., Francis S., Walsh G.; IMPACT Trialists. Short-term changes in Ki-67 during neoadjuvant treatment of primary breast cancer with anastrozole or tamoxifen alone or combined correlate with recurrence-free survival//Clin. Cancer Res. 2005. Vol. 11 (2 Pt 2). 951s-958s
- Eiermann W., Paepke S., Appfelstaedt J., Llombart-Cussac A., Eremin J., Vinholes J., Mauriac L., Ellis M., Lassus M., Chaudri-Ross H.A., Dugan M., Borgs M.; Letrozole Neo-Adjuvant Breast Cancer Study Group.Preoperative treatment of postmenopausal breast cancer patients with letrozole: A randomized double-blind multicenter study//Ann. Oncol. 2001. Vol. 12 (11). P. 1527-1532
- Ellis M.J., Coop A., Singh B., Mauriac L., Llombert-Cussac A., Jänicke F., Miller W.R., Evans D.B., Dugan M., Brady C., Quebe-Fehling E., Borgs M. Letrozole is more effective neoadjuvant endocrine chemotherapy than tamoxifen for ErbB-1-and/or ErbB-2-positive, estrogen receptor-positive primary breast cancer: evidence from a phase III randomized trial//J. Clin. Oncol. 2001. Vol. 19 (18). P. 3808-3816
- Ellis M.J., Tao Y., Luo J., A’Hern R., Evans D.B., Bhatnagar A.S., Chaudri Ross H.A., von Kameke A., Miller W.R., Smith I., Eiermann W., Dowsett M. Outcome prediction for estrogen receptor-positive breast cancer based on postneoadjuvant endocrine therapy tumor characteristics//J. Natl. Cancer Inst. 2008. Vol. 100 (19). P. 1380-1388. doi: 10.1093/jnci/djn309
- Fayanju O.M., Nwaogu I., Jeffe D.B., Margenthaler J.A. Pathological complete response in breast cancer patients following neoadjuvant chemotherapy at a Comprehensive Cancer Center: The natural history of elusive prognosticator//Mol. Clin. Oncol. 2015. Vol. 3. P. 775-780
- Gil M.J., Barnadas A., Cirera L., Tusquets I., Muñoz M., Arcusa A., Prieto L., Moreno A., Graupera J., Margeli M. Primary hormonal therapy with exemestane in patients with breast tumors >3 cm in diameter: Results of a Spanish multicenter phase II trial//J. Clin. Oncol. 2004. Vol. 22 (14S). P. 603
- Goldhirsch A., Winer E.P., Coates A.S., Gelber R.D., Piccart-Gebhart M., Thürlimann B., Senn H.J.; Panel members. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013//Ann. Oncol. 2013. Vol. 24 9. P. 2206-2223 DOI: 10.1093/annonc/mdt303
- Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation//Cell. 2011. Vol. 144 (5). P. 646-674. doi: 10.1016/j. Cell.2011.02.013
- Howell A., Harland R.N., Barnes D.M., Baildam A.D., Wilkinson M.J., Hayward E., Swindell R., Sellwood R.A. Endocrine therapy for advanced carcinoma of the breast: relationship between the effect of tamoxifen upon concentrations of progesterone receptor and subsequent response to treatment//Cancer Res. 1987. Vol. 47 (1). P. 300-304
- Makris A., Powles T., Allred D.C., Ashley S., Ormerod M.G., Titley J.C., Dowsett M. Changes in hormone receptors and proliferation markers in tamoxifen treated breast cancer patients and the relationship with response//Breast Cancer Res. Treat. 1998. Vol. 48 (1). P. 11-20
- Romero Q., Bendahl P.-O., Ferno M., Grabau D., Borgquist S. A novel model for Ki67 assessment in breast cancer//Diagnostic pathology. 2014. Vol. 9. P. 118 DOI: 10.1186/1746-1596-9-118
- Rossi L., Stevens D., Pierga J., Lerebours F., Reyal F., Robain M., Asselain B., Rouzier R. Impact of Adjuvant Chemotherapy on Breast Cancer Survival: A Real-World Population//PloS. One. 2015. Vol. 10 (7): e0132853 DOI: 10.1371/journal.pone.0132853
- Sachelarie I., Grossbard M.L., Chadha M., Feldman S., Ghesani M., Blum R.H. Primary Systemic Therapy of Breast Cancer//The Oncologist. 2006. Vol. 11 (6). P. 574-589
- Semiglazov V.F., Semiglazov V.V., Ivanov V.G., Bozhok A., Ziltzova E.K., Paltuev R.M., Dashian G.A., Kletzel A., Topuzov E.E., Berstein L. The relative efficacy of neoadjuvant endocrine therapy versus chemotherapy in postmenopausal women with ER-positive breast cancer//J. Clin. Oncol. 2004. Vol. 22 (14S). P. 519
- Von Minckwitz G., Untch M., Blohmer J.U., Costa S.D., Eidtmann H., Fasching P.A., Gerber B., Eiermann W., Hilfrich J., Huober J., Jackisch C., Kaufmann M., Konecny G.E., Denkert C., Nekljudova V., Mehta K., Loibl S. Definition and Impact of Pathologic Complete Response on Prognosis After Neoadjuvant Chemotherapy in Various Intrinsic Breast Cancer Subtypes//J. Clin. Oncol. 2012. Vol. 30 (15). P. 1796-1804 DOI: 10.1200/JCO.2011.38.8595
- Witteveen A., Vliegen I.M., Sonke G.S., Klaase J.M., IJzerman M.J., Siesling S. Personalisation of breast cancer follow-up: a time-dependent prognostic nomogram for the estimation of annual risk of locoregional recurrence in early breast cancer patients//Breast Cancer Res. Treat. 2015. Vol. 152 (3). P. 627-636 DOI: 10.1007/s10549-015-3490-4


