Прогностическая роль белков PD-l1 и P53 при плоскоклеточной карциноме ротоглотки в зависимости от статуса вируса папилломы человека
Автор: Полатова Д.Ш., Гильдиева М.С., Мадаминов А.Ю., Савкин А.В., Скляров Д.С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Введение: Рост случаев ВПЧ-ассоциированной плоскоклеточной карциномы ротоглотки (ПККР), а также появление у 20-25% пациентов с ВПЧ + ПККР рецидивов в течение 3 лет вызвало интерес к исследованию ВПЧ статуса таких больных. Это стало мощным стимулом широкого использования биомаркеров. В связи с этим для выявления пациентов с высоким риском рецидива и смерти необходимо использование различных прогностических маркеров.Методы: В исследование были включены 62 пациента с ПККР T1-4N0-3M0 (7-е издание, AJCC), пролеченных в 2015-2020 годах в Республиканском специализированном научно-практическом медицинском центре онкологии и радиологии и в Ташкентском и Самаркандском городских филиалах. Было изучено прогностическое значение белков PD-L1 и p53 при ПККР с учетом ВПЧ статуса. Кроме того, была проанализирована взаимосвязь между PD-L1, р53 и статусом ВПЧ, а также влияние их на выживаемость пациентов с ПККР.Результаты: Положительный ВПЧ статус вместе с высокой экспрессией PD-L1 незначительно улучшают показатели общей выживаемости пациентов по сравнению с отсутствием ВПЧ (p = 0,261). Мутантный тип белка р53 имеет отрицательную корреляцию с ВПЧ статусом и снижает время дожития (p р53 встречается у небольшого числа больных, он демонстрирует положительную корреляцию со статусом ВПЧ и является предиктором, снижающим риск смерти (p = 0,01).Заключение: Положительный ВПЧ статус не всегда является надежным предиктором при стратификации риска развития опухоли для больных ПККР, поскольку для повышения ценности прогностических предикторов кроме ВПЧ статуса необходимо идентифицировать дополнительные факторы, взаимосвязанные с развитием ПККР.
Плоскоклеточная карцинома ротоглотки, вирус папилломы человека, экспрессия белка, р16 ink4a, pd-l1, р53
Короткий адрес: https://sciup.org/140303407
IDR: 140303407 | DOI: 10.18027/2224-5057-2023-13-3-11-19
Текст научной статьи Прогностическая роль белков PD-l1 и P53 при плоскоклеточной карциноме ротоглотки в зависимости от статуса вируса папилломы человека
Несмотря на цифровизацию и технологическое развитие медицины, наряду с изменениями окружающей среды, старением населения и изменением образа жизни человека, наблюдается резкий рост некоторых видов рака. Согласно классификации Международного агентства по изучению рака одним из наиболее распространенных факторов, вызывающих рак, является вирус папилломы человека (ВПЧ) высокого риска [1]. ВПЧ высокого риска привел к резкому росту заболеваемости плоскоклеточной карциномы ротоглотки (ПККР) в последние десятилетия XX века [2,3]. В глобальном масштабе частота встречаемости больных с ВПЧ ассоциированным ПККР (ВПЧ + ПККР) в 2021 году составляла около 33%, однако распространенность данной патологии значительно варьирует в зави- симости от географического региона, с оценками от 0% на юге Индии до 85% в Ливане [4]. По заболеваемости раком ротоглотки Республика Узбекистан занимает 7-е место среди стран Азии, стандартизованные по возрасту показатели на 100 тыс. населения по мировому стандарту составляют 0,92, а смертность 0,60 соответственно [5]. Разработанные вакцины являются профилактическими и не могут защитить очень большое количество людей от канцерогенного вируса, в том случае если многие уже инфицированы или находятся в группе риска серьезного заболевания. Однако, несмотря на наличие вакцин против наиболее распространенных типов ВПЧ, бремя опухолей, связанных с этим вирусом, все еще далеко от устойчивого снижения [6].
Согласно данным ряда авторов, 75–80% пациентов с ВПЧ + ПККР живут в течении пяти лет после постановки диагноза, большинство пациентов с ВПЧ отрицательным ПККР (ВПЧ- ПККР) имеют плохой прогноз, и только меньше 50% пациентов доживают до этого срока [7].
В то время, когда растет число случаев заболевания и наблюдаются положительные исходы болезни у пациентов с ВПЧ + ПККР, выявление статуса ВПЧ стало мощным и широко используемым маркером [8,9]. Кроме того, у почти 25% пациентов ВПЧ + ПККР обнаруживаются рецидивы в течение 3 лет с экспансией невосприимчивого клона опухолевых клеток к лечению [10]. Наиболее существенным препятствием для выявления пациентов с высоким риском рецидива и смерти является отсутствие клинически используемых прогностических маркеров.
Целью нашего исследования явилось изучение молекулярно-клинических особенностей плоскоклеточной карциномы ротоглотки с помощью иммуногистохимической оценки экспрессии белков PD-L1 1 и р53 в зависимости от наличия косвенного биомаркера — вируса папилломы человека р16 INK4A — и влияния идентифицированных белков на клиническое течение и прогноз болезни.
МЕТОДЫ
В наше ретроспективное исследование вошли 62 пациента с ПККР T1–4N0–3M0 (7-е издание Американского объединенного комитета по раку, AJCC), пролеченных в 2015–2020 годах в Республиканском специализированном научно-практическом медицинском центре онкологии и радиологии и его филиалах, расположенных в двух крупных городах Узбекистана (Ташкент и Самарканд). Первоначально были проанализированы данные 114 пациентов с гистологическим подтверждением ПККР. Из этих пациентов для дальнейшего более глубокого анализа были отобраны 62 пациента имеющих архивный гистологический материал, соответствующий требованиям иммуногистохимии и критериям исследования.
Критериями включения в исследование являлись гистологически подтвержденная плоскоклеточная карцинома, опухоли, располагающиеся только в ротоглотке (небная миндалина, основание языка, мягкое небо, боковая стенка, задняя стенка), отсутствие отдаленных метастазов при установлении диагноза, пациенты, получившие противоопухолевую терапию и пациенты старше 18 лет.
Была создана база данных всех собранных случаев ПККР с использованием ведомственных реестров рака и медицинских карт пациентов в соответствии с методологическими требованиями.
Исследование было одобрено протокольным решением научного Совета учреждения, поскольку архивный опухолевой материал использовался для иммуногистохимического анализа в соответствии с местными этическими требованиями.
Всем ретроспективно отобранным пациентам (n = 62) был проведен ИГХ анализ на наличие белка p16 INK4a , PD-L1 и р53 в образцах опухолевой ткани, фиксированных формалином и залитых в парафин (ФФЗП).
В настоящем исследовании ИГХ анализ белка р16 INK4a был единственным тестом для установления статуса ВПЧ у пациентов с ПККР, который интерпретировался в соответствии с рекомендациями Коллегии американских патологоанатомов [11]. Отсутствие или локальное окрашивание белка р16 INK4a , а также наличие < 70% окрашенных опухолевых клеток в образцах считали ВПЧ-отрицательными, если ≥ 70% опухолевых клеток демонстрировали сильное и диффузное ядерное и цитоплазматическое окрашивание, то они считались ВПЧ-положительными. Для определения повышенной экспрессии белка p16 INK4a был использован ИГХ тест CINtec® Histology в соответствии с инструкциями производителя (Ventana Medical Systems, Inc.), содержащий первичные моноклональные мышиные антитела клона E6H4, которые оптимально подходят для использования в системе Ventana BenchMark в сочетании с комплектом OptiView DAB IHC Detection Kit. Однако наличие повышенной экспрессии p16 INK4a само по себе не может быть надежным предиктором при ПККР. Поэтому с целью выявления дополнительных предикторов, влияющих на исход ПККР, оценивали интенсивность экспрессии белков PD-L1 и p53 с учетом ВПЧ статуса, которые также участвуют в канцерогенной трансформации и дальнейшем прогрессирования ПККР.
Экспрессию PD-L1 оценивали с использованием кроличьих моноклональных антител клона SP263 (Ventana Medical Systems, Inc.) на автоматическом иммуногистостейнере Ventana BenchMark по стандартным протоколам в образцах ФФЗП. Уровень экспрессии PD-L1 оценивали по доле положительно окрашенных опухолевых клеток (TPS, tumor proportion score), демонстрирующих частичное линейное или полное круговое окрашивание мембраны. Результаты ИГХ анализа PD-L1 оценивали, как положительные, если окрашенные опухолевые клетки составляли ТPS ≥ 1%. В соответствии с количествами окрашенных опухолевых клеток уровень белка PD-L1 классифицирован как отрицательный — TPS 0–0,9% (PD-L1-О), низкий — ТPS 1–9% (PD-L1-Н), средний — ТPS 10–29% (PD-L1-С), высокий — ТPS 30–49% (PD-L1-В) и очень высокий -ТPS ≥ 50% (PD-L1-ОВ). При определении экспрессии белка р53 в опухолевых образцах ФФЗП были использованы моноклональные мышиные антитела клона Bp53–11 (Ventana Medical Systems, Inc.) на той же автоматизированной системе для проведения иммуногистохимических реакций Ventana BenchMark. Первичные антитела клона Bp53–11, детерминируют как мутантный тип белка, так и дикий тип ядер-ного белка p53 (Tissue Diagnostics Product Catalog 2021, Roche Diagnostics). Пороговым значением положительной экспрессии мутантного типа р53 было установлено окрашивание ядер ≥ 10% опухолевых клеток. В зависимости от количественной оценки окрашенных клеток уровень мутантного белка р53 был классифицирован как отрица- тельный — при 0–9% (р53М-О), низкий — 10–29% (р53М-Н), средний — 30–49% (p53М-С), высокий — 50–79% (p53М-В) и очень высокий —≥ 80% (p53М-ОВ), аналогичная оценка была для дикого типа (p53Д).
Статистический анализ проводился с помощью программы SPSS Statistics version 26.0 под управлением пользовательской операционной системы Windows 10. Мы использовали корреляцию Пирсона (r-коэффициент Пирсона) для оценки взаимосвязи между экспрессией белков PD-L1 , р53 и ВПЧ статусом. При сравнительном анализе средних значений применялся t-критерий Стьюдента для выборок. Для описания кривых выживания использовали метод Каплана-Мейера, а различия между группами были проверены на значимость с использованием логарифмического рангового критерия. Общая выживаемость определялась с момента первоначального установления диагноза до даты смерти от любой причины. Регрессионная модель пропорциональных рисков Кокса использовалась для оценки влияния переменных на общую выживаемость. Также, оценивали отношение рисков и 95% доверительный интервал. Значение р менее 0,05 считался статистически значимым.
РЕЗУЛЬТАТЫ
Из 62 пациентов с ПККР 35 (56,5%) человек были мужчины и 27 (43,5%) женщин, при этом соотношение между ними составило 1,3:1. На первом этапе данного исследования все пациенты были разделены на 2 группы. Первую группу составили 28 (45,2%) пациентов, у которых было установлено наличие ВПЧ (ВПЧ + ПККР), а остальные 34 (54,8%) были без вирусной персистенции и оценены как ВПЧ- ПККР (2 группа).
Данные, представленные в табл. 1, показывают, что средний возраст пациентов в ВПЧ + группе составляет 47,3 года, несколько ниже по сравнению с пациентами общей группы (53,8 лет) и ВПЧ- 2-й группы (59,2; р < 0,001).
У 50% пациентов 1 группы ВПЧ + , первичные опухоли соответствовали начальным стадиям Т1 и Т2, а у большинства пациентов общей группы и во 2 группе (ВПЧ-) были зафиксированы продвинутые стадии Т3 и Т4 (в 71% и 88,2% случаях соответственно; р < 0,001). Распределение по стадиям (TNM 7-е издание, AJCC) показало, что в 1 группе 24 (85,7%) пациента ВПЧ + имели продвинутые стадии (III + IV), во 2 группе 32 пациента ВПЧ- (94,1%) и 56 пациентов общей группы (90,3%, р = 0,061) также имели стадии III и IV.
Пересмотр стадий болезни по классификации TNM 8-го издания (AJCC, 2018) привело к увеличению доли пациентов с ранними стадиями (I + II) почти в 5 раз в общей группе, что составило 45,1 %, а у 92,8% пациентов из 1 группы с ВПЧ + в 6,5 раз. У пациентов из группы 2 с ВПЧ- изменения не были обнаружены (р < 0,001).
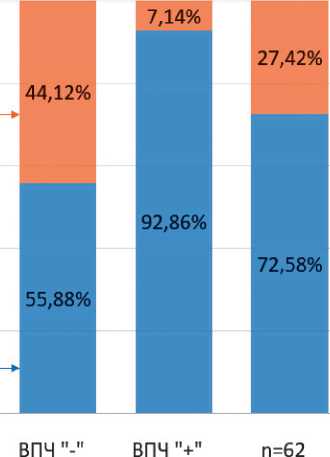
В зависимости от ВПЧ статуса локализация опухоли в анатомических отделах ротоглотки различалась между группами. В отличие от других групп у 92,8% (26) пациентов из группы ВПЧ + опухоли локализовались в небной миндалине и основании языка (р < 0,001). Опухоли, исходящие из небной миндалины и основания языка богатые лимфоидной тканью, были включены в тонзиллярную группу, а опухоли, развившиеся из мягкого неба, боковых и задних стенок, не вошли в тонзиллярную группу. Рис. 1 демонстрирует, что у пациентов, не связанных с ВПЧ инфекцией, частота не тонзиллярных опухолей значительно выше, чем у пациентов в других группах.
Более чем у половины пациентов общей группы (37, или 59,7%) выявлена положительная экспрессия белка PD-L1 , а в остальных случаях (25, или 40,3%) — отрицательная. Общая частота экспрессии PD-L1 существенно не отличалась между группами, разделенными по статусу ВПЧ и результаты были статистически не значимы (р = 0,882).
Уровень белка р53 М (мутантный тип) имел незначительные отличия. Положительная экспрессия была выявлена у 28 (45,2%) пациентов, отрицательная — у 34 (54,8%) пациентов общей группы. Во 2 ВПЧ- группе p53 М был выявлен у 27 (79,4%) пациентов, а отсутствие p53 М у 7 (20,6%). У пациентов 1 группы с ВПЧ + p53 М был идентифицирован как исключение, только в 1 случае (3,6%; р < 0,001). У пациентов из общей группы положительная экспрессия белка р53 Д (дикий тип) была выявлена только у 5 (8,1 %), все эти 5 пациентов относятся к 1 группе ВПЧ + . У остальных 57 (91,9%) пациентов общей группы экспрессия p53 Д не выявлялась (негативные паттерны), у пациентов 2 группы ВПЧ- присутствие этого белка также не идентифицировано (р = 0,01).
Наши результаты иммуногистохимического анализа показали, что распределение пациентов в зависимости от уровней экспрессии белков PD-L1 и р53 по группам, белки с уровнями PD-L1 -В и PD-L1 -ОВ в основном были обнаружены в ВПЧ- группе, а PD-L1 -Н и PD-L1 -С в ВПЧ + группе (p = 0,254). В отношении экспрессии белка p53 М многие паттерны (27, или 79,4%) с положительными экспрессиями р53 М относятся к ВПЧ- группе, больше всего
Таблица 1. Распределение пациентов по группам связанные с возрастными показателями.
|
Группа |
Частота (%) |
Средний возраст (95% ДИ*) |
СО¶ |
М инимум |
Максимум |
|
ВПЧ « + » |
28 (45,2) |
47,3 (42,1–52,4) |
13,3 |
24 |
77 |
|
ВПЧ «-» |
34 (54,8) |
59,2 (55,1–63,3) |
11,7 |
34 |
79 |
|
Общая |
62 (100,0) |
53,8 (50,3–57,2) |
13,7 |
24 |
79 |
*доверительный интервал;
¶стандартное отклонение
|
п=62 |
62,9% |
9,68% |
6,45% |
8,06% |
12,9% |
|
впч «+» |
82,14% |
10,72% |
3,57% |
0,0% |
3,57% |
|
впч «-» |
47,06% |
8,82% |
8,82% |
14,71% |
20,59% |

■ Тонзиллярная■ Нетонзиллярная
Мягкое небо
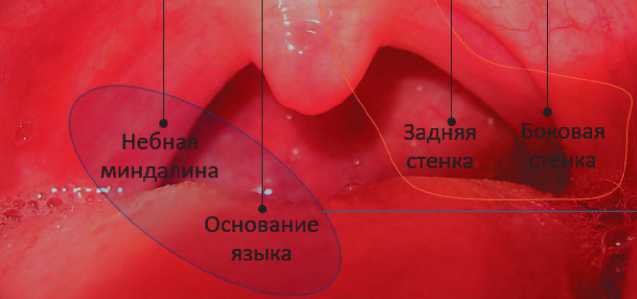
Рисунок 1. Распределение пациентов по группам в зависимости от локализации первичной опухоли по анатомическим частям ротоглотки.
из них имели p53 М -В (12, 35,29 %) и p53 М -ОВ (7, 20,59 %) (p < 0,001). Из 5 (8,1%) положительных р53 Д , 4 (6, 5%) были p53 Д -Н и 1 (1,6%) p53 Д -С, все они относятся к ВПЧ + группе, напротив, в ВПЧ- группе р53 Д не идентифицирован (p = 0,015).
В исследовании применен метод корреляции по Пирсону (r — коэффициент Пирсона) для оценки взаимосвязи между молекулярными предикторами (PD-L1, p53М, p53Д) и ВПЧ статусом. По результатам оценки выявлено, что между ВПЧ статусом и PD-L1 практически не было значительной взаимосвязи (r = 0,019; р = 0,882), но с дифференциальной экспрессией имеется слабая отрицательная корреляция (r = -0,147; p = 0,254). Мы также стремились изучить взаимосвязь между ВПЧ статусом, p53М и p53Д (табл. 2). При оценке выявлено, что между р53М и ВПЧ статусом была обнаружена очень сильная отрицательная корреляция с высокой статистической достоверности (r = -0,758; p < 0,001), а между p53Д — умеренная положительная корреляция (r = 0,326; p = 0,01). Когда корреляции между предикторами анализировались без учета ВПЧ статуса, PD-L1 имел слабую положительную корреляцию со всеми другими переменными, в то время как р53М имеет низкую отрицательную корреляцию с p53Д (r = -0,269, p = 0,035). При корреляционном анализе с участием р53Д обнаружена совершенно иная закономерность, имеющая отрицательную корреляцию со всеми факторами, кроме
Таблица 2. Корреляционный анализ между ВПЧ статуса и молекулярными маркерами.
|
Переменные |
Корреляция |
ВПЧ статус |
PD-L1 |
p53mut |
p53wild |
|
ВПЧ |
Коэффициент |
1 |
0,019 |
–0,758 |
0,326 |
|
р-значение |
0,882 |
< 0,001 |
0,010 |
||
|
PD-L1 |
Коэффициент |
0,019 |
1 |
0,019 |
0,123 |
|
р-значение |
0,882 |
0,882 |
0,342 |
||
|
p53mut |
Коэффициент |
–0,758 |
0,019 |
1 |
–0,269 |
|
р-значение |
< 0,001 |
0,882 |
0,035 |
||
|
p53wild |
Коэффициент |
0,326 |
0,123 |
–0,269 |
1 |
|
р-значение |
0,010 |
0,342 |
0,035 |
|
Группа |
Медиана (месяц) |
ДЛВ (%) |
КР |
ОР |
95% ДИ |
р |
|
Мужчины Женщины |
36 29 |
57,2 55,6 |
–0,034 |
0,967 |
0,498–1,876 |
0,921 |
|
ВПЧ « + » ВПЧ «-» |
НД 13 |
96,4 23,5 |
–2,933 |
0,053 |
0,018–0,156 |
< 0,001 |
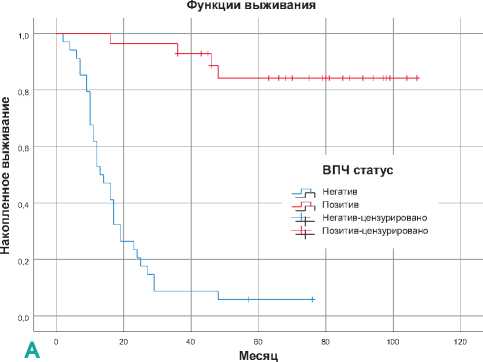
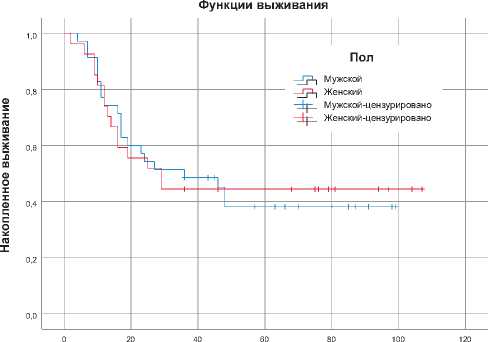
Рисунок 2. Показатели общей выживаемости пациентов в зависимости от пола (А) и ВПЧ статуса (Б).
Месяц
Б
PD - L1 . По результатам этого анализа ВПЧ статус и р53 Д можно рассматривать как защитные факторы.
Анализ выживаемости пациентов показал, что медиана общей выживаемости (МОВ) у мужчин 36 месяцев (95% ДИ 14,2–57,8) против 29 месяцев у женщин (95% ДИ 12,1–45,9), однако к концу наблюдения кривая становится несколько выше в женской популяции (p = 0,092) (рис. 2А). Дихотомическое распределение пациентов по ВПЧ статусу привело к резкой разнице в показателях выживаемости между группами, так как МОВ у пациентов группы ВПЧ + намного
Месяц
|
Группа |
Медиана (месяц) |
ДЛВ (%) |
КР |
ОР |
95% ДИ |
р |
|
PD-L1 «-» PD-L1 « + » |
19 46 |
48% 60,5% |
–0,3 |
0,741 |
0,384–1,431 |
0,372 |
|
p53mut «-» p53mut « + » |
НД 13 |
85,3% 21,4% |
2,067 |
7,901 |
3,653–17,09 |
< 0,001 |
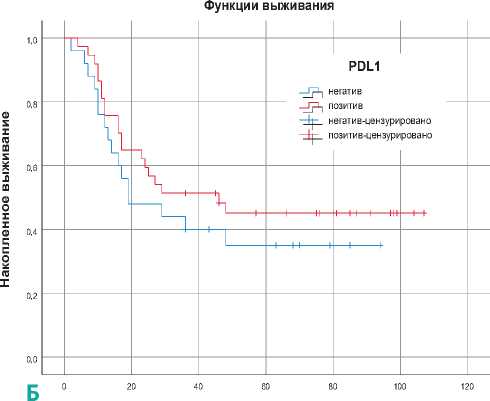
Рисунок 3. Показатели общей выживаемости пациентов в зависимости от экспрессии PD-L1 (А) и p53М (Б).
улучшена по сравнению с ВПЧ- (медиана не достигнута (МНД), двухлетняя выживаемость (ДЛВ) 96,4% против МОВ 13 месяца, ДЛВ 23,5%, p < 0,001) (рис. 2Б). Кроме того, для изучения зависимости времени дожития от независимых переменных и предположения прогнозирования риска наступления новых события для наблюдаемых пациентов применен метод регрессии Кокса. Если обратить внимание на рис. 3, то становится ясно, что ВПЧ статус и пол пациентов имеют отрицательные показатели коэффициента регрессии, но риск наступления смерти наиболее выше в гендерном факторе по сравнению со ВПЧ статусом (0,967 против 0,053).
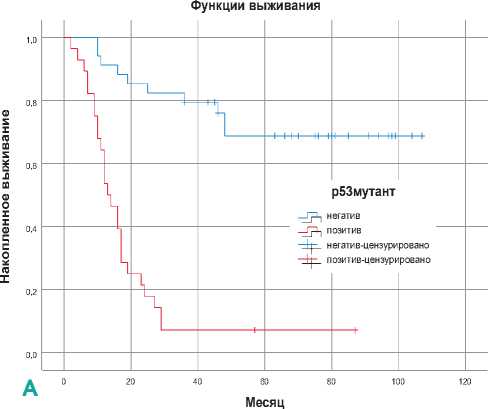
В общей популяции пациенты с положительной экспрессией PD-L1 имеют немного более длительное время выживания, чем пациенты с отрицательной экспрессией (p = 0,364) (рис. 3А), однако пациенты с положительной экспрессией p53 М продемонстрируют худшие показатели выживаемости по сравнению с отрицательными (p < 0,001) (рис. 3Б). Установлено, что р53 М является доминантным фактором риска с отрицательным влиянием на выживаемость пациентов (КР = 2,067, ОР = 7,901 [95 % ДИ 3,653– 17,090], р < 0,001).
ОБСУЖДЕНИЕ
В этом исследовании изучалось прогностическое значение белков PD-L1 и p53 при ПККР с учетом ВПЧ статуса. Кроме того, была проанализирована взаимосвязь между PD-L1 , р53 и статусом ВПЧ, а также влияние их на выживаемость пациентов. Данные анализа показывают, что двойная положительность ВПЧ статуса с PD-L1 улучшают показатели общей выживаемости по сравнению с их отрицательностью (p = 0,261). Если интерпретировать по уровням экспрессии PD-L1 , то его низкие и средние уровни снижают риск смерти пациентов, и они часто встречаются в ВПЧ-положительной группе, при этом высокие и очень высокие уровни повышают риск смерти и больше всего принадлежат к ВПЧ-отрицательной группе (p = 0,019). Во всех случаях наблюдалась отрицательная корреляция между белком p53 М и ВПЧ статусом, которые оценивались как противодействующие факторы (p < 0,001). Только в ВПЧ-отрицательной группе отрицательная экспрессия р53 М приводила к незначительному продлению жизни пациентов по сравнению с положительной (p < 0,001). Высокие и очень высокие уровни экспрессии белка р53 М сокращают время выживания пациентов в большей степени, чем низкие и средние уровни. Хотя белок р53 Д выявляется у небольшого числа пациентов, он показывает положительную корреляцию со ВПЧ статусом как сильного защитного фактора, снижающего риск смерти (p = 0,01).
PD-L1 представляет собой трансмембранный белок, обнаруживаемый в опухолевых и стромальных клетках при воспалительных состояниях, который действует как протонкогенный фактор в раковых клетках, которые связываются с корецептором PD-1, обнаруженным на цитотоксических Т-клетках. Этот комплекс PD-1/PD-L1 ингибирует иммунный противоопухолевый ответ и инактиви- рует Т-клетки, что позволяет раковым клеткам уклоняться от иммунологического ответа, активируя сигнальные пути пролиферации и выживания [12]. Персистирующая вирусная инфекция или характерное микроокружение опухоли провоцирует истощение действия цитотоксических T-клеток за счет усиления экспрессии коингибиторного лиганда для избегания от иммунной системы [13]. Высокие уровни экспрессии PD-L1 могут свидетельствовать о высокой патогенности опухолевых клеток, иммуносупрессивном микроокружении или интенсивной Т-клеточной атаке, вооруженной рецептором РD-1. Новейшее открытие того, что блокирование пути PD-L1/PD-1 усиливает эффективность Т-лимфоцитов, и собственная иммунная система организма может распознавать неоантигены и инициировать адаптивный ответ против опухолевых клеток, привело к укреплению противоопухолевой терапии и стало захватывающим направлением в борьбе с карциномами [14].
По данным авторов примерно 60–70% мутаций TP53 в основном являются миссенс в одном аллеле с подавлением второго аллеля из-за потери гетерозиготности [15]. Остальная группа (30–40%) не подвергается потерям гетерозиготности, сохраняя аллель TP53 дикого типа [16]. Кроме того, многие мутации гена TP53 приводит к усилению онкогенной функции, которая может усиливать прогрессирование опухоли, метастатический потенциал и/или устойчивость к лекарствам при сверхэкспрессии белка р53 М , даже подавляет активность р53 Д в клетках (доминантно-негативный механизм) [16,17]. В отличие от наиболее часто встречающихся миссенс-мутаций гена TP53 , делеция или нонсенс мутации часто приводит к удалению или незавершенного трансляции белка р53 за счет остаточной транскрипционной активностью [18]. Таким образом, модулирование котрансляционного фолдинга во время синтеза, обеспечивает формирование незрелой нативной структуры белка р53 . Такое сформирование молекулярно некорректных полипептидных цепей может привести к потере специфических сайтов связывания с антителами при иммуногистохимическом окрашивании. На основании результатов нашего исследования и приведенных выше данных следует подчеркнуть, что отсутствие экспрессии белка р53 Д в ВПЧ-отрицательной группе можно объяснить подавлением неповрежденного аллеля за счет потерь гетерозиготности или усилением онкогенной функции р53 М . Несмотря на деградацию белка р53 под воздействием Е6 ВПЧ, дикий вариант белка обнаруживается в небольшом количестве в ВПЧ-положительных паттернах. Редкое возникновение мутаций гена TP53 при ВПЧ + ПККР, обеспечивает сохранения активности р53 Д . Более половины пациентов в общей группе (54,8%) не имели мутации гена TP53 , не исключено, что среди них могут быть делеции или нонсенс-мутации, потому что иммуногистохимически идентифицировать этих структурно некорректных фолдинговых белков несколько сложно.
Более длительная выживаемость пациентов с ВПЧ + ПККР по сравнению с ВПЧ- побудила к разработке различных стратегий по деинтенцификации лечения.
Однако ВПЧ + статус не всегда является надежным предиктором при стратификации риска для снижения объема лечения у пациентов ПККР. Поэтому, с нашей точки зрения для надежного укрепления ресурса прогностических молекулярных предикторов кроме ВПЧ статуса, необходимо идентифицировать дополнительных указателей канонически взаимосвязанным с развитием ПККР. Основываясь на наших результатах, что опухоли которых имеют хорошую вариацию экспрессии молекулярных маркеров: p16 INK4a — 70–100% (ВПЧ +)/ PD-L1 –0–30%, TPS/ р53 Д -позитив/53М-не-гатив представляют собой идеальную популяцию для испытаний по де-интенсификации, учитывая их чрезвычайно низкий риск смерти и отличную выживаемость, так как в основном они ВПЧ + пациенты. Опухоли, которые обладают плохую вариацию экспрессии молекулярных маркеров: p16 INK4a —0–70%, (ВПЧ-)/ PD-L1 –30–100%, TPS/ р53 Д -нега-тив/ р53 М -позитив продемонстрируют противоположный результат, и в основном они ВПЧ- пациенты.
Таким образом, в зависимости от уровня интенсивности экспрессия белка PD-L1 с одной стороны, характеризует сбалансированный ответ иммунной системы хозяина, а с другой стороны, может вызывать периферическую иммунотолерантность, что создает условия для опухолевой прогрессии. С другой стороны, нарушение функции белка р53 под воздействием Е6 ВПЧ тесно связано с модуляцией контроля клеточного цикла и последующим повышением пролиферативной активности, приводящей к потере стабильности генома, из-за сокращения антрактов точек рестрикции и репарации ДНК. В ВПЧ-инфицированных клетках деградация онкосупрессоров Rb и р53 , связанная с ранними белками Е6 и Е7 ВПЧ, приводит к стабильной активации фактора транскрипции E2F [19], несмотря на высокую активность белка р16 INK4a его онкосупрессор-ные мотивы не реализуются.
В целом, конвергенция нашего относительно нового понимания этиологической связи между ВПЧ и ПККР, модуляция клеточного цикла и конспиративного уклонения от иммунного надзора инфицирированных клеток означают, что в ВПЧ + ПККР преобладает специфический клинико-биологический профиль. Хотим отметить собственное понимание, немного отдалившись от темы, чем массивнее интеграция вирусной ДНК с геномом клетки человека, тем пациенты становятся менее чувствительными к лечению и имеют более короткие показатели выживаемости. В каком-то образе это делает заболевания похожими на ВПЧ- тип, даже иногда персистенцию вирусов невозможно определять специальными тестами из-за того, что сборка вирусов утеряна за счет нарушения жизненного цикла.
ЗАКЛЮЧЕНИЕ
Апостериорные анализы показывают, что клиницисты, занимающиеся лечением ПККР, сталкиваются с уникальным набором проблем, учитывая потенциальное неблагоприятное воздействие дефинитивной химиолучевой терапии или хирургических вмешательств на качество жизни пациентов, иногда с появлением непоправимых осложнений. Надежные прогностические маркеры помогают раскрывать уникальные клинико-молекулярные особенности заболевания, чтобы помочь принять правильное решение в этих сложных клинических обстоятельствах. Идентификация неортодоксального предиктора должна быть сверхнадежной, в противном случае качество компенсируется количеством. ВПЧ + ПККР дебютирует обычно в относительно молодом возрасте, с вялотекущей клиникой и высокой чувствительностью на лечение. В этом контексте, надежными защитными предикторами являются положительный статус ВПЧ и дикий тип белка p53 , а белок PD-L1 также относится к этой категории только с низкой уверенностью и силой. Мутантный тип белка р53 входит в группу факторов риска и отрицательно влияет на выживаемость пациентов с ПККР. Однако, интерпретировать эти выводы следует с осторожностью, так как для предоставления более точных и пространственных выводов необходимы более масштабные исследования.
Список литературы Прогностическая роль белков PD-l1 и P53 при плоскоклеточной карциноме ротоглотки в зависимости от статуса вируса папилломы человека
- de Martel C, Georges D, Bray F, Ferlay J, Clifford GM. Global burden of cancer attributable to infections in 2018 : a worldwide incidence analysis. Lancet Glob Health. 2020 ; 8 (2) : e180-e190. https://doi.org/10.1016/S2214-109X(19)30488-7.
- Chaturvedi AK, Engels EA, Pfeiffer RM, et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol. 2011 ; 29 (32) : 4294-4301. https://doi.org/10.1200/JCO.2011.36.4596.
- Gillison ML, Chaturvedi AK, Anderson WF, Fakhry C. Epidemiology of Human Papillomavirus-Positive Head and Neck Squamous Cell Carcinoma. J Clin Oncol. 2015 ; 33 (29) : 3235-3242. https://doi.org/10.1200/JCO.2015.61.6995.
- Carlander AF, Jakobsen KK, Bendtsen SK, et al. A Contemporary Systematic Review on Repartition of HPV-Positivity in Oropharyngeal Cancer Worldwide. Viruses. 2021 ; 13 (7) : 1326. https://doi.org/10.3390/v13071326.
- Global Cancer Observatory, https://gco.iarc.fr.
- Giuliano AR, Nyitray AG, Kreimer AR, et al. EUROGIN 2014 roadmap : differences in human papillomavirus infection natural history, transmission and human papillomavirus-related cancer incidence by gender and anatomic site of infection. Int J Cancer. 2015 ; 136 (12) : 2752-2760. https://doi.org/10.1002/ijc.29082.
- Sinha P, Karadaghy OA, Doering MM, Tuuli MG, Jackson RS, Haughey BH. Survival for HPV-positive oropharyngeal squamous cell carcinoma with surgical versus non-surgical treatment approach : A systematic review and meta-analysis. Oral Oncol. 2018 ; 86 : 121-131. https://doi.org/10.1016/j.oraloncology.2018.09.018.
- Мудунов А. М. Вирус папилломы человека - новый этиологический фактор в развитии рака органов головы и шеи. Проблемы и перспективы их решения. Эпидемиология и Вакцинопрофилактика. 2018 ; 17 (5) : 100-105. https://doi.org/10.31631/2073-3046-2018-17-5-100-105.
- Белякова Е. Н. Клинико-эпидемиологическая характеристика и факторы риска ВПЧ-ассоциированного рака головы и шеи в России : результаты выборочного исследования. Анализ риска здоровья. 2022 ; 1 : 72-80. https://doi.org/10.21668/health.risk/2022.1.07.
- Lechner M, Liu J, Masterson L, Fenton TR. HPV-associated oropharyngeal cancer : epidemiology, molecular biology and clinical management. Nat Rev Clin Oncol. 2022 ; 19 (5) : 306-327. https://doi.org/10.1038/s41571-022-00603-7.
- Lewis JS Jr, Beadle B, Bishop JA, et al. Human Papillomavirus Testing in Head and Neck Carcinomas : Guideline From the College of American Pathologists. Arch Pathol Lab Med. 2018 ; 142 (5) : 559-597. https://doi.org/10.5858/arpa.2017-0286-CP.
- Han Y, Liu D, Li L. PD-1 / PD-L1 pathway : current researches in cancer. Am J Cancer Res. 2020 ; 10 (3) : 727-742. Published 2020 Mar 1.
- Golrokh Mofrad M, Taghizadeh Maleki D, Faghihloo E. The roles of programmed death ligand 1 in virus-associated cancers. Infect Genet Evol. 2020 ; 84 : 104368. https://doi.org/10.1016/j.meegid.2020.104368.
- Salmaninejad A, Khoramshahi V, Azani A, et al. PD-1 and cancer : molecular mechanisms and polymorphisms. Immunogenetics. 2018 ; 70 (2) : 73-86. https://doi.org/10.1007/s00251-017-1015-5.
- Zhou G, Liu Z, Myers JN. TP53 Mutations in Head and Neck Squamous Cell Carcinoma and Their Impact on Disease Progression and Treatment Response. J Cell Biochem. 2016 ; 117 (12) : 2682-2692. https://doi.org/10.1002/jcb.25592.
- Liu Y, Chen C, Xu Z, et al. Deletions linked to TP53 loss drive cancer through p53-independent mechanisms. Nature. 2016 ; 531 (7595) : 471-475. https://doi.org/10.1038/nature17157.
- Caponio VCA, Troiano G, Adipietro I, et al. Computational analysis of TP53 mutational landscape unveils key prognostic signatures and distinct pathobiological pathways in head and neck squamous cell cancer. Br J Cancer. 2020 ; 123 (8) : 1302-1314. https://doi.org/10.1038/s41416-020-0984-6.
- Blandino G, Di Agostino S. New therapeutic strategies to treat human cancers expressing mutant p53 proteins. J Exp Clin Cancer Res. 2018 ; 37 (1) : 30. Published 2018 Feb 15. https://doi.org/10.1186/s13046-018-0705-7.
- Стукань А. И., Чухрай О. Ю., Порханов В. А. и др. Орофарингеальная карцинома, ассоциированная с вирусом папилломы человека : тенденции эпидемиологии и методы выявления вируса в опухоли. Опухоли головы и шеи. 2018 ; 8 (3) : 77-83.


