Прогностическая значимость маркеров эпителиально-мезенхимального перехода и морфологических характеристик плоскоклеточных карцином головы и шеи в развитии лимфогенных метастазов
Автор: Бычков Вячеслав Алексеевич, Бондарь Людмила Николаевна, Небова Юлия Андреевна, Ларионова Ирина Валерьевна, Черемисина Ольга Владимировна, Перельмутер Владимир Михайлович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
Предыдущие исследования морфологических особенностей плоскоклеточных карцином головы и шеи выявили значимую ассоциацию наличия дискретных опухолевых клеток и низкого уровня воспалительного инфильтрата с лимфогенным метастазированием. Цель исследования - количественно установить содержание опухолевых клеток в состоянии эпителиально-мезенхимального перехода в клеточных структурах разной степени дифференцировки и оценить прогностическую модель лимфогенного метастазирования. Материал и методы. Для этого проведена оценка основных клинико-морфологических показателей у 92 пациентов с плоскоклеточными карциномами головы и шеи. У 16 пациентов проведено исследование экспрессии опухолевыми клетками маркеров эпителиально-мезенхимального перехода - белков Snail и Vimentin при помощи конфокальной микроскопии. Результаты. Была оценена выраженность эпителиально-мезенхимального перехода в клеточных структурах разной степени дифференцировки, максимальное количество Snail- и Vimentin-позитивных клеток (по 20 %) наблюдалось в дискретных опухолевых клетках. При этом доля клеток в состоянии эпителиально-мезенхимального перехода не различалась у пациентов с наличием и отсутствием лимфогенного метастазирования. Таким образом, в прогностическую модель лимфогенного метастазирования вошли два показателя: наличие одиночных опухолевых клеток и низкая выраженность воспаления. Чувствительность модели составила 54,5 %, специфичность - 89 %.
Опухоли головы и шеи, эпителиально-мезенхимальный переход, внутриопухолевая гетерогенность, морфология, воспаление, лимфогенное метастазирование
Короткий адрес: https://sciup.org/140254306
IDR: 140254306 | УДК: 617.51/.53-006.6-033..2:611-018.98-037:577.21 | DOI: 10.21294/1814-4861-2019-18-6-67-74
Текст научной статьи Прогностическая значимость маркеров эпителиально-мезенхимального перехода и морфологических характеристик плоскоклеточных карцином головы и шеи в развитии лимфогенных метастазов
Хорошо известна фенотипическая вариабельность плоскоклеточных карцином головы и шеи (ПКГШ), которая проявляется наличием клеточных структур разной степени дифференцировки. Большинство исследователей определяет гистопатологическую степень плоскоклеточных карцином согласно рекомендациям ВОЗ [1]. Изучению прогностической значимости таких факторов, как клиническая стадия, гистологические знаки и патологическая степень, посвящено большое количество исследований [2–4], однако многие авторы отмечают, что общепринятая классификация далеко не всегда правильно позволяет оценить прогноз ПКГШ.
Продолжают публиковаться работы, предлагающие новые критерии оценки наблюдаемого морфологического разнообразия плоскоклеточных карцином [5]. Ранее нами также был изучен новый критерий прогноза течения ПКГШ на основе гистопатологического описания среза опухоли. В каждой опухоли идентифицировали 5 типов устойчивых клеточных структур разной степени дифференцировки: структуры с ороговением
(I тип), с клетками базалоидного и шиповатого типов без ороговения (II тип), с клетками базалоидного типа (III тип), структуры с выраженным клеточным полиморфизмом (IV тип) и одиночные опухолевые клетки (V тип) [6].
В связи с тем, что во многих исследованиях показана связь уровня лимфоцитов, инфильтрирующих опухоль (TILs), с улучшенным прогнозом [7], мы проводили оценку воспалительного инфильтрата в срезах плоскоклеточных карцином головы и шеи. В результате было показано, что наличие в опухоли структур IV и V типов, а также низкий уровень воспалительного инфильтрата ассоциированы с лимфогенным метастазированием [8].
Одним из возможных механизмов метастазирования является эпителиально-мезенхимальный переход (ЭМП), когда опухолевая клетка подвергается анаплазии, теряет межклеточные контакты, меняет эпителиоидную форму и приобретает способность к локомоции. По косвенным признакам, по крайней мере, часть структур V типа может находиться в состоянии ЭМП (потеря клеточных контактов, низкая степень дифференцировки, выраженная ассоциация с лимфогенным метастазированием).
Цель исследования – изучить выраженность ЭМП в 5 типах клеточных структур, оценить его роль в метастатическом поражении лимфоузлов, разработать прогностическую модель лимфогенного метастазирования.
Материал и методы
Материалом исследования служили срезы опухоли от 92 пациентов с плоскоклеточным раком головы и шеи T1–4N0–3M0, получавших лечение в НИИ онкологии Томского НИМЦ в 2007–16 гг. В исследование вошли карциномы преддверья ротовой полости (n=18), ротовой полости (n=32), глотки (n=12), гортани (n=29) и верхнечелюстной пазухи (n=1). Во всех случаях диагноз был верифицирован морфологически. Специфического лечения до взятия образцов опухоли больные не получали. Исследование проходило с разрешения локального этического комитета института, все пациенты подписали информированное согласие. Клинические данные были получены из амбулаторных карт.
Анализ морфологической гетерогенности плоскоклеточных карцином проводился методом световой микроскопии препаратов, окрашенных гематоксилином и эозином. При этом оценивались следующие параметры: пол, стадия по TNM, количество пораженных лимфоузлов, степень дифференцировки, наличие клеточных структур определенного типа, инвазия в окружающие ткани, выраженность и тип воспалительного инфильтрата по аналогии с рекомендациями Международной рабочей группы [9] (рис. 1).
Эпителиальные клетки в состоянии эпителиально-мезенхимального перехода начинают синтезировать белки, характерные для клеток мезенхимы. Идентификация опухолевых клеток в состоянии ЭМП осуществлялась на основе определения в них белков Snail и виментина при помощи первичных антител (Santa Cruz Biotechnology, USA), которые, в свою очередь, метились вторичными антителами, конъюгированными с флуорес- центными метками (Dako, USA). Для окраски ядер клеток применялся Dapi (Sigma-Aldrich, USA). Детекция флуоресцентного сигнала осуществлялась при помощи конфокального лазерного сканирующего микроскопа LSM 780 NLO («Carl-Zeiss», Германия). В исследование включено 9 пациентов без лимфогенных метастазов (N0) и 7 больных с метастатическим поражением региональных лимфоузлов (N1–2). На каждый случай получали 3–5 микрофотографий плоскоклеточной карциномы, на которых подсчитывали общее количество клеток и количество клеток, экспрессирующих маркеры ЭМП, для каждого типа структур. Результат выражали в процентах.
Для проверки статистически значимой разницы результатов в исследуемых группах использовались непараметрические критерии Фишера, Манна – Уитни и Краскела – Уоллиса, проводили корреляционный анализ Спирмена. Использовался метод логистической регрессии для оценки влияния изучаемых факторов на метастазирование. Различия считались значимыми при р<0,05
Результаты и обсуждение
Каждая плоскоклеточная карцинома была оценена по наличию 5 типов структур различной степени дифференцировки. В подавляющем числе случаев ПКГШ были представлены сочетанием структур (табл. 1). Чаще всего встречалось сочетание клеточных структур I, II и III типов (32,6 %), в 2–3 раза реже наблюдалось сочетание I–III структур с IV и V типами. В целом, чаще всего обнаруживались структуры II и III типов (94,6 и 95,7 % соответственно), реже всего – структуры IV типа (31,5 %). Выявлена слабая корреляция между I–II типами (R=0,392, p<0,01) и IV–V типами клеточных структур (R=0,349, p<0,01).
При анализе частоты изучаемых клеточных структур в зависимости от основных клиникоморфологических характеристик опухоли (табл. 2) показано, что I тип в 5 раз чаще обнаруживается в
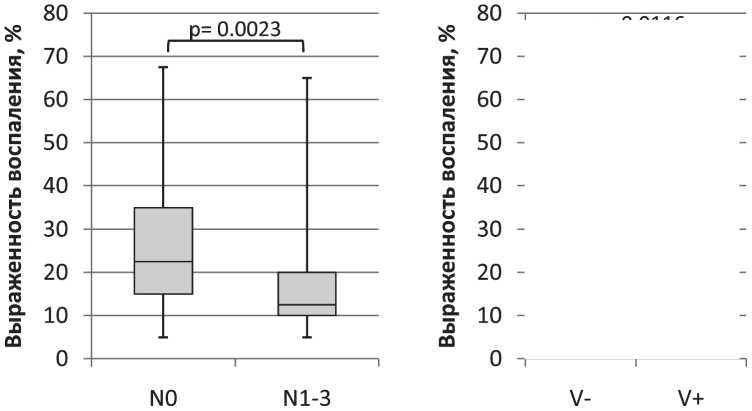
Рис. 1. Выраженность воспалительного инфильтрата в гистологических срезах плоскоклеточных карцином у пациентов с интактными и пораженными метастазами лимфоузлами, а также с наличием или отсутствием клеточных структур V типа (Me(Q1;Q3), %)
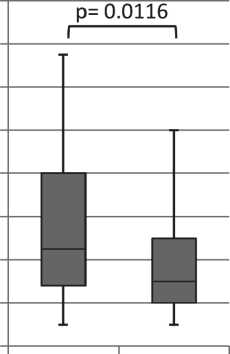
Таблица 1
|
I тип |
II тип |
III тип |
IV тип |
V тип |
Частота |
|
+ |
+ |
+ |
30/92 (32,6 %) |
||
|
+ |
+ |
+ |
+ |
+ |
14/92 (15,2 %) |
|
+ |
+ |
+ |
+ |
13/92 (14,1 %) |
|
|
+ |
+ |
+ |
+ |
8/92 (8,7 %) |
|
|
+ |
+ |
7/92 (7,6 %) |
|||
|
+ |
+ |
+ |
+ |
6/92 (6,5 %) |
|
|
+ |
+ |
+ |
5/92 (5,4 %) |
||
|
+ |
+ |
3/92 (3,3 %) |
|||
|
+ |
2/92 (2,2 %) |
||||
|
+ |
1/92 (1,1 %) |
||||
|
+ |
+ |
1/92 (1,1 %) |
|||
|
+ |
+ |
1/92 (1,1 %) |
|||
|
+ |
+ |
+ |
+ |
1/92 (1,1 %) |
|
|
67/92 (72,8 %) |
87/92 (94,6 %) |
88/92 (95,7 %) |
29/92 (31,5 %) |
43/92 (46,7 %) |
Таблица 2
|
Параметр |
I- |
I+ |
II- |
II+ |
III- |
III+ |
IV- |
IV+ |
V- |
V+ |
|
|
3 |
12 |
0 |
15 |
0 |
15 |
14 |
1 |
10 |
5 |
||
|
T1–2 |
|||||||||||
|
(12,0 %) |
(17,9 %) |
(0 %) |
(17,2 %) |
(0 %) |
(17,1 %) |
(22,2 %) |
(3,4 %) |
(20,4 %) |
11,6 %) |
||
|
T |
22 |
55 |
5 |
72 |
4 |
73 |
49 |
28 |
39 |
38 |
|
|
T3–4 |
(88,0 %) |
(82,1 %) |
(100 %) |
(82,8 %) |
(100 %) |
(82,9 %) |
(77,8 %) |
(96,6 %) |
(79,6 %) |
(88,4 %) |
|
|
p |
0,7519 |
0,5872 |
1,0 |
0,0313 |
0,3969 |
||||||
|
13 |
42 |
1 |
54 |
2 |
53 |
42 |
13 |
37 |
18 |
||
|
N0 |
(52,0 %) |
(62,7 %) |
(20,0 %) |
(63,2 %) |
(50 %) |
(62,4 %) |
(66,7 %) |
(44,8 %) |
(75,5 %) |
(41,8 %) |
|
|
N |
12 |
25 |
4 |
33 |
2 |
32 |
21 |
16 |
12 |
25 |
|
|
N1–2 |
|||||||||||
|
(48,0 %) |
(37,7 %) |
(80,0 %) |
(36,8 %) |
(50 %) |
(37,6 %) |
(33,3 %) |
(55,2 %) |
(24,5 %) |
(58,2 %) |
||
|
p |
0,4739 |
0,1535 |
0,6347 |
0,0669 |
0,0014 |
||||||
|
Высо- |
1 |
15 |
0 |
16 |
2 |
14 |
13 |
3 |
12 |
4 |
|
|
Степень |
кая |
(4,8 %) |
(23,8 %) |
(0 %) |
(19,8 %) |
(50,0 %) |
(17,5 %) |
(22,8 %) |
(11,1 %) |
(26,1 %) |
(10,5 %) |
|
Уме- |
14 |
40 |
1 |
53 |
0 |
54 |
35 |
19 |
30 |
24 |
|
|
диффе-ренци- |
ренная |
(66,7 %) |
(63,5 %) |
(33,3 %) |
(65,4 %) |
(0 %) |
(67,5 %) |
(61,4 %) |
(70,4 %) |
(65,2 %) |
(63,2 %) |
|
6 |
8 |
2 |
12 |
2 |
12 |
9 |
5 |
4 |
10 |
||
|
ровки |
Низкая |
(28,5 %) |
(12,7 %) |
(66,7 %) |
(14,8 %) |
(50,0 %) |
(15,0 %) |
(15,8 %) |
(18,5 %) |
(8,7 %) |
(26,3 %) |
|
p |
0,0492 |
0,0891 |
0,9758 |
0,3805 |
0,0323 |
||||||
|
16 |
45 |
3 |
58 |
4 |
57 |
42 |
19 |
35 |
26 |
||
|
Инвазия |
Нет |
(76,2 %) |
(72,6 %) |
(100 %) |
(72,5 %) |
(100 %) |
(72,2 %) |
(75,0 %) |
(70,4 %) |
(77,8 %) |
(68,4 %) |
|
в под- |
5 |
17 |
0 |
22 |
0 |
22 |
14 |
8 |
10 |
12 |
|
|
лежащие ткани |
Есть |
(23,8 %) |
(27,4 %) |
(0 %) |
(27,5 %) |
(0 %) |
(27,8 %) |
(25,0 %) |
(29,6 %) |
(22,2 %) |
(31,6 %) |
|
p |
1,0 |
0,5618 |
0,5618 |
0,7913 |
0,4547 |
||||||
|
Лимфо- |
19 |
41 |
4 |
56 |
2 |
58 |
41 |
19 |
35 |
25 |
|
|
Тип |
идный |
(76,0 %) |
(65,1 %) |
(80,0 %) |
(67,5 %) |
(66,7 %) |
(68,2 %) |
(68,3 %) |
(67,9 %) |
(79,5 %) |
(59,5 %) |
|
воспали- |
|||||||||||
|
Сме- |
|||||||||||
|
тельного |
6 |
22 |
1 |
27 |
1 |
27 |
19 |
9 |
11 |
17 |
|
|
инфиль- |
шан-ный |
(24,0 %) |
(34,9 %) |
(20,0 %) |
(32,5 %) |
(33,3 %) |
(31,8 %) |
(31,7 %) |
(32,1 %) |
(20,5 %) |
(40,5 %) |
|
p |
0,4475 |
1,0 |
1,0 |
1,0 |
0,1129 |
||||||
Комбинации клеточных структур в опухоли
Ассоциация различных типов клеточных структур с клинико-морфологическими характеристиками опухоли
высокодифференцированных новообразованиях, тогда как V тип в 3 раза чаще – в низкодифференцированных опухолях. Структуры с высоким клеточным полиморфизмом (IV тип) в подавляющем большинстве случаев (96,6 %) выявлены у пациентов с поздними стадиями заболевания (T3–4). Наконец, V тип клеточных структур в 2,3 раза чаще обнаруживается у больных с поражением лимфоузлов (N1–2) по сравнению с пациентами с интактными лимфоузлами (N0).
Вероятно, структуры I, II и III типов можно назвать основными, «базовыми», т.е. образующимися на первых этапах канцерогенеза, что подтверждается тем, что у пациентов ПКГШ с ранними стадиями (T1–2) I тип клеточных структур обнаружился в 80 %, а II и III типы – в 100 % случаев (табл. 2). При этом отдельные опухолевые клетки (V тип), хотя и могут встречаться у пациентов с I–III типами клеточных структур, в большей степени ассоциированы с высокополиморфными структурами IV типа (значимая корреляция), которые практически не наблюдаются при опухолях ранних стадий (табл. 2).
Изучение выраженности эпителиально-мезенхимального перехода в изучаемых клеточных структурах показало, что количество Snail- и виментин-позитивных клеток в структурах I–III типов значимо не различается и колеблется на уровне 2–5 % для Snail и 6–10 % для вименти-на. В сравнении с указанными структурами в высокополиморфных клеточных структурах IV типа имелась тенденция к увеличению Snail- и виментин-позитивных клеток – 11 и 16 % соответственно (p>0,05), тогда как в структурах V типа доля клеток в состоянии ЭМП была значимо выше – 19 и 20 % соответственно (p<0,05) (рис. 2).
При этом Snail можно рассматривать как маркер раннего, частичного ЭМП, а виментин – как маркер позднего, завершенного ЭМП. По данным литературы, для длительного поддержания ЭМП требуется наличие опухолевых клеток, постоянно продуцирующих биологически активные факторы и создающих определенное сигнальное микроокружение (TGF-β и др.) [10]. Отмечается, что при этом они должны поддерживать «эпителиальный» фенотип, чтобы сохранять продукцию этих факторов [11]. С этой точки зрения опухолевые структуры IV типа хорошо подходят на роль такой поддерживающей популяции клеток за счет корреляции со структурами V типа.
Далее мы оценили количество клеток в состоянии ЭМП у пациентов с пораженными (N1–2) и интактными (N0) лимфоузлами. Несмотря на высокую долю Snail- и виментин-позитивных клеток в одиночно расположенных опухолевых клетках, для которых показана ассоциация с лимфогенным метастазированием, в целом выраженность эпителиально-мезенхимального перехода в плоскоклеточных карциномах у больных с N1–3 и с
N0 не отличалась (табл. 3). Возможно, это связано с малым объемом выборки пациентов, однако ряд авторов указывают на низкую прогностическую значимость маркеров ЭМП при ПКГШ [12, 13]. Тем не менее ЭМП является одним из возможных механизмов, объясняющих увеличение частоты метастатического поражения лимфоузлов, уточнение его масштабов и особенностей является важной фундаментальной задачей.
При анализе степени воспалительной реакции в зависимости от клинических характеристик и морфологических особенностей плоскоклеточных карцином было показано, что меньшая выраженность воспалительной инфильтрации ассоциирована с метастатическим поражением лимфоузлов и наличием в опухоли одиночно расположенных опухолевых клеток (V тип структур), что позволяет предположить, что наблюдаемые признаки патогенетически связаны. Действительно, снижение воспалительной реакции можно рассматривать как признак подавления иммунного ответа [14, 15]. При этом агрессивные свойства опухоли в значительной степени определяются условиями, в которых происходят ее рост и развитие [16–24]. В результате инвазивный и метастатический потенциал опухолевых клеток увеличивается, и это находит отражение на уровне морфологии опухоли: формируется инвазивный фронт, возникают паттерны коллективной и индивидуальной инвазии, меняется форма одиночных опухолевых клеток. В связи с этим представляется важным оценивать одновременно как стромальные, так и паренхиматозные факторы для определения прогноза развития злокачественного заболевания.
Нами была оценена математическая модель прогноза метастатического поражения лимфоузлов
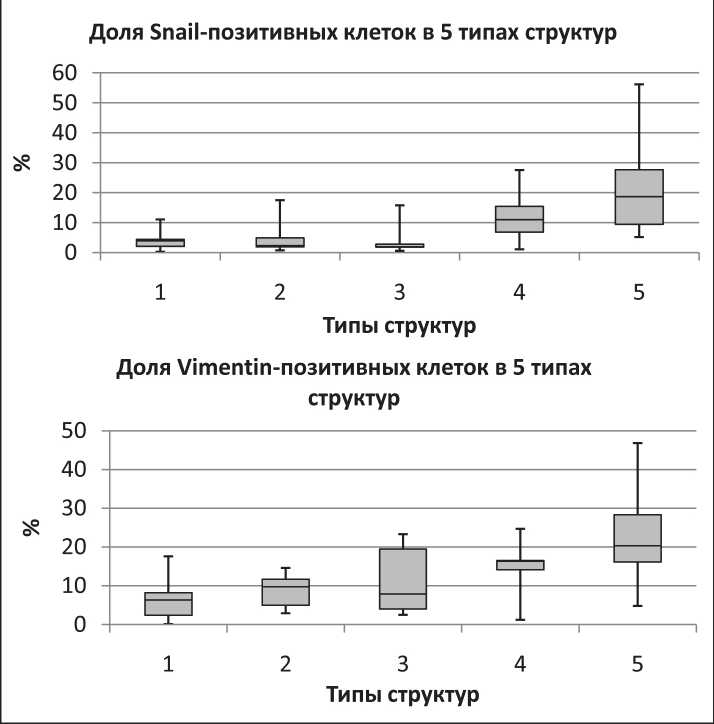
Рис. 2. Доля клеток с признаками раннего и позднего ЭМП в различных типах клеточных структур (Me(Q1;Q3), %)
Таблица 3
Содержание клеток в состоянии ЭМП у пациентов в зависимости от состояния регионарных лимфоузлов (М%(Q1;Q3))
|
Параметр |
Больные без лимфогенных метастазов (n=9) |
Больные с лимфогенными метастазами (N1–2) (n=7) |
p |
|
Snail |
2,5 (1,9; 5,6) |
4,5 (3,0; 5,2) |
p=0,56 |
|
Vimentin |
12,5 (7,1; 21,4) |
11,9 (9,4; 13,7) |
p=0,74 |
Таблица 4
Характеристика прогностической модели лимфогенного метастазирования, полученной на основе регрессионного анализа
|
Среднеквадра- |
95 % доверительный |
|
Показатель B Вальд Значение Exp (B) тичная ошибка |
интервал для EXP(B) Нижняя Верхняя |
Список литературы Прогностическая значимость маркеров эпителиально-мезенхимального перехода и морфологических характеристик плоскоклеточных карцином головы и шеи в развитии лимфогенных метастазов
- Amin M.B., Greene F.L., Edge S.B., Compton C.C., Gershenwald J.E., Brookland R.K., Meyer L., Gress D.M., Byrd D.R., Winchester D.P. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging. CA Cancer J Clin. 2017 Mar; 67(2): 93-99. 10.3322/ caac.21388. DOI: 10.3322/caac.21388
- Philip J., James R. Maxillary squamous cell carcinoma: An 11-year retrospective study of one regional cancer centre. Int J Oral Maxillofac Surg. 2014 Oct; 43(10): 1195-8. DOI: 10.1016/j.ijom.2014.05.020
- Montes D.M., Carlson E.R., Fernandes R., Ghali G.E., Lubek J., Ord R., Bell B., Dierks E., Schmidt B.L. Oral maxillary squamous carcinoma: An indication for neck dissection in the clinically negative neck. Head Neck. 2011 Nov; 33(11): 1581-5. DOI: 10.1002/hed.21631
- Yang X., Song X., Chu W., Li L., Ma L., Wu Y. Clinicopathological characteristics and outcome predictors in squamous cell carcinoma of the maxillary gingiva and hard palate. J Oral Maxillofac Surg. 2015 Jul; 73(7): 1429-36. DOI: 10.1016/j.joms.2014.12.034
- Boxberg M., Jesinghaus M., Dorfner C., Mogler C., Drecoll E., Warth A., Steiger K., Bollwein C., Meyer P., Wolff K.D., Kolk A., Weichert W. Tumour budding activity and cell nest size determine patient outcome in oral squamous cell carcinoma: proposal for an adjusted grading system. Histopathology. 2017 Jun; 70(7): 1125-1137. DOI: 10.1111/his.13173


