Прогностическая значимость оценки экспрессии иммуногистохимических маркеров и степени патоморфоза до и после лечения больных раком простаты высокого риска прогрессирования
Автор: Воронина Е.С., Фомкин Р.Н., Бучарская А.Б., Палатова Т.В., Попков В.М., Маслякова Г.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: провести анализ экспрессии иммуногистохимических маркеров у пациентов с аденокарциномой простаты высокого риска прогрессирования до и после комбинированного и сочетанного лечения больных с уровнем простатического специфического антигена (ПСА) крови ниже дискриминационного. Материал и методы. Исследовали пациентов (n=80) с диагнозом «рак простаты высокого риска прогрессирования», с клинической стадией T3a, суммой баллов по шкале Глисона от 8 до 10, уровнем общего ПСА более 20 нг / мл. Пациентам 1-й группы (n=42) проведено только комбинированное хирургическое лечение в объеме ТУР и HIFU-аблации простаты; 2-й группе пациентов (n=38) дополнительно применена андрогенная депривация в адъювантном режиме. Результаты. ПСА крови, определяемый у пациентов после различных методов лечения, не всегда является объективным показателем его эффективности. Иммуногистохимические исследования ткани опухоли на пролиферативную активность опухолевых клеток, активацию в них апоптоза, а также оценки специфических онкомаркеров и генов супрессоров опухоли показали, что снижение экспрессии указанных маркеров у пациентов с показателями ПСА крови ниже дискриминационного наблюдается у всех больных независимо от вида лечения. Однако после лечения в 1-й группе пациентов, несмотря на достижение показателя ПСА уровня nadir, наблюдается снижение экспрессии маркера межклеточной адгезии Е-кадгерина, что свидетельствует о повышении риска метастазирования опухоли, а также увеличении экспрессии маркеров ингибитора апоптоза Всl-2 и андрогенов, что свидетельствует о возможности прогрессирования опухолевого роста. Заключение. Для более точной оценки лечебного патоморфоза у больных раком простаты высокого риска прогрессирования, которым проведена монотерапия методом HIFU-аблации, наряду с определением уровня ПСА крови, необходимо при контрольной биопсии простаты проведение иммуногистохимического исследования ткани опухоли для определения прогноза и риска развития рецидива.
Высокоинтенсивный сфокусированный ультразвук (hifu), иммуногистохимический анализ, патоморфоз, рак простаты
Короткий адрес: https://sciup.org/149135296
IDR: 149135296 | УДК: 616.65-002-006.6-085(045)
Текст научной статьи Прогностическая значимость оценки экспрессии иммуногистохимических маркеров и степени патоморфоза до и после лечения больных раком простаты высокого риска прогрессирования
-
1 Введение. Рак простаты (РП) является одной из наиболее актуальных проблем современной онкологии. По данным государственной медицинской статистики, распространенность РП в России неуклонно растет: с 478 случаев на 100 тыс. населения в 2006 г. до 1384 на 100 тыс. населения в 2016 г. [1]. На его долю приходится около 6% всех злокачественных новообразований. РП включает опухоли различной степени дифференцирования и агрессивности, что определяет прогноз заболевания. Тактика лечения определяется распространенностью опухолевого процесса и различными клиническими характеристиками заболевания, которые обусловливают риск прогрессирования онкологического процесса после радикального лечения [2, 3].
К радикальным методам лечения относят радикальную простатэктомию, лучевую терапию — дистанционную или брахитерапию, HIFU-аблацию простаты. Для оценки риска прогрессирования заболевания после проведенного радикального лечения существует несколько предикторных таблиц и номограмм. A. V. D»Amico и соавт. (1999) предложили характеристику риска прогрессирования заболевания в зависимости от основных клинических данных у больных РП после проведенной ЛТ [4]. Последующая валидация данной номограммы на подгруппах больных, перенесших хирургическое лечение, подтвердила ее прогностическую значимость [5].
Лечение больных группы высокого и очень высокого риска прогрессирования представляет определенную сложность [6, 7]. Группы высокого риска характеризуются более агрессивным течением заболевания и достоверно меньшими показателями безрецидивной, опухолеспецифической и общей выживаемости по сравнению с группами низкого и промежуточного риска. У такой категории пациентов риск развития биохимического рецидива, прогрессирования заболевания и смерти от РП значительно выше. Кроме того, в подгруппах высокого риска прогрессирования заболевания мультимодальная терапия с применением комбинации хирургического или лучевого методов и назначением гормональной терапии является основной терапевтической страте-
гией, поскольку приводит к достоверному улучшению показателей выживаемости больных [8].
В статье представлены результаты комбинированного и сочетанного лечения пациентов с высоким риском прогрессирования, которым выполнена комбинация трансуретральной резекции (ТУР) и высокоинтенсивной сфокусированной ультразвуковой аблации простаты (HIFU — High Intensity Focused Ultrasound) в сочетании и без сочетания с андрогенной депривацией.
Неоспоримым критерием оценки степени лечебного патоморфоза после воздействия на ткань простаты высокоинтенсивным сфокусированным ультразвуком является гистологический метод исследования. Известно, что морфологическими проявлениями патоморфоза служат повреждения паренхимы и стромы в виде дистрофии и некроза [9–11]. Однако нарушение метаболизма клеток может сочетаться с этими признаками и даже быть причиной указанных изменений, а не его проявлением. Поэтому для более объективной оценки лечебного патоморфоза в настоящее время используют иммуногистохимическое исследование. Иммуногистохимия является ценным дополнением к диагностике мельчайших очагов простатической карциномы и отличает ее от доброкачественных миметиков [12].
Цель: провести анализ экспрессии иммуногистохимических маркеров у пациентов с аденокарциномой простаты высокого риска прогрессирования до и после комбинированного и сочетанного лечения больных с уровнем простатического специфического антигена (ПСА) крови ниже дискриминационного.
Материал и методы. Исследование включало 80 пациентов в возрасте 73,5±1,2 года. У всех больных РП диагностирован при трансректальной биопсии, как минимум, из 12 точек. Выполнены магниторезонансная томография (МРТ) и остеосцинтиграфия для стадирования и исключения наличия метастазов в кости и лимфатических узлах. Критериями исключения являлись: ожидаемая продолжительность жизни менее пяти лет, высокий анестезиологический риск (American Society of Anesthesiologists class >3), Eastern Cooperative Oncology Group (ECOG) — статус (общее состояние) >2, наличие в настоящий момент или в анамнезе колоректального рака или воспалительных заболеваний прямой кишки, предшествующая ампутация прямой кишки, предшествующая брахитерапия, наличие ректальной фистулы в анамнезе.
Риск пациентов оценен согласно критериям D'Amico et al. (1999) и включал в себя дооперационный уровень общего ПСА, клиническую стадию и сумму баллов по шкале Глисона. К группе пациентов высокого риска были отнесены больные с клинической стадией T3a, суммой баллов по шкале Глисона от 8 до 10, уровнем общего ПСА более 20 нг/мл. Все пациенты были разделены на две группы, сопоставимые по исследуемым показателям. В 1-ю группу включены пациенты (n=42), которым проведено только комбинированное хирургическое лечение в объеме ТУР и HIFU-аблации простаты; во 2-ю группу — пациенты, которым применена сочетанная терапия в виде комбинированного хирургического лечения в объеме ТУР и HIFU-аблации простаты с назначением андрогенной депривации в адъювантом режиме (n=38).
В качестве андрогенной депривации применяли аналоги ЛГРГ в сочетании с периферическими блокаторами андрогеновых рецепторов. HIFU-аблация простаты проводилась на аппарате Ablatherm Integrated Imaging® (фирма-производитель EDAP TMS, Франция). Оценку и анализ лечебного патомор-фоза проводили через 2–18 месяцев после лечения. Для этого всем пациентам выполняли контрольную биопсию простаты, МРТ, ТРУЗИ, ЦДК, определяли уровень ПСА, однако в данной работе приводится только морфологическая оценка послеоперационных результатов лечения.
Иммуногистохимические исследования проводили с помощью стрептавидин-биотинового метода с использованием системы LSAB2 System, HRP (K0675) фирмы Dako, в качестве хромогена применяли диаминобензидин (Dako). Использовали следующие антитела: Monoclonal Mouse Anti-Human Androgen Receptor Clone AR 441, фирма Dako (разведение 1:50); Monoclonal Mouse Antibody-Human Vascular Endothelial Growth Factor (VEGF) CloneVG1, фирма Dako (разведение 1:50); Monoclonal Mouse Anti-Human Е-cadherin Clon NCH-38, фирма Dako (разведение 1:50); Monoclonal Mouse Anti-Human Ki-67 Antigen Clone MIB-1, фирма Dako (разведение 1:100); AMACR Rabbit Polyclonal Antibody RP 134 R, фирма Diagnoatic BioSystems (разведение 1:50); Monoclonal Mouse anti-Bcl-2 oncoprotein, фирма Dako (разведение 1:50); Monoclonal Mouse Anti-Human р53 Protein (клон D07, разведение 1:100), фирма Dako. Результаты экспрессии цитоплазматических и мембранных маркеров (AMACR, Вcl-2, Ecad, VEGF) оценивали полуколичественным методом по шкале от 0 до 3, с учетом выраженности реакции: 0 — отсутствие реакции, 1 — слабая реакция, 2 — умеренная реакция, 3 — выраженная реакция маркера. Результаты с ядерным антигеном (Andr и р53, Ki-67) оценивали по подсчету histochemical score (Hs): Hs =∑ P ( i ) * i , где i — интенсивность окрашивания, выраженная в баллах от 0 до 3; P ( i ) — процент окрашенных клеток.
Обработку данных осуществляли при помощи пакета программ статистической обработки результатов SSPS 13.0 for Windows. Тестирование полученных данных на нормальность распределения проводили тестом Колмогорова — Смирнова. При анализе результатов иммуногистохимической экспрессии для определения значимости различий между двумя зависимыми выборками (до и после лечения) использовали Т-критерий Вилкоксона. Значимость различия принималась при Т≤0,01.
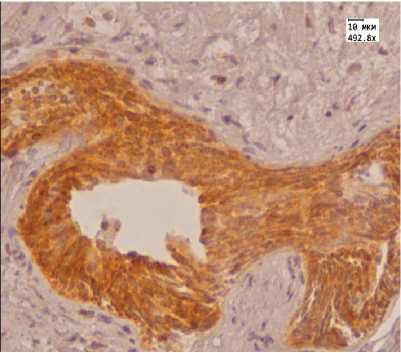
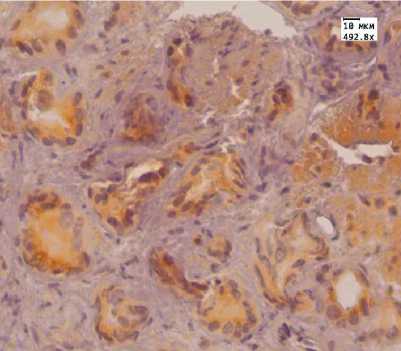
Результаты. При иммуногистохимическом исследовании с антителами к онкомаркеру альфа-ме-тилацил-КоА-рацемазе (AMACR) до лечения в обеих группах пациентов наблюдали выраженную и умеренную цитоплазматическую экспрессию данного маркера в виде мелких зерен коричневого цвета. Слабой и отрицательной экспрессии не было. После лечения у пациентов 1-й группы экспрессия данного маркера в простате у 27,5% пациентов оставалась на высоком уровне, у 47,5% она была слабой и отрицательной (рисунок: А, Б).
После лечения у пациентов 2-й группы экспрессия данного маркера снижалась: у 5% пациентов экспрессия оставалась на высоком уровне, у 57,5% пациентов была слабой. При статистическом анализе полученных данных с помощью Т-критерия Вил-коксона полученное эмпирическое значение T находилось в зоне значимости. Таким образом, различия в уровнях выборок существенные (таблица).
Для оценки пролиферативной активности, определения степени злокачественности аденокарциномы использовали маркер Ki-67. До лечения в обеих группах пациентов в аденокарциноме пролиферативная активность опухолевых клеток у 90% пациентов была умеренной и сильной. Слабая реакция была лишь у 2,5% пациентов, отрицательной реакции не было. Показатели гистосчета находились в пределах Hs= от 140 до 270 (медиана 180). После лечения у пациентов 1-й группы показатели гистосчета снижались: Hs= от 0 до 160 (медиана 45). Сильной реакции у пациентов не наблюдалось, у 75% пациентов экспрессия данного ядерного маркера была отрицательной и слабой. Сравнивая показатели групп до и после лечения по критерию Вилкоксона, установили, что полученное эмпирическое значение T находится в зоне значимости. После лечения у 67,5% пациентов 2-й группы преобладала слабая реакция: Hs= от 0 до 100 (медиана 30), у 25% реакция была отрицательной. Сравнивая показатели групп до и после лечения по критерию Вилкоксона, мы также получили существенные различия.
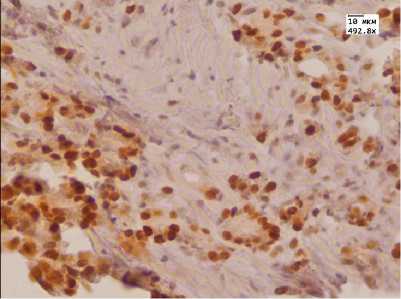
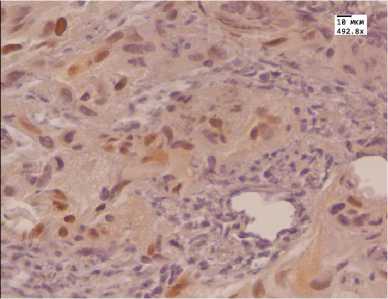
Ядерная экспрессия антител к рецепторам андрогенов на исходном этапе у 70% пациентов в обеих группах была выраженной (медиана Hs=190). У 30% пациентов отмечалась умеренная и слабая экспрессия данного маркера, показатели гистосчета у 68 % пациентов были выше 100 (медиана Hs=138). Количество рецепторов к андрогенам после лечения у пациентов 1-й группы оставалось на достаточно высоком уровне (медиана Hs=145). У 57,5% реакция была выраженной, у 25% пациентов умеренной. Критерий Вилкоксона не показал существенных различий между группами. После лечения у пациентов 2-й группы экспрессия маркера к рецепторам андрогенов заметно снижалась и у 82,5% пациентов была слабой и отрицательной (рисунок: В, Г). При статистическом анализе полученное эмпирическое значение T находится в зоне значимости, различия в уровнях выборок до и после лечения можно считать существенными.
При анализе экспрессии цитоплазматического и мембранного иммуногистохимического маркера Всl-2 до лечения в обеих группах мы получили следующие результаты: у 60% пациентов была выраженная экспрессия данного маркера, у 30% умеренная.
После лечения в 1-й группе у 77,5% пациентов экспрессия данного маркера была выраженной, у остальных пациентов умеренной. При статистической обработке данных групп мы не получили существенных различий между ними. После лечения у 50% пациентов 2-й группы экспрессия снижалась и становилась слабой, а у 12,5% она была от-
А
Б
В
Г
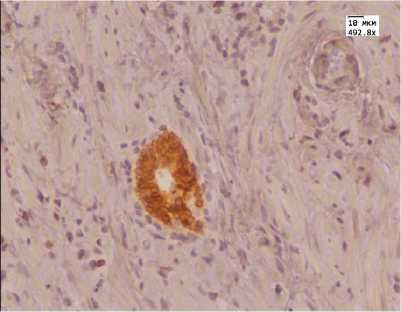
Д
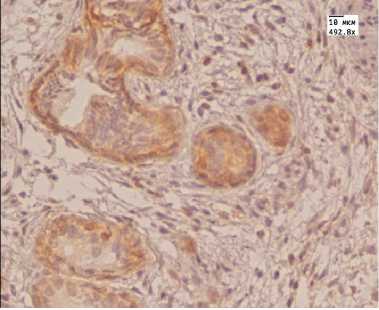
Е
Аденокарцинома простаты (Ув. 492,8): А — иммуногистохимическая реакция с антителом к AMACR до лечения HIFU-аблацией; Б — иммуногистохимическая реакция с антителом к AMACR после лечения HIFU-аблацией; В — иммуногистохимическая реакция с антителом Androgen до лечения МАБ; Г — иммуногистохимическая реакция с антителом Androgen после лечения МАБ; Д — иммуногистохимическая реакция с антителом к Bcl-2 до лечения МАБ; Е — иммуногистохимическая реакция с антителом к Bcl-2 после лечения МАБ
Экспрессия иммуногистохимических маркеров до и после лечения
|
Интенсивность экспрессии |
До лечения пациентов, % |
После лечения пациентов, % |
||
|
AMACR |
||||
|
1-я группа* |
2-я группа* |
1-я группа* |
2-я группа* |
|
|
+++ |
32,5 |
30 |
27,5 |
5 |
|
++ |
67,5 |
70 |
25 |
37,5 |
|
+ |
0 |
0 |
25 |
57,5 |
|
Отрицательная |
0 |
0 |
22,5 |
0 |
Окончание таблицы
Мембранная экспрессия антитела к Е-кадгерину до лечения у большинства пациентов (82,5%) обеих групп была выраженной и умеренной. После лечения у пациентов 1-й группы экспрессия данного маркера снижалась: лишь у 20% пациентов оставалась выра- женной, у 49% пациентов была отрицательной и слабой. При статистическом анализе Т-критерия полученное эмпирическое значение находится в зоне значимости, различия в уровнях выборок можно считать существенными. После лечения у пациентов 2-й группы экспрессия данного маркера снижалась незначительно, у 57,5% пациентов оставалась выраженной, у 17,5% умеренной, у 25% слабой и отрицательной. В результате сравнительного статистического анализа различия в уровнях выборок до и после лечения были несущественными.
При сравнительном изучении экспрессии антитела к васкулоэндотелиальному фактору роста (VEGF) у большинства пациентов экспрессия до лечения была умеренной и слабой (82%). После лечения у пациентов 1-й группы экспрессия VEGF немного снижалась, но по-прежнему преобладали пациенты с умеренной и слабой экспрессией (67,5%). После лечения у пациентов 2-й группы в 80% случаев экспрессия была слабой и умеренной. При обоих методах лечения различия в группах были статистически не значимы.
При анализе ядерной экспрессии маркера регуляции клеточного цикла р53 в группе пациентов до терапии показатели гистосчета у 79% пациентов показали выраженную реакцию, у 17,5% пациентов умеренную, у 12,5% слабую и отрицательную. После лечения у пациентов 1-й группы ядерная экспрессия данного маркера заметно снижалась, и лишь у 10% гистосчет показал выраженную реакцию, а у 75% пациентов реакция была отрицательной и слабой. При статистическом анализе теста Вилкоксона полученное эмпирическое значение T находилось в зоне значимости, различия в уровнях выборок до и после лечения можно считать существенными. После лечения у пациентов 2-й группы ядерная экспрессия данного маркера снижалась, и лишь у 5% гистосчет показал выраженную реакцию, а у 75% пациентов реакция с данным маркером была слабая или отрицательная. При статистическом сравнении этих групп полученное эмпирическое значение T находилось в зоне значимости, различия в уровнях выборок до и после лечения можно считать существенными.
Обсуждение. Уровень сывороточного ПСА является важнейшим признаком, позволяющим судить об эффективности лечения и о рецидивах опухоли [13]. В нашем исследовании у пациентов 1-й группы после лечения уровень ПСА крови снижался ниже дискриминационного уровня и в тканях простаты существенно снижалась экспрессия онкомаркера AMACR, маркера пролиферации Ki-67, маркера регуляции клеточного цикла р53, маркера клеточной адгезии Е-кадгерина. У пациентов 2-й группы после лечения уровень ПСА крови также снижался ниже дискриминационного уровня, и в простатической ткани существенно снижалась экспрессия онкомаркера AMACR, маркера пролиферации Ki-67, маркера регуляции клеточного цикла р53, маркера рецепторов к андрогенам и маркера апоптоза Вcl-2.
Таким образом, три иммуногистохимических маркера независимо от способа лечения аденокарциномы существенно снижаются при нормальных показателях ПСА. Значение онкомаркера AMACR и маркера пролиферации Ki-67 в диагностике и оценке лечебного патоморфоза признают и другие авторы [14–16]. Значение маркера регуляции клеточного цикла в оценке результатов лечения РП, по данным литературы, спорно [17, 18]. Однако в нашем исследовании у пациентов после лечения с уровнем ПСА ниже дискриминационного было существенное снижение экспрессии данного маркера в обеих группах. После лечения РП в обеих группах у пациентов снижалась и экспрессия Е-кадгерина, маркера межклеточной адгезии. Вероятно, это связано со специфическим воздействием высокоинтенсивного ультразвука на межклеточные адгезивные связи, так как в работах других авторов до лечения не выявлено корреляции уровня ПСА с экспрессией Е-кадгерина [19]. После проведенного лечения у пациентов 2-й группы в ядрах опухолевых клеток также существенно снижалась экспрессия антитела к рецепторам андрогенов, экспрессия Вcl-2, который повышает выживаемость опухолевых клеток и способствует опухолевой прогрессии, ингибируя апоптоз. VEGF (васкулоэндо-телиальный фактор роста) повышает способность эндотелиальных клеток к миграции, а опухолевых клеток к инвазии и метастазированию. В группах пациентов после лечения снижение экспрессии данного маркера были несущественными. Данные результаты совпадают с выводами других авторов, которые указывают, что экспрессия данного маркера не выявила статистически значимой прогнозирующей ценности при РП [20].
Заключение. Исследование показало, что ПСА крови, определяемое у пациентов с ацинарной аденокарциномой простаты после различных методов лечения, не всегда является объективным показателем его эффективности. Проведенное после лечения иммуногистохимическое исследование ткани опухоли на пролиферативную активность опухолевых клеток, активацию в них апоптоза, а также оценки специфических онкомаркеров и генов супрессоров опухоли показали, что снижение экспрессии всех указанных маркеров у пациентов с показателями ПСА крови ниже дискриминационного наблюдается у всех больных независимо от вида лечения. Однако после лечения в 1-й группе пациентов, несмотря на достижение показателя ПСА уровня nadir, наблюдается снижение экспрессии маркера межклеточной адгезии Е-кадгерина, что свидетельствует о повышении риска метастазирования опухоли, а также увеличении экспрессии маркеров ингибитора апоптоза Всl-2 и андрогенов, что свидетельствует о возможности прогрессирования опухолевого роста. Таким образом, для более точной и комплексной оценки лечебного патоморфоза у больных раком простаты высокого риска прогрессирования, которым проведена монотерапия методом HIFU-аблации, наряду с определением уровня ПСА крови, необходимо при контрольной биопсии простаты проведение иммуногистохимического исследования ткани опухоли для определения прогноза и риска развития рецидива.
Список литературы Прогностическая значимость оценки экспрессии иммуногистохимических маркеров и степени патоморфоза до и после лечения больных раком простаты высокого риска прогрессирования
- Русаков И. Г., Мишуткин С. В. Рак предстательной железы: тенденции и перспективы. Медицинский совет 2017; 14: 78-81
- Каприн А. Д., Троянов А. В., Иванов С. А., Карякин О. Б. Комплексное гормонохимиолучевое лечение больных неметастатическим раком предстательной железы группы высокого и очень высокого риска прогрессирования. Онкоурология 2017; 13 (1): 101-11
- Фомкин Р. Н., Глыбочко П. В., Попков В. М., Блюмберг Б. И. Лечение рака простаты у больных пожилого и старческого возраста высокоинтенсивным сфокусированным ультразвуком. Клиническая геронтология 2011; 17 (9-10): 27-33
- D'Amico AV, Whittington R, Malkowicz SB, et al. Pretreatment nomogram for prostate-specifc antigen recurrence after radical prostatectomy or external-beam radiation therapy for clinically localized prostate cancer. J Clin Oncol 1999; 17 (1): 168-72
- Heidenreich A, Bastian PJ, Bellmunt J, et al. Guidelines on Prostate Cancer. European Association of Urology, 2012
- Shao YH, Demissie K, Shih W, et al. Contemporary risk profle of prostate cancer in the United States. J Natl Cancer Inst 2009; 101 (18): 1280-3
- Фомкин Р. Н., Попков В. М., Блюмберг Б. И., Бромберг Б. Б. Эффективность высокоинтенсивной сфокусированной ультразвуковой абляции в лечении рака простаты высокой степени онкологического риска. Вестник Российской военно-медицинской академии 2013; 44 (4): 55-60
- Нюшко К. М., Алексеев Б. Я., Крашенинников А. А., Каприн А. Д. Хирургическое лечение больных раком предстательной железы с высоким риском прогрессирования. Онкоурология 2014; 10 (2): 38-45
- Бирманн К., Белтран А. Л. и др. Гистопатологические результаты после лечения рака предстательной железы использованием высокой интенсивности сфокусированного ультразвука (HIFU). Простата 2010; 11: 1196-200
- Фомкин Р. Н., Воронина Е. С., Попков В. М. и др. Патоморфоз рака предстательной железы при лечении высокоинтенсивным сфокусированным ультразвуком (HIFU). Онкоурология 2013; 1: 55-62
- Фомкин Р.Н., Воронина Е. С., Попков В. М., и др. Прогностическое значение молекулярно-биологических, морфологических и клинических маркеров в оценке эффективности лечения локализованного рака предстательной железы высокоинтенсивным сфокусированным ультразвуком. Экспериментальная и клиническая урология 2013; 4: 29-33
- Anand ODE, Satyanarayana RP, Kumar CK, Bhaskar RV. Diagnostic Utility of Immunohistochemical Markers in Prostate Cancer. Journal of Dental and Medical Sciences (IOSR-JDMS) 2017; 16 (3): 22-8
- Курзанов А. Н., Стрыгина Е. А., Медведев В. Л. Диагностические и прогностические маркеры рака предстательной железы. Современные проблемы науки и образования 2016; 2 URL: http://www.science- education.ru / ru / article / view? id=24439
- Paner GP, Luthringer DJ, Amin MB. Best practice in diagnostic immunohistochemistry: prostate carcinoma and its mimics in needle core biopsies. Arch Pathol Lab Med 2008; 132 (9): 1388-96. 10.1043 / 1543-2165 (2008)
- DOI: 10.1043/1543-2165(2008)
- Hameed O, Humphrey PA. Immunohistochemistry in diagnostic surgical pathology of the prostate. Semin Diagn Pathol 2005; 22 (1): 88-104
- Gobbo AD, Pellegrinelli A, Gaudioso G, et al. Analysis of NSCLC tumour heterogeneity, proliferative and 18F-FDG PET indices reveals Ki67 prognostic role in adenocarcinomas. Histopathology 2016; 68 (5): 746-51
- Saito H, Kitagawa K, Yoneda T, et al. Combination of p53-DC vaccine and rAd-p53 gene therapy induced CTLs cytotoxic against p53-deleted human prostate cancer cells in vitro. Cancer Gene Therapy 2017; 24: 289-96
- Gobbo AD, Ferrero S. Immunohistochemical Markers as Predictors of Histopathologic Response and Prognosis in Rectal Cancer Treated with Preoperative Adjuvant Therapy. Gastroenterology Research and Practice 2017; 2017: 2808235
- Hsu Y-S, Wang JS, Wu TT. E-Cadherin Expression in Prostate Adenocarcinomas in Chinese and Its Pathological Correlates. Urol Int 2004; 73: 36-40
- Liu Z-Q, Fang J-M, Xiao Y-Y, et al. Prognostic role of vascular endothelial growth factor in prostate cancer: a systematic review and meta-analysis. Int J Clin Exp Med 2015; 8 (2): 2289-98.


