Прогностические факторы выживаемости после повторных коронарных реваскуляризирующих вмешательств при рестенозах стентов на основе сравнительного анализа результатов ангиографического и ультразвукового методов исследований
Автор: Федорченко А.Н., Осиев А.Г., Кочкина Т.А., Протопопов А.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 3 т.11, 2007 года.
Бесплатный доступ
На основе многоцентрового клинического исследования, объединившего результаты чрескожных коронарных вмешательств у 133 больных с ИБС в течение 18 мес. определены прогностические факторы развития осложнений после повторных вмешательств при рестенозах стентированных коронарных артерий с использованием методов коронарной ангиографии и внутрисосудистого коронарного исследования. В результате проведенного анализа нами установлено, что единственным независимым прогностическим фактором благоприятных клинических результатов повторных вмешательств является площадь поперечного сечения сосуда. Рассчитано пограничное значение площади поперечного сечения сосуда, равное 4, 7 мм2. Для больных с площадью сосуда более 4, 7 мм2 выживаемость без осложнений составила 91 ± 8 %, для пациентов с площадью менее 4,7 мм2- 69 ± 15 % (р = 0,008). Благоприятные клинические результаты у больных с большей площадью поперечного сечения сосуда (>4,7 мм2) свидетельствуют об отсутствии необходимости применения дополнительных реваскуляризирующих методик. Тогда как у больных, где достижение большего размера сосуда невозможно (в силу анатомических причин или особенностей вмешательства), необходимо применение агрессивных методов терапевтического воздействия (внутрисосудистое облучение как вариант).
Короткий адрес: https://sciup.org/142233383
IDR: 142233383
Текст научной статьи Прогностические факторы выживаемости после повторных коронарных реваскуляризирующих вмешательств при рестенозах стентов на основе сравнительного анализа результатов ангиографического и ультразвукового методов исследований
А.Н. Федорченко*, А.Г. Осиев**,Т.А. Кочкина***, А.В. Протопопов***
-
* Краевая клиническая больница № 1 им. С.В. Очаповского, Краснодар
-
* * ФГУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина Росмедтехнологий» *** Краевая клиническая больница, Красноярск
На основе многоцентрового клинического исследования, объединившего результаты чрескожных коронарных вмешательств у 133 больных с ИБС в течение 18 мес. определены прогностические факторы развития осложнений после повторных вмешательств при рестенозах стентированных коронарных артерий с использованием методов коронарной ангиографии и внутрисосудистого коронарного исследования. В результате проведенного анализа нами установлено, что единственным независимым прогностическим фактором благоприятных клинических результатов повторных вмешательств является площадь поперечного сечения сосуда. Рассчитано пограничное значение площади поперечного сечения сосуда, равное 4,7 мм2. Для больных с площадью сосуда более 4,7 мм2 выживаемость без осложнений составила 91±8%, для пациентов с площадью менее 4,7 мм2 - 69±15% (р=0,008). Благоприятные клинические результаты у больных с большей площадью поперечного сечения сосуда (>4,7 мм2) свидетельствуют об отсутствии необходимости применения дополнительных реваскуляризирующих методик. Тогда как у больных, где достижение большего размера сосуда невозможно (в силу анатомических причин или особенностей вмешательства), необходимо применение агрессивных методов терапевтического воздействия (внутрисосудистое облучение как вариант).
До настоящего времени не определен оптимальный метод лечения рестенозов стентов. Повторная баллонная ангиопластика может считаться приемлемым методом лечения при коротких (<10 мм) рестенозах, с частотой возникновения повторных рестенозов от 14 до 31% [1,3] и благоприятными клиническими результатами в течение года (частота побочных событий 8-17%) [3, 11]. Однако при протяженных поражениях (>10 мм) баллонная ангиопластика сопровождается высокой частотой ангиографических рестенозов и неблагоприятных клинических событий [1,3, 11, 14]. Альтернативные методики, направленные на удаление материального компонента рестеноза из стентированного сегмента (лазер, ротационная и направленная атерэктомия), могут улучшать клинические результаты у этой категории больных. Какая-либо информация о превосходстве одной методики над другой в литературе отсутствует или представлена отрывочно. В нерандомизированном исследовании, включающем 821 больного, не было обнаружено различий по исходам после баллонной ангиопластики, лазерной и ротационной атерэктомий и имплантацией дополнительных стентов. Частота необходимости вы полнения повторных реваскуляризаций в течение 1 года составила от 23 до 31% [10].
Механизм, результаты повторных ангиопластик, детальный анализ просвета сосуда и стентированного сегмента возможно тщательно исследовать с использованием метода внутрисосудистого ультразвукового исследования (ВСУЗИ). Общепринятым механизмом увеличения просвета сосудистого сегмента после повторной ангиопластики считается комбинация перераздувания стента большим давлением и уменьшения объема неоинтимы в стентированном сегменте [8, 13]. Однако теоретически логично предположить, что комплексное применение атерэктомии с баллонной ангиопластикой в лечении больных с рестенозами стентов может иметь потенциальные преимущества по причине достижения большего диаметра сосудистого сегмента после такого вмешательства, чем только баллонная ангиопластика, благодаря выраженному уменьшению объема неоинтимы и меньшей степени перераздувания стента [4, 9, 14]. Данные о том, что имеет большее значение для клинических результатов - перераздувание стента или уменьшение объема неоинтимы - противоречивы. Таким образом, цель нашего иссле- дования - определение влияния двух механизмов увеличения просвета сосуда - переразду-вание стента и уменьшение объема неоинти-мальной ткани - на клинические результаты у больных после повторных вмешательств по поводу рестенозов стентов при наблюдении в течение 1 года.
МАТЕРИАЛ И МЕТОДЫ
В проспективное регистрационное многоцентровое исследование вошли 133 больных, которым на базе научно-исследовательского института патологии кровообращения им. акад. Е.Н. Мешалкина (Новосибирск), краевой клинической больницы № 1 им. С.В. Очаповского (Краснодар) и краевой клинической больницы (Красноярск) выполнялись повторные вмешательства по поводу рестенозов стентов. Регистрировалась клиническая и ангиографическая информация на момент имплантации стента, повторного вмешательства и в течение периода наблюдения. Повторные вмешательства выполнялись с применением ВСУЗИ.
В качестве повторных вмешательств рассматривались две методики: баллонная ангиопластика и сочетание ротационной атерэктомии (Rotablator, Heart Technology Inc.) с баллонной ангиопластикой. Характер вмешательства определялся рентгенохирургом на основании диаметра сосуда, степени стеноза и длины поражения. Ротационная атерэктомия в сочетании с баллонной ангиопластикой преимущественно использовалась при протяженных и критических поражениях. При баллонной ангиопластике применяли баллонный катетер, по возможности, равный диаметру имплантированного стента. Дилатацию проводили высоким давлением (>10 атм.). Повторной имплантации стентов намеренно избегали.
При ротационной атерэктомии использовали несколько буров в возрастающих диаметрах для достижения соотношения диаметров бур/ артерия 0,75. Размер бура подбирали с помощью ВСУЗИ. Дополнительно выполняли баллонную дилатацию низким давлением для достижения адекватных ангиографических и ультразвуковых результатов. Блокаторы GP IIb/IIIa рецепторов тромбоцитов не использовали. На рутинной основе все больные получали сочетанную антиагрегантную терапию тиенопи-ридинами и аспирином в течение, как минимум, одного месяца.
Данные коронарографии оценивались до и после вмешательства с помощью количествен ного анализа по оптимальной проекции для исследуемого артериального сегмента. Определяли средний диаметр сосуда, диаметр сосуда в непораженной части (референтный размер), степень стеноза и длину поражения.
Внутрисосудистое ультразвуковое исследование выполнялось с помощью 20 MHz механического ультразвукового трансдъюссера и ультразвукового сканера In-Vision Gold (Volcano Ther.). Изображение записывалось на S-VHS видеокассету в режиме автоматического возвратного перемещения датчика со скоростью 0,5 см/с. Для исследований выбирали срезы с минимальной площадью просвета сосуда и лучшей визуализацией структур стента. Поперечная площадь сосуда и стента измерялась в режиме ручной планиметрии. В качестве ориентиров использовали гиперэхогенные структуры стентов. Продольная реконструкция исследуемых сегментов выполнялась на основе записанных изображений во время автоматического возвратного движения датчика. Площадь неоинтимы в стенте рассчитывалась как «площадь поперечного сечения стента» минус «площадь поперечного сечения сосуда». Так же вычисляли величину уменьшения объема неоинтимы.
Клинические результаты оценивались в течение 18 мес. после вмешательства по поводу рестеноза стента. Состояние больных оценивали на основании данных историй болезней и амбулаторных карт, обращая внимание на возникновение побочных событий и выраженность симптомов заболевания. Дополнительная информация поступала от участковых врачей поликлинических приемов. Повторные коронарографии выполняли всем больным с многососудистым поражением и при возникновении или усилении симптомов стенокардии. К контрольным клиническим точкам относили смерть от любых причин, инфаркт миокарда, нестабильную стенокардию, потребность в выполнении повторных реваскуляризаций и ангиографически подтвержденный рестеноз. Определение этих побочных событий были заимствованы нами из литературных источников по сходной тематике исследований [1-3, 6-8, 11, 14].
Продолженные значения рассчитывались как средние (±1 стандартное отклонение); качественные значения представлялись в виде процентных показателей. Сравнение качественных показателей между группами проводили с использованием теста Фишера или вероятностного соотношения chi-square. Продолженные значения сравнивали с помощью t-теста Стьюдента или u-теста Манн-Уитни. Тест Уилкоксо- на применяли для индивидуальных сравнений. Для определения прогностических факторов развития клинических событий использовали многофакторный логистический регрессивный анализ (с включением всех факторов со значением р<0,10, по данным однофакторного анализа). Значение р<0,05 принималось как статистически значимое.
РЕЗУЛЬТАТЫ
Из 133 больных, включенных в наше исследование, в 63 случаях повторная коронарография выполнялась без ВСУЗИ. У 70 больных для диагностики рестенозов стентов использовали обе методики визуализации. Дальнейшему анализу подвергались 70 больных с комбинированной диагностикой - коронарографией и ВСУЗИ. Показаниями для имплантации стентов в коронарные артерии у наших больных были: субоптимальные результаты баллонной ангиопластики у 43 (61%) больных, диссекции типа С и Д в 16 (23%) случаях, как принятая методика у 7 (10%) больных с ОИМ и при реканализации хронической окклюзии коронарных артерий в 4 (6%) случаях. Использовали стенты MultiLink (Guidant) у 31 больного, FlexMaster F1 (Abbot VD) у 29 больных и R-stent (Orbus Mt) в 10 случаях. Имплантацию стентов проводили высоким давлением (>12 атм.). Средний диаметр сосуда во время имплантации, по данным коронарографии, составлял 2,30±0,42 мм. Все пациенты получали антиагрегантную терапию ти-енопиридинами в сочетании с аспирином.
Повторные коронарографии выполняли при рецидиве симптомов стенокардии в 35 (50%) случаях, немой ишемии, выявленной при нагрузочном тестировании в 16 (23%) случаях и при систематическом контроле у 19 (27%) больных. Рестеноз определялся нами при уменьшении диаметра стентированного сегмента >50% от исходного после первичного вмешательства. У двоих больных были выявлены тотальные окклюзии, пять больных имели рестенозы после выполнения баллонной ангиопластики по поводу рестеноза стента. Средний временной интервал между имплантацией стента и повторным вмешательством составлял 166±78 дней.
Как выяснилось при сопоставлении полученных данных, больные из группы с выполненной ротационной атерэктомией и баллонной ангиопластикой характеризовались меньшим средним диаметром сосудов при коронарографии, меньшей площадью поперечного сечения сосуда, протяженным поражением и меньшим диаметром сосуда в непораженном сегменте. У этих же больных отмечалась большая площадь гиперплазии неоинтимы в стенте (табл. 1).
В результате вмешательств, по данным коронарографии, увеличивался средний диаметр
Таблица 1
Результаты коронарографии и ВСУЗИ до повторного вмешательства
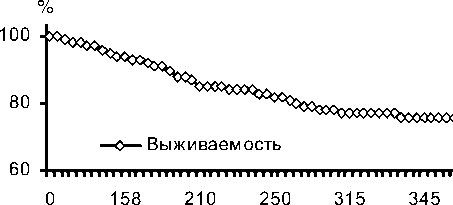
Среднее время наблюдения за пациентами, включенными в наше исследование, составило 166 дней (от 120 до 300 дней у больных без осложнений и от 60 до 225 дней у больных с побочными событиями). За время наблюдения у 14 больных (20%) отмечено возникновение побочных нежелательных явлений (осложнений). Умерли 2 пациента - от ОНМК и внезапной смерти; в 12 случаях зарегистрирован рецидив стенокардии и рестеноз при коронарографии -четверым больным выполнено коронарное шунтирование, в 7 случаях произведены повторные ангиопластики, один больной находится на медикаментозной терапии. График выживаемости больных без осложнения представлен на рис. 1, вероятность выживаемости по итогам года составила 0,76±0,05.
Клинические данные и характеристика выполненных вмешательств исследуемым больным с осложнениями и без них представлены в табл. 3. Сравнение этих двух групп больных не выявило различий в А поперечного сечения неоинтимы (1,3±1,3 и 1,3±2,4 мм2, р=0,90) и в А поперечного сечения стента (1,3±1,3 и 1,8±1,9 мм2, р=0,25). Все доступные параметры были включены в многофакторный анализ ( А поперечного сечения стента, А поперечного сечения неоинтимы, площадь поперечного сечения сосуда (ПСС), тип вмешательства, окончательный средний диаметр сосуда по данным коронарографии, протяженность поражения).
В результате проведенного анализа нами установлено, что единственным независимым прогностическим фактором благоприятных клинических результатов повторных вмешательств была площадь поперечного сечения сосуда (отношение шансов 4,5 при 95% доверительном интервале, р=0,03 на каждый дополнительный 1 мм2). С помощью дискриминантного анализа мы установили пограничное значение ПСС со-
Таблица 2
Результаты коронарографии и ВСУЗИ после повторных вмешательств
Таблица 3
Сравнительные характеристики больных с осложнениями и пациентов без побочных событий
**** соотношения chi-square
* t-теста Стьюдента; ** U-теста Манн-Уитни; *** теста Фишера;
Дни
Рис. 1. Выживаемость больных без побочных неблагоприятных событий в течение года.
Дни
^^ ППС>4,7 мм2
-6— ППС<4,7 мм2
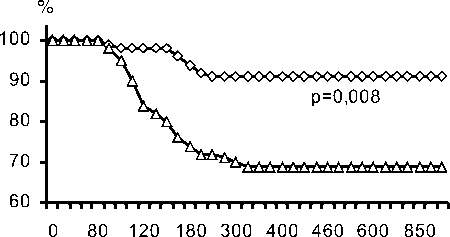
Рис. 2. Выживаемость больных в зависимости от ППС сосуда после вмешательства.
суда, равное 4,7 мм2. Согласно полученному значению, мы разделили исследуемых больных на группы в зависимости от этого показателя: 35 пациентов имели ППС больше 4,7 мм2 и 35 больных - меньше 4,7 мм2. Актуарные кривые выживаемости больных двух групп приведены на рис. 2. Для больных с площадью сосуда более 4,7 мм2 возможность выживаемости без осложнений составила 91±8%, для пациентов с площадью менее 4,7 мм2 - 69±15% (р=0,008).
ОБСУЖДЕНИЕ
На основании проведенного исследования нам удалось установить, что клинические исходы лечения больных с рестенозами стентов в большей мере зависят от ППС сосуда после вмешательства и не зависят от механизма и метода вмешательства. С помощью ВСУЗИ стало возможным изучить механизм увеличения просвета стентированного сосудистого сегмента после вмешательства при рестенозах: перераздувание стента и уменьшение объема неоинтимы в стенте [8]. При баллонной ангиопластике оба механизма имеют равное значение для увеличения про света [8, 13]; при комбинированных вмешательствах, включающих атерэктомию и баллонную ангиопластику, наблюдается меньшая степень перераздувания и большее уменьшение объем а неоинтимы [9]. В нашем исследовании 40 больным выполняли баллонную ангиопластику и 30 больным - атерэктомию и баллонную ангиопластику. Оба типа вмешательств сопровождались высокой степенью перераздувания стентов (2,2±2,0 мм2, в среднем) и уменьшения неоинтимы (1,3±2,1 мм2, в среднем).
Вид вмешательства определяло я выбором хирурга на основе данных коронарографии. В результате такого подхода пациенты с выполненной атерэктомией и баллонной ангиопластикой имели более длинные поражения и меньший диаметр и ППС сосудов. Однако после окончания вмешательств не отмечалось разницы между группами в показателях среднего диаметра сосудов и ППС. Как и ожидалось, в группе баллонной ангиопластики зафиксирована большая степень перераздувания стентов (2,4±1,6 и 1,9±2,0 мм2, р=0,03) и меньшее уменьшение площади неоинтимы (0,7±2,2 и 2,1±2,1 мм2, р=0,01), чем у больных с сочетанием атерэктомии и баллонной ангиопластики. Такие различия в механизмах увеличения сосудистого просвета согласуются с данными других исследователей [4, 5, 9, 14].
В нашем исследовании частота возможной выживаемости в течение года составила 76±5% и сочеталась с общей частотой развития осложнений в 20% случаев. Частота неблагоприятных побочных событий в группе баллонной ангиопластики составила 25%. Это совпадает с литературными данными (частота развития осложнений от 14 до 46% после проведения баллонной ангиопластики по поводу рестенозов) [3, 8, 14]. Данные других исследований по эффективности комбинированного применения атерэктомии и баллонной ангиопластики продемонстрировали частоту побочных событий от 19 до 35% на протяжении года [2, 14, 15]. В нашем исследовании такой показатель зарегистрирован на уровне 13%, что может быть объяснено короткой длиной поражений (12,7±7,4 мм).
Некоторые авторы утверждают, что сочетанное применение атерэктомии и баллонной ангиопластики ведет к лучшим клиническим результатам, чем изолированная баллонная ангиопластика [2, 4, 6, 8, 14]. Несмотря на то, что целью нашего исследования не было сравнение двух методик, мы не можем не отметить, что в группе сочетанных вмешательств достиг- нута положительная тенденция в отдаленных результатах (13% осложнений при сочетанных вмешательствах, 25% - при баллонной ангиопластике, р=0,22). Такая тенденция отмечена нами, несмотря на большую длину поражений в группе комбинированных вмешательств.
Гипотеза о существенном влиянии уменьшения объема неоинтимы и степени перераз-дувания стента на клинические исходы нами не подтверждена. Фактически, единственным значимым прогностическим фактором был показатель ППС после окончания вмешательства. Поэтому преимуществом сочетанного метода вмешательства может быть признано только достижение большего сосудистого просвета. Важность этого показателя наглядно демонстрирует анализ частоты развития неблагоприятных событий у больных с ППС сосуда более 4,7 мм2. Эти результаты могут быть согласованы с другими данными о прогностическом влиянии величины диаметра сосуда на частоту осложнений [2, 7, 8] и повторных рестенозов [12]. Однако этот вывод нельзя перенести на случаи имплантации дополнительных стентов, несмотря на достижение большего диаметра сосуда [10].
Благоприятные клинические результаты у больных с большей ППС сосуда (>4,7 мм2) свидетельствуют об отсутствии необходимости применения дополнительных терапевтических методик. Тогда как у больных, где достижение большего размера сосуда невозможно (в силу анатомических причин или особенностей вмешательства), необходимо применение агрессивных методов терапевтического воздействия (внутрисосудистое облучение как вариант).
Возможные недостатки исследования:
-
1. В исследование включались больные только с проведением ВСУЗИ; 2. В исследование вошли лишь несколько больных с выраженным диффузным характером рестенозов в стентах; 3. Исследование не планировалось как сравнительное для выявления эффективности двух методик: изолированной баллонной ангиопластики и комбинации атерэктомии и баллонной ангиопластики; 4. Больные с имплантацией дополнительных стентов не вошли в исследование; 5. Изучались клинические результаты
без применения систематической контрольной коронарографии.
ВЫВОДЫ
Наше исследование не подтвердило влияния степени перераздувания стента и уменьшения объема неоинтимы на частоту развития повторных рестенозов и клинические результаты после вмешательства. Единственным фактором благоприятного прогноза клинического течения заболевания является диаметр стентированного сегмента сосуда после вмешательства, вне зависимости от механизма и метода его увеличения.
Список литературы Прогностические факторы выживаемости после повторных коронарных реваскуляризирующих вмешательств при рестенозах стентов на основе сравнительного анализа результатов ангиографического и ультразвукового методов исследований
- Bauters C., Banos J.L., Van Belle E., et al. // Circulation. 1998. Vol. 97. P. 318-321.
- Dauerman H., Baim D., Cutlip E., et al. // Am. J. Cardiol. 1998. Vol. 82. P. 277-284.
- Elchaninof H., Koning R., Tron C., et al. // J. Am. Coll. Cardiology. 1998. Vol. 32. P. 980-984.
- EDN: ABLUCZ
- Goldberg S.L., Berger P.B., Cohen D.J., et al. // Circulation. 1998. Vol. 98 (Suppl.). P. I-363.
- Kini A., Sharma S.K., Dangas G., et al. // Circulation. 1998. Vol. 98. (Suppl.). P. 1-717.


