Прогностическое значение ангиогенных маркеров рака эндометрия (обзор литературы)
Автор: Золотухина Н.С., Гуляева Л.Ф.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 4 т.21, 2022 года.
Бесплатный доступ
Цель исследования - обобщение имеющихся данных о роли ангиогенных маркеров ангиогенеза в развитии, прогрессировании и оценке прогноза рака эндометрия. Материал и методы. Проведен поиск по ключевым словам доступных литературных источников, опубликованных в базах данных pubmed и elibrary. Использовано 56 источников, содержание которых в наибольшей мере соответствовало цели обзора. Результаты. На данный момент существует многообразие различных данных о связях между молекулярными маркерами ангиогенеза в раке эндометрия и прогнозом рака эндометрия. В статье обобщены результаты последних исследований, посвященных изучению ангиогенных маркеров рака эндометрия, а также характеристикам микроциркуляторного русла с акцентом на их прогностическое и диагностическое значение, представлено потенциальное значение использования их в клинической практике. Отдельное внимание уделяется инактивации онкосупрессорного белка pteN, ингибитора pi3K/akt/mtoR-сигнального пути, играющего большую роль в патогенезе и прогнозе рака эндометрия. Заключение. Многие из маркеров ангиогенеза могут быть использованы при оценке развития и прогноза рака эндометрия. Однако противоречивые результаты исследований в отношении некоторых маркеров требуют дальнейшего изучения, их валидации с последующим внедрением в практику.
Рак эндометрия, железистая гиперплазия эндометрия, pten, патологическая неоваскуляризация, эндотелиальный сосудистый фактор роста
Короткий адрес: https://sciup.org/140295757
IDR: 140295757 | УДК: 618.14-006.6-037 | DOI: 10.21294/1814-4861-2022-21-4-137-146
Текст научной статьи Прогностическое значение ангиогенных маркеров рака эндометрия (обзор литературы)
Рак эндометрия (РЭ) занимает 3-е место в структуре заболеваемости злокачественными новообразованиями среди женского населения России, составляя 8,0 %, и 1-е место среди опухолей женских половых органов [1]. Согласно Бохману, рак эндометрия классифицируется по 2-м типам: гормонозависимый рак эндометрия (I типа) и гормононезависимый (II типа), который встречается гораздо реже [2]. В настоящее время наблюдается большая гетерогенность течения РЭ даже в пределах клинически однородных групп пациенток, что проявляется в различной степени агрессивности опухоли, разном ответе на лечение, прогнозе и частоте метастазирования. Подобное явление связывают с тем, что среди схожих морфологических вариантов РЭ можно выделить несколько молекулярно-биологических субтипов, значительно различающихся по своему патогенезу [2].
В основе патогенеза РЭ лежит онкогенная трансформация клеток, приводящая к малигни-зации. Данный процесс зависит от активности как онкосупрессорных, так и онкогенных белков. Найдено большое количество соматических мутаций в генах PTEN, p53, K-ras, p16, BAX, β-катенин, PIK3CA и др., которые ассоциированы с клинико-морфологическими параметрами рака эндометрия [3]. Экспрессия многих из этих сигнальных молекул в клетках эндометрия связана с неоангиогенезом. Опухолевый неоангиогенез оказывает существенное влияние на такие значимые биологические характеристики опухоли, как рост, инвазия, миграция опухолевых клеток, метастазирование. Поэтому крайне актуальным является изучение процессов неоангионегеза в опухоли, а также ассоциированных с ним молекулярнобиологических маркеров.
Влияние ангиогенеза на прогноз опухолевых заболеваний
Ангиогенез представляет собой сложный процесс, в ходе которого образуются новые кровеносные сосуды из эндотелиального предшественника, что является ключевым фактором для опухолевой инвазии, миграции и метастазирования [4]. Экспериментальные данные свидетельствуют, что рост опухоли более 1–2 мм3 невозможен без развития адекватного ангиогенеза [5]. Гипотеза о существенной роли ангиогенеза в росте опухоли была впервые предложена Фолкманом в 1971 г. [6]. Опухолевые клетки для своего роста нуждаются в постоянном питании, поэтому, по Фолкману [6] и Наумову [7], способность опухолей прогрессировать от неангиогенного к ангиогенному фенотипу является центральной для прогрессирования рака и называется «ангиогенным переключателем» [8]. Этот процесс является предпосылкой для дальнейшего роста опухоли и метастазирования. Опухоли, расположенные в аваскулярных зонах, в основном остаются в состоянии покоя в течение более длительных периодов по сравнению с расположенными в хорошо васкуляризованной области. Первые связаны с поздними симптомами и поздним метастазированием по сравнению с последними [6, 8, 9]. Однако тенденция к «спячке» опухоли связана с многими факторами и не полностью зависит лишь от ангиогенеза [10].
Характерной особенностью сосудов опухоли является их экспансивный рост из-за постоянно повышенного уровня стимуляторов ангиогенеза в микроокружении, что проявляется в их морфологических изменениях и особенностях общей сосудистой архитектоники в опухоли. К морфологическим особенностям опухолевых сосудов относятся измененная форма, дилатация, высокая проницаемость, а также отсутствие четко выраженной принадлежности к известным типам сосудов (венулам, артериолам, капиллярам) [11]. Формирование сосудов в опухоли регулируется комплексом различных факторов, продуцируемых как клетками стромы, так и неопластическими клеточными элементами солидных опухолей [12].
Различные типы формирования опухолевых сосудов рассматриваются как важный фактор для прогноза онкологических заболеваний и чувствительности к противоопухолевой терапии. Выделяют пять типов формирования опухолевых сосудов: почкование, васкулогенез, кооптация, интусуспек-тивный ангиогенез и васкулогенная мимикрия [13]. Тип формирования опухолевых сосудов – это важный фактор, влияющий на их морфологию, участие в опухолевой прогрессии, прогноз заболевания и чувствительность к противоопухолевой и антиангиогенной терапии [14, 15]. Кроме того, при оценке прогностической значимости опухолевых сосудов следует учитывать не только особенности их происхождения, но также степень их зрелости, которая определяется несколькими факторами: пролиферативной активностью эндотелиальных клеток, характером покрытия сосудов перицитами, а также особенностями строения базальной мембраны [13]. Оценка роли разных типов формирования сосудов в аденокарциноме эндометрия и факторов, влияющих на степень зрелости сформированных сосудов, – важная и перспективная область для дальнейших исследований опухолей этой локализации.
Микроциркуляторное русло и его прогностическое значение при развитии рака эндометрия
Значение опухолевого ангиогенеза в качестве предиктора рецидивирования, быстрой прогрессии и метастазирования продемонстрировано при раке различных локализаций. В частности, при аденокарциноме эндометрия показано, что плотность микрососудов коррелировала с опухолевой стадией, степенью инвазии в миометрий и инвазией в лимфатическое пространство (рис. 1) [16]. В этом же исследовании у пациенток с высокими значениями плотности микрососудов отмечены более плохие показатели безрецидивной и общей выживаемости. В то же время не было обнаружено корреляции между количеством микрососудов и стадией заболевания, а также поражением лимфоузлов.
Касательно оценки связи между состоянием эндометрия и плотностью микроциркуляторного русла опубликованы противоречивые результаты. Одни исследования путем определения эндотелиального маркера CD34 показывают, что средняя плотность сосудов микроциркуляторного русла
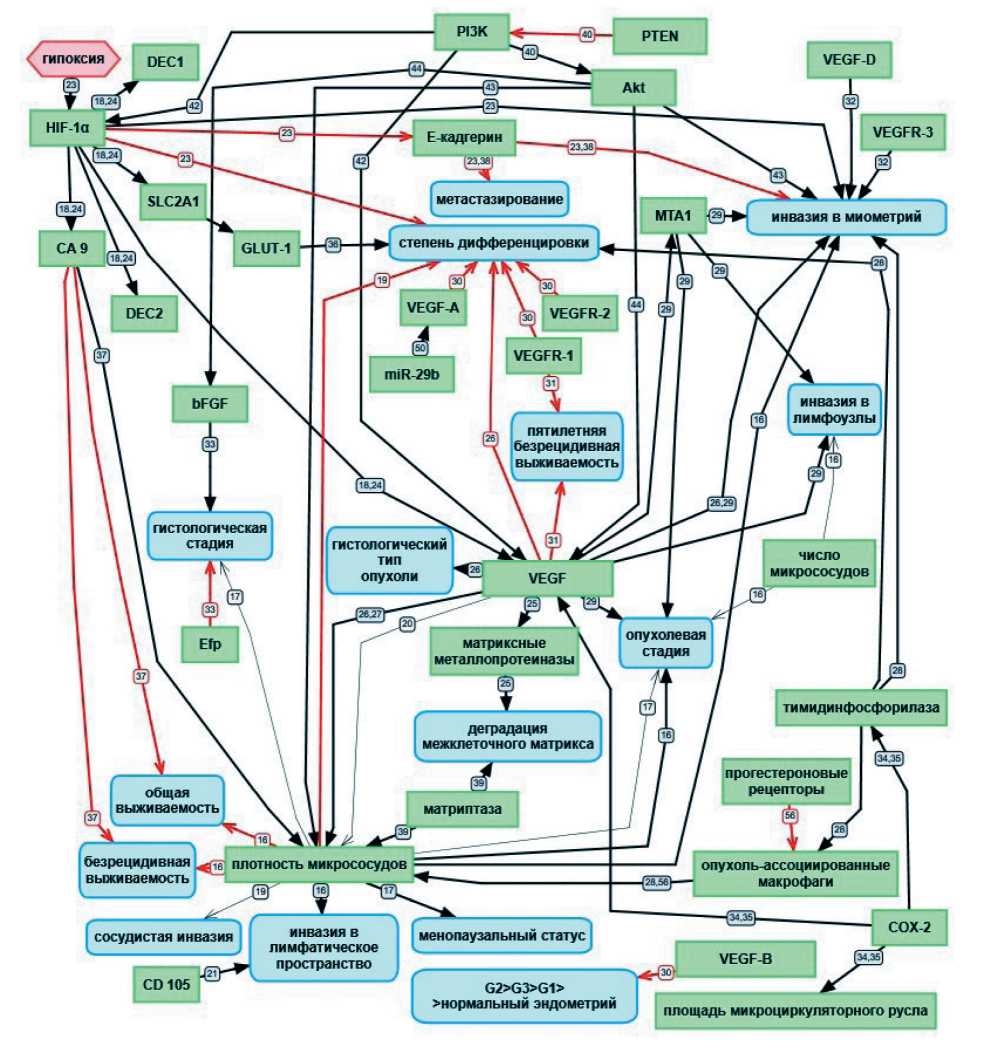
Рис. 1. Корреляционные связи между различными факторами, влияющими на ангиогенез и прогноз рака эндометрия. Черными толстыми стрелками обозначены прямые корреляционные связи. Красными стрелками обозначены обратные корреляционные связи. Черными тонкими стрелками обозначено отсутствие корреляционной связи в эксперименте. Номер на стрелке указывает на порядковый номер статьи в списке литературы
Fig. 1. Correlation between various factors influencing angiogenesis and prognosis of endometrial cancer. Black thick arrows indicate direct correlations. Red arrows indicate inverse correlations. Black thin arrows indicate the absence of a correlation in the experiment. The number on the arrow indicates the ordinal number of the article in the list of references
при комплексной железистой гиперплазии эндометрия выше по сравнению с простой железистой гиперплазией эндометрия, а при аденокарциноме эндометрия в 2 раза выше, чем в эндометрии с гиперпластическими процессами [17, 18], причем значимый прирост сосудистого русла начинается уже при РЭ I стадии, особенно в участках инвазии в миометрий. Плотность микроциркуляторного русла зависит от степени дифференцировки аденокарциномы эндометрия, и этот показатель выше при опухоли низкой степени дифференцировки [19]. Другие исследования с использованием эндотелиального маркера CD34 демонстрируют отсутствие корреляционной связи между плотностью сосудов микроциркуляторного русла при сравнении нормального эндометрия в фазе секреции, железистой гиперплазии эндометрия и аденокарциномы эндометрия (рис. 2) [20].
O. Abulafia et al. [19] указывают на наличие корреляционной связи между плотностью сосудов микроциркуляторного русла при сравнении эндометрия фазы пролиферации, железистой гиперплазии эндометрия и аденокарциномы эндометрия при определении фактора фон Вилебрандта, при этом связь между степенью васкуляризации и наличием сосудистой инвазии не выявлена.
Обнаружено отсутствие корреляции между клинической или гистологической стадией аденокарциномы эндометрия и значением микрососу- дистой плотности, измеренной с использованием антител к CD34 и к CD105 [17]. В то же время показатель микрососудистой плотности, измеренный с помощью этих маркеров, коррелировал с менопаузальным статусом пациенток. Также были обнаружены значимые различия между значением микрососудистой плотности, измеренной с помощью антител к маркеру CD105 в группах женщин с доброкачественными и злокачественными состояниями эндометрия.
Исследование маркера CD105, который экспрессируется только пролиферирующими эндоте-лиоцитами, показало, что уровень его экспрессии значимо различается в исследуемых группах (нормальный эндометрий – железистая гиперплазия эндометрия – аденокарцинома эндометрия), что свидетельствует об активации неоангиогенеза при гиперпластических процессах в эндометрии [19]. Также показана корреляционная связь между повышением экспрессии CD105 и риском возникновения инвазии в лимфатические сосуды с последующим метастазированием [21].
Ангиогенные маркеры рака эндометрия и их прогностическое значение
Пролиферация эпителия при гиперпластических процессах в эндометрии приводит к дефициту кислорода и нутриентов. Данный механизм работает в физиологических условиях для обеспечения пита-
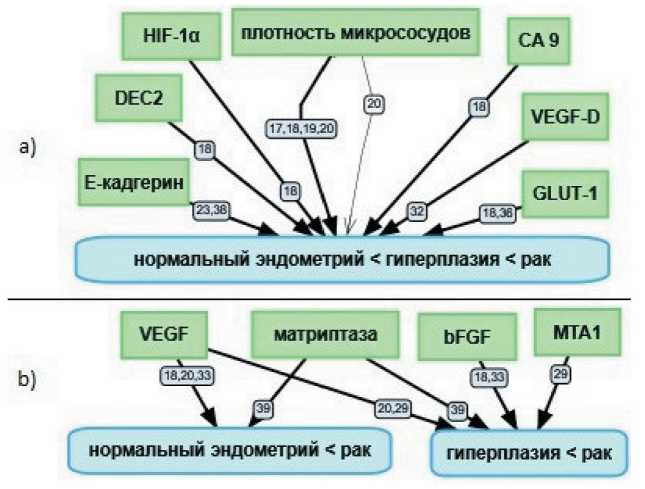
Рис. 2. Корреляционные связи между уровнем экспрессии в образцах эндометрия: 2a) значение перечисленных факторов при раке эндометрия выше, чем при гиперплазии эндомтерия, а при гиперплазии выше, чем в нормальном эндометрии; 2b) значение перечисленных факторов при раке эндометрия выше, чем в гиперплазии эндометрия; или значение перечисленных факторов при раке эндометрия выше, чем в нормальном эндометрии. Черными толстыми стрелками обозначены прямые корреляционные связи. Черной тонкой стрелкой обозначено отсутствие корреляционной связи в эксперименте. Номер на стрелке указывает на порядковый номер статьи в списке литературы
Fig. 2. Correlation between expression levels in endometrial samples. 2a) The expression levels in endometrial cancer are higher than those in endometrial hyperplasia, and they are higher in endometrial hyperplasia than in normal endometrium. 2b) The expression levels are higher in endometrial cancer than in endometrial hyperplasia; or the expression levels are higher in endometrial cancer than in normal endometrium. Black thick arrows indicate direct correlations. The black thin arrow indicates the absence of a correlation in the experiment. The number on the arrow indicates the ordinal number of the article in the list of references
ния растущего функционального слоя эндометрия, приобретая особое значение при канцерогенезе [22]. Гипоксия в ткани опухоли через активацию фактора-1α, индуцируемого гипоксией (HIF-1α), запускает ангиогенез, инвазию, а также определяет ключевой момент начала метастазирования [23]. Чрезмерная экспрессия HIF-1α отсутствует в нормальном эндометрии, но появляется при железистой гиперплазии и аденокарциноме эндометрия, при этом наиболее мощно она представлена в опухолевой ткани вокруг очагов некроза, указывая на предшествующую гипоксию [18]. Уровень экспрессии HIF-1α коррелирует с неблагоприятными прогностическими факторами опухоли – большей глубиной инвазии и низкой степенью дифференцировки [23]. HIF-1α имеет 5 генов-мишеней: DEC1, DEC2, CA 9, VEGF и SLC2A1 [18, 24].
Считается, что в соответствии с процессом ремоделирования тканей высвобождение VEGF инициируется гипоксией или ишемией. Когда ткань находится в состоянии гипоксии, происходит активация HIF, приводящая к высвобождению различных факторов роста, включая VEGF, что ведет к деградации внеклеточного матрикса с помощью матриксных металлопротеиназ [25].
Фактор роста эндотелия сосудов (VEGF) является одним из ангиогенных факторов и служит избирательным митогеном для эндотелиоцитов. Чрезмерная экспрессия VEGF связана с глубокой инвазией аденокарциномы эндометрия в миометрий и меньшей степенью дифференцировки опухоли, а также с плотностью микрососудов в опухоли и гистологическим типом опухоли [26]. Изучение аденокарциномы эндометрия показало, что уровень экспрессии VEGF коррелирует с плотностью микрососудов, определенной методом цветной допплерографии [27]. По данным O. Erdem et al. [20], уровень экспрессии VEGF как в образцах аденокарциномы эндометрия, так и в образцах гиперплазии эндометрия был значимо выше, чем в неизмененном эндометрии, однако без значимой разницы между уровнем экспрессии VEGF при аденокарциноме и при гиперплазии эндометрия. При этом средняя плотность микрососудистого русла, оцененная с помощью эндоглина (входит в рецепторный комплекс TGFb), была повышена для аденокарциномы эндометрия по сравнению с нормальным и с гиперпластическим эндометрием. В то же время уровень экспрессии VEGF в образцах с различным состоянием эндометрия не коррелировал с показателем микрососудистой плотности [20]. Показано, что уровень экспрессии VEGF в области инвазивного фронта опухоли в 4–10 раз превышает его уровень в центре опухоли [28]. Совместное изучение экспрессии VEGF вместе с MTA1 (белком, ассоциированным с метастазами) показало наличие прямой корреляционной связи между этими показателями [29]. Кроме того, уровень экспрессии VEGF и MTA1 в аденокар- циноме эндометрия был выше, чем в нормальном эндометрии. Уровень экспрессии как VEGF, так и MTA1 коррелировал с клинической стадией, метастазированием в лимфоузлы и глубиной инвазии в миометрий.
Семейство белков VEGF включает в себя подтипы VEGF-A, -B, -C и -D, рецепторами которых являются VEGFR-1, VEGFR-2 и VEGFR-3. Уровень экспрессии различных форм VEGF находится во взаимосвязи со степенью дифференцировки рака эндометрия. Показано, что уровень экспрессии VEGF-A, VEGF-R1 и VEGFR-2 увеличивался по мере уменьшения степени дифференцировки рака эндометрия. Похожая взаимосвязь обнаружена и для VEGF-B в ряду: G2> G3> G1> контрольная группа [30]. Также для больных РЭ с высокими показателями экспрессии VEGF и VEGFR-1 в опухоли показано снижение уровня пятилетней безрецидивной выживаемости по сравнению с пациентками с низким уровнем экспрессии этих маркеров [31]. Уровень экспрессии белков VEGF-D, отвечающих за рост лимфатических сосудов, в опухолевых клетках аденокарциномы эндометрия (в т. ч. и в стромальных) усиливается при прогрессии от нормального эндометрия к инвазивному раку. Уровень экспрессии соответствующих рецепторов к этому белку (VEGFR-3) увеличивается в клетках опухоли и эндотелиальных клетках. Высокие уровни экспрессии VEGF-D и VEGFR-3 положительно коррелируют с инвазией в миометрий и метастазированием в лимфоузлы [32].
Уровень экспрессии белков VEGF и bFGF (основной фактор роста фибробластов) при атипической гиперплазии и РЭ выше, чем в нормальном эндометрии [18, 33]; также найдена положительная корреляционная связь между уровнем экспрессии bFGF и гистологической стадией РЭ [33].
Уровень экспрессии белка Efp (estrogenresponsive ring finger protein) в аденокарциноме эндометрия превышал таковой в нормальном эндометрии. Найдена отрицательная корреляция между уровнем экспрессии Efp и гистологической стадией опухоли [33].
Уровень экспрессии циклооксигеназы-2 (COX-2), участвующей в синтезе провоспалитель-ных агентов, отмеченной только в клетках паренхимы и отсутствующей в строме, значимо выше при гиперплазии или аденокарциноме эндометрия, чем в любую из фаз нормального менструального цикла. Уровень экспрессии циклооксигеназы-2 коррелирует с площадью микроциркуляторного русла, уровнями экспрессии VEGF и тимидинфосфорила-зы [34, 35]. Для экспрессии тимидинфосфорилазы обнаружены корреляционные связи с высокой степенью дифференцировки, поздними стадиями опухоли, глубиной инвазии в миометрий [28].
Экспрессия белка GLUT-1 (глюкозный транспортер первого типа) кодируется геном SLC2A1 , который, в свою очередь, регулируется через
HIF-1α. GLUT-1 может быть интересен с точки зрения дифференциальной диагностики состояния эндометрия. Этот транспортный белок отсутствует в эндометрии фазы пролиферации, редко определяется в простой гиперплазии эндометрия и постоянно экспрессируется в атипической гиперплазии и аденокарциноме эндометрия. При этом уровень экспрессии GLUT-1 коррелирует со степенью дифференцировки аденокарциномы эндометрия [36]. Мембранная экспрессия GLUT-1, CA 9 и DEC2 отсутствует в нормальном эндометрии, но повышается по мере прогрессирования патологии в гиперплазии и аденокарциноме эндометрия [18].
Имммуногистохимическое окрашивание CA 9 (карбоангидразы 9 – фермента, регулирующего клеточный рН) в образцах рака эндометрия выявило связь между повышенным уровнем экспрессии этого маркера гипоксии и повышенным уровнем микрососудистой плотности в 16,4 % случаев. При таких вариантах РЭ показано снижение показателей общей и безрецидивной выживаемости [37].
Повышенная экспрессия HIF-1α приводит к снижению экспрессии Е-кадгерина, участвующего в межклеточных контактах [23]. Экспрессия Е-кадгерина снижается от нормального эндометрия в сторону аденокарциномы эндометрия, снижение его экспрессии достоверно коррелирует с повышением частоты инвазии и метастазирования, особенно при одновременном нарушении работы гена-супрессора PTEN , мутация которого часто определяется при злокачественных опухолях эндометрия [23, 38].
Опухолевая прогрессия характеризуется инвазией в лимфатические сосуды и метастазированием. Для реализации данных процессов необходимы вещества, разрушающие внеклеточный матрикс. Одним из таких соединений является матриптаза – трансмембранная сериновая протеаза II типа, связанная с ангиогенезом, деградацией экстрацеллюлярного матрикса и прогрессией аденокарциномы эндометрия. Уровень экспрессии матриптазы в аденокарциноме эндометрия выше по сравнению с железистой гиперплазией эндометрия и нормальным эндометрием [39].
Влияние PI3K/AKT/MTOR-сигнального пути на ангиогенез при раке эндометрия
Известно, что в патогенезе практически всех подтипов рака эндометрия одним из важнейших механизмов является активация PI3K/Akt/mTOR-сигнального пути, компоненты которого могут стать мишенями для таргетной терапии [40]. Этот киназный путь регулирует клеточный рост и метаболизм, а также осуществляет регуляцию апоптоза. Нерегулируемая активация данного сигнального каскада приводит к ингибированию апоптоза, что сопровождается накоплением генетически модифицированных и избыточно пролиферирующих клеток эндометрия. В 1997 г. в локусе 10q23.3
был картирован ген-супрессор опухолей PTEN (phosphatase and tensin homolog). Продукт этого гена, белок PTEN, является негативным регулятором PI3K/Akt/mTOR-сигнального пути. Инактивация белка PTEN – одно из самых частых событий в канцерогенезе эндометрия, регистрируемое в 35–50 % случаев рака эндометрии эстрогенового типа и в 10 % случаев рака эндометрия неэстрогенового типа [41]. Недавние исследования показали, что PI3K и Akt играют важную роль в регуляции роста опухоли и ангиогенеза через усиление экспрессии VEGF и HIF-1. В трансформированных клетках человека PI3K регулирует экспрессию этих двух белков через белки HDM2 и p70S6K1 [42].
I.I. Lee et al. показано влияние PI3K/Akt/mTOR-сигнального пути на ангиогенез в клеточной линии Ишикава (клетки аденокарциномы эндометрия) [43]. Комбинированное лечение ингибитором Аkt и прогестином значительно уменьшило инвазию эндотелиальных клеток и образование сосудов по сравнению с изолированным приемом этих препаратов. Кроме того, этими же авторами был проведен эксперимент на мышиной модели рака эндометрия ( PTEN d/d), у которых нокаутирован ген PTEN . У этих мышей развивались карцинома in situ в течение 1 мес и карцинома с инвазией миометрия в течение 3 мес. Комбинированное лечение мышей PTEN d/d ингибитором Аkt и прогестероном показало снижение ангиогенеза и пролиферации, что подтверждено ИГХ-анализом CD31 и Ki67 соответственно. Влияние ингибиторов Akt на активность VEGF также отмечено J. Zhang et al., которые показали, что экспрессия VEGF и bFGF в клетках Ишикава, положительных по эстрогеновому рецептору, и в клетках HEC-1A, отрицательных по эстрогеновому рецептору, блокировалась ингибиторами Akt [44].
Нокаут по гену молекулы адгезии E-кадгерину у мышей приводит к дезорганизации клеточной структуры эпителия матки и исчезновению эндометриальных желез, но не приводит к возникновению опухоли матки [45]. Мыши, нокаутные по этому гену, становятся стерильными из-за дефектов при имплантации и децидуализации.
Критически важную роль в канцерогенезе эндометрия играет потеря функции PTEN в клетках эндометрия [46]. Нокаут по гену белка-онкосупрессора PTEN у мышей (PgrCre/+) приводит к гиперплазии эндометрия, возникающей на 10-й день постнатального развития и прогрессирующей до карциномы эндометрия с инвазией в миометрий к 3 мес [47]. В данном исследовании обращает на себя внимание факт отсутствия у экспериментальных животных отдаленных метастазов. Хотя некоторые из опухолей диссиминировали по брюшине, причиной смерти мышей был рост первичной опухоли.
В качестве модели для изучения неопластической трансформации эндометрия M. Lindberg et al.
использовали мышей, нокаутных по гену белка-онкосупрессора PTEN и по гену молекулы адгезии E-кадгерину одновременно ( Cdh1 d/d PTEN d/d) [38]. Матки у таких мышей на макроуровне имели аномальное строение, с изогнутыми рогами, на микроуровне наблюдались дезорганизация эпителиальной ткани и повышенная клеточная пролиферация в матке. С помощью ИГХ-метода с использованием CD31 у этих мышей обнаружены более крупные кровеносные сосуды в эндометрии и миометрии, что указывает на активный ангиогенез. Кроме того, обнаружено снижение экспрессии эстрогеновых и прогестероновых рецепторов, потеря клеточной адгезии, а также активация Akt в матке мышей. Показательно, что мыши данной группы умирали на 15–19-й дни жизни из-за массивной кровопотери. Тем не менее у таких мышей ( Cdh1 d/d PTEN d/d) не было выявлено комплексной гиперплазии эндометрия. В матке у группы мышей Cdh1 d/d PTEN d/dобнаружено крайне аномальное развитие эпителия с папиллярной дифференцировкой, при этом не было обнаружено комплексной гиперплазии эндометрия. В группе мышей с нокаутом гена PTEN ( PTEN d/d) присутствовала комплексная гиперплазия эндометрия.
Особого внимания в качестве маркера ангиогенеза заслуживают микроРНК, влияющие на PI3K/ Akt/mTOR-сигнальный путь. В исследовании Widodo et al. методами in silico найдено несколько микроРНК, ассоциированных с начальной стадией рака эндометрия и экспрессией PTEN. Для микроРНК-495 и микроРНК-152 экспериментально доказано снижение их экспрессии в злокачественных клетках эндометрия по сравнению с неизмененным эндометрием, тогда как для микроРНК-181d, напротив, – повышение экспрессии [48]. Обратная корреляция с экспрессией PTEN также показана для микроРНК-181a в образцах рака эндометрия у женщин с индексом массы тела меньше 30 [49]. Ингибирование ангиогенеза в клетках рака эндометрия путем воздействия на ангиогенный фактор VEGF-A через сигнальные
Список литературы Прогностическое значение ангиогенных маркеров рака эндометрия (обзор литературы)
- Злокачественные новообразования в России в 2017 г. (заболеваемость и смертность). М., 2018. 250 с. [Malignant neoplasms in Russia in 2017 (morbidity and mortality). Moscow, 2018. 250 p. (in Russian)].
- Talhouk A., McAlpine J.N. New classification of endometrial cancers: the development and potential applications of genomic-based classification in research and clinical care. Gynecol Oncol Res Pract. 2016; 3: 14. doi: 10.1186/s40661-016-0035-4.
- Salvesen H.B., Haldorsen I.S., Trovik J. Markers for individualised therapy in endometrial carcinoma. Lancet Oncol. 2012; 13(8): 353-61. doi: 10.1016/S1470-2045(12)70213-9.
- Papa A., Zaccarelli E., Caruso D., Vici P., Benedetti Panici P., Tomao F. Targeting angiogenesis in endometrial cancer - new agents for tailored treatments. Expert Opin Investig Drugs. 2016; 25(1): 31-49. doi: 10.1517/13543784.2016.1116517.
- Farnsworth R.H., Lackmann M., Achen M.G., Stacker S.A. Vascular remodeling in cancer. Oncogene. 2014; 33(27): 3496505. doi: 10.1038/onc.2013.304.
- Naumov G.N., Folkman J., Straume O., Akslen L.A. Tumor-vascular interactions and tumor dormancy. APMIS. 2008; 116(7-8): 569-85. doi: 10.1111/j.1600-0463.2008.01213.x.
- Folkman J. Role of angiogenesis in tumor growth and metastasis. Semin Oncol. 2002; 29(16): 15-8. doi: 10.1053/ sonc.2002.37263.
- Naumov G.N., Akslen L.A., Folkman J. Role of angiogenesis in human tumor dormancy: animal models of the angiogenic switch. Cell Cycle. 2006; 5(16): 1779-87. doi: 10.4161/ cc.5.16.3018.
- Naumov G.N., Folkman J., Straume O. Tumor dormancy due to failure of angiogenesis: role of the microenvironment. Clin Exp Metastasis. 2009; 26(1): 51-60. doi: 10.1007/s10585-008-9176-0.
- Gelao L., Criscitiello C., Fumagalli L., Locatelli M., Manunta S., Esposito A., Minchella I., Goldhirsch A., Curigli-ano G. Tumour dormancy and clinical implications in breast cancer. Ecancermedicalscience. 2013; 7: 320. doi: 10.3332/ ecancer.2013.320.
- Benjamin L.E., Golijanin D., Itin A., Pode D., Keshet E. Selective ablation of immature blood vessels in established human tumors follows vascular endothelial growth factor withdrawal. J Clin Invest. 1999; 103(2): 159-65. doi: 10.1172/JCI5028.
- Alcalde R.E., Terakado N., Otsuki K., Matsumura T. Angiogenesis and expression of platelet-derived endothelial cell growth factor in oral squamous cell carcinoma. Oncology. 1997; 54(4): 324-8. doi: 10.1159/000227711.
- СеньчуковаМА.,МакароваЕВ.,КалининЕА., ТкачевВ.В. Современные представления о происхождении, особенностях морфологии, прогностической и предиктивной значимости опухолевых сосудов. Российский биотерапевтический журнал. 2019; 18(1): 6-15. [Senchukova M.A., Makarova E.V., KalininE.A., Tkachev V.V. Modern ideas about the origin, features of morphology, prognostic and predictive significance of tumor vessels. Russian Journal of Biotherapy. 2019; 18(1): 6-15. (in Russian)]. doi:10.17650/1726-9784-2019-18-1-6-15.
- Zuazo-Gaztelu I., Casanovas O. Unraveling the Role of Angiogenesis in Cancer Ecosystems. Front Oncol. 2018; 8: 248. doi: 10.3389/fonc.2018.00248.
- Minder P., Zajac E., Quigley J.P., Deryugina E.I. EGFR regulates the development and microarchitecture of intratu-moral angiogenic vasculature capable of sustaining cancer cell intravasation. Neoplasia. 2015; 17(8): 634-49. doi: 10.1016/j. neo.2015.08.002.
- Kaku T., Kamura T., Kinukawa N., KobayashiH., Sakai K., Tsuruchi N., Saito T., Kawauchi S., Tsuneyoshi M., Nakano H. Angiogenesis in endometrial carcinoma. Cancer. 1997; 80(4): 741-7. doi: 10.1002/(sici)1097-0142(19970815)80:4-741::aid-cncr13>3.0.co;2-t.
- CzekierdowskiA., Czekierdowska S., Czuba B., Cnota W., SodowskiK., Kotarski J., Zwirska-Korczala K. Microvessel density assessment in benign and malignant endometrial changes. J Physiol Pharmacol. 2008; 59(4):45-51.
- Horree N., van DiestP.J., van der Groep P., Sie-Go D.M., Heintz A.P. Hypoxia and angiogenesis in endometrioid endometrial carcinogenesis. Cell Oncol. 2007; 29(3): 219-27. doi: 10.1155/2007/434731.
- Abulafia O., Triest W.E., Sherer D.M., Hansen C.C., Ghezzi F. Angiogenesis in endometrial hyperplasia and stage I endometrial carcinoma. Obstet Gynecol. 1995; 86: 479-85. doi: 10.1016/0029-7844(95)00203-4.
- Erdem O., Erdem M., Erdem A., Memis L., Akyol G. Expression of vascular endothelial growth factor and assessment of microvascular density with CD 34 and endoglin in proliferative en-dometrium, endometrial hyperplasia, and endometrial carcinoma. Int J Gynecol Cancer. 2007; 17(6): 1327-32. doi: 10.1111/j.1525-1438.2007.00942.x.
- Saad R.S., Jasnosz K.M., Tung M.Y., Silverman J.F. Endoglin (CD105) expression in endometrial carcinoma. Int J Gynecol Pathol. 2003; 22(3): 248-53. doi: 10.1097/01. PGP.0000070852.25718.37.
- КорневаЮ.С., Украинец Р.В., Доросевич А.Е. Прогностическое значение изменений микроциркуляторного русла и клеточного микроокружения при железистой гиперплазии эндометрия и раке эндометрия (обзор литературы). Опухоли женской репродуктивной системы. 2019; 15(1): 67-72. [Korneva Yu.S., Ukrainets R.V., Dorosevich A.E. Prognostic value of microcirculatory changes and alterations in the cellular microenvironment in patients with glandular hyperplasia of the endometrium and endometrial cancer (literature review). Tumors of Female Reproductive System. 2019; 15(1): 67-72. (in Russian)]. doi: 10.17650/1994-4098-2019-15-1-67-72.
- Feng Z., Gan H., Cai Z., Li N., Yang Z., Lu G., Chen J. Aberrant expression of hypoxia-inducible factor 1a, TWIST and E-cadherin is associated with aggressive tumor phenotypes in endometrioid endometrial carcinoma. Jpn J Clin Oncol. 2013; 43(4): 396-403. doi: 10.1093/jjco/hys237.
- Yunokawa M., Tanimoto K., Nakamura H., Nagai N., Kudo Y., Kawamoto T., Kato Y., Hiyama E., Hiyama K., Nishi-yama M. Differential regulation of DEC2 among hypoxia-inducible genes in endometrial carcinomas. Oncol Rep. 2007; 17(4): 871-8.
- Christoffersson G., Vagesjo E., Vandooren J., Liden M., Massena S., Reinert R.B., Brissova M., Powers A.C., Opdenak-ker G., Phillipson M. VEGF-A recruits a proangiogenic MMP-9-delivering neutrophil subset that induces angiogenesis in transplante dhypoxic tissue. Blood. 2012; 120(23): 4653-62. doi: 10.1182/blood-2012-04-421040.
- Topolovec Z., CorusicA., BabicD., MrcelaM., Sijanovic S., Muller-Vranjes A., Curzik D. Vascular endothelial growth factor and intratumoral microvessel density as prognostic factors in endometrial cancer. Coll Antropol. 2010; 34(2): 447-53.
- Lee C.N., Cheng W.F., Chen C.A., Chu J.S., Hsieh C.Y., Hsieh F.J. Angiogenesis of endometrial carcinomas assessed by measurement of intratumoral blood flow, microvessel density, and vascular endothelial growth factor levels. Obstet Gynecol. 2000; 96(4): 615-21. doi: 10.1016/s0029-7844(00)00976-5.
- Sivridis E. Angiogenesis and endometrial cancer. Anticancer Res. 2001; 21(6B): 4383-8.
- Yang Y.M., LiuH., Li W.B. [Expression ofMta-1 and VEGF and their correlation in the endometrial cancer]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2010; 26(7): 682-4.
- DziobekK., OptawskiM., GrabarekB.O., ZmarzfyN., Toma-laB., Halski T., LesniakE., JanuszykK., BrusR., KietbasinskiR., Boron D. Changes in the Expression Profile of VEGF-A, VEGF-B, VEGFR-1, VEGFR-2 in Different Grades of Endometrial Cancer. Curr Pharm Biotechnol. 2019; 20(11): 955-63. doi: 10.2174/138 9201020666190717092448.
- Dobrzycka B., Terlikowski S.J., Kwiatkowski M., Gar-bowicz M., Kinalski M., Chyczewski L. Prognostic significance of VEGF and its receptors in endometrioid endometrial cancer. Ginekol Pol. 2010; 81(6): 422-5.
- Yokoyama Y., Charnock-Jones D.S., Licence D., Yanai-hara A., Hastings J.M., Holland C.M., Emoto M., Sakamoto A., Sakamoto T., Maruyama H., Sato S., Mizunuma H., Smith S.K. Expression of vascular endothelial growth factor (VEGF)-D and its receptor, VEGF receptor 3, as a prognostic factor in endometrial carcinoma. Clin Cancer Res. 2003; 9(4): 1361-9.
- Dai H., Zhao S., Xu L., Chen A., Dai S. Expression of Efp, VEGF and bFGF in normal, hyperplastic and malignant endometrial tissue. Oncol Rep. 2010; 23(3): 795-9.
- Fujiwaki R., Iida K., Kanasaki H., Ozaki T., Hata K., Miyazaki K. Cyclooxygenase-2 expression in endometrial cancer: correlation with microvessel count and expression of vascular endothelial growth factor and thymidine phosphorylase. Hum Pathol. 2002; 33(2): 213-9. doi: 10.1053/hupa.2002.31292.
- BorubanM.C., AltundagK., Kilic G.S., Blankstein J. From endometrial hyperplasia to endometrial cancer: insight into the biology and possible medical preventive measures. Eur J Cancer Prev. 2008; 17(2): 133-8. doi: 10.1097/CEJ.0b013e32811080ce.
- Ashton-Sager A., Paulino A.F., AfifyA.M. GLUT-1 is preferentially expressed in atypical endometrial hyperplasia and endometrial adenocarcinoma. Appl Immunohistochem Mol Morphol. 2006; 14(2): 187-92. doi: 10.1097/01.pai.0000162003.43334. c7.
- Reijnen C., van Weelden W.J., Arts M.S.J.P., Peters J.P., Rijken P.F., van de Vijver K., SantacanaM., BronsertP., Bulten J., Hirschfeld M., Colas E., Gil-Moreno A., Reques A., Mancebo G., Krakstad C., Trovik J., Haldorsen I.S., Huvila J., Koskas M., Weinberger V., Minar L., Jandakova E., Snijders M.P.L.M., van den Berg-van Erp S., Kusters-Vandevelde H.V.N., Matias-Guiu X., Amant F.; ENITEC-consortium, Massuger L.F.A.G., Bussink J., Pijnenborg J.M.A. Poor outcome in hypoxic endome-trial carcinoma is related to vascular density. Br J Cancer. 2019; 120(11): 1037-44. doi: 10.1038/s41416-019-0461-2.
- Lindberg M.E., Stodden G.R., KingM.L., MacLean J.A., Mann J.L., DeMayo F.J., Lydon J.P., Hayashi K. Loss of CDH1 and Pten accelerates cellular invasiveness and angiogenesis in the mouse uterus. Biol Reprod. 2013; 89(1): 8. doi: 10.1095/ biolreprod.113.109462.
- Nakamura K., Hongo A., Kodama J., AbarzuaF., Nasu Y., Kumon H., Hiramatsu Y. Expression of matriptase and clinical outcome of human endometrial cancer. Anticancer Res. 2009; 29(5): 1685-90.
- BarraF., Evangelisti G., FerroDesideriL., DiDomenicoS., FerraioliD., Vellone V.G., De Cian F., Ferrero S. Investigational PI3K/AKT/mTOR inhibitors in development for endometrial cancer. Expert Opin Investig Drugs. 2019; 28(2): 131-42. doi: 10.1080/13543784.2018.1558202.
- Doll A., Abal M., Rigau M., Monge M., Gonzalez M., Demajo S., Colas E., Llaurado M., Alazzouzi H., Planaguma J., Lohmann M.A., Garcia J., Castellvi S., Ramon y Cajal J., Gil-Moreno A., Xercavins J., Alameda F., Reventos J. Novel molecular profiles of endometrial cancer-new light through old windows. J Steroid Biochem Mol Biol. 2008; 108(3-5): 221-9. doi: 10.1016/j. jsbmb.2007.09.020.
- JiangB.H., LiuL.Z. PI3K/PTEN signaling in tumorigenesis and angiogenesis. Biochim Biophys Acta. 2008; 1784(1): 150-8. doi: 10.1016/j.bbapap.2007.09.008.
- Lee I.I., Maniar K., Lydon J.P., Kim J.J. Akt regulates progesterone receptor B-dependent transcription and angiogenesis in endometrial cancer cells. Oncogene. 2016; 35(39): 5191-201. doi: 10.1038/onc.2016.56.
- Zhang J., Song H., Lu Y., Chen H., Jiang S., Li L. Effects of estradiol on VEGF and bFGF by Akt in endometrial cancer cells are mediated through the NF-kB pathway. Oncol Rep. 2016; 36(2): 705-14. doi: 10.3892/or.2016.4888.
- Reardon S.N., King M.L., MacLean J.A., Mann J.L., DeMayo F.J., Lydon J.P., Hayashi K. CDH1 is essential for endometrial differentiation, gland development, and adult function in the mouse uterus. Biol Reprod. 2012; 86(5): 141, 1-10. doi: 10.1095/biolreprod.112.098871.
- Memarzadeh S., Zong Y., Janzen D.M., Goldstein A.S., Cheng D., Kurita T., Schafenacker A.M., Huang J., Witte O.N. Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. Proc Natl Acad Sci USA. 2010; 107(40): 17298-303. doi: 10.1073/ pnas.1012548107.
- Daikoku T., Hirota Y., Tranguch S., Joshi A.R., DeMayoF.J., Lydon J.P., Ellenson L.H., Dey S.K. Conditional loss of uterine Pten unfailingly and rapidly induces endometrial cancer in mice. Cancer Res. 2008; 68(14): 5619-27. doi: 10.1158/0008-5472. CAN-08-1274.
- Widodo, Djati M.S., Rifa'i M. Role of MicroRNAs in carcinogenesis that potential for biomarker of endometrial cancer. Ann Med Surg (Lond). 2016; 7: 9-13. doi: 10.1016/j. amsu.2016.01.091.
- GeletinaN.S., Kobelev V.S., BabayantsE.V., FengL., Pu-stylnyak V.O., GulyaevaL.F. PTEN negative correlates with miR-181a in tumour tissues of non-obese endometrial cancer patients. Gene. 2018; 655: 20-4. doi: 10.1016/j.gene.2018.02.051.
- Chen H.X., Xu X.X., Tan B.Z., Zhang Z., Zhou X.D. Mi-croRNA-29b Inhibits Angiogenesis by Targeting VEGFA through the MAPK/ERK and PI3K/Akt Signaling Pathways in Endometrial Carcinoma. Cell Physiol Biochem. 2017; 41(3): 933-46. doi: 10.1159/000460510.
- Silver S.A., Sherman M.E. Morphologic and immunophe-notypic characterization of foam cells in endometrial lesions. Int J Gynecol Pathol. 1998; 17(2): 140-5. doi: 10.1097/00004347199804000-00008.
- Iavazzo C., Kalmantis K., Ntziora F., Balakitsas N., Pas-chalinopoulos D. Detection of large histiocytes in pap smears: role in the prediction of endometrial pathology? Bratisl Lek Listy. 2008; 109(11): 497-8.
- Nguyen T.N., Bourdeau J.L., Ferenczy A., Franco E.L. Clinical significance of histiocytes in the detection of endometrial adenocarcinoma and hyperplasia. Diagn Cytopathol. 1998; 19(2): 89-93. doi: 10.1002/(sici)1097-0339(199808)19:2-89::aid-dc3>3.0.co;2-i.
- Nassar A., Fleisher S.R., Nasuti J.F. Value of histiocyte detection in Pap smears for predicting endometrial pathology. An institutional experience. Acta Cytol. 2003; 47(5): 762-7. doi: 10.1159/000326602.
- Ashkenazy M., Lancet M., Borenstein R., Czernobil-sky B. Endometrial foam cells. Non-estrogenic and estrogenic. Acta Obstet Gynecol Scand. 1983; 62(3): 193-7. doi: 10.3109/00016348309155791.
- Jiang X.F., Tang Q.L., Li H.G., Shen X.M., Luo X., Wang X.Y., Lin Z.Q. Tumor-associated macrophages correlate with progesterone receptor loss in endometrial endometrioid ad-enocarcinoma. J Obstet Gynaecol Res. 2013; 39(4): 855-63. doi: 10.1111/j.1447-0756.2012.02036.x.


