Прогностическое значение биологических характеристик резидуальной опухоли после проведения неоадъювантной химиотерапии при раннем раке молочной железы с тройным негативным фенотипом
Автор: Фролова М.А., Стенина М.Б., Глазкова Е.В., Игнатова Е.О., Меньшикова С.Ф., Петровский А.В., Крохина О.В., Вишневская Я.В., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 т.9, 2019 года.
Бесплатный доступ
Неоадъювантная (НА) лекарственная терапия широко применяется в лечении больных тройным негативным и Her2-позитивным раком молочной железы (РМЖ) ранних стадий. Это позволяет оценить эффективность лечения in vivo, у части больных уменьшить объем локального лечения, а также оценить прогноз и при наличии резидуальной опухоли назначить адъювантную лекарственную терапию. В исследовании изучалась прогностическая значимость оценки ответа опухоли на лечение по системе RCB (Residual Cancer Burden), а также оценены уровень Ki-67 и содержание инфильтрирующих опухоль лимфоцитов (ИОЛ) в резидуальной опухоли у больных первично операбельным РМЖ с тройным негативным фенотипом (ТН РМЖ), получавших НА платиносодержащую химиотерапию (ХТ). Показано, что комплексная оценка показателей RCB, Ki-67 и ИОЛ позволяет получить более точную прогностическую информацию, чем простая констатация наличия или отсутствия резидуальной опухоли, и выделить группы больных для эскалации и де-эскалации адъювантной системной терапии.
Рак молочной железы, тройной негативный фенотип, резидуальная опухоль, иол
Короткий адрес: https://sciup.org/140246948
IDR: 140246948 | DOI: 10.18027/2224-5057-2019-9-3-5-11
Текст научной статьи Прогностическое значение биологических характеристик резидуальной опухоли после проведения неоадъювантной химиотерапии при раннем раке молочной железы с тройным негативным фенотипом
Неоадъювантная (НА) системная терапия первоначально cтала применяться при местнораспространенном первично не операбельном РМЖ и позволяла в случае успеха системной терапии перевести опухоль в операбельное состояние и выполнить хирургическое вмешательство.
Некоторое время назад стали предприниматься попытки предоперационного назначения системной терапии и при первично операбельном РМЖ. Предполагалось, что это будет способствовать ранней элиминации микрометастазов и дальнейшему улучшению результатов лечения. В исследовании NSABP В-18 с участием 1523 больных первично операбельным РМЖ проведено сравнение отдаленных результатов лечения при проведении 4 курсов химиотерапии по схеме АС (доксорубицин + циклофосфамид) до или после хирургического вмешательства [1]. Не было выявлено различий в частоте локорегионарных рецидивов, безрецидивной (БРВ) и общей выживаемости (ОВ). Органосохраняющую операцию удалось выполнить в большем проценте случаев в группе больных, получавших НА терапию, в сравнении с группой больных, которые получали адъювантную терапию, разница составила 12%. Крайне важным научным выводом этого исследования был тот факт, что достижение полной патоморфологической регрессии (пПР) ассоциировалось с увеличением БРВ (ОР 0,47, p=0,0001) и ОВ (ОР 0,32, p=0,0001).
Таким образом, возможность оценки эффективности НА системной терапии in vivo (по степени патоморфоза) является серьезным преимуществом в сравнении с адъювантной терапией, которая проводится «вслепую», т. е. в отсутствие клинически определяемой опухоли, что не позволяет высказаться о том, принесла ли адъювантная терапия ожидаемую пользу конкретной пациентке. Оценка персонального прогноза в зависимости от наличия или отсутствия пПР позволяет сегодня индивидуализировать адъювантную лекарственную терапию. Целесообразность назначения адъювантной ХТ больным с резидуальной опухолью изучалась в исследовании CREATE-X, в котором было показано, что у больных Her2-негативным РМЖ с резидуальной опухолью после НАХТ с включением антраци-клинов и таксанов проведение 6–8 курсов адъювантной ХТ капецитабином позволило существенно увеличить БРВ (ОР 0,70, p=0,01) и ОВ (ОР 0,59, p=0,01) [2]. Наиболее значимый выигрыш в БРВ был отмечен у больных ТН РМЖ (ОР 0.58 по сравнению с 0.81 при люминальном подтипе).
В связи с отсутствием мишеней для известных таргет-ных препаратов единственным стандартным подходом к лечению ТН РМЖ пока остается химиотерапия. Отличительными особенностями ТН РМЖ являются с одной стороны высокая химиочувствительность, с другой — быстрое развитие химиорезистентности, а также крайне аг- рессивное течение с ранним развитием рецидивов болезни. Чаще ТН РМЖ страдают женщины молодого возраста, этот подтип составляет наибольшую часть BRCA1-ассоцииро-ванных опухолей. С учетом высокой агрессивности ТН РМЖ адъювантная химиотерапия показана всем больным, начиная с T1bN0М0 (т. е. при опухолях размерами ≥5 мм).
Будучи высоко химиочувствительным, ТН РМЖ характеризуется высокой частотой пПР при проведении НА химиотерапии. В исследовании Liedtke с соавт. было показано, что при достижении пПР больные ТН РМЖ имеют высокие показатели выживаемости, сопоставимые с аналогичными показателями при других подтипах. Однако при наличии резидуальной опухоли выживаемость больных ТН РМЖ значительно ниже, чем при других подтипах с наличием резидуальной опухоли [3].
При этом не у всех больных с резидуальной опухолью в дальнейшем возникает прогрессирование болезни, что делает актуальным поиск дополнительных характеристик опухоли, отвечающих за прогноз. Одной из дополнительных возможностей разделения опухоли на прогностические группы после НАХТ является оценка ответа опухоли на лечение по системе RCB (Residual Cancer Burden), которая включает в себя комплексную характеристику ложа первичной опухоли, клеточности, количества метастатических лимфатических узлов, размера наибольшего метастаза в лимфатическом узле. Эти данные вносятся в специальную формулу, с помощью которой вычисляются индекс RCB (как непрерывная переменная) и класс RCB [ cfm?pagename=jsconvert3]. При оценке ответа опухоли на лечение по системе RCB выделяют 4 класса: 0, I, II, IV, где 0 соответствует пПР.
Целью нашей работы был анализ влияния наличия и характеристик резидуальной опухоли на прогноз больных ранним ТН РМЖ, получавших НАХТ с включением антра-циклинов, таксанов и платины.
ПАЦИЕНТЫ И МЕТОДЫ
В исследовании приняли участие 120 больных ТН РМЖ T1-2N0-1M0 стадий, которые получали НА (предоперационную) дозоинтенсивную ХТ по схеме: доксорубицин 25 мг/м2 в 1-й день + паклитаксел 100 мг/м2 в 1-й день + цисплатин 30 мг/м2 в 1-й день внутривенно капельно еженедельно, 8 циклов с поддержкой Г-КСФ (филграстим 5 мкг/кг подкожно 1 раз в день, со 2-го по 4-й дни каждого цикла).
Подобное описание процедур исследования приведено в статье Игнатовой Е.О. с соавт. [4], поэтому мы не будем на них останавливаться. В табл. 1 приведена клиникоанамнестическая характеристика больных.
Медиана возраста составила 47 лет, больше половины больных (55%) имели опухоли 3-й степени злокачественности (табл. 1). Медиана Ki-67 составила 85%. У 42 больных выявлены герминальные мутации в генах BRCA1 / 2, у 2
больных— в гене CHEK2. У 97 больных определен уровень ИОЛ в первичной опухоли, у 17,5% больных данный показатель был расценен как высокий (>40%), медиана уровня ИОЛ составила 10% (диапазон 5–70%).
После окончания НАХТ больным выполнялись хирургические вмешательства различного объема.
Оценка ответа опухоли на лечение проводилась по системе RCB. При наличии резидуальной опухоли проводилось определение ИОЛ согласно рекомендациям международной рабочей группы по определению ИОЛ в резидуальной опухоли [5], а также индекса пролиферации Ki-67 (при RCB II–III класса).
РЕЗУЛЬТАТЫ
Частота достижения пПР (RCB0) составила 57%. У 51 больной не была достигнута пПР. Гистологические препараты с резидуальной опухолью были доступны у 50 больных. В этих препаратах проведена оценка резидуальной опухоли по системе RCB, а также определены уровни ИОЛ и Ki67. Частота RCBI составила 16%, RCBII — 23,6%, RCBIII — 2,5 %.
В данной статье мы сфокусируемся на оценке некоторых биологических характеристик резидуальной опухоли и их прогностическом значении.
Таблица 1. Клинико-анамнестическая характеристика больных
|
Признак |
n=120* (%) |
|
Возраст, медиана (диапазон), годы |
47 (23-72) |
|
Критерий Т |
|
|
• Т1 |
30 (25%) |
|
• Т2 |
90 (75%) |
|
Критерий N |
|
|
• N0 |
77 (64,2%) |
|
• N1 |
43 (35,8%) |
|
Степень злокачественности |
|
|
• 2 |
54 (45%) |
|
• 3 |
66 (55%) |
|
Ki-67, медиана (диапазон), % |
85 (12-100) |
|
ИОЛ, % n=97 |
|
|
• <40 |
80 (82,5%) |
|
• >40 |
17 (17,5%) |
|
Герминальные мутации |
|
|
• Нет |
75 (62,5%) |
|
• BRCA1/2 |
42 (35%) |
|
• CHEK2 |
2 (1,7%) |
|
• Не оценивалась |
1 (0,8%) |
* Операция выполнена 119 больным
Динамика индекса пролиферации Ki-67
Индекс пролиферации Ki-67 был определен в резидуальной опухоли 25 больных. Медиана составила 20% (диапазон 5–75). При попарном сравнении значений Ki-67 до и после лечения имело место значимое снижение индекса пролиферации на фоне проведения НАХТ (р<0,001) (рис. 1). У больных с RCBII–III низкий уровень Ki67 (<20) имелся в 43,5 % случаев.
Динамики уровня ИОЛ
Уровень ИОЛ в резидуальной опухоли определен у 47 больных, медиана составила 50% (диапазон 5–90%). У 42 больных известен уровень ИОЛ до и после лечения (рис. 2). При попарном сравнении уровня ИОЛ до и после НА химиотерапии выявлено статистически значимое повышение ИОЛ (р<0,001). У 47,4% (18 из 38) больных с низкими ИОЛ до лечения (<40%), в резидуальной опухоли определялся высокий уровень ИОЛ (≥50%). У 52,6% (20 из 38) больных с низким уровнем ИОЛ до лечения он и остался низким. У 4 больных с высоким уровнем ИОЛ до лечения он так и остался высоким.
Оценка выживаемости
При медиане времени наблюдения 39,7 мес. (диапазон 15,0–94,8 мес.) прогрессирование зафиксировано у 9 (7,5%) больных. Медиана времени до прогрессирования составила 15,9 мес. (диапазон 4,6–35,3 мес.). У 7 из 9 (77,8%) больных прогрессирование наступило в сроки до 24 мес. после окончания первичного лечения. Во всей группе больных 3-летняя БРВ составила 91,1 %, ОВ — 97,8%.
При анализе значения клинико-морфологических характеристик было выявлено, что такие факторы, как возраст, размер первичной опухоли, степень злокачественности, наличие герминальной мутации в генах BRCA1/2, уровень Ki-67 в первичной опухоли, уровень ИОЛ в первичной опухоли не являются предикторами рецидива. Из характеристик первичной опухоли только поражение регионарных лимфатических узлов показало тенденцию к статистической значимости в отношении риска развития рецидива (р=0,07). В то же время наличие резидуальной опухоли, стадирование по RCB, характеристики резидуальной опухоли показали значимое влияние на частоту рецидивов.
В группе больных с пПР частота рецидивов была статистически значимо ниже, чем при наличии резидуальной опухоли (2,9% против 13,7%, р=0,037); при оценке по системе RCB — 4,6 % против 16,1 % при RCB0+I и RCBII+III соответственно (р=0,05). Анализ изученных биологических характеристик резидуальной опухоли показал, что при уровне Ki-67 <20% частота рецидивов была в 3 раза меньше по сравнению с уровнем ≥20% (8,3% против 30,8%). Не было выявлено статистически значимых различий в частоте рецидивов при низком и высоком уровне ИОЛ в резиду-
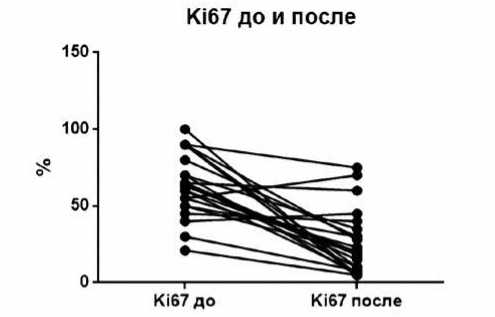
Рисунок 1. Попарное сравнение уровня Ki-67 в первичной (до лечения) и резидуальной (после НАХТ) опухоли.
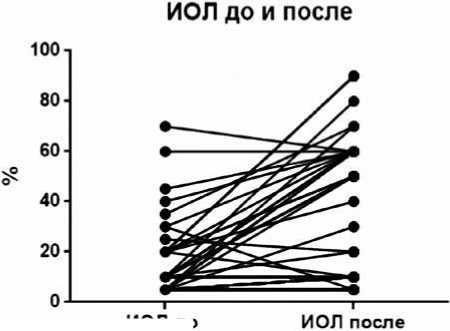
ИОЛ до
Рисунок 2. Попарное сравнение уровня ИОЛ в первичной (до лечения) и резидуальной (после НАХТ) опухоли.
альной опухоли. Мы проанализировали также динамику ИОЛ до и после НАХТ. Оказалось, что повышение уровня ИОЛ с низкого (<40%) в первичной опухоли до высокого (≥50%) в резидуальной является фактором благоприятного прогноза: ни у одной из 18 больных с подобной динамикой ИОЛ не было зафиксировано прогрессирования болезни. У больных со стабильным уровнем ИОЛ (т. е. был низким и остался низким или был высоким и остался высоким) частота рецидивов составила 26,1% (р=0,02).
Мы объединили информацию по классам RCB, уровням Ki-67 и ИОЛ, динамике ИОЛ в резидуальной опухоли. Оказалось, что частота рецидива была наиболее высокой при следующих сочетаниях этих признаков: RCBII–III и уровне Ki-67≥20%, уровне ИОЛ<50% и отсутствии изменения уровня ИОЛ. При многофакторном анализе только интеграция данных по классам RCB и изменению уровня ИОЛ имели прогностическую значимость в отношении риска рецидива (ОШ 11,25, 95% ДИ 2,35–53,7, р=0,002).
Трехлетняя БРВ выживаемость больных с пПР составила 96,5%, у больных с резидуальной опухолью — 83,5% (ОР 0.18, 95% ДИ 0,05–0,74; р=0,017) (рис. 3).
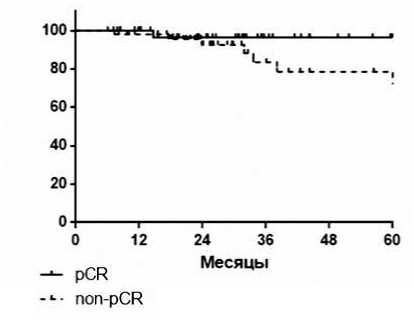
Рисунок 3. Безрецидивная выживаемость больных с пПР и резидуальной опухолью.
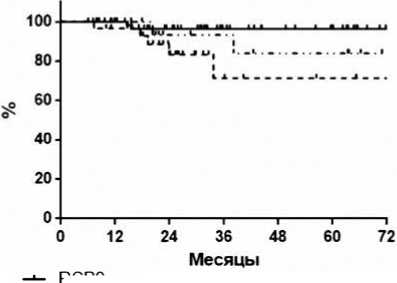
Стадирование по системе RCB в сочетании с динамикой Ki-67 и ИОЛ позволило получить еще более важную информацию в отношении выживаемости. Трехлетняя БРВ для больных с RCB0 составила 96,5% с RCBI — 93,3% и 71,5% при RCBII+III (р=0,0087) (рис. 4).
Двухлетняя БРВ больных с RCB0+I, RCBII+III и Ki-67<20% составила 95,8% и 88,9% против 64,2% у больных с RCBII+III и Ki-67≥20% (р=0,0001) (рис. 5).
Трехлетняя БРВ больных с RCB0+I, RCBII+III с повышением ИОЛ после НАХТ составила 95,8% и 100% против 66,5% у больных с RCBII+III и отсутствием динамики уровня ИОЛ (р=0,0013) (рис. 6).
ОБСУЖДЕНИЕ И ВЫВОДЫ
RCBO
-•■ RCBI
-•■• RCBII+III
В нашем исследовании исходные клинико-морфологические характеристики, такие как размер первичной опухоли, степень злокачественности, исходный уровень Ki-67 и ИОЛ, наличие BRCA1/2 мутации, не показали значимого влияния на частоту рецидива и выживаемость.
Наиболее интересные данные были получены при изучении факторов, связанных с наличием и характеристиками резидуальной опухоли. При наличии резидуальной опухоли частота рецидивов была статистически значимо выше, чем при достижении пПР, а 3-летняя БРВ составила 96,5 и 83,5% при пПР и резидуальной опухоли соответственно (р=0,017).
Рисунок 4. Безрецидивная выживаемость больных с RCB0, I и RCBII+III.
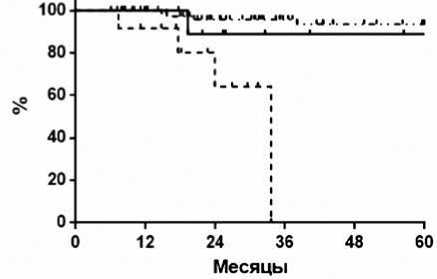
Далее мы проанализировали выживаемость больных в зависимости от класса RCB. 3-летняя БРВ составила 96,5%, 93,3% и 71,5% при RCB0, RCBI и RCBII+III соответственно (р=0,0087). Наши данные согласуются с результатами исследования MDACC LAB 98–240 [6], в котором именно для ТН РМЖ было показано, что выживаемость больных с RCB0 и RCBI не отличалась, но была значительно выше, чем при RCBII+III. Таким образом, мы подтвердили важность оцен-

0 4-----------!-----------1-----------1-----------1-----------1-----------Г"
О 12 24 36 48 60 72
Месяцы
-•• RCBO+I
RCBII+III Ki67<20%
-*•• RCBII+III Ki67>20%
-•■ RCBO+I
-^ RCBII-III ИОЛ повысились ь RCBII+III ИОЛ не изменились
Рисунок 5. Безрецидивная выживаемость в зависимости от класса RCB и уровня Ki-67 в резидуальной опухоли.
Рисунок 6. Безрецидивная выживаемость в зависимости от класса RCB и динамики ИОЛ.
ки резидуальной опухоли по системе RCB, что позволяет получить более точную прогностическую информацию.
Поскольку не у всех больных даже с выраженной резидуальной опухолью в дальнейшем развивается прогрессирование болезни, большой интерес представляет изучение характеристик резидуальной опухоли, которые могут дать дополнительную прогностическую информацию, помимо класса RCB. Мы изучили роль индекса пролиферации Ki-67 и уровня ИОЛ в резидуальной опухоли. Оказалось, что низкий уровень Ki-67 (<20%), а также повышение ИОЛ в результате НАХТ (с <40 % в первичной опухоли до ≥50% в резидуальной опухоли) статистически значимо коррелируют с более высокими показателями БРВ. Далее мы объединили данные по уровню Ki-67, динамике ИОЛ и классам RCB. Это позволило еще более четко выделить резидуальные опухоли благоприятного и неблагоприятного прогноза. Так, 2-летняя БРВ больных с RCB0+I и RCBII+III в сочетании с Ki-67<20% составила 95,8% и 88,9% против 64,2%у больныхс RCBII+III и Ki-67≥20% (р=0,0001). Наши результаты согласуются с данными A. Sheri [7], которые убедительно показали, что сочетание информации по классам RCB и уровню Ki-67 имеет бóльшую прогностическую точность, чем каждый показатель в отдельности.
При повышении уровня ИОЛ в процессе НАХТ выживаемость была статистически значимо выше, чем при отсутствии динамики со стороны ИОЛ (низкие → низкие, высокие → высокие). В нашем исследовании повышение ИОЛ отмечено у 18 больных, среди которых ни у одной не отмечено прогрессирование процесса, причем у 4 из них был высокий уровень Ki-67 в резидуальной опухоли, а у 5 — жизнеспособные клетки в лимфатических узлах. Можно предположить, что динамика ИОЛ имеет даже большее прогностическое значение, чем уровень Ki-67. При объединении данных по уровню и динамике ИОЛ с классами RCB были получены следующие результаты: высокий уровень ИОЛ и особенно повышение уровня ИОЛ в резидуальной опухоли (в сравнении с первичной) имели статистически значимое положительное влияние на выживаемость: 3-летняя БРВ больных с RCB0+I и RCBII+III в сочетании с повышением ИОЛ составила 95,8% и 100% против 66,5% у больных с RCBII+III, у которых уровень ИОЛ не изменился (р=0,0013). Таким образом, именно больные с RCBII–III в сочетании с высоким уровнем Ki-67 или отсутствием динамики ИОЛ являются кандидатами для проведения адъювантной ХТ капецитабином, в то время как при RCB0-I и RCBII–III в сочетании с низким уровнем Ki67 или повышением ИОЛ можно думать об отказе от дополнительного адъювантного лечения. То есть такие простые показатели, как RCB, Ki-67 и ИОЛ, определение которых не требует дополнительных дорогостоящих методик и затрат времен, позволяет более точно оценить риск рецидива и, возможно, индивидуализировать адъювантную ХТ у больных с резидуальной опухолью.
В доступной литературе мы нашли лишь несколько исследований, в которых изучалось роль ИОЛ в резидуальной опухоли при ТН РМЖ после антрациклин/таксансодержа-щей химиотерапии. Полученные данные в целом свидетельствуют о положительном прогностическом влиянии на выживаемость высокого уровня ИОЛ в резидуальной опухоли. Так, в исследовании Dieci с соавт. больные с высоким уровнем ИОЛ (>60%) имели значимо более высокие показатели 5-летней безметастатической выживаемости по сравнению с больными, у которых содержание ИОЛ в опухоли было низким: 81,5 и 46% соответственно [8]. Кроме того, авторы провели анализ динамики ИОЛ в 19 случаях и отметили, что в 4 случаях уровень ИОЛ был высоким до и после лечения, а в остальных случаях он изменился с низкого на высокий. Небольшое количество наблюдений не позволило авторам оценить влияние динамики ИОЛ на выживаемость. В нашей работе рост ИОЛ отмечен в 47% случаев. В недавно опубликованной работе тех же авторов, изучалась дополнительная к классам RCB прогностическая роль ИОЛ в резидуальной опухоли. Авторы показали, что уровень ИОЛ статистически значимо коррелирует с выживаемостью. Наибольшее положительное прогностическое значение высокого уровня ИОЛ отмечалось при RCBII в отличие от RCBIII: 3-летняя БРВ при RCBII и уровне ИОЛ ≤20% составила 57% в сравнении с 83% при уровне ИОЛ >20% [9].
В работе Miyashita с соавт., 2015 [9] изучалось влияние ИОЛ и их субпопуляций в резидуальной опухоли на выживаемость больных ТН РМЖ. Как и в нашем исследовании, уровень ИОЛ в целом не оказывал значимого влияния на выживаемость. В то же время высокий уровень CD8+ ИОЛ и высокое отношение CD8/FOXP3 коррелировали с более высокими показателями БРВ. Кроме того, авторы показали, что повышение содержания CD8+ ИОЛ также имело положительное прогностическое значение: 5-летняя БРВ составила 74% при значительном повышении уровня CD8+ ИОЛ и всего 20% — при незначительном повышении этого показателя.
Еще один аспект, о котором необходимо упомянуть, касается вопросов стадирования. Среди «недостатков» НА подхода в первую очередь упоминается невозможность точного клинического стадирования, что может привести к неадекватному (недостаточному или, наоборот, избыточному) лечению. Наше исследование показало, что информация, которую мы получаем в результате проведения НАХТ несет гораздо большую прогностическую значимость, чем точное определение стадии опухолевого процесса. Например, даже опухоли с изначальной клинической стадией T1N0 могут иметь в результате проведения НАХТ резидуальную опухоль класса RCBII с высоким уровнем Ki-67 и/или отсутствием динамики ИОЛ, что будет говорить о менее благоприятном прогнозе в сравнении с опухолью большей распространенности, даже с поражением лимфатических узлов, но с пПР. При выполнении на первом этапе хирургического лечения мы, разумеется, будем иметь точную патоморфологическую стадию, но потеряем крайне важную прогностическую информацию, которая может помочь нам при планировании адъювантной лекарственной терапии.
Таким образом, в нашем исследовании убедительно показано значение неоадъювантного подхода в лечении больных ранним раком молочной железы с тройным негативным фенотипом. Оценка резидуальной опухоли по системе RCB, а также определение дополнительных биологических характеристик резидуальной опухоли, таких как уровень Ki-67 и ИОЛ позволяет более точно оценить прогноз и индивидуализировать адъювантную терапию.
Список литературы Прогностическое значение биологических характеристик резидуальной опухоли после проведения неоадъювантной химиотерапии при раннем раке молочной железы с тройным негативным фенотипом
- Fisher B, Brown A, Mamounas E, et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18. J Clin oncol. 1997; 15:2483 - 2493.
- Masuda N, Lee SJ, Ohtani S, et al. Adjuvant Capecitabine for Breast Cancer after Preoperative Chemotherapy. N Engl J Med. 2017; 376:2147 - 59.
- Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triplenegative breast cancer. J Clin Oncol 2008; 26:1275 - 81.
- Игнатова Е. О., Фролова М. А., Петровский А. В., с соавт. Оценка эффективности и токсичности интенсифицированного платиносодержащего режима предоперационной химиотерапии при первично операбельном раке молочной железы с тройным негативным фенотипом. Злокачественные опухоли. 2016; 4 (20): 49 - 57.
- Dieci MV, Radosevic-Robin N, Fineberg S. Update on tumor-infiltrating lymphocytes (TILs) in breast cancer, including recommendations to assess TILs in residual disease after neoadjuvanttherapy and in carcinoma in situ: A report of the International Immuno-Oncology Biomarker Working Group on Breast Cancer. Semin Cancer Biol. 2018 Oct;52 (Pt 2):16 - 25
- Symmans WF, Peintinger F, Hatzis C et al. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy. J Clin Oncol. 2007 Oct 1;25 (28):4414 - 22.
- Sheri А, Smith IE, Johnston SR. Residual proliferative cancer burden to predict longterm outcome following neoadjuvant chemotherapy. Ann Oncol. 2015; 26: 75 - 80.
- Dieci MV, Criscitiello C, Goubar A, et al. Prognostic value of tumor-infiltrating lymphocytes on residual disease after primary chemotherapy for triple-negative breast cancer: a retrospective multicenter study. Ann. Oncol. 2014; 25: 611 - 618.
- Miyashita M, Sasano H, Tamaki K Prognostic significance of tumor-infiltrating CD8+ and FOXP3+ lymphocytes in residual tumors and alterations in these parameters after neoadjuvant chemotherapy in triple-negative breast cancer: a retrospective multicenter study. Breast Cancer Res. 2015 Sep 4;17:124.


