Прогностическое значение церебральной оксигенации и ретроградного давления при каротидной эндартерэктомии
Автор: Карпенко А.А., Кужугет Росси Александрович, Каменская О.В., Игнатенко П.В., Стародубцев В.Б., Шилова Анна Николаевна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Сосудистая хирургия
Статья в выпуске: 2 т.20, 2016 года.
Бесплатный доступ
Цель. Определить прогностическую ценность показателей ретроградного давления и церебральной оксигенации в оценке ишемического повреждения головного мозга при каротидной эндартерэктомии. Материал и методы. В нерандомизированное проспективное пилотное исследование включены 87 пациентов с бессимптомными стенозами более 70%, которым проведена каротидная эндартерэктомия под общей анестезией. Толерантность головного мозга к ишемии определяли на основании методов оценки измерения ретроградного давления, ΔrSO2 и церебральной оксигенации (rSO2) на этапе пробного пережатия сонной артерии. Больные в зависимости от степени снижения церебральной оксигенации от исходного уровня (ΔrSO2) на этапе пробного пережатия сонной артерии разделены на З группы: 1-я группа (n = З5) - ΔrSO22 с 1О до 19,9%, 3-я группа (n = 14) - ΔrSO2 ≥20%. Первичной конечной точкой исследования являлось значение AUC более 0,70, означающее высокое прогностическое качество методов исследования. Результаты. Периоперационных инсультов, инфарктов миокарда не выявлено. Среднее время пережатия сонной артерии составило 28 (26-30) мин. 3 пациента, у которых использованы временные шунты, исключены из исследования, так как у них имелось синхронное снижение показателей ретроградного давления, rSO2 и ΔrSO2. Выявлено, что концентрация протеина S-100 и NSE во всех группах на разных этапах существенно не отличалась (р>0,05). Показано, что временное выключение кровотока по сонной артерии во время каротидной эндартерэктомии сопровождается обязательным достоверным повышением концентрации маркеров повреждения головного мозга (S-100, NSE) с последующим восстановлением маркеров на третьи сутки после операции. ROC-анализ показал, что ни один из методов оценки толерантности головного мозга к ишемии (ретроградное давление, ΔrSO2 и ΔSO2) не обладает высоким качеством (AUC >0,7) при прогнозировании повреждения головного мозга во время каротидной эндартерэктомии. Удовлетворительным, но низким качеством прогнозирования (AUC 2, в то время как для протеина S-100 по показателям ΔrSO2 и rSO2 и для NSE по показателям ретроградного давления и rSO2 значения AUC не превышали 0,60. Выводы. Методы измерения ретроградного давления и церебральной оксигенации являются лишь отражением коллатерального кровотока и кислородного статуса головного мозга, имеющие тесную взаимосвязь, однако они не могут полностью прогнозировать ишемическое повреждение нейронов при выполнении каротидной эндартерэктомии, так как не обладают высоким прогностическим уровнем.
Каротидная эндартерэктомия, церебральная оксигенация, ретроградное давление, протеин s-100, нейроcпецифичеcкая енолаза
Короткий адрес: https://sciup.org/142140748
IDR: 142140748 | DOI: 10.21688-1681-3472-2016-2-95-10З
Текст научной статьи Прогностическое значение церебральной оксигенации и ретроградного давления при каротидной эндартерэктомии

Статья доступна по лицензии Creative Commons Attribution 4.0.
Таблица 1 Характеристика пациентов
|
Характеристика |
Всего, n = 87 |
Группа больных |
р |
|||
|
1-я, n = 35 |
2-я, n = 35 |
3-я, n = 17 |
||||
|
1–2 |
0,126 |
|||||
|
Возраст, лет |
63 (58–73) |
67 (61–74) |
61 (56–68) |
62 (58–72) |
2–3 |
1,000 |
|
1–3 |
0,413 |
|||||
|
1–2 |
0,910 |
|||||
|
Мужской пол, n (%) |
52 (60) |
16 (46) |
24 (69) |
12 (71) |
2–3 |
1,000 |
|
1–3 |
1,000 |
|||||
|
1–2 |
1,000 |
|||||
|
Курящие, n (%) |
34 (39) |
10 (29) |
14 (40) |
10 (57) |
2–3 |
1,000 |
|
1–3 |
0,398 |
|||||
|
1–2 |
0,343 |
|||||
|
Дислипидемия, n (%) |
47 (54) |
14 (40) |
22 (63) |
11 (64) |
2–3 |
1,000 |
|
1–3 |
0,421 |
|||||
|
1–2 |
1,000 |
|||||
|
Стеноз оперированной сонной артерии, n (%) |
78 (74–87) |
72 (68–81) |
73 (69–80) |
73 (69–79) |
2–3 |
1,000 |
|
1–3 |
1,000 |
|||||
|
1–2 |
1,000 |
|||||
|
Разомкнутый виллизиев круг, n (%) |
63 (72) |
22 (63) |
25 (71) |
16 (93) |
2–3 |
0,730 |
|
1–3 |
0,307 |
|||||
|
1–2 |
1,000 |
|||||
|
Мультифокальный атеросклероз, n (%) |
81 (93) |
31 (89) |
33 (94) |
17 (100) |
2–3 |
1,000 |
|
1–3 |
1,000 |
|||||
|
1–2 |
1,000 |
|||||
|
Ишемическая болезнь сердца, n (%) |
72 (83) |
29 (83) |
27 (77) |
16 (93) |
2–3 |
1,000 |
|
1–3 |
1,000 |
|||||
|
1–2 |
1,000 |
|||||
|
Постинфарктный кардиосклероз, n (%) |
33 (32) |
8 (23) |
11 (31) |
10 (57) |
2–3 |
0,484 |
|
1–3 |
0,186 |
|||||
|
1–2 |
1,000 |
|||||
|
Реваскуляризация миокарда в анамнезе, n (%) |
40 (46) |
14 (40) |
16 (46) |
10 (57) |
2–3 |
1,000 |
|
1–3 |
1,000 |
|||||
|
1–2 |
1,000 |
|||||
|
Симптомный стеноз внутренней сонной артерии, n (%) |
28 (32) |
12 (34) |
12 (34) |
4 (26) |
2–3 |
1,000 |
|
1–3 |
1,000 |
|||||
Ишемический инсульт сохраняет медико-социальную значимость в связи с частотой развития, высоким процентом инвалидизации и смертности. Своевременная хирургическая реваскуляризация сонных артерий доказала эффективность в снижении риска ишемического инсульта [1, 2]. Однако операция на сонных артериях может привести к периоперационным осложнениям, в том числе инсульту [3]. Одной из особенностей реконструктивной хирургии сонных артерий является необходимость временного выключения магистральной артерии головного мозга (ГМ) из кровотока, которое может привести к гемодинамическому нарушению церебральной перфузии с последующим развитием инсульта [4], поэтому во время основного этапа операции важно осуществлять контроль над функциональным состоянием ГМ, позволяющим проводить меры по коррекции нарушений при выявлении его гипоперфузии [5]. В то же время нет единой точки зрения о наиболее информативных показателях, отражающих степень ишемии ГМ в период пережатия сонных артерий [6]. Для интраоперационного определения показаний к использованию временного шунта (ВШ) рекомендуют измерение ретроградного давления (РД) в сонной артерии, измерение скорости кровотока по средней мозговой артерии с помощью транскраниальной допплерографии и церебральной оксиметрии [7]. В настоящее время еще нет достаточных доказательств преимуществ одной из форм мониторирования по сравнению с другими для определения показаний к применению ВШ и прогнозирования ишемического повреждения нейронов ГМ при каротидной эндартерэктомии (КЭ). Более того, недостаточно доказательств в поддержку рутинного или селективного использования ВШ во время КЭ или отказа от него. [7, 8, 9]. Также окончательно не определены оптимальные пороги РД и церебральной оксигенции при установлении показаний к временному шунтированию [10, 11, 12].
Сравнительный анализ степени ишемического повреждения ГМ при КЭ в зависимости от уровня кислород- ного статуса и коллатерального кровотока позволят понять механизмы ишемии головного мозга при временной окклюзии сонной артерии.
Материал и методы
Проведено нерандомизированное проспективное пилотное исследование. В анализ включены 87 пациентов с бессимптомными стенозами более 70%, перенесших КЭ под общей анестезией в 2013 г. в центре сосудистой и гибридной хирургии ФГБУ «ННИИПК им. акад. Е.Н. Ме-шалкина» Минздрава России. Исследование рассмотрено и одобрено этическим комитетом. Все пациенты подписывали информированное согласие для участия в исследовании.
Исключались пациенты с гемодинамически незначимыми стенозами сонных артерий; симптомными стенозами; перенесшие инфаркты миокарда и черепно-мозговую травму давностью менее 6 мес.; с хронической сердечной недостаточностью IV функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA) и злокачественными заболеваниями, пациенты, нуждающиеся в одновременной коррекции коронарного и каротидного бассейнов; с сахарным диабетом. Пациенты, которым устанавливались ВШ, в последующем не включены в исследование, так как временная окклюзия внутренней сонной артерии не превышала 2–3 мин.
Из табл. 1 видно, что по гендерным признакам, количеству курящих, дислипидемии, выраженности и симптом-ности стеноза сонной артерии, развитию виллизиева круга, распространенности атеросклероза, сердечной патологии достоверного различия в группах не отмечено (р>0,05).
Всем пациентам выполнена КЭ под общей ингаляционной анестезией севофлюраном и болюсов фентанила. Пациенты (n = 87) в зависимости от степени снижения уровня rSO2 от исходного уровня ( ∆ rSO2) на оперируемой стороне во время пробного пережатия сонной артерии были разделены на 3 группы. В 1-ю группу вошли больные (n = 35) с ∆ rSO2 ≤ 9,9%, во 2-ю группу (n = 35) включены пациенты с ∆ rSO2 от 10 до 19,9%, в 3-ю группу (n = 17) вошли больные с ∆ rSO2 ≥ 20%.
Толерантность ГМ к ишемии определяли на основании методов оценки РД, ∆rSO2 и rSO2 на этапе пробного пережатия сонной артерии. Показаниями к установке ВШ были синхронное снижение РД ≤40 мм рт. ст., rSO2 ≤40% и повышение ∆rSO2 ≥20%. При изолированном снижении или повышении данных показателей ВШ не применяли. Из исследования в дальнейшем исключены 3 больных из 3-й группы, которым применялся ВШ. Таким образом, в исследовании остались 84 пациента. Уровень rSO2 при пробном пережатии сонной артерии оценивали через 2 мин после его начала с помощью транскраниального спектрос- копического мониторинга с билатеральным измерением rSO2 в лобно-височных областях головы одновременно на оперируемой и контралатеральной стороне прибором INVOS-5100 (Somanetics Corp., США).
Для лабораторной оценки ишемического повреждения нейронов ГМ на 5 этапах исследования был выполнен забор крови из внутренней яремной вены: первый – в начале операции, второй – перед пробным пережатием сонной артерии, третий – после восстановления кровотока по сонной артерии, четвертый – 1-е сутки после операции, пятый – 3-е сутки после операции. Для определения концентрации протеина S-100 использовали наборы химических реагентов для иммуноферментного анализа CanAg S100 EIA (Fujirebio, Швеция), диапазон нормальных значений 0–105 нг/л. Для определения концентрации NSE использовали тест-систему CanAg NSE EIA (Fujirebio, Швеция), диапазон нормальных значений 0–13 мкг/л.
Статистический анализ проводили с помощью программ Statistica 7.0, MedCalc Statistical Software v15.4. Для проверки нормальности распределения параметров применяли W-критерий Шапиро – Уилка. Количественные данные представлены в виде медианы (Ме) и 25–75% процентили (25–75%). Количественные попарные признаки сравнивали с применением критерия Манна – Уитни, для оценки различий более двух независимых признаков использовали критерий Краскела – Уолиса. Зависимые переменные сравнивали критерием Уилкоксона. Для оценки взаимосвязи параметров проведен ранговый корреляционный анализ Спирмена. Уровень отклонения нулевой гипотезы об отсутствии различий между группами принимали при р<0,05. Для определения прогностической значимости (AUC) параметров РД, rSO2 и ∆ rSO2, для прогнозирования превышения их референтных значений применяли ROC-анализ. Первичной конечной точкой исследования являлось изменение показателя AUC более 0,7, показателей РД, rSO2, ∆ rSO2, что свидетельствовало о высоком качестве прогнозирования.
Результаты
Операции выполнены ангиохирургами одинаковой квалификации с применением различных способов реконструкции бифуркации сонных артерий: эверсионный способ – 45 (54%), пластика заплатой – 31 (37%), протезирование внутренней сонной артерии – 8 (10%). Значимых различий по способу реконструкции бифуркации сонной артерии между группами не выявлено (p>0,05). Периоперационных инфарктов миокарда, инсультов и летальности до 30 дней после КЭ не отмечено. Среднее время пережатия сонной артерии составило 27 (21–30) мин, при этом оно не имело достоверного различия в группах (р>0,05). Уровень пока-
Таблица 2 Показатели ретроградного давления, rSO2 и ∆ rSO2
Из табл. 2 видно, что уровень rSO2 до пробного пережатия сонной артерии в группах не имел различий (р>0,05) и в среднем составил 61 (54–69). Уровень rSO2 при пробном
---о-- Уровнь rSO2, % (Y слева)
Степень сниженияr rSO2, % (Y слева)
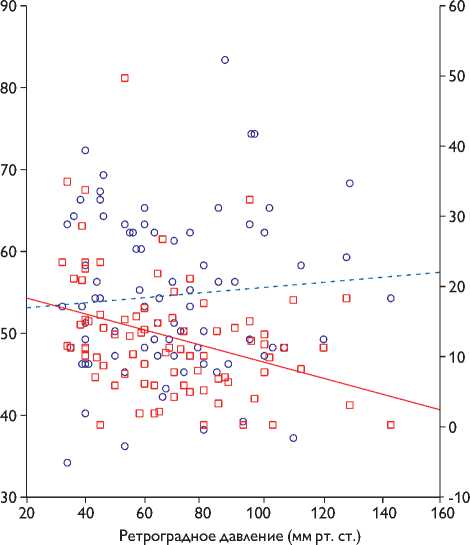
Рис. 1. Диаграмма рассеяния и линейной регрессии с двойной осью Y для выявления взаимосвязи ретроградного давления с rSO2 и ∆ rSO2 на этапе пробного пережатия сонной артерии
Fig. 1 . Scatter/double Y-axis linear regression diagram for determining the relationship between retrograde pressure and rSO2 and ∆ rSO2 indicators during carotid artery trial clamping
Таблица 3 Динамика концентрации протеина S-100 в зависимости от ∆ rSO2 на этапах
Для определения взаимосвязи РД и rSO2 и ∆ rSO2 на этапе пробного пережатия сонной артерии построена диаграмма рассеяния и линейной регрессии с двойной осью Y (рис. 1).
Как видно из рис. 1, на этапе пробного пережатия сонной артерии зависимости между уровнем РД (ось X графика) и rSO2 (правая ось Y графика) не выявлено (R = 0,07; р = 0,48). Однако выявлена тесная связь между уровнем ретроградного давления (ось X) и ∆ rSO2 (левая ось Y графика) (R = –0,40; р = 0,0002), что подтверждает эффективность показателя ∆ rSO2 для оценки толерантности головного мозга к ишемии наряду с РД для установки ВШ, а не значения rSO2 на этапе пробного пережатия сонной артерии.
Проведен сравнительный анализ динамики концентрации протеина S-100 в зависимости от ∆ rSO2 на этапах исследования. Установлено, что уровень концентрации протеина S-100 между группами на всех этапах исследования не имел достоверного различия (р>0,050) (табл. 3).
Для оценки динамики концентрации протеина S-100 на этапах исследования вычислялись их средние значения.
На первом этапе концентрация протеина S-100 составила в среднем 70,5 (53,5–84,2) нг/л. На втором этапе отмечалось достоверное увеличение концентрации протеина S-100 во всех группах до 101,4 (76,6–124,2) нг/л (p<0,0001). На третьем этапе выявлен дальнейший достоверный рост протеина S-100 от исходного уровня до 112,3 (83,1–159,7) нг/л (p<0,0001). При этом концентрация протеина S-100 во всех группах на данном этапе превышала референтные значения (норма 0–105 нг/л). На четвертом этапе отмечается восстановление концентрации протеина S-100 во всех группах до исходных значений, что составило 61,4 (48,2–77,6) нг/л. На третьи сутки зафиксировано дальнейшее уменьшение протеина S-100 до 56,6 (48,2–77,6) нг/л в трех группах по сравнению с исходными значениями.
Следующим маркером повреждения нейронов ГМ являлась NSE (диапазон нормальных значений 0–13 мкг/л). Из табл. 4 видно, что уровень концентрации NSE в группах и на этапах исследования не различался (р>0,05).
Выявлено, что преимуществом прогнозирования обладает РД, где AUC 0,63 (95% ДИ 0,52–0,73), однако оно имеет слабое качество прогнозирования. Неудовлетворительным качеством обладает ∆ rSO2, где AUC 0,59 (95% ДИ 0,48–0,70), и rSO2, где AUC 0,58 (95% ДИ 0,47–0,69). При этом значимого различия AUC между параметрами не выявлено (р>0,05).
Для оценки преимущества методов оценки толерантности ГМ к ишемии РД, ∆ rSO2 и rSO2 в прогнозировании повышения референтных значений NSE построена ROC-кривая, при этом проведено попарное сравнение площадей под ROC-кривыми (AUC) (рис. 3).
Преимуществом прогнозирования свыше референтных значений NSE обладает ∆ rSO2, где AUC составляла 0,63 (95% ДИ 0,52–0,73), следующим по значимости параметром является РД, где AUC 0,61 (95% ДИ 0,50–
Таблица 4 Динамика концентрации NSE в зависимости от ∆ rSO2 на этапах исследования
|
Этап |
NSE, мкг/л |
р |
|||
|
Среднее, n = 84 |
1-я группа, n = 35 |
2-я группа, n = 35 |
3-я группа, n = 14 |
||
|
1 |
4,9 (3,7–7,1) |
4,8 (3,6–6,4) |
5,3 (3,8–6,8) |
4,9 (4,0–9,5) |
1–2: 1,000 2–3: 1,000 1–3: 1,000 |
|
2 |
6,7 (4,7–10,5) |
6,1 (4,2–9,5) |
6,6 (4,9–10,8) |
8,5 (5,4–12,6) |
1–2: 0,718 2–3: 1,000 1–3: 0,493 |
|
3 |
7,6 (5,4–13,3) |
7,0 (4,2–9,5) |
8,0 (5,4–11,9) |
12,1 (5,6–15,7) |
1–2: 1,000 2–3: 1,000 1–3: 0,436 |
|
4 |
6,1 (4,8–8,1) |
5,9 (5,2–6,8) |
6,0 (4,3–9,9) |
6,4 (3,6–8,5) |
1–2: 1,000 2–3: 1,000 1–3: 1,000 |
|
5 |
5,1 (3,6–6,9) |
4,5 (3,6–6,0) |
5,2 (3,8–7,5) |
4,9 (3,3–6,6) |
1–2: 0,414 2–3: 1,000 1–3: 1,000 |
0,72), однако оба параметра обладают слабым качеством прогнозирования. Неудовлетворительным качеством обладает rSO2, где AUC 0,54 (95% ДИ 0,42–0,64). При этом значимого различия AUC между параметрами не выявлено (р>0,05).
Таким образом, высоким прогностическим значением (AUC более 0,7) не обладает ни один из методов оценки толерантности ГМ к ишемии. Удовлетворительным, но низким качеством прогнозирования повышения референтных значений нейромаркеров поврежде-
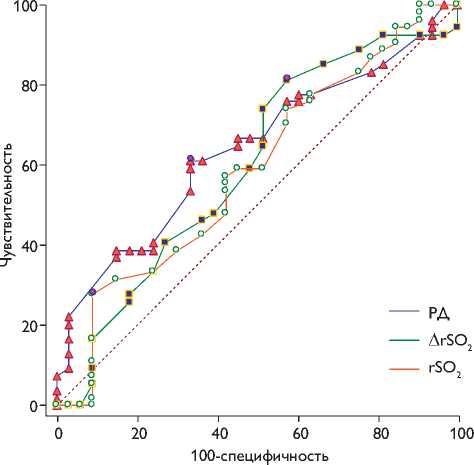
Рис. 2. Сравнение ROC-кривых параметров ретроградного давления, ∆ rSO2 и rSO2 по отношению к прогнозированию протеина S-100 свыше 105 нг/л
Fig. 2. Comparison of ROC-curves of retrograde pressure, ∆ rSO2 and rSO2 parameters with regard to prediction of S-100 protein value exceeding 105 ng/l.
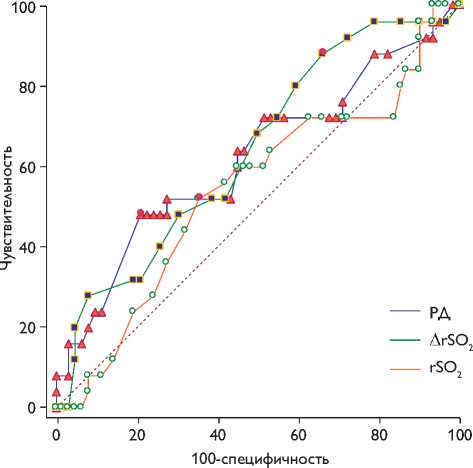
Рис. 3. Сравнение ROC-кривых параметров ретроградного давления, ∆ rSO2 и rSO2 по отношению к прогнозированию NSE свыше 13 мкг/л
Fig. 3. Comparison of ROC-curves of retrograde pressure, ∆ rSO2 and rSO2 parameters with regard to prediction of NSE protein value exceeding 13 µg/l.
ния ГМ (протеин S-100 и NSE) обладает РД, в то время другие показатели ( ∆ rSO2 и rSO2) не превышали AUC более 0,60. При значении AUC ниже 0,60 метод прогнозирования расценивается как обладающий неудовлетворительным качеством прогнозирования.
Обсуждение
Повышение экстракции кислорода из притекающей крови приводит к снижению насыщения гемоглобина кислородом в оттекающей от мозга венозной крови и является признаком развивающейся тканевой ишемии и гипоксии [1, 13]. В то же время ишемические и гипоксические церебральные процессы напрямую связаны с состоянием коллатерального кровотока ГМ, показателем которое является РД в сонной артерии. Известно, что степень снижения rSO2 при временном пережатии сонной артерии, измеренного при церебральной оксигенации, имеет диагностическое и прогностическое значение. Снижение ∆rSO2 ≥20% на этапе пробного пережатия сонной артерии свидетельствует о неэффективности коллатерального кровотока ГМ и является значимым диагностическим критерием при определении тактики хирургического лечения по сравнению с абсолютными показателями кислородного обеспечения ГМ [14, 15]. Настоящее исследование еще раз доказывает, что ∆rSO2 на этапе пробного пережатия сонной артерии имеет прямую взаимосвязь с уровнем РД (R = –0,40; р = 0,0002) по сравнению с абсолютными значениями rSO2 (R = 0,07; р = 0,48).
В настоящее время продолжается поиск и изучение надежных достоверных биохимических маркеров церебральной ишемии [16, 17], что может стать ключевым компонентом успешного лечения и мониторинга исходов цереброваскулярной патологии. В качестве маркеров тканевого повреждения мозга в последние годы предлагается использовать ряд нейроспецифических белков, входящих в состав нервной и глиальной ткани, появляющихся в крови в повышенных концентрациях при различных повреждениях мозга [18, 19]. Циркулирующие в крови нейроспецифические белки S-100 и NSE были предложены в качестве биохимических маркеров неблагоприятного неврологического исхода [20]. Известно, что белки S-100 и NSE являются достоверными маркерами повреждения ГМ при выполнении операций на брахиоцефальных артериях и других состояниях, приводящих к церебральной ишемии [21, 22, 23], в том числе при развитии инсульта [24].
Настоящее исследование показало, что при КЭ у больных даже с выраженной степенью ∆ rSO2, по сравнению с исходным значением, на этапе пробного пережатия сонной артерии уровень экспрессии маркеров повреждения ГМ не различается от такового у пациентов с нормальными значениями ∆ rSO2.
Авторы ряда исследований указывают разные значения прогностической значимости РД и церебральной оксигенации при оценке толерантности ГМ к ишемии, считая их недостаточно надежными во время определения необходимости шунтирования сонной артерии [10, 11, 12]. Однако данные исследования выполнены при КЭ под местной анестезией. Исследования под общей анестезией для определения прогностической значимости методов недостаточно представлены из соображений безопасности пациента. В этом исследовании прогностическую значимость параметров РД и церебральной оксигенации при КЭ под общей анестезией изучили на основании маркеров повреждения ГМ. Установлено, что метод оценки РД при пороговом значении ≤ 40 мм рт. ст. обладает низким уровнем прогнозирования повышения референтных значений нейромаркеров (AUC = 0,63), при ∆ rSO2 ≥ 20% и rSO2 ≤ 40% – неудовлетворительным (AUC <0,60). Таким образом, при КЭ высоким прогностическим уровнем (значение AUC >0,7) не обладает ни один из методов оценки толерантности ГМ к ишемии (РД, ∆ rSO2 и rSO2), которые оцениваются по экспертной шкале для значений AUC [25].
Заключение
Методы измерения ретроградного давления и церебральной оксигенации отражают тесно взаимосвязанные коллатеральный кровоток и кислородный статус головного мозга, однако не способны в полной мере прогнозировать ишемическое повреждение нейронов при каротидной эндартерэктомии из-за низкого прогностического уровня.
Ограничения
Проведенное пилотное исследование обладает ограничениями, связанными с небольшим объемом выборки. Также в исследовании не оценивали когнитивную дисфункцию в зависимости от имеющихся параметров.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Прогностическое значение церебральной оксигенации и ретроградного давления при каротидной эндартерэктомии
- Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST)//Lancet. 1998. Vol. 35 (1). P. 1З79-1З87.
- North American Symptomatic Carotid Endarterectomy Trial Collaboration. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade stenosis//J. New England Medicine. 1991. Vol. 32 (5). P. 445-45З.
- Rerkasem K., Rothwell P.M. Carotid endarterectomy for symptomatic carotid stenosis//Cochrane Database Syst. Rev. 2011. Vol. 4. P. CD ОО1О81 DOI: 10.1002/14651858.CD001081.pub2
- Федин А.И., Кузнецов М.Р., Берестень Н.Ф., Холопова Е.А., Тугдумов Б.В., Румянцева Е.И., Павочкина Е.С. Состояние ауторегуляции мозгового кровотока//Журнал неврологии и психиатрии имени С.С. Корсакова. 2011. Т. З. № 1. С. 68-7З.
- Deogaonkar A., Vivar R., Bullock R., Price K., Chambers I., Mendelow A.D. Bispectral index monitoring may not reliably indicate cerebral ischaemia during awake carotid endarterectomy//British. J. Anaesthesia. 2ОО5. Vol. 94 (6). P. 8ОО-8О4.
- Гулешов В.А., Белов Ю.В., Селезнев М.Н. Анестезиологическое обеспечение операций на брахиоцефальных артериях//Кардиология и сердечно-сосудистая хирургия. 2008. № 4. С. 69-74.
- Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий. Режим доступа http://www.angiolsurgery.org/recommendations/2013/recommendations_ brachiocephalic.pdf (дата обращения 7.04.2016).
- Aburahma A.R., Stone P.A., Hass S.M., Dean L.S., Habib J., Keiffer T., Emmett M. Prospective randomized trial of routine versus selective shunting in carotid endarterectomy based on stump pressure//J. Vasc. Surg. 2010. Vol. 51 (5). P. 11ЗЗ-11З8 DOI: 10.1016/j.jvs.2009.12.046
- Rerkasem K., Rothwell P.M. Routine or selective carotid artery shunting for carotid endarterectomy (and different methods of monitoring in selective shunting)//Cochrane Stroke Group Cochrane Database of Systematic Reviews. 2ОО9. Vol. 2. P. CD000190 DOI: 10.1002/14651858.CD000190.pub2
- Belardi P., Lucertini G., Ermirio D. Stump pressure and transcranial Doppler for predicting shunting in carotid endarterectomy//Eur. J. Vasc. Endovasc. Surg. 2ООЗ. Vol. 25 (2). P. 164-167.
- Calligaro K.D., Dougherty M.J. Correlation of carotid artery stump pressure and neurologic changes during 474 carotid endarterectomies performed in awake patients//J. Vasc. Surg. 2ОО5. Vol. 42 (4). P. 684-689.
- Rigamonti A., Scandroglio M., Minicucci F., Magrin S., Carozzo A., Casati A. A clinical evaluation of near-infrared cerebral oximetry in the awake patient to monitor cerebral perfusion during carotid endarterectomy//J. Clin. Anesth. 2ОО5. Vol. 17 (6). P. 426-430.
- Edmonds H.L., Zhang Y.P., Shields C.B. New neurophysiology and central nervous system dysfunction//Curr. Opin. Crit. Care. 2ООЗ. Vol. 9 (2). P. 98-1О5.
- Караськов А.М., Левичева Е.Н., Логинова И.Ю., Каменская О.В., Карпенко А.А., Стародубцев В.Б., Кужугет Р.А. Возможности церебральной оксиметрии в оценке эффективности коллатерального кровообращения головного мозга при проведении каротидной эндартерэктомии//Грудная и сердечно-сосудистая хирургия. 2010. № 6. С. 37-41.
- Samra S.K., Dy E.A., Welch K., Dorje P., Zelenock G.B., Stanley J.C. Evaluation of a cerebral oximeter as a monitor of cerebral ischemia during carotid endarterectomy//Anesthesiology. 2ООО. Vol. 93 (4). P. 964-970.
- Скоромец А.А. Дамбинова С.А., Дьяконов М.М., Гранстрем О.К., Билецкий П.С., Седова О.А., Скоромец А.П., Скоромец Т.А., Смолко Д.Г., Хунтеев Г.В., Шикуев А.В., Шумилина М.В. Биохимические маркеры в диагностике ишемии головного мозга//Международный неврологический журнал. 2009. Т. 27. № 5. С. 15-20.
- Whiteley W., Tseng М., Sandercock P. Blood biomarkers in the diagnosis of ischemic Stroke: a systematic review//Stroke. 2008. Vol. 39 (10). 2902-2909 DOI: 10.1161/STROKEAHA.107.511261
- Крижановский Г.Н. Общая патофизиология нервной системы. М., 1997. 349 с.
- Молочный В.П., Макарова Т.Е., Головкова Н.Ф., Обухова Г.Г. Нейроспецифическая енолаза и глиофибрилярный кислый протеин крови и цереброспинальной жидкости как маркер повреждения ткани мозга при бактериальных гнойных менингитах у детей//Дальневосточный медицинский журнал. 2012. № 2. С. 48-51.
- Gao F., Harris D.N., Sapsed-Byrne S., Stanfield N.J. Nerve tissue protein S-100 and neurone specific enolase concentrations in cerebrospinal fluid and blood during carotid endarterectomy//Anaesthesia. 2000. Vol. 55 (8). P. 764-769.
- Brightwell R.E., Sherwood R.A., Athanasiou T., Hamady T., Cheshire N.J. The neurological morbidity of carotid revascularisation: using markers of cellular brain injury to compare CEA and CAS//Eur. J. Vasc. Endovasc. Surg. 2007. Vol. 34 (5). P. 552-560. DOI: 10.1016/j. ejvs.2007.06.016.
- Shinozaki K., Oda S., Sadahiro T., Nakamura M., Hirayama Y., Abe R., Tateishi Y., Hattori N., Shimada T., Hirasawa H. S-100B and neuron-specific enolase as predictors of neurological outcome in patients after cardiac arrest and return of spontaneous circulation: a systematic review//Crit. Care. 2009. Vol. 13 (4). P. R121 DOI: 10.1186/cc7973
- Schneemilch C.E., Ludwig S., Ulrich A., Halloul Z., Hachenberg T. Somatosensory evoked potentials and biochemical markers of neuronal deficits in patients undergoing carotid endarterectomy under regional anesthesia//Zentralbl. Chir. 2007. Vol. 132 (3). P. 176-182 DOI: 10.1055/s-2007-960727
- Zaheer S., Beg M., Rizvi I., Islam N., Ullah E., Akhtar N. Correlation between serum neuron specific enolase and functional neurological outcome in patients of acute ischemic stroke//Ann. Indian. Acad. Neurol. 2013. Vol. 16 (4). P. 504-508 DOI: 10.4103/0972-2327.120442
- Гланц С. Медико-биологическая статистика. М.: Практика, 1998. 459 с.


