Прогностическое значение экспрессии транскрипционных факторов, фактора роста VEGF, его рецептора, протеинкиназы m-TOR и активности внутриклеточных протеиназ у больных диссеминированным раком почки
Автор: Юрмазов Захар Александрович, Усынин Евгений Анатольевич, Спирина Людмила Викторовна, Кондакова Ирина Викторовна, Слонимская Елена Михайловна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
Введение. Поиск дополнительных информативных прогностических параметров у больных раком почки является актуальной задачей современной онкологии. Цель исследования. Изучение прогностической значимости экспрессии транскрипционных факторов, фактора роста VEGF, его рецептора, протеинкиназы m-TOR и активности внутриклеточных протеиназ у больных диссеминированным раком почки в соотношении со шкалой MSKCC. Материал и методы. В исследование было включено 40 пациентов с метастатическим почечно-клеточным раком (TNM). Согласно шкале MSKCC все больные были 3-40-11распределены на 3 группы: с хорошим (n=13), промежуточным (n=26) и неблагоприятным прогнозом (n=1). В дальнейшем анализ касался больных, имеющих хороший и промежуточный прогноз (n=39). Всем пациентам на первом этапе проводилась таргетная терапия пазопанибом или эверолимусом, после которой выполнялась паллиативная нефрэктомия. Содержание транскрипционных и ростовых факторов изучено методом ИФА; активность протеасом и кальпаинов - с помощью флюорометрического метода. Результаты. Исходно высокие уровни экспрессии транскрипционного фактора HIF-1 и ростового фактора VEGF в опухоли почки ассоциированы с хорошим прогнозом заболевания по шкале MSKCC. У этой категории больных на фоне лечения наблюдалось снижение экспрессии транскрипционных факторов HIF-1, NF-κB р65, NF-κB р50, ростового фактора VEGF и активности протеасом. Выявленное повышение активности кальпаинов у больных с промежуточным прогнозом было ассоциировано с прогрессированием заболевания. Заключение. Выделены дополнительные молекулярные показатели, повышающие информативность шкалы MSKCC, что позволяет с большей точностью предсказать возможный исход заболевания у больных метастатическим раком почки.
Диссеминированный рак почки, прогноз, протеасомы, кальпаины
Короткий адрес: https://sciup.org/14056578
IDR: 14056578 | УДК: 616.61-006.6:577.2
Текст научной статьи Прогностическое значение экспрессии транскрипционных факторов, фактора роста VEGF, его рецептора, протеинкиназы m-TOR и активности внутриклеточных протеиназ у больных диссеминированным раком почки
Введение. Поиск дополнительных информативных прогностических параметров у больных раком почки является актуальной задачей современной онкологии. Цель исследования. Изучение прогностической значимости экспрессии транскрипционных факторов, фактора роста VEGF, его рецептора, протеинки-назы m-TOR и активности внутриклеточных протеиназ у больных диссеминированным раком почки в соотношении со шкалой MSKCC. Материал и методы. В исследование было включено 40 пациентов с метастатическим почечно-клеточным раком (T3–4N0–1M1). Согласно шкале MSKCC все больные были распределены на 3 группы: с хорошим (n=13), промежуточным (n=26) и неблагоприятным прогнозом (n=1). В дальнейшем анализ касался больных, имеющих хороший и промежуточный прогноз (n=39). Всем пациентам на первом этапе проводилась таргетная терапия пазопанибом или эверолимусом, после которой выполнялась паллиативная нефрэктомия. Содержание транскрипционных и ростовых факторов изучено методом ИФА; активность протеасом и кальпаинов – с помощью флюорометрического метода. Результаты. Исходно высокие уровни экспрессии транскрипционного фактора HIF-1 и ростового фактора VEGF в опухоли почки ассоциированы с хорошим прогнозом заболевания по шкале MSKCC. У этой категории больных на фоне лечения наблюдалось снижение экспрессии транскрипционных факторов HIF-1, NF- κ B р65, NF- κ B р50, ростового фактора VEGF и активности протеасом. Выявленное повышение активности кальпаинов у больных с промежуточным прогнозом было ассоциировано с прогрессированием заболевания. Заключение. Выделены дополнительные молекулярные показатели, повышающие информативность шкалы MSKCC, что позволяет с большей точностью предсказать возможный исход заболевания у больных метастатическим раком почки.
Рак почки представляет собой гетерогенную группу опухолей, из которых более 75 % приходится на светлоклеточный почечно-клеточный тип [14], связанный с мутационными изменениями белка фон Хиппель-Линдау, увеличением содержания ядерного фактора HIF-1, гиперэкспрессией эндотелиального фактора роста (VEGF), активацией тирозинкиназных путей [16] и ключевой серин-треониновой протеинкиназой TOR (m-TOR) [9]. Это позволяет рассматривать данные молекулярные маркеры в качестве основных мишеней. Помимо этого, в патогенезе рака почки важную роль играет фактор транскрипции NF- κ B (nuclear factor kappa-В), который вовлечен в апоптоз и пролиферацию опухолевых клеток [12].
Одним из механизмов регуляции содержания транскрипционных факторов NF- κ B и HIF-1 α является внутриклеточный протеолиз, осуществляемый протеиназами, к числу которых относят протеасомы и кальпаины [1, 2, 4, 18]. В литературе представлены данные о том, что снижение деградации HIF-1α при использовании ингибиторов протеиназ или гипоксии приводит к значительному повышению экспрессии VEGF в опухолевых клетках [20]. Активация транскрипционного фактора NF- κ B также осуществляется при участии протеа-сом [13]. Показана связь экспрессии транскрипционных факторов NF- κ B, HIF-1 и ростового фактора VEGF с активностью и субъединичным составом протеасом у больных раком почки при развитии
гематогенных метастазов [3, 4]. Кроме этого, на культуре почечно-клеточного рака (ПКР) выявлено влияние протеасом на содержание активных компонентов m-TOR сигнального пути [19].
При определении тактики лечения больных метастатическим почечно-клеточным раком значимую роль играют факторы прогноза – патоморфо-логические и клинико-лабораторные показатели, входящие в состав ряда прогностических шкал (прогностическая модель ECOG, номограмма Kattan, шкалы Motzer и HENG) [11, 15]. Наиболее известной и широко используемой для прогнозирования течения заболевания является шкала, разработанная в Мемориальном онкологическом центре Слоан-Кеттеринг MSKCC (МОЦСК/MSKCC), которая включает в себя такие параметры, как соматический статус больного по шкале Карновского, уровень ЛДГ, концентрация скорректированного кальция в сыворотке крови, уровень гемоглобина и наличие в анамнезе нефрэктомии.
Однако далеко не всегда этой информации бывает достаточно для прогноза заболевания, что обусловлено сложными механизмами патогенеза рака почки, поэтому ведется непрерывный поиск дополнительных информативных прогностических параметров [10, 18]. Примером таких исследований может служить шкала Heng, в которую кроме критериев MSKCC были включены такие лабораторные показатели, как количество тромбоцитов и нейтрофилов [7, 11].
Целью исследования явилось изучение прогностической значимости экспрессии транскрипционных факторов, фактора роста VEGF, его рецептора, протеинкиназы m-TOR и активности внутриклеточных протеиназ у больных диссеминированным ПКР и соотношение их со шкалой MSKCC.
Материал и методы
В исследование включено 40 больных (табл. 1) с метастатическим морфологически верифицированным почечно-клеточным раком T3–4N0–1M1 стадий, получавших лечение в отделении общей онкологии Томского НИИ онкологии в период с 2010 по 2013 г. Из них 25 мужчин и 15 женщин. На первом этапе пациентам в течение 2 мес проводилась таргетная терапия препаратами пазопаниб (n=26) по 800 мг или эверолимус (n=14) в дозе 10 мг ежедневно.
Разделение больных на группы согласно шкале MSKCC. В зависимости от прогноза заболевания были выделены группы больных с благоприятным, промежуточным и плохим прогнозом. Оценка проводилась по 5 независимым параметрам. Неблагоприятными факторами считали: статус по шкале Карновского <80 %, уровень лактатдегидрогеназы в 1,5 раза выше нормы, скорректированный кальций крови >10 мг/дл, уровень гемоглобина <130 г/л и отсутствие в анамнезе нефрэктомии. В группу благоприятного прогноза вошли пациенты (n=13), у которых не было ни одного из вышеперечисленных факторов, промежуточного (n=26) – при наличии одного или двух факторов, и неблагоприятного (n=1) – при наличии трех факторов и более [15]. В дальнейшем анализ касался больных, имеющих хороший и промежуточный прогноз (n=39). После
Таблица 1
Клиническая характеристика больных, получавших пазопаниб и эверолимус в предоперационном режиме
Материалом для исследования явились образцы опухолевой ткани, полученные при выполнении диагностической биопсии и радикального оперативного вмешательства, которые после забора замораживались и хранились при температуре –80°С.
Получение гомогенатов. Замороженную ткань (100 мг) гомогенизировали в жидком азоте, затем ресуспендировали в 300 мкл 50 мМ трис-HCl буфера (pH=7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1 мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10 000 g и 4оС.
Определение активности протеасом. Химо-трипсинподобную активность тотального пула протеасом определяли в осветленных гомогенатах опухолевых и неизмененных тканей, а также во фракциях протеасом, по гидролизу флуороген-ного олигопептида N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, утилизирующегося химотрипсинподобными центрами протеасом [6], на флуориметре Hitachi-850 (Япония) при длине волны возбуждения 380 нм и эмиссии 440 нм. Реакционная смесь содержала 20 мМ трис-HCl (pH=7,5), 1 мМ дитиотреитола, 30 мкМ N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, 5 мМ хлорида магния и 1 мМ АТФ. Реакцию проводили при 37°С в течение 20 мин и останавливали 1 % додецил сульфатом натрия. Для оценки активности примесных протеаз в образцах применяли специфический ингибитор протеасом – MG132. Удельную активность протеасом выражали в единицах активности на 1 мг белка. Содержание белка определяли по методу Лоури.
Определение активности кальпаинов. Активность кальпаинов определяли в осветленных гомогенатах тканей по методу Sandmann [17]. В качестве субстрата использовали тот же флуорогенный олигопептид N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, который был использован для определения активности протеасом. Реакционная смесь содержала 100 мМ Tris-HCl (pH 7,3), 145 мМ NaCl. Реакцию проводили, добавляя к 30 мкМ Suc-LLVY-AMC, растворенному в реакционной смеси, 5 мкл супернатанта, и инкубируя при 25°С в течение 30 мин в присутствии или отсутствии 10 мМ CaCl2 и 0,4 мкM ингибитора N-ацетил-Leu-Leu-норлейцинал (Sigma) [5].
Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 8.0. В зависимости от вида распределения результаты представлены как m ± M, где m – среднее выборочное, M – ошибка среднего, или как медиана с интерквартильным размахом (25-й и 75-й процентили). Значимость различий исследовали с помощью t-критерия Стьюдента или критерия Манна – Уитни.
Проведение данной работы одобрено этическим комитетом Томского НИИ онкологии.
Результаты исследования и обсуждение
Данные, характеризующие исходный уровень транскрипционных факторов, а также динамика их изменения на фоне лечения таргетными препаратами у больных с хорошим и промежуточным прогнозом заболевания по шкале MSKCC представлены в табл. 2.
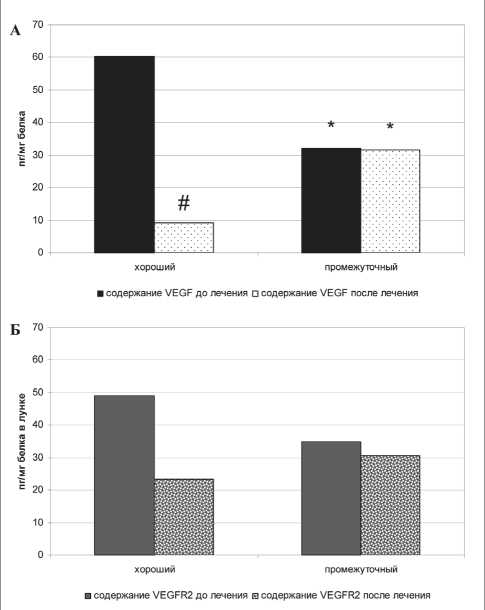
Рис. 1. Содержание ростового фактора VEGF (А) и его рецептора VEGFR2 (Б) в опухоли больных раком почки в зависимости от шкалы MSKCC и этапа лечения. Примечание: * – различия статистически значимы по сравнению с показателями у больных с хорошим прогнозом (р<0,05); # – различия статистически значимы по сравнению с показателями у больных до лечения (р<0,05)
Таблица 2
Экспрессия транскрипционных факторов NF- κ B p65, NF- κ B p50 и HIF-1 α в опухоли больных раком почки в зависимости от шкалы MSKCC и этапа лечения
|
Прогноз по шкале MSKCC |
Содержание NF- κ B p65, УЕ/мг белка в лунке |
Содержание NF- κ B p50, УЕ/мг белка в лунке |
Экспрессия HIF-1 α , УЕ/мг белка в лунке |
|||
|
До лечения |
После лечения |
До лечения |
После лечения |
До лечения |
После лечения |
|
|
Хороший |
20,8 (9,8–37,0) |
4,6 (3,96–4,84)# |
24,7 (9,8–42,6) |
4,0 (3,34–4,9)# |
13,08 (6,2–20,5) |
1,11 (0,34–1,98)# |
|
Промежуточный |
17,9 (6,3–23,0) |
9,0 (3,98–16,46)# |
10,8 (6,0–32,5) |
6,33 (4,0–12,1) |
6,35 (3,2–12,7)* |
1,0 (0,26–3,6) |
Примечание: * – различия статистически значимы по сравнению с показателями у больных с хорошим прогнозом (р<0,05); # – различия статистически значимы по сравнению с показателями у больных до лечения (р<0,05).
Таблица 3
Содержание протеинкиназы p-m-TOR в опухоли больных раком почки в зависимости от шкалы MSKCC и этапа лечения
|
Прогноз по шкале MSKCC |
Содержание p-m-TOR, пг/мг белка в лунке |
|
|
До лечения |
После лечения |
|
|
Хороший |
13,9 (0,0– 20,0) |
6,65 (2,15–7,89)# |
|
Промежуточный |
12,5 (0–14,3) |
15,84 (1,58–21,8)* |
Примечание: * – различия статистически значимы по сравнению с показателями у больных с хорошим прогнозом (р<0,05); # – различия статистически значимы по сравнению с показателями до лечения (р<0,05).
Выявлена исходно высокая экспрессия ядер-ных факторов NF- κ B р65 и NF- κ B р50 в опухоли больных обеих групп до начала лечения. В отличие от этих молекулярных показателей уровень транскрипционного фактора HIF-1 α различался в зависимости от прогноза заболевания по шкале MSKCC. Так, исходная экспрессия ядерного фактора в ткани опухоли у пациентов с хорошим прогнозом была в 2 раза выше по сравнению с больными, у которых прогноз был определен как промежуточный.
На фоне проведенной таргетной терапии у больных как с благоприятным, так и промежуточным прогнозом уменьшался уровень NF- κ B р65. Наиболее существенное снижение этих показателей (в 4,5 раза после приема таргетных препаратов) наблюдалось только у больных с хорошим прогнозом по шкале MSKCC. У этих же пациентов отмечено и снижение уровня транскрипционных факторов NF- κ B р50 и HIF-1 α – в 6,1 и 11,8 раза соответственно, в то время как у пациентов с промежуточным прогнозом таких изменений не отмечалось.
Аналогичные данные были получены и в отношении протеинкиназы p-m-TOR. Ее уровень снижался на фоне лечения у больных с хорошим прогнозом в 2 раза и оставался практически равным исходному у пациентов с промежуточным прогнозом (табл. 3).
Содержание ростового фактора VEGF и его рецептора в опухоли больных диссеминированным ПКР в зависимости от прогноза заболевания по шкале MSKCC и этапа лечения представлено на рис. 1. Зафиксирован исходно высокий уровень изучаемого параметра у больных с хорошим прогнозом, который снижался в 6,5 раза на фоне приема таргетных препаратов, тогда как у больных с
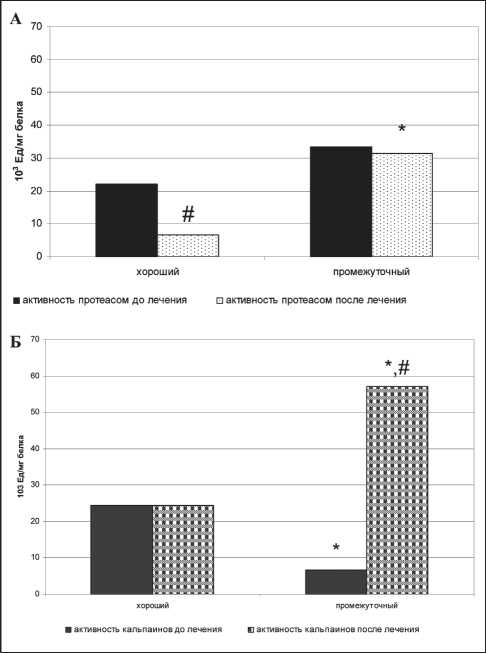
Рис. 2. Активность внутриклеточных протеиназ: протеасом (А), кальпаинов (Б) в опухоли больных раком почки в зависимости от шкалы MSKCC и этапа лечения. Примечание: * – различия статистически значимы по сравнению с показателями у больных с хорошим прогнозом (р<0,05); # – различия статистически значимы по сравнению с показателями у больных до лечения (р<0,05)
промежуточным прогнозом подобной динамики не отмечалось. Экспрессия рецептора VEGFR2 имела только тенденцию к снижению, причем более выраженную у больных с хорошим прогнозом.
Активность внутриклеточных протеиназ у больных диссеминированным раком почки также имела ряд особенностей (рис. 2). На фоне приема таргетных препаратов выявлено снижение активности протеасом в 3,33 раза у больных с хорошим прогнозом, при этом активность кальпаинов оставалась неизменной. Динамика изменений активности внутриклеточных протеиназ у больных с промежуточным прогнозом была противоположной: в ткани опухоли активность протеасом на фоне лечения не изменялась, а активность каль-паинов увеличилась в 8,6 раза. При этом известна значимость кальпаинов в активации локомоторных свойств опухолевых клеток [8]. Возможно, в связи с этим фактом можно обсуждать роль кальпаинов в механизмах прогрессирования заболевания у больных с промежуточным прогнозом и рассматривать этот показатель в качестве прогностического.
Таким образом, исходно высокие показатели экспрессии транскрипционного фактора HIF-1,
Список литературы Прогностическое значение экспрессии транскрипционных факторов, фактора роста VEGF, его рецептора, протеинкиназы m-TOR и активности внутриклеточных протеиназ у больных диссеминированным раком почки
- Кондакова И.В., Спирина Л.В., Коваль В.Д., Шашова Е.Е., Чойнзонов Е.Л., Иванова Э.В., Коломиец Л.А., Чернышова А.Л., Слонимская Е.М., Усынин Е.А., Афанасьев С.Г. Химотрипсинподобная активность и субъединичный состав протеасом в злокачественных опухолях человека//Молекулярная биология. 2014. Т. 48., № 3. С. 444-451
- Спирина Л.В., Кондакова И.В., Усынин Е.А., Винтизенко С.И. Регуляция ангиогенеза при злокачественных новообразованиях почки и мочевого пузыря//Сибирский онкологический журнал. 2008. № 4 (28). С. 65-70
- Спирина Л.В., Кондакова И.В., Усынин Е.А., Коломиец Л.А., Винтизенко С.И., Бочкарева Н.В., Чернышева А.Л. Активность протеасом и содержание ростовых факторов при раке почки, мочевого пузыря и эндометрия//Российский онкологический журнал. 2010. № 1. С. 23-25
- Спирина Л.В., Кондакова И.В., Усынин Е.А., Юрмазов З.А. Регуляция экспрессии транскрипционных факторов и фактора роста эндотелия сосудов протеосомной системой при метастазировании рака почки//Вестник РОНЦ им. Н.Н. Блохина РАМН. 2012. Т. 23, № 1. С. 27-32
- Atencio I.A., Ramachandra M., Shabram P., Demers G.W. Cal-pain inhibitor 1 activates p53-dependent apoptosis in tumor cell lines//Cell Growth Differ. 2000. Vol. 11 (5). P. 247-253
- Ben-Shahar S., Komlosh A., Nadav E., Shaked I., Ziv T., Admon A., DeMartino G.N., Reiss Y. 26 S proteasome-mediated production of an authentic major histocompatibility class I-restricted epitope from an intact protein substrate//J. Biol. Chem. 1999. Vol. 274 (31). P. 21963-21972
- DiriCan A., Kucukzeybek Y., Somali I., Erten C., Demir L., Can A., Bahriye Payzin K., Vedat Bayoglu I., Akyol M., Koseoglu M., Alacacioglu A., Oktay Takhan M. The association of hematologic parameters on the prognosis of patients with metastatic renal cell carcinoma//J. BUON. 2013. Vol. 18 (2). P. 413-419
- Glading A., Bondar R.J., Reynolds I.J., Shiraha H., Satish L., Potter D.A., Blair H.C., Wells A. Epidermal growth factor activates m-calpain (calpain II), at least in part, by extracellular signal-regulated kinase-mediated phosphorylation//Mol. Cell Biol. 2004. Vol. 24 (6). P. 2499-2512
- Guertin D.A., Sabatini D.M. An expanding role for mTOR in cancer//Trends. Mol. Med. 2005. Vol. 11 (8). P. 353-361
- Heng D.Y., Xie W., Regan M.M., Warren M.A., Golshayan A.R., Sahi C., Eigl B.J., Ruether J.D., Cheng T., North S., Venner P., Knox J.J., Chi K.N., Kollmannsberger C., McDermott D.F., Oh W.K., large multicenter study//J. Clin. Oncol. 2009. Vol. 27 (34). P. 5794-5799 DOI: 10.1200/JCO.2008.21.4809
- Heng D.Y., Xie W., Regan M.M., Harshman L.C., Bjarnason G.A., Vaishampayan U.N, Mackenzie M., Wood L., Donskov F., Tan M.-H., Rha S.Y., Agarwal N., Kollmannsberger C., Rini B.I., Choueiri T.K. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study//Lancet. Oncol. Vol. 14 (2). P. 141-148 DOI: 10.1016/S1470-2045(12)70559-4
- Hoffmann A., Baltimore D. Circuitry of nuclear factor kappaB signaling//Immunol. Rev. 2006. Vol. 210. P. 171-186
- Juvekar A., Manna S., Ramaswami S., Chang T.P., Vu H.Y., Ghosh C.C., Celiker M.Y., Vancuriva I. Bortezomib induces nuclear translocation of IkBα resulting in gene-specific suppression of NF-kB-dependent transcription and induction of apoptosis in CTCL//Mol. Cancer Res. 2011. Vol. 9 (2). P. 183-194 DOI: 10.1158/1541-7786.MCR-10-0368
- Keefe S.M., Nathanson K.L., Rathmell W.K. The molecular biology of renal cell carcinoma//Semin. Oncol. 2013. Vol. 40 (4). P. 421-428 DOI: 10.1053/j.seminoncol.2013.05.006
- Motzer R.J., Bacik J., Schwartz L.H., Reuter V., Russo P., Marion S., Mazumdar M. Prognostic factors for survival in previously treated patients with metastatic renal cell carcinoma//J. Clin. Oncol. 2004. Vol. 22 (3). P. 454-463
- Na X., Wu G., Ryan C.K., Shoen S.R., di’Santagness P.A., Messing E.M. Overproduction of vascular endothelial growth factor related to von Hippel-Lindau tumor suppressor gene mutations and hypoxia-inducible factor-1 alpha expression in renal cell carcinomas//J. Urol. 2003. Vol. 170 (2 Pt 1). P. 588-592
- Sandmann S., Prenzel F., Shaw L., Schauer R., Unger T. Activity profile of calpains I and II in chronically infarcted rat myocardium -influence of the calpain inhibitor CAL 9961//Br. J. Pharmacol. 2002. Vol. 135 (8). P. 1951-1958
- Spirina L.V., Yunusova N.V., Kondakova I.V., Kolomiets L.A., Koval V.D., Chernyshova A.L., Shpileva O.V. Association of growth factors, HIF-1 and NF-κB expression with proteasomes in endometrial cancer//Mol. Biol. Rep. 2012. Vol. 39 (9). P. 8655-8662. doi: 10.1007/s11033-012-1720-y
- Wu W.K., Volta V., Cho C.H., Wu Y.C., Li H.T., Yu L., Li Z.J., Sung J.J. Repression of protein translation and mTOR signaling by protea-some inhibitor in colon cancer cells//Biochem. Biophys. Res. Commun. 2009. Vol. 386 (4). P. 598-601 DOI: 10.1016/j.bbrc.2009.06.080
- Yue C.X., Ma J., Zhou H.J. The effect of RhoA and proteasome inhibitor MG132 on angiogenesis in tumors//Sichuan Da Xue Xue Bao Yi Xue Ban. 2011. Vol. 42 (4). 445-450


