Прогностическое значение KI67, циклооксигеназы-2 (COX-2) и P16INK4A у больных местнораспространенным раком шейки матки
Автор: Чуруксаева Ольга Николаевна, Коломиец Лариса Александровна, Савенкова Ольга Владимировна, Недосеков Василий Васильевич, Ибрагимова Марина Константиновна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.15, 2016 года.
Бесплатный доступ
Исследование, проведенное у больных местнораспространенным раком шейки матки (МРРШМ), показало, что высокий уровень экспрессии маркера пролиферации Ki67 у первичных больных, повышенные уровни циклооксигеназы-2 (COX-2) и белка p16ink4a после проведения неоадъювантной химиотерапии коррелируют с неблагоприятным прогнозом, что позволяет использовать эти показатели в мониторинге течения заболевания. Показано, что до начала противоопухолевого лечения уровень экспрессии Ki67 был максимально высоким у тех больных, у которых впоследствии наблюдалось прогрессирование заболевания, и достигал 85 %. Выявлено, что у больных МРРШМ с уровнем экспрессии Ki6750 %. Уровень экспрессии циклооксигеназы COX-2, определяемый после химиотерапевтического лечения, коррелирует с общей выживаемостью больных МРРШМ. Так, 5-летняя выживаемость больных МРРШМ при уровне экспрессии COX-250 % - 66 %. Показано, что уровень экспрессии белка p16ink4a коррелирует с показателями безрецидивной выживаемости.
Местно-распространенный рак шейки матки, факторы прогноза
Короткий адрес: https://sciup.org/140254068
IDR: 140254068 | УДК: 618.146-006:616-091.818 | DOI: 10.21294/1814-4861-2016-15-5-25-32
Текст научной статьи Прогностическое значение KI67, циклооксигеназы-2 (COX-2) и P16INK4A у больных местнораспространенным раком шейки матки
Рак шейки матки (РШМ) занимает ведущее место в структуре онкологической женской заболеваемости и смертности [1]. Отдаленные результаты лечения больных РШМ остаются неудовлетворительными, рецидивы после специального лечения чаще возникают через 12–20 мес и наблюдаются в 32–78,3 % случаев [2]. До 45 % больных погибают в течение первых 5 лет от прогрессирования заболевания [3]. Наряду с совершенствованием методов лечения, значимым аспектом в проблеме местнораспространенного рака шейки матки (МРРШМ) является поиск и оценка факторов прогноза заболевания. Доказано влияние на течение заболевания таких прогностических факторов, как размер первичной опухоли, глубина инвазии, гистотип опухоли, наличие опухолевых эмболов в лимфатических сосудах, длительность облучения. В то же время существует ряд молекулярных маркеров, связанных с биологическим поведением опухоли, которые часто являются более значимыми в плане исхода заболевания, чем терапевтический эффект [4–6]. Рецепторы гормонов, биохимические маркеры, экспрессия онкогенов и антигенов, связанная с пролиферацией, а также другие молекулярные маркеры признаны прогностически значимыми
[6–8]. В то же время данные литературы о роли таких показателей, как VEGF, EGFR, COX-2, Ki67, p16ink4a при местнораспространенном раке шейки матки достаточно противоречивы. Несомненно, что знание биологических маркеров позволит понять злокачественный потенциал опухоли, прогнозировать течение заболевания и определить индивидуальную тактику лечения.
Цель исследования – изучить прогностическое значение показателей Ki67, COX-2, p16ink4a у больных МРРШМ, получивших комбинированное лечение с использованием неоадъювантной химиотерапии.
Материал и методы
Изучались возможности маркера пролиферативной активности Ki67, белка p16ink4a, являющегося ингибитором циклинзависимых киназ, и циклооксигеназы COX-2 в определении прогноза течения местнораспространенного РШМ. Материалом исследования служила ткань опухоли шейки матки, полученная от 25 больных. Средний возраст пациенток составил 38,04 ± 1,6 года.
Оценивалась первоначальная экспрессия перечисленных иммуногистохимических маркеров
в опухоли и после проведения 2 курсов платиносодержащей неоадъювантной химиотерапии (НАХТ). Иммуногистохимическое исследование проводилось по стандартной методике на депарафинированных срезах с блоков тканей шейки матки, полученных от препаратов резекций или биопсий шейки матки. Все препараты пересматривались патоморфологом для уточнения гистологического диагноза и соответствия блоков выбранным срезам. Для антитела p16ink4a использовали фирменный набор CINtec histology kit (производство mtm laboratories AG, Германия). Для остальных антител использовались следующие МКА: COX-2 (клон CX-294, мышиное, рабочее разведение 1:150, производство Dako, демаскировка в ЭДТА буфере pH=9,0); Ki67 (клон MIB1, мышиное, готовое к применению, производство Dako, демаскировка в цитратном буфере pH=6,0). При ИГХ-реакции использовался непрямой двухшаговый стрептовидин-биотиновый метод. Окраска проводилась диаминобензидином и гематоксилином.
Оценку результатов окрашивания проводили с применением светового микроскопа Carl Zeiss Microlmaging (Германия). Для всех маркеров оценивали локализацию окрашивания в клетке (ядро, цитоплазма, мембрана). Результаты ИГХ-анализа оценивали количественно и качественно по интенсивности окрашивания цитоплазмы: 0 – окрашивание отсутствует, 1 – слабое окрашивание, 2 – окрашивание средней интенсивности, 3 – сильное окрашивание. Количественно оценивали процент окрашенных клеток (от 0 до 100 %) и содержание их в максимально насыщенных слоях эпителия.
Для оценки пролиферативной активности (ПА) опухоли подсчитывали количество Ki67 положительных клеток на 200–300 опухолевых клеток. Индекс Ki67 определяли по формуле: ПА = число Ki67 положительных клеток × 100 / общее количество клеток.
Неоадъювантная химиотерапия проводилась по схеме цисплатин в дозе 75 мг/м2 в 1-й день и гемцитабин в дозе 1 250 мг/м2 в 1-й и 8-й дни, с последующими сочетанной лучевой терапией по радикальной программе или оперативным лечением в случае резектабельности опухоли с адъювантной лучевой терапией.
Непосредственные результаты неоадъювантной химиотерапии оценивались с помощью шкалы RECIST (Response Evaluation Criteria In Solid Tumors). Оценка объективного ответа подтверждалась результатами клинического, ультразвукового и КТ/ МРТ исследований.
Материалом для исследования на ВПЧ служили соскобы из цервикального канала (эндоцервикс). Проводилось генотипирование 12 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) вируса папилломы человека высокого канцерогенного риска (ВПЧ ВКР) с определением вирусной нагрузки методом
ПЦР-диагностики в режиме «реального времени» с применением диагностических тест-систем «Амплисенс FRT ВПЧ ВКР скрининг» и «Ампли-сенс FRT ВПЧ ВКР генотип» (Россия) на основе мультипраймерной типоспецифической ПЦР, на 6-канальном амплификаторе RotorGene 6000 фирмы Corbett Research, Австралия.
Для статистической обработки полученных результатов использовали критерии Стьюдента и Манна – Уитни, Вилкоксона, Мак-Немара, критерий Фишера, критерии согласия Шапиро – Уилкса, Колмогорова – Смирнова, Лиллефорса. Достоверность различий оценена по лог-ранговому критерию (Survival Analysis). Кривые общей, скорректированной и безрецидивной выживаемости строились по методу Каплана – Майера. Значимость различий в выживаемости между группами оценена по критерию Гехана – Вилкоксона или F-критерию Кокса. Статистическая обработка полученных результатов проводилась с помощью пакета программ Statistica for Windows, версия 8.0.
Результаты и обсуждение
У всех пациенток верифицирован плоскоклеточный рак шейки матки, из них у 9 (25 %) диагностирована IIВ стадия, у 16 (64 %) – IIIВ стадия заболевания. Умеренная дифференцировка опухоли отмечалась у 12 (48 %), низкодифференцированная опухоль – у 13 (52 %) пациенток. ВПЧ-инфекция высокого канцерогенного риска (ВПЧ ВКР) обнаружена в 20 (80 %) случаях, 5 (20 %) пациенток были ВПЧ-отрицательными. В 15 (75 %) наблюдениях выявлен 16 тип ВПЧ ВКР, в остальных случаях – 18, 31, 39 и 56 типы.
Было выявлено, что индекс пролиферации в среднем у больных МРРШМ составил 60 % (рис. 1). Высокий и очень высокий уровень экспрессии (более 50 %) наблюдался у 16 (64 %) больных МРРШМ (рис. 2), слабый уровень экспрессии Ki67 – у 4 (16 %) пациенток (рис. 3). Полученные результаты согласуются с данными авторов, утверждающих, что уровень пролиферативной активности плоскоклеточного рака шейки матки предопределяет отдаленные результаты лечения, а также является предсказательным фактором для определения чувствительности к химио- и лучевой
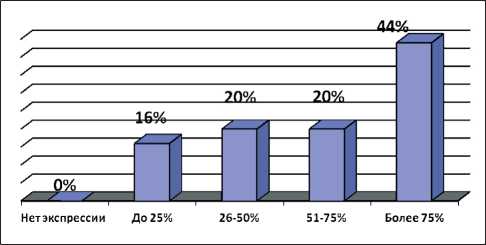
Рис. 1. Экспрессия Ki67 как показателя пролиферативной активности у больных МРРШМ
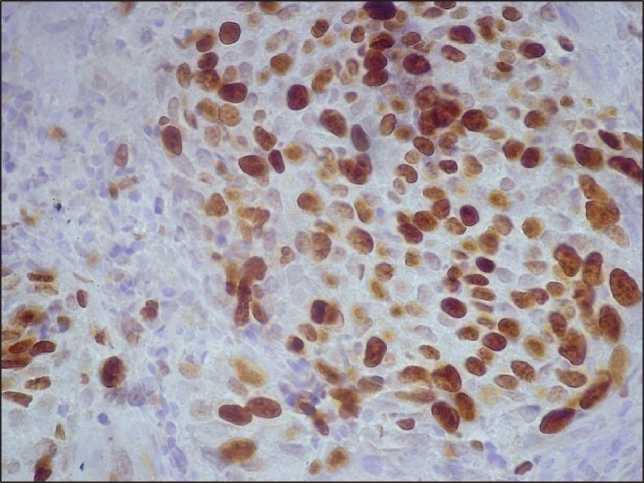
Рис. 2. Микрофото. ИГХ-исследование. Индекс метки Ki-67 выше 80 % в опухолевых гнездах умеренно дифференцированной плоскоклеточной карциномы шейки матки, ×400
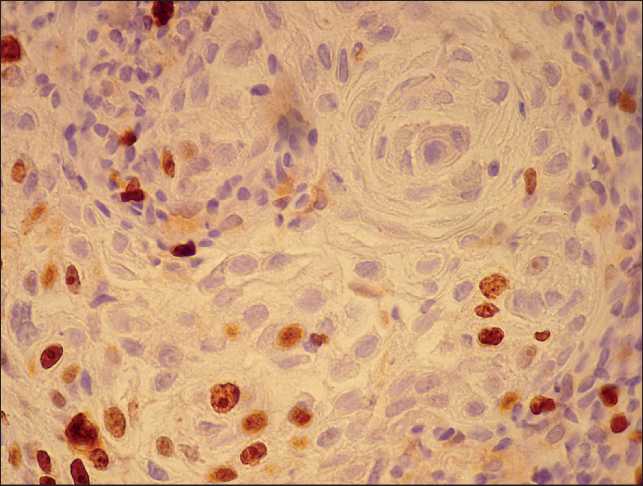
Рис. 3. Микрофото. ИГХ-исследование. Высокодифференцированная плоскоклеточная карцинома шейки матки. Низкая пролиферативная активность опухолевых клеток. Индекс метки Ki-67 <15 %, ×200
терапии [9]. Кроме того, имеются данные о том, что пролиферативная активность эпителиальных клеток при предраковых поражениях шейки матки зависит от наличия ВПЧ ВКР [10]. В то же время есть исследования, не обнаруживающие такой зависимости и указывающие, что пролиферативная активность при РШМ может варьировать в широких пределах, отличаясь у разных больных более чем в 10 раз [11]. Ряд авторов предлагают определять экспрессию PCNA, Ki67 и p16ink4a, служащих суррогатными маркерами экспрессии вирусных онкогенов, с целью предсказывания активности вирусных генов Е6/Е7 [12–14].
Проведена оценка экспрессии циклооксигеназы COX-2, являющейся индуцибельной изоформой фермента, участвующего в образовании простагландинов из арахидоновой кислоты, у больных МРРШМ (рис. 4). Анализ полученных данных показал, что экспрессия COX-2 выявлялась у 19 (76 %) больных МРРШМ. Высокий уровень экс-
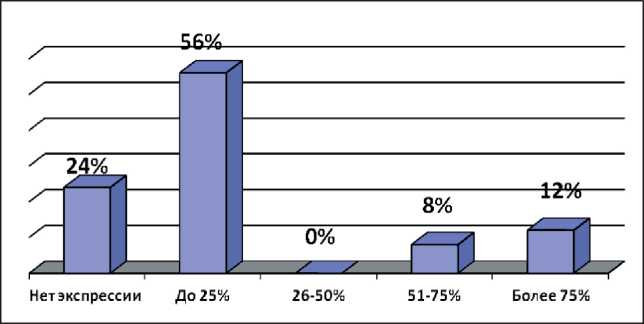
Рис. 4. Экспрессия циклооксигеназы COX-2 у больных МРРШМ
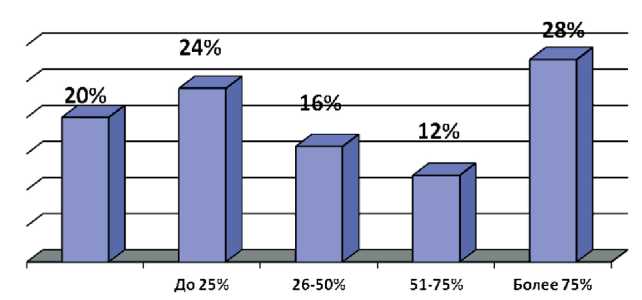
Рис. 5. Экспрессия белка p16ink4a у больных МРРШМ прессии наблюдался у 5 (20 %), низкий уровень экспрессии COX-2 – у 19 (56 %) больных. Полученные данные не противоречат результатам других авторов [15]. Ряд исследователей сообщают о вовлеченности СOX-2 в цервикальный канцерогенез и свидетельствуют об ассоциации этого маркера с распространенными стадиями заболевания, плохим прогнозом и рецидивами [16, 17]. В других работах значимость COX-2 как фактора прогноза отрицается [18]. Одни авторы обнаруживают корреляционную связь между экспрессией COX-2 и ВПЧ, утверждая, что онкобелки Е6 и Е7 увеличивают транскрипцию COX-2 через EGFR-сигнальный путь, другие указывают на отсутствие связи экспрессии COX-2 с наличием ВПЧ-инфекции [19, 20].
В современной литературе в качестве одного из прогностических факторов, ассоциированного с худшим течением РШМ, рассматривается повышенная экспрессия белка p16ink4a, продуцируемого геном INK4a, этот протеин принадлежит к группе ингибиторов циклинзависимых киназ (рис. 5). Нами выявлено, что значимо чаще белок p16ink4a экспрессировался в клетках больных МРРШМ – в 20 (80 %) случаях. Уровень экспрессии в среднем у этих пациенток составил 47 % (рис. 6). У 8 (40 %) больных МРРШМ отмечалась высокая и очень высокая экспрессия этого белка, низкая экспрессия (до 25 %) наблюдалась в 6 (24 %) случаях.
Результаты анализа взаимосвязи наличия ВПЧ-инфекции с белком p16ink4a представлены на рис. 7. Известно, что у больных МРРШМ актив-
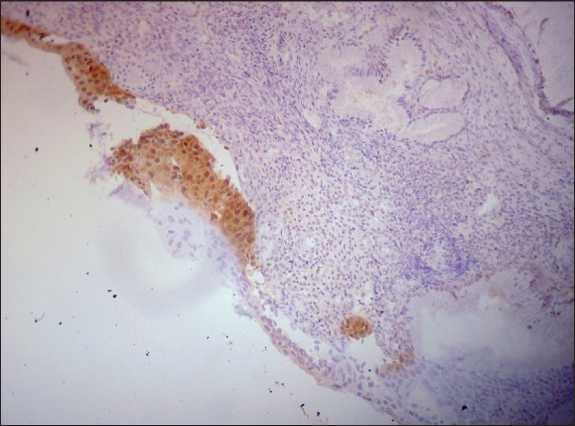
Рис. 6. Микрофото. ИГХ-исследование. Фокальная экспрессия протеина p16ink4a в ядрах клеток опухолевой ткани шейки матки, ×200
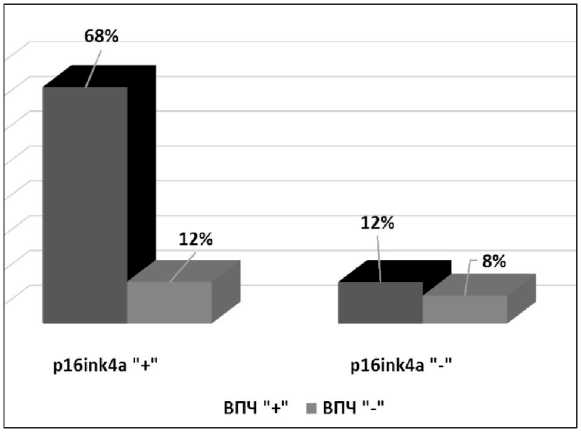
Рис. 7. Экспрессия белка p16ink4a у вирус-ассоциированных больных МРРШ
ность p16ink4a повышается при экспрессии ряда вирусных или клеточных онкогенов. Полученные результаты свидетельствуют, что в большинстве случаев экспрессия белка p16ink4a сочетается с наличием ВПЧ-инфекции онкогенных типов. У больных МРРШМ такое сочетание наблюдается в 68 % случаев. Возможно, что гиперэкспрессия этого белка у ВПЧ-инфицированных больных объясняется взаимодействием белкового продукта онкогена Е7 ВПЧ с Rb, что приводит к инактивации последнего. Доказано, что, в свою очередь, по механизму обратной связи усиливается транскрипция гена, кодирующего белок p16ink4a [21].
Рядом исследований показано, что появление клеток, экспрессирующих белок p16ink4a, отмечается уже на ранних стадиях опухолевого процесса. Так, при раке in situ наблюдается четкий сдвиг в сторону фокального и диффузного окрашивания, которое является преобладающим в инвазивных карциномах. В то же время отсутствие экспрессии p16INK4a в ткани плоскоклеточной карциномы, возможно, указывает на иной механизм развития последней, не ассоциированный с ВПЧ [22]. Было выявлено, что присутствие генома HPV высокого риска не является необходимым условием для осуществления экспрессии белка p16ink4a в опухолевых клетках. Этот белок отмечался и в тканях больных раком молочной железы, легкого и мочевого пузыря. В то же время причины его повышенной экспрессии до конца не выявлены.
С целью изучения прогностического значения параметров Ki67, COX-2 и p16INK4a была проанализирована динамика этих показателей у больных МРРШМ до лечения и после 2 курсов ПХТ (табл. 1). После 2 курсов НАХТ полная регрессия опухоли наблюдалась у 1 (4 %) больной, частичная регрессия – у 22 (88 %), стабилизация процесса – у 2 (8 %) пациенток. Клинический эффект НАХТ у больных местнораспространенным раком шейки матки проявлялся в статистически значимом уменьшении объема опухоли шейки матки, уменьшении частоты межменструальных кровянистых выделений, болевого синдрома, контактных кровянистых выделений.
Таблица 1
Частота встречаемости экспрессии Ki67, COX-2, p16ink4a у больных МРРШМ до и после проведения НАхТ
|
Уровень экспрессии |
Иммуногистохимические показатели Ki67 COX-2 p16ink4a p До лечения После ПХТ До лечения После ПХТ До лечения После ПХТ |
|
Нет экспрессии |
– 6 (24 %) 6 (24 %) 15 (60 %) 5 (20 %) 12 (48 %) p 1 р3 р4 p1=0,0111 |
|
До 25 % 26–50 % |
4 (16%) 4 (16 %) 13 (52 %) 9 (36 %) 6 (24 %) 5 (20 %) p2=0,0251 5 (20 %) 7 (28 %) 1 (4 %) – 4 (16 %) 3 (12 %) p3=0,0218 |
|
51–75 % |
p4=0,00641 5 (2p02%) – 2 (8 %) 1 (4 %) 3 (12 %) 1 (4 %) |
|
Более 75 % |
11 (44 %) 8 (32 %) 3 (12 %) – 7 (28 %) 4 (16 %) |
Примечание: p1 – уровень статистической значимости по показателю Ki-67 до лечения и после ХТ (по критерию Фишера); p2 – уровень статистической значимости по показателю Ki-67 до лечения и после ХТ (по критерию Фишера); p3 – уровень статистической значимости по показателю COX-2 до лечения и после ХТ (χ2); p4 – уровень статистической значимости по показателю p16ink4a до лечения и после ХТ (χ2).
Таблица 2
Динамики уровня экспрессии Ki67, COX-2 и p16ink4a до и после курсов НАхТ у 18 операбельных больных МРРШМ, получивших комбинированное лечение
Иммуногистохимические показатели
Ki67 COX-2 p16ink4a
До лечения После НАХТ До лечения После НАХТ До лечения После НАХТ
-
53,9 % 31,5 % 43,7 % 7,5 %* 27,5 % 16,7 %**
Примечание: * – статистическая значимость различий показателя COX-2 до и после НАХТ, p=0,04 (SignTest); ** – статистическая значимость различий показателя p16ink4a до и после НАХТ, p=0,04 (SignTest).
Анализ иммуногистохимических маркеров, определяемых до начала противоопухолевого лечения и после 2 курсов НАХТ у больных МРРШМ, выявил достоверное снижение удельного веса опухолей шейки матки, экспрессирующих Ki67, циклооксигеназу COX-2 и ингибитор циклинзави-симых киназ – белок p16ink4a, после завершения курсов химиотерапии. Показано, что если до начала лечения показатель пролиферативной активности Ki67 выявлялся у всех больных МРРШМ, то после курсов НАХТ 6 (24 %) пациенток не экспрессировали этот антиген. Среднее его значение уменьшилось с 60 до 42 % (p<0,05), т.е. менее половины опухолевых клеток находилось в митотическом периоде клеточного цикла. Доля случаев с высокой и очень высокой экспрессией Ki67 снизилась в 2 раза по сравнению с показателями до лечения – с 64 до 32 %.
Отчетливая экспрессия циклооксигеназы COX-2, оказывающей влияние на подавление апоптоза, активацию неоангиогенеза и адгезию опухолевых клеток, выявлялась у 19 (76 %) больных МРРШМ. После проведения НАХТ отмечается значимое снижение опухолей, экспрессирующих COX-2, – до 10 (40 %) наблюдений, причем в 9 (36 %) случаях наблюдается слабая экспрессия СОХ-2 – до 25 %.
Анализ экспрессии белка-ингибитора циклинза-висимых киназ p16ink4a после проведения НАХТ показал его достоверное снижение. До лечения p16ink4a экспрессировался у 20 (80 %) пациенток МРРШМ, после лечения – у 13 (52 %) больных. Также отмечается снижение уровня экспрессии: если до лечения экспрессия более 50 % отмечалась у 10 (40 %) больных МРРШМ, то после лекарственной терапии высокая и очень высокая экспрессия выявлялась в 2 раза реже.
Проведен анализ динамики уровня экспрессии показателей Ki67, COX-2, p16ink4a у 18 больных МРРШМ, прооперированных после 2 курсов НАХТ (табл. 2). Анализ динамики уровня циклооксигеназы COX-2 и белка p16ink4a установил значимое уменьшение экспрессии этих маркеров у пациенток, перешедших после НАХТ в группу операбельных и достигших полной регрессии опухоли после завершения комбинированного лечения. Со стороны индекса пролиферативной активности Ki67 отмечалась положительная дина- мика снижения экспрессии антигена Ki67, однако значимых различий не выявлено.
В работе была проанализирована связь Ki67, COX-2, p16ink4a с отдаленными результатами лечения у больных МРРШМ (рис. 8). Выявлено, что у больных МРРШМ с уровнем экспрессии Ki67 менее 50 % показатели 5-летней общей выживаемости значимо превышают аналогичные показатели у больных с экспрессией Ki67>50 % (Gehan’sWilcoxon p=0,01056, Log-RankTest p=0,00899, Cox-MantelTest p=0,01011). В группе больных с экспрессией Ki67 ниже 50 % 5-летняя общая выживаемость составила 100 %, среди пациенток с высоким уровнем пролиферативной активности (Ki67>50 %) – 67 %. Показатели без-рецидивной 5-летней выживаемости у пациенток МРРШМ с различным уровнем экспрессии Ki67 значимо не отличались.
Значимой взаимосвязи исходных уровней COX-2 и p16ink4a у больных МРРШМ с показателями выживаемости не выявлено. Однако установлено, что экспрессия этих показателей после НАХТ сопряжена с отдаленными результатами лечения. Так, 5-летняя выживаемость больных МРРШМ при экспрессии COX-2<50 % составила 84 %, при экспрессии >50 % – 66 %. Анализ зависимости без-рецидивной выживаемости от уровня экспрессии белка p16ink4a после НАХТ показал, что безреци-дивная выживаемость больных МРРШМ, у которых экспрессии данного белка не отмечалось, значимо
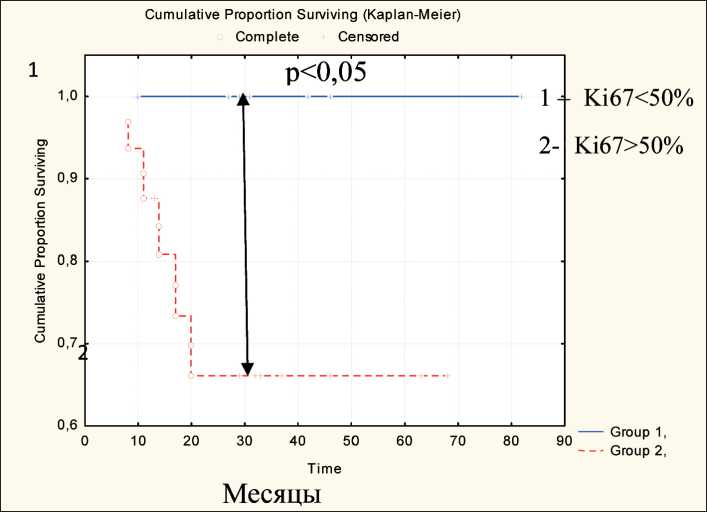
Рис. 8. Общая выживаемость больных МРРШМ в зависимости от исходного уровня маркера пролиферативной активности Ki67
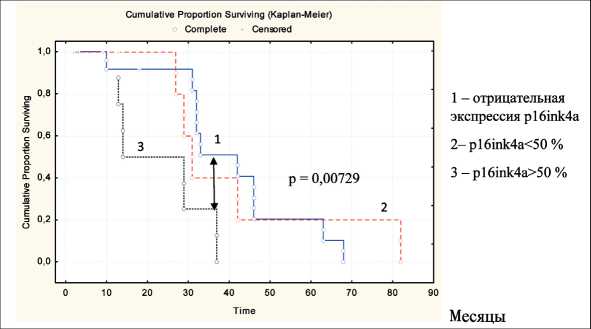
Рис. 9. Безрецидивная выживаемость в зависимости от экспрессии p16ink4a после проведения курсов НАХТ (p<0,05)
превышала аналогичный показатель у пациенток с высокой и очень высокой экспрессией этого белка (рис. 9). Показатель 3-летней безрецидивной выживаемости у p16ink4a-отрицательных больных составил 50 %, у пациенток с низкой экспрессией – 40 %, с высокой экспрессией – 25 %. Пятилетняя безрецидивная выживаемость у больных МРРШМ с отсутствием экспрессии и низким ее уровнем не отличалась и достигала 20 %, больных с высокой экспрессией белка p16ink4a в этом сроке наблюдения не было. Аналогичные результаты получены другими авторами [9, 16]. Отсутствие значимых различий в ряде случаев, вероятно, может быть связано с небольшим количеством пациенток, что предполагает продолжение исследований в данном направлении.
Список литературы Прогностическое значение KI67, циклооксигеназы-2 (COX-2) и P16INK4A у больных местнораспространенным раком шейки матки
- Ferlay J., Shin H.R., Bray F. GLOBOCAN 2008 v1.2 Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 . Lyon, France: International Agency for Reserch on Cancer; 2010 . Available from: http: globocan.iarc.fr.
- Коломиец Л.А., Чуруксаева О.Н. Уразова Л.Н. Чернышова А.Л., Молчанов С.В., Мунтян А.Б., Замкова О.В., Видяева И.Г. Вакцинация против ВПЧ -первичная профилактика рака шейки матки. Томск: Печатная мануфактура, 2011, 116 с.
- Максимов С.Я., Гусейнов К.Д. Комбинированное лечение рака шейки матки//Практическая онкогинекология: избранные лекции/Под ред. А.Ф. Урманчеевой, С.А. Тюляндина, В.М. Моисеенко. СПб.: Центр ТОММ, 2008: 168-180.
- Карапетян В.Л., Степанова Е.В., Барышников А.Ю., Никогосян С.О., Кузнецов В.В. Молекулярно-биологические факторы прогноза рака яичников начальных стадий. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2011. Т. 22, № 1: 37-41.
- Calado R.T., Chen J. Telomerase: not just for the elongation of telomeres. Bioessays. 2006 Feb; 28 (2): 109-12.


