Прогностическое значение миксоидного матрикса в забрюшинной высокодифференцированной липосаркоме
Автор: Волков Александр Юрьевич, Козлов Николай Александрович, Неред Сергей Николаевич, Стилиди Иван Сократович, Строганова Анна Михайловна, Архири Петр Петрович, Антонова Елена Юрьевна, Привезенцев Сергей Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Цель исследования - оценка взаимосвязи миксоидного матрикса в забрюшинных высокодифферен-цированных липосаркомах (ВДЛПС) с отдаленными результатами хирургического лечения больных. Материал и методы. В исследование включено 111 пациентов с первичными забрюшинными ВДЛПС, которым выполнялось радикальное хирургическое лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. После пересмотра гистологических препаратов и реклассификации в соответствии с критериями ВОЗ (2013) все случаи были разделены на гистологические подтипы ВДЛПС. В зависимости от наличия/отсутствия миксоидного матрикса в ВДЛПС больные были поделены на группы сравнения, включенные в межгрупповой анализ общей (ОВ) и безрецидивной (БРВ) выживаемости. Результаты. ОВ достоверно хуже в группе больных с миксоидным матриксом в опухоли (p=0,002; log-rank test). Медиана ОВ в группе без миксоидного матрикса составила 142 (95 % ДИ, 108, 176) мес, в группе с миксоидным матриксом - 84 (95 % ДИ, 29, 139) мес. Показатели 5-летней выживаемости в группах с ВДЛПС без миксоидного матрикса и ВДЛПС с миксоидным матриксом были 79 % и 44 % соответственно. БРВ больных также достоверно хуже в группе ВДЛПС с миксоидным матриксом, чем в группе пациентов с ВДЛПС без миксоидного матрикса (p=0,006; log-rank test). Медиана БРВ в группе ВДЛПС без миксоидного матрикса составила 55 (95 % ДИ, 38, 72) мес, в группе ВДЛПС с миксоидным матриксом 31 (95 % ДИ, 15, 47) мес. Показатели 2-летней БРВ в группах без миксоидного матрикса и с миксоидным матриксом составили 75 % и 44 % соответственно. Заключение. Результаты исследования демонстрируют более агрессивное течение заболевания при наличии миксоидного матрикса в ВДЛПС. Мы полагаем, что наличие миксоидного матрикса в ВДЛПС может служить эффективным морфологическим маркером менее благоприятного прогноза при забрюшинных ВДЛПС.
Липосаркома, высокодифференцированная липосаркома, гистологические подтипы, неорганные забрюшинные опухоли, миксоидный, прогноз, миксоидный матрикс
Короткий адрес: https://sciup.org/140254451
IDR: 140254451 | УДК: 617.553-006.3.04-037 | DOI: 10.21294/1814-4861-2021-20-1-46-52
Текст научной статьи Прогностическое значение миксоидного матрикса в забрюшинной высокодифференцированной липосаркоме
Саркомы мягких тканей относятся к редким злокачественным опухолям, развивающимся из клеток мезенхимального происхождения. В России в 2018 г. было зарегистрировано около 3590 новых случаев сарком, что составляет менее 1 % от всех онкологических заболеваний [1]. Забрюшинные саркомы составляют 10–15 % всех сарком мягких тканей [2]. Наиболее часто встречающейся забрюшинной мезенхимальной опухолью является липо-саркома, доля которой превышает 50 % от общего числа сарком [3]. Высокодифференцированная липосаркома/атипичная липоматозная опухоль (ВДЛПС/АЛО) является самым распространённым гистологическим типом липосарком и составляет 40–45 % случаев данной группы опухолей. ВДЛПС относится к местно агрессивным опухолям с низкой степенью злокачественности и отсутствием метастатического потенциала [4–8]. Термин «высокодифференцированная липосаркома» применим для забрюшинной и медиастинальной локализации, где затруднено или невозможно выполнение широкого иссечения, а частота локального рецидива наиболее высока. В то время как термин
«атипичная липоматозная опухоль» относится к резектабельным опухолям конечностей с благоприятным прогнозом [4, 5, 9].
Согласно последней классификации опухолей костей и мягких тканей ВОЗ (2013), ВДЛПС подразделяются на 3 гистологических варианта: 1) липомоподобный – опухоль преимущественно или полностью представлена жировой тканью, гистологически сходной с неизмененной жировой тканью или липомой; 2) склерозирующий – большая часть липогенной опухоли представлена полями коллагена с низким содержанием стромальных клеток без признаков липогенной дифференцировки. Данный вариант ВДЛПС наиболее характерен для забрюшинной локализации и семенного канатика; 3) воспалительный – независимо от доли жирового или склеротического компонентов опухоль отличается высоким содержанием воспалительных клеток (нейтрофилы, лимфоциты, плазмоциты). Данный вариант ВДЛПС чаще всего встречается при забрюшинной локализации опухоли. В последние 15 лет был описан сравнительно редкий веретеноклеточный вариант ВДЛПС, представленный характерными веретеновидными клетками с патогномоничными мутациями генов RB1, RCBTB2, DLEU1 и ITM2B (при отсутствии характерной для ВДЛПС амплификации гена MDM2) и локализацией почти исключительно в мягких тканях конечностей. Несмотря на нередкое появление у ВДЛПС миксоидных изменений различной выраженности, микроскопически имитирующих миксоидную липосаркому, эксперты ВОЗ не сочли необходимым выделение миксоидного варианта ВДЛПС/АЛО [4, 5].
ВДЛПС/АЛО характеризуются хромосомными аберрациями, содержащими амплифицированные сегменты на участке 12q13-15, с гиперэкспресси-рованными онкогенами MDM2 и CDK4, встречающимися почти в 100 % и 90 % случаев [10–15].
Несмотря на широкий спектр гистологических вариантов ВДЛПС, описанных в классификации ВОЗ (2013), ни один из них, по мнению экспертов, не ассоциирован с течением и прогнозом заболевания [17, 18]. Тем не менее следует отметить, что подобные выводы сделаны по данным исследований 1990-х и начала 2000-х годов [4, 7, 17, 18]. Кроме того, на протяжении последних 10 лет оценка связи того или иного гистологического компонента ВДЛПС/АЛО с прогнозом заболевания не проводилась.
В настоящем исследовании мы изучили связь наличия миксоидного матрикса в забрюшинных ВДЛПС с отдаленными результатами хирургического лечения больных, а именно общей (ОВ) и безрецидивной выживаемостью (БРВ).
Материал и методы
В ретроспективное исследование было включено 111 пациентов с первичными забрюшинными неорганными ВДЛПС, которым выполнялось радикальное хирургическое лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в период с 2004 по 2018 г. Пациенты с первичномножественными злокачественными опухолями в исследование не были включены. У всех больных отсутствовали отдаленные метастазы (М0).
В исследовании были использованы архивные гистологические препараты операционного материала, изготовленные стандартным методом и окрашенные гематоксилином и эозином. После пересмотра гистологических препаратов операционного материала ВДЛПС патологоанатомом все случаи были разделены на гистологические подтипы ВДЛПС в соответствии с требованиями Классификации ВОЗ (2013). В семи диагностически спорных случаях c помощью флуоресцентной гибридизация in situ (FISH) была проведена оценка амплификации гена MDM2 – во всех случаях обнаружена характерная для ВДЛПС генетическая аберрация, что позволило исключить наличие у этой группы пациентов миксоидной липосаркомы.
В соответствии с критериями Классификации ВОЗ миксоидный компонент ВДЛПС определялся как участки опухоли с типичными изменениями матрикса опухоли и низкой клеточностью (рис. 1, 2). Оценка объема миксоидного компонента ВДЛПС проводилась путем световой микроскопии: для каждого клинического случая во всех срезах
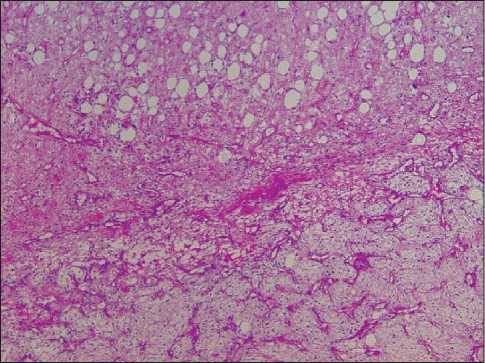
Рис. 1. Микрофото. Высокодифференцированная липосаркома. Опухоль в нижней половине снимка отличается наличием заметного миксоидного матрикса.
Окраска гематоксилин-эозином, ×40
Fig. 1. Microphoto. Well-differentiated liposarcoma.
The tumor is characterized by the presence of a noticeable myxoid matrix in the lower half of the image. Hematoxylin-eosin stain, ×40
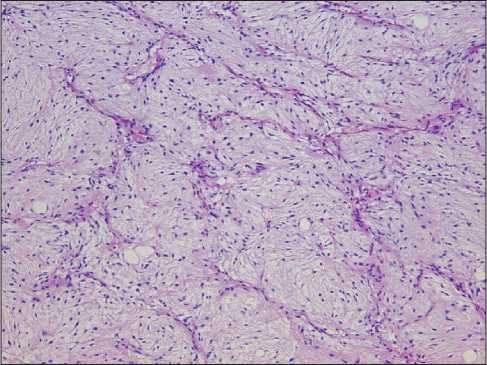
Рис. 2. Микрофото. Высокодифференцированная липосаркома. Помимо участков типичного для ВДЛПС строения, в опухоли отмечались выраженные миксоидные изменения матрикса в сочетании с сетью тонкостенных сосудов и слабой ядерной атипией.
Окраска гематоксилин-эозином, ×100 Fig. 2. Microphoto. Well-differentiated liposarcoma.
In addition to areas of a typical structure for WDLPS, myxoid changes pronounced in the matrix in combination with a network of thin-walled vessels and weak nuclear atypia were noted in the tumor. Hematoxylin-eosin stain, ×100
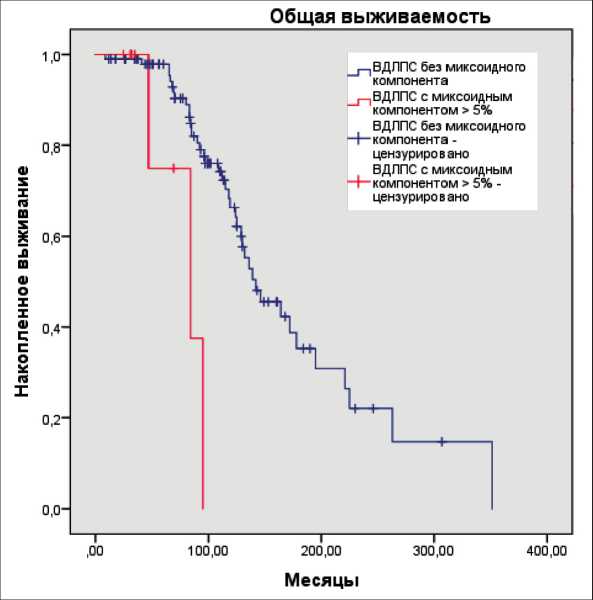
Рис. 3. ОВ пациентов в зависимости от наличия или отсутствия миксоидного компонента ВДЛПС (метод Kaplan–Meier)
Fig. 3. OS of patients depending on the presence or absence of the myxoid component in WDLPS (Kaplan–Meier method)
опухолевой ткани был определен процентный состав миксоидного компонента с округлением в ближайшую сторону с 5 % шагом (например, 0 %, 5 %, 10 % и т. д.). Полученные значения доли (%) миксоидного компонента были суммированы, а полученная сумма разделена на число исследованных срезов в каждом случае. Итоговый показатель доли (%) миксоидного компонента опухоли был выражен как среднее арифметическое и округлен в ближайшую сторону с 5 % шагом.
В зависимости от наличия или отсутствия миксоидного матрикса в опухоли больные были разделены на группы сравнения и проведен межгрупповой анализ общей и безрецидивной выживаемости. Первая группа включила пациентов без миксоидного компонента в опухоли. Во вторую группу вошли пациенты с миксоидным матриксом (доля миксоидного компонента ≥5 %). Также были проанализированы клинические показатели больных (пол, возраст, стадия заболевания по TNM 8-го издания).
Статистический анализ проводился с помощью программы IBM SPSS Statistics v23. Графики общей и безрецидивной выживаемости построены по методу Kaplan–Meier. Достоверность различий между группами определялась по логарифмическому ранговому (log-rank) критерию.
Результаты
Возраст пациентов варьировал от 17 до 74 лет: 16 (14 %) человек до 40 лет, 81 (73 %) – от 41 до 60 лет, 14 (13 %) – старше 61 года. Количество женщин вдвое превышало число мужчин: 33 (30 %) против 75 (70 %). В соответствии с TNM 8-го из- дания по T-статусу все случаи были распределены следующим образом: Т1 – 1 (0,5 %), Т2 – 5 (5 %), Т3 – 6 (5,5 %) случаев, Т4 – 99 (89 %) наблюдений. При первичном выявлении забрюшинной липосаркомы ни в одном случае не было отмечено метастатического поражения лимфатических узлов (N0 – 100 % случаев). В соответствии с критериями ВОЗ (2013) все ВДЛПС имели низкую степень злокачественности/low grade (G1). Проведено стадирование заболевания по TNM-классификации 8-го издания: IA стадия выявлена в 1 (1 %), IB стадия – в 110 (99 %) случаях.
Больные были поделены на две группы. В первую группу вошло 102 (92 %) пациента с ВДЛПС без миксоидного матрикса. Во вторую группу включено 9 (8 %) пациентов с ВДЛПС с миксоидным матриксом – доля миксоидного компонента в опухоли не менее 5 %. Проведен сравнительный межгрупповой анализ общей и безрецидивной выживаемости. Общая выживаемость (ОВ) была значимо хуже в группе больных с ВДЛПС с миксоидным матриксом, чем в группе пациентов с ВДЛПС без миксоидного матрикса (p=0,002; logrank test). Медиана ОВ в группе ВДЛПС без миксоидного матрикса составила 142 (95 % ДИ, 108, 176) мес, в группе ВДЛПС с миксоидным матриксом – 84 (95 % ДИ, 29, 139) мес. Показатели 5-летней выживаемости в группах с ВДЛПС без миксоидного матрикса и ВДЛПС с миксоидным матриксом – 79 % и 44 % соответственно (рис. 3).
Безрецидивная выживаемость (БРВ) больных также достоверно хуже в группе ВДЛПС с миксоидным матриксом, чем в группе пациентов с ВДЛПС без миксоидного матрикса (p=0,006;
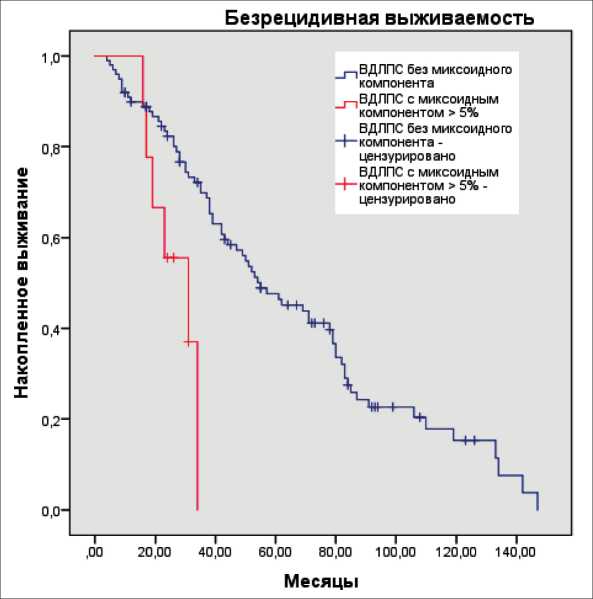
Рис. 4. БРВ пациентов в зависимости от наличия или отсутствия миксоидного компонента ВДЛПС (метод Kaplan–Meier)
Fig. 4. RFS of patients depending on the presence or absence of the myxoid component in WDLPS (Kaplan–Meier method)
log-rank test). Медиана БРВ в группе ВДЛПС без миксоидного матрикса составила 55 (95 % ДИ, 38, 72) мес, в группе ВДЛПС с миксоидным матриксом – 31 (95 % ДИ, 15, 47) мес. Показатели 2-летней БРВ в группах без миксоидного матрикса и с миксоидным матриксом составили 75 % и 44 % соответственно (рис. 4).
Обсуждение
В настоящем исследовании продемонстрирована связь наличия миксоидного матрикса в ВДЛПС с течением и прогнозом заболевания. ОВ и БРВ у пациентов с ВДЛПС без миксоидного матрикса достоверно выше, чем у больных ВДЛПС с миксоидным матриксом (р=0,002; р=0,006). Механизм, лежащий в основе нарастания биологической агрессии ВДЛПС с миксоидным компонентом, остается неизвестным. Можно предположить, что исчезновение светооптических признаков липогенной дифференцировки в части опухолевых клеток
Список литературы Прогностическое значение миксоидного матрикса в забрюшинной высокодифференцированной липосаркоме
- Kaprin A.D., Starinskii V.V., Petrova G.V. Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2018 godu. M., 2019. 236.
- Liles J.S., Tzeng C.W., Short J.J., Kulesza P., Heslin M.J. Retroperitoneal and intra-abdominal sarcoma. Curr Probl Surg. 2009 Jun; 46(6): 445-503. https://doi.org/10.1067/j.cpsurg.2009.01.004.
- Dalal K.M., Kattan M.W., Antonescu C.R., Brennan M.F., Singer S. Subtype specific prognostic nomogram for patients with primary liposarcoma of the retroperitoneum, extremity, or trunk. Ann Surg. 2006 Sep; 244(3): 381-91. https://doi.org/10.1097/01.sla.0000234795.98607.00.
- Fletcher C.D., Bridge J.A., Hogendoorn P., Mertens F. WHO Classification of Tumours of soft tissue and bone. 4th Ed. IARC. 2013; 3344.
- Creytens D. What’s new in adipocytic neoplasia? Virchows Arch. 2020 Jan; 476(1): 29-39. https://doi.org/10.1007/s00428-019-02652-3.
- Vanhoenacker F.M., Parizel P.M., Gielen J.L. Imaging of Soft Tissue Tumors. 4th Ed 2017; 225230.
- Goldblum J.R., Weiss S.W., Folpe A.L. Enzinger and Weiss’s soft tissue tumors. Philadelphia, PA: Elsevier. 2020; 1: 304.
- Afanas'ev S.G., Dobrodeev A.Yu., Volkov M.Yu. Rezul'taty khirurgicheskogo lecheniya neorgannykh zabryushinnykh opukholei. Sibirskii onkologicheskii zhurnal. 2015; 3: 51-54.
- Canter R.J., Qin L.X., Ferrone C.R., Maki R.G., Singer S., Brennan M.F. Why do patients with low-grade soft tissue sarcoma die? Ann Surg Oncol. 2008 Dec; 15(12): 3550-60. https://doi.org/10.1245/s10434-008-0163-0.
- Thway K., Flora R., Shah C., Olmos D., Fisher C. Diagnostic utility of p16, CDK4, and MDM2 as an immunohistochemical panel in distinguishing well-differentiated and dedifferentiated liposarcomas from other adipocytic tumors. Am J Surg Pathol. 2012; 36(3): 462-9. https://doi.org/10.1097/PAS.0b013e3182417330.
- Dei Tos A.P., Doglioni C., Piccinin S., Sciot R., Furlanetto A., Boiocchi M., Dal Cin P., Maestro R., Fletcher C.D., Tallini G. Coordinated expression and amplification of the MDM2, CDK4, and HMGI-C genes in atypical lipomatous tumours. J Pathol. 2000 Apr; 190(5): 531-6. https://doi.org/10.1002/(SICI)1096-9896(200004)190:5-531::AID-PATH579-3.0.CO;2-W.
- Italiano A., Bianchini L., Keslair F., Bonnafous S., Cardot-Leccia N., Coindre J.M., Dumollard J.M., Hofman P., Leroux A., Mainguené C., Peyrottes I., Ranchere-Vince D., Terrier P., Tran A., Gual P., Pedeutour F. HMGA2 is the partner of MDM2 in well-differentiated and dedifferentiated liposarcomas whereas CDK4 belongs to a distinct inconsistent amplicon. Int J Cancer. 2008 May 15; 122(10): 223341. https://doi.org/10.1002/ijc.23380.
- Sirvent N., Coindre J.M., Maire G., Hostein I., Keslair F., Guillou L., Ranchere-Vince D., Terrier P., Pedeutour F. Detection of MDM2-CDK4 amplification by fluorescence in situ hybridization in 200 paraffinembedded tumor samples: utility in diagnosing adipocytic lesions and comparison with immunohistochemistry and real-time PCR. Am J Surg Pathol. 2007 Oct; 31(10): 1476-89. https://doi.org/10.1097/PAS.0b013e3180581fff.
- Tap W.D., Eilber F.C., Ginther C., Dry S.M., Reese N., BarzanSmith K., Chen H.W., Wu H., Eilber F.R., Slamon D.J., Anderson L. Evaluation of well-differentiated/de-differentiated liposarcomas by high-resolution oligonucleotide array-based comparative genomic hybridization. Genes Chromosomes Cancer. 2011 Feb; 50(2): 95-112. https://doi.org/10.1002/gcc.20835.
- Louis-Brennetot C., Coindre J.M., Ferreira C., Pérot G., Terrier P., Aurias A. The CDKN2A/CDKN2B/CDK4/CCND1 pathway is pivotal in well-differentiated and dedifferentiated liposarcoma oncogenesis: an analysis of 104 tumors. Genes Chromosomes Cancer. 2011 Nov; 50(11): 896-907. https://doi.org/10.1002/gcc.20909.
- Chrisinger J.S.A., Al-Zaid T., Keung E.Z., Leung C., Lin H.Y., Roland C.L., Torres K.E., Benjamin R.S., Ingram D.R., Khan S., Somaiah N., Amini B., Feig B.W., Lazar A.J., Wang W.L. The degree of sclerosis is associated with prognosis in well-differentiated liposarcoma of the retroperitoneum. J Surg Oncol. 2019 Sep; 120(3): 382-388. https://doi.org/10.1002/jso.25585.
- Weiss S.W., Rao V.K. Well-differentiated liposarcoma (atypical lipoma) of deep soft tissue of the extremities, retroperitoneum, and miscellaneous sites. A follow-up study of 92 cases with analysis of the incidence of «dedifferentiation». Am J Surg Pathol. 1992 Nov; 16(11): 1051-8. https://doi.org/10.1097/00000478-199211000-00003.
- Evans H.L. Atypical lipomatous tumor, its variants, and its combined forms: a study of 61 cases, with a minimum follow-up of 10 years. Am J Surg Pathol. 2007 Jan; 31(1): 1-14. https://doi.org/10.1097/01.pas.0000213406.95440.7a.


