Прогноз эффективности комбинированной терапии у больных местнораспространенным плоскоклеточным раком орофарингеальной зоны
Автор: Бахронов И.А., Какурина Г.В., Жуйкова Л.Д., Кондакова И.В., Чойнзонов Е.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.23, 2024 года.
Бесплатный доступ
Актуальность. Плоскоклеточный рак орофарингеальной зоны характеризуется диагностикой на поздних стадиях заболевания и высокой смертностью. Общепринятым стандартом лечения опухолей этой локализации является комбинированное лечение с предоперационной химиолучевой терапией. Существует проблема поиска критериев прогноза эффективности предоперационной химиолучевой терапии для назначения ее пациентам. Цель исследования - выявить актин-связывающие белки в сыворотке крови, способные прогнозировать эффективность комбинированной предоперационной терапии у больных раком орофарингеальной зоны. Материал и методы. Изучали сыворотку крови 45 первичных больных плоскоклеточным раком орофарингеальной области II-IV стадии. Все пациенты получали предоперационную химиолучевую терапию, включающую паклитаксел и карбоплатин, с назначением через 2 нед лучевой терапии в стандартном режиме. До лечения в сыворотке крови определяли актин-связывающие белки САР1, фасцин, эзрин, гельзолин и профилин методом ИФА.
Плоскоклеточный рак орофарингеальной зоны, предоперационная химиолучевая терапия, актин-связывающие белки, эзрин, прогноз
Короткий адрес: https://sciup.org/140305910
IDR: 140305910 | УДК: 617.51/.52-006.6-08-059:577.112]-037 | DOI: 10.21294/1814-4861-2024-23-2-56-63
Текст научной статьи Прогноз эффективности комбинированной терапии у больных местнораспространенным плоскоклеточным раком орофарингеальной зоны
В общей структуре онкологической смертности в РФ плоскоклеточный рак области головы и шеи (ПРГШ) занимает 8-е ранговое место, а по распространенности среди других злокачественных новообразований – 6-е место [1]. При этом в России злокачественные новообразования области головы и шеи составляют 6,2 % от общей онкологической заболеваемости, доля мужского населения составляет – 7,7 %, женского населения – 4,8 %. [1]. В мировой статистике ежегодно регистрируется свыше 500 тыс. новых случаев злокачественных опухолей области головы и шеи и более 270 тыс. больных ПРГШ умирает в течение года [2, 3]. Несмотря на доступность для осмотра и возможность своевременной диагностики, в 60–80 % случаев опухоли области головы и шеи регистрируются на III–IV стадиях заболевания, что свидетельствует о значительном уровне запущенности и высокой летальности. Так, на III–IV стадии опухолевый процесс диагностируется в 59,3 % случаев среди впервые выявленных больных раком гортани, рак ротоглотки – в 63,3 %, рак полости рта – в 44 % [4, 5].
Считается, что объединенная группа опухолей плоскоклеточного рака головы и шеи характеризуется не только однотипным гистологическим строением, но и сходными клиническими прояв- лениями, в том числе характерной для неоплазий этой локализации агрессивностью течения [6]. При первичном обращении более чем у 60 % больных ПРГШ выявляются местнораспространенные опухоли. При распространенном опухолевом процессе стандартом является комбинированное лечение, сочетающее хирургическое удаление первичного опухолевого очага с лимфодиссекцией по показаниям, и пред- или послеоперационный курс лучевой или химиотерапии (ХЛТ) [7]. Комплексный подход с неоадъювантным химиолучевым компонентом обусловлен сложностью анатомических структур головы и шеи, наличием жизненно важных органов, эстетическими аспектами и, в конечном счете, способствует увеличению эффективности лечения. При последующей операции такой подход позволяет сохранить форму и функцию пораженного органа, порой даже при изначально сомнительно резектабельном процессе [8].
Важным компонентом комбинированного лечения больных распространенным ПРГШ является лучевая терапия (ЛТ), возможности которой не следует переоценивать [9]. В связи с этим крайне важно применение комбинированных программ лечения, элиминирующих диссеминированные по организму опухолевые клетки, с последующей ЛТ и/или хирургическим лечением [10, 11]. В настоя- щее время применяется ряд препаратов, наиболее эффективных в отношении местнораспространенного ПРГШ: препараты платины, 5-фторурацил, паклитаксел, доцетаксел и цетуксимаб. Из этой линейки препараты платины проявили себя как наиболее эффективные противоопухолевые средства, несмотря на их высокую токсичность. В свете развития персонализированной медицины необходима разработка критериев для назначения предоперационной ХЛТ именно тем пациентам, для которых она будет эффективна. Эти критерии могли бы прогнозировать эффективность ХЛТ и улучшить результаты лечения с сокращением его стоимости [12].
Актуально исследование молекулярных маркеров, позволяющих прогнозировать эффективность предоперационной ХЛТ у больных раком орофарингеальной области [13]. Потенциальными предикторами могут быть актин-связывающие белки, которые осуществляют реорганизацию актинового цитоскелета [14]. Актин-связывающие белки принимают участие не только в формировании клеточной мобильности, они также участвуют в регуляции пролиферации, апоптоза клеток, адгезии, эндоцитоза и экзоцитоза [15–17]. В наших предварительных исследованиях показано присутствие в сыворотке крови больных раком головы и шеи циклаза-ассоциированного протеина-1 (CAP1), который участвует в регуляции актинового цитоскелета и сигналинге Ras/cAMP [18, 19]; кофилина, деполимеризующего актиновые нити; гельзолина, разрывающего нить актина; профилина, усиливающего рост актиновых микрофиламентов, и эзрина, соединяющего актиновые нити с плазматической мембраной [20].
Цель исследования – выявить актин-связы-вающие белки в сыворотке крови, способные прогнозировать эффективность комбинированной предоперационной терапии у больных раком орофарингеальной зоны.
Материал и методы
В исследование вошло 45 первичных больных плоскоклеточным местнораспространенным раком орофарингеальной области II–IV стадии (33 мужчины и 12 женщин), которые получили комбинированное лечение в НИИ онкологии Томского НИМЦ. Возраст пациентов – от 41 до 74 лет (медиана – 61,5 года). Плоскоклеточный рак полости рта выявлен у 27, ротоглотки – у 18 пациентов (табл. 1). У всех больных получено гистологическое подтверждение диагноза: высокодифференцированный рак диагностирован у 15 (33 %), умеренно дифференцированный – у 29 (64 %), низкодифференцированный – у 1 (3 %) пациента.
Химиотерапия (ХТ) проводилась по следующей схеме: паклитаксел – 175 мг/м2 внутривенно, капельно в 1-й день, карбоплатин (расчет дозы на AUC 6) – внутривенно, капельно в 1-й день, по- вторный курс – через 3 нед. Все пациенты получили 2 курса ХТ. Через 2 нед после второго курса ХТ назначалась дистанционная гамма-терапия (ДГТ), которая проводилась на установке Тератрон, РОД 2,0 Гр, поля облучения – 10×10 см или 6×6 см. У всех пациентов после СОД 40,0 изоГр на область первичной опухоли и регионарного лимфооттока в сочетании с 2 курсами полихимиотерапии выполнялась компьютерная томография с контрастированием и эндоскопическое исследование для оценки эффективности по шкале RECIST.
Пациенты были распределены на 2 группы:
I группа: 25 пациентов с первичными злокачественными опухолями полости рта и ротоглотки (стадии Т1–4N0–2M0). Больным назначалось химиолучевое лечение, включающее лучевую терапию СОД 60–65 изоГр на область первичной опухоли и регионарных лимфоузлов и 2 курса химиотерапии по вышеуказанной схеме. Пациента относили к I группе при регрессии опухоли на 75 % и более (по шкале RECIST) после 2 курсов ХТ и ДГТ СОД 40 изоГр.
II группа: 20 больных с первичными злокачественными опухолями полости рта, ротоглотки (стадии Т1–4N0–2M0). Больные этой группы получали аналогичную химиолучевую терапию. На 2-м этапе комбинированного лечения выполнялось оперативное вмешательство на первичном очаге и лимфопутях (по показаниям) с использованием органосохраняющих и функционально-щадящих методик. Критерий включения во II группу – регрессия опухоли менее 75 % после 2 курсов химиотерапии и ДГТ СОД 40 изоГр.
В сыворотке крови больных до лечения проводили анализ уровня актин-связывающих белков: САР-1, профилина-1, кофилина-1, фасцина-1, эз-рина. Исследование выполняли на микропланшет-ном ИФА ридере Multiskan FC 100 (ThermoFisher Scientific) с помощью ELISA-метода [20].
Статистический анализ результатов проводили с применением пакета программ Statistica 8.0. Выполнена проверка результатов на соответствие выборки нормальному распределению с использованием критерия Шапиро–Уилка. Достоверность различий оценивали с помощью непараметрических критериев: U-критерия Манна–Уитни и критерия Краскела–Уоллиса. Достоверными считались различия при уровне значимости р≤0,05. Результаты, представленные в таблицах, выражали как Ме (Q1;Q3), где Ме – медиана, Q1 и Q3 – нижний и верхний квартили. Методом ROC-анализа оценивали чувствительность, специфичность и прогностическую значимость кандидатных маркеров, также рассчитывали показатель «площадь под кривой» AUC и 95 % ДИ.
Результаты
Все больные удовлетворительно переносили ХЛТ. Чаще всего нежелательные явления наблю-
Таблица 1/table 1
Характеристика групп больных characteristics of patient groups
|
Параметры/Parameteres |
I группа (n=25)/ Group I (n=25) |
II группа (n=20)/ Group II (n=20) |
|
|
Пол/ Sex |
Мужчины/Male |
20 |
13 |
|
Женщины/Female |
5 |
7 |
|
|
Возраст, лет (диапазон)/Age, years, range |
41–74 |
52–74 |
|
|
Ротоглотка/ Oropharynx |
11 |
7 |
|
|
Локализация опухоли/Tumor localization |
Полость рта/Oral cavity |
14 |
13 |
|
II |
11 |
2 |
|
|
Стадия заболевания/Disease stage |
III |
4 |
6 |
|
IV |
10 |
12 |
|
|
Т1 |
1 |
– |
|
|
Размер первичной опухоли (Т)/ |
Т2 |
16 |
1 |
|
Primary tumor size (T) |
Т3 |
7 |
7 |
|
Т4 |
1 |
12 |
|
|
N0 |
18 |
7 |
|
|
Метастазы в лимфоузлы шеи (N)/ |
N1 |
5 |
8 |
|
Lymph Node metastases (N) |
N2 |
2 |
5 |
|
N3 |
– |
– |
|
|
Примечание: таблица составлена авторами. Note: created by the authors. Таблица 2/table 2 Оценка эффекта предоперационной химиолучевой терапии (СОД 40 Гр) по шкале Recist evaluation of the tumor response to preoperative chemoradiotherapy (sod 40 gy) according to the Recist scale |
|||
|
Тип ответа/Response type |
I группа (n=25)/ Group I (n=25) |
II группа (n=20)/ Group II (n=20) |
|
|
Полный ответ/Complete response |
18 (72 %) |
– |
|
|
Частичный ответ/Partial response |
7 (28 %) |
2 (10 %) |
|
|
Стабилизация/Stable disease |
– |
13 (65 %) |
|
|
Прогрессирование заболевания/ Disease progression |
– |
5 (25 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
дались в виде лейкоцито- и тромбоцитопений, обширных стоматитов. Выраженность стоматитов увеличивалась на фоне применяемых цитостатиков по сравнению с общепринятыми вариантами облучения без химиотерапии. Стоит отметить, что в I группе после 2 курсов ХТ и ДГТ с СОД 40,0 Гр эффективность предоперационной химиолучевой терапии по шкале RECIST у всех пациентов была 75 % и более (табл. 2), во II группе эффективность ХЛТ была ниже.
Далее в I группе после оценки эффективности терапии продолжена ДГТ по радикальной программе до СОД 66,0 Гр. У всех пациентов после завершения лечения наблюдался полный или частичный ответ (табл. 2). Через 6 мес у 4 пациентов I группы верифицирован продолженный рост ранее верифицированных метастазов в лимфатические узлы, им выполнена лимфодиссекция шеи (табл. 2).
Во II группе после 2 курсов ХТ и ДГТ в СОД 40,0 Гр и оценки объективного ответа в связи с неэффективностью лечения вторым этапом выполнено хирургическое лечение с использованием органосохраняющих и функционально-щадящих методик в объеме удаления первичного очага с лимфодиссекцией. Удаление злокачественной опухоли одной анатомической зоны выполнено у 10 (25 %) больных. У 6 (15 %) больных раком языка проведены половинная резекция языка и лимфодиссекция шеи. Резекцию альвеолярного отростка нижней челюсти провели в 2 случаях. При распространении опухолевого процесса на несколько анатомических областей – 12 (20 %) больных – выполнялись расширенные комбинированные операции. Объемы при одномоментной резекции языка: половина, две трети или субтотальная. Проводили краевую или сегментарную резекцию тканей нижней челюсти, дна полости рта, ротоглотки. Реконструктивно-пластическое замещение обширных послеоперационных дефектов проводили во время основной операции.
Наблюдение в послеоперационном периоде показало, что у 1 пациента через 3 мес отмечено прогрессирование, у 5 пациентов через 6 мес верифицированы метастазы в лимфатических узлах
Таблица 3/table 3
Методы лечения и отдаленные результаты лечения больных type of the treatment and long–term treatment outcomes
|
Метод лечения/Type of the treatment |
I группа (n=25)/ Group I (n=25) |
II группа (n=20)/ Group II (n=20) |
|
Химиотерапия/Сhemotherapy |
25 |
20 |
|
Лучевая терапия, ДГТ СОД 40,0 Гр/ External beam radiotherapy, total dose: 40.0 Gy |
– |
20 |
|
Лучевая терапия, ДГТ СОД 66,0 Гр/ External beam radiotherapy, total dose: 66.0 Gy |
25 |
– |
|
Хирургическое лечение/Surgery |
– |
20 |
|
Прогрессирование через 3 мес после комбинированного лечения/ Progression after combined modality treatment for 3 months |
2 |
1 |
|
Метастазы в лимфоузлы шеи через 6 мес после комбинированного лечения/ Metastases in the neck lymph nodes after combined modality treatment for 6 months |
4 |
5 |
|
Безрецидивный период в течение 24 мес/Relapse-free period for 24 months |
19 |
14 |
Примечание: таблица составлена авторами.
Note: created by the authors.
Таблица 4/table 4
Содержание актин-связывающих белков в сыворотке крови в зависимости от эффективности химиолучевой терапии the content of actin binding proteins in blood serum depending on the response to chemoradiotherapy
|
Белки/Proteins |
Эффективность/Efficiency |
p |
|
|
>75 % |
<75 % |
||
|
CFL1 |
0,65 (0,56; 0,73) |
0,74 (0,68; 0,87) |
0,06 |
|
PFN1 |
0,41 (0,26;0,78) |
0,28 (0,23; 0,83) |
0,28 |
|
EZRIN |
2,60 (1,67; 10,13) |
2,31 (1,27; 2,60) |
0,04 |
|
FSCN1 |
3,96 (0,62; 7,50) |
1,93 (0,82; 6,40) |
0,85 |
|
CAP1 |
1,10 (0,14; 1,56) |
0,94 (0,15; 1,53) |
0,69 |
Примечание: таблица составлена авторами.
Note: created by the authors.
шеи в контралатеральной стороне. У 14 пациентов после 24 мес наблюдения данных за регионарные метастазы и рецидивы не выявлено (табл. 3).
В наших ранее проведенных работах установлено, что содержание всех перечисленных актин-связывающих белков в сыворотке крови больных ПРГШ значимо отличалось от соответствующих показателей у здоровых доноров [18, 20]. Поэтому для выявления молекулярных показателей, которые могли бы прогнозировать эффективность предоперационной терапии, был проведен анализ содержания актин-связывающих белков в сыворотке крови в вышеперечисленных группах больных ПРГШ. Значимые различия в зависимости от эффективности предоперационной ХЛТ показаны только для содержания эзрина (табл. 4). Проведение ROC-анализа продемонстрировало перспективы определения уровня эзрина в сыворотке крови, определяемого до назначения предоперационной химиотерапии, для разделения больных с прогнозируемым хорошим или плохим ответом на лечение (рис. 1). Оценка прогностической значимости эзрина по определению эффективности ХЛТ показала, что сывороточный уровень этого белка >2,50 нг/мл может указывать на неблагоприятный ответ опухоли на ХЛТ (менее 75 % по шкале RECIST). При этом AUC=0,80 (95 % ДИ: 0,65; 0,95) позволяет классифицировать эзрин как хороший маркер прогноза эффективности предоперационной ХЛТ у больных раком орофарингеальной области, с чувствительностью Se=72 %, специфичностью Sp=71 %. Полученные результаты показывают, что до лечения можно прогнозировать индивидуальную чувствительность опухолей на проводимую химио-лучевую терапию с помощью определения уровня эзрина методом ИФА в сыворотке крови больных раком орофарингеальной области.
Обсуждение
Общепринятым в лечении рака орофарингеальной зоны считается использование предоперационной ХЛТ. Местнораспространенный и рецидивный орофарингеальный рак характеризуется неблагоприятным клиническим прогнозом, особенно в случаях рецидива или продолженного опухолевого роста при резистентности к ЛТ и/или ХТ. При одно-
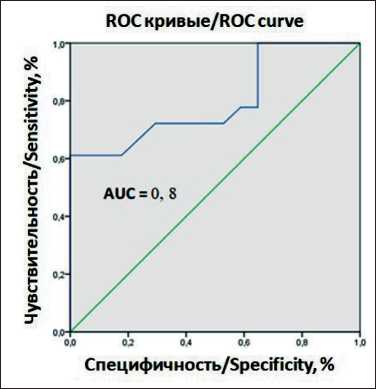
Рис. 1. ROC-анализ уровня эзрина в сыворотке крови как фактора прогноза эффективности предоперационной ХЛТ у больных раком орофарингеальной области.
Примечание: рисунок выполнен авторами
Fig. 1. ROC-analysis of ezrin level in blood serum as a predictor of preoperative chemoradiotherapy efficacy in patients with oropharyngeal cancer. Note: created by the authors временной химиолучевой терапии ответ на лечение (сумма полных и частичных регрессий) достигает 75 %. [21]. Представленные результаты показывают, что предоперационная ХЛТ наиболее эффективна у больных с первичными злокачественными опухолями полости рта и ротоглотки Т1–4N0M0 стадии по сравнению со стадией Т1–4N0–2M0. Однако эффективность лечения не всегда связана с этим критерием. Отсутствие однозначного ответа опухолей на ХЛТ диктует необходимость поиска дополнительных молекулярных предикторов, способных объективно прогнозировать ответ опухоли на предоперационную ХЛТ. Следует отметить, что в литературе представлено крайне мало сведений о молекулярных предикторах ХЛТ для рака орофарингеальной области. Так, в качестве вероятных диагностических маркеров разработана панель
Список литературы Прогноз эффективности комбинированной терапии у больных местнораспространенным плоскоклеточным раком орофарингеальной зоны
- Zlokachestvennye novoobrazovaniya v Rossii v 2021 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2022. 252 s.
- Choinzonov E.L., Kondakova I.V., Spirina L.V., Lebedev I.N., Gol'dberg V.E., Chizhevskaya S.Yu., Shishkin D.A., Urazova L.N., Kakurina G.V., Bychkov V.A., Khrichkova T.Yu., Mel'nikov A.A. Ploskokletochnyi rak golovy i shei: Molekulyarnye osnovy patogeneza. M., 2016. 224 s.
- Marur S., Forastiere A.A. Head and Neck Squamous Cell Carcinoma: Update on Epidemiology, Diagnosis, and Treatment. Mayo Clin Proc. 2016; 91(3): 386-96. https://doi.org/10.1016/j.mayocp.2015.12.017.
- Simard E.P., Torre L.A., Jemal A. International trends in head and neck cancer incidence rates: differences by country, sex and anatomic site. Oral Oncol. 2014; 50(5): 387-403. https://doi.org/10.1016/j.oraloncology.2014.01.016.
- Panferova O.I., Nikolenko V.N., Kochurova E.V., Kudasova E.O. Etiologiya, patogenez, osnovnye printsipy lecheniya ploskokletochnogo raka slizistoi obolochki polosti rta. Golova i sheya. 2022; 10(2): 69-77. https://doi.org/10.25792/HN.2022.10.2.69-77.
- Johnson D.E., Burtness B., Leemans C.R., Lui V.W.Y., Bauman J.E., Grandis J.R. Head and neck squamous cell carcinoma. Nat Rev Dis Primers. 2020; 6(1): 92. https://doi.org/10.1038/s41572-020-00224-3. Erratum in: Nat Rev Dis Primers. 2023; 9(1): 4.
- Choinzonov E. L., Novikov V.A., Mukhamedov M.R., Shishkin D.A., Chizhevskaya S.Yu., Syrkashev V.A., Shtin V.I., Kul'bakin D.E. Kombinirovannoe lechenie zlokachestvennykh novoobrazovanii golovy i shei s rekonstruktivno-plasticheskimi operativnymi vmeshatel'stvami. Voprosy onkologii. 2015; 61(4): 602-6.
- Mesia R., Iglesias L., Lambea J., Martínez-Trufero J., Soria A., Taberna M., Trigo J., Chaves M., García-Castaño A., Cruz J. SEOM clinical guidelines for the treatment of head and neck cancer (2020). Clin Transl Oncol. 2021; 23(5): 913-21. https://doi.org/10.1007/s12094-020-02533-1. Erratum in: Clin Transl Oncol. 2021.
- Alieva S.B., Romanov I.S., Podvyaznikov S.O., Zaderenko I.A., Tyulyandin S.A. Effektivnost' induktsionnoi khimioterapii s ispol'zovaniem dotsetaksela, tsisplatina i 5-ftoruratsila i posleduyushchei odnovremennoi khimioluchevoi terapii v lechenii raka glotki i polosti rta III-IV stadii. Opukholi golovy i shei. 2011(2): 14-9.
- Jain P., Kumar P., Pai V.R., Parikh P.M. Neoadjuvant chemotherapy or chemoradiotherapy in head and neck cancer. Indian J Cancer. 2008; 45(3): 83-9. https://doi.org/10.4103/0019-509x.44061.
- Fury M.G., Lee N.Y., Sherman E., Lisa D., Kelly K., Lipson B., Carlson D., Stambuk H., Haque S., Shen R., Kraus D., Shah J., Pfister D.G. A phase 2 study of bevacizumab with cisplatin plus intensity-modulated radiation therapy for stage III/IVB head and neck squamous cell cancer. Cancer. 2012; 118(20): 5008-14. https://doi.org/10.1002/cncr.27498.
- Alsahafi E., Begg K., Amelio I., Raulf N., Lucarelli P., Sauter T., Tavassoli M. Clinical update on head and neck cancer: molecular biology and ongoing challenges. Cell Death Dis. 2019; 10(8): 540. https://doi.org/10.1038/s41419-019-1769-9.
- Solomon B., Young R.J., Rischin D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 2018; 52(Pt 2): 228-40. https://doi.org/10.1016/j.semcancer.2018.01.008.
- Izdebska M., Zielińska W., Hałas-Wiśniewska M., Grzanka A. Involvement of Actin and Actin-Binding Proteins in Carcinogenesis. Cells. 2020; 9(10): 2245. https://doi.org/10.3390/cells9102245.
- Chen C., Enomoto A., Weng L., Taki T., Shiraki Y., Mii S., Ichihara R., Kanda M., Koike M., Kodera Y., Takahashi M. Complex roles of the actin-binding protein Girdin/GIV in DNA damage-induced apoptosis of cancer cells. Cancer Sci. 2020; 111(11): 4303-17. https://doi.org/10.1111/cas.14637.
- Mgrditchian T., Sakalauskaite G., Müller T., Hoffmann C., Thomas C. The multiple roles of actin-binding proteins at invadopodia. Int Rev Cell Mol Biol. 2021; 360: 99-132. https://doi.org/10.1016/bs.ircmb.2021.03.004.
- Davidson P.M., Cadot B. Actin on and around the Nucleus. Trends Cell Biol. 2021; 31(3): 211-23. https://doi.org/10.1016/j.tcb.2020.11.009.
- Kakurina G.V., Kondakova I.V., Choinzonov E.L., Shishkin D.A., Cheremisina O.V. Osobennosti proteoma syvorotki krovi bol'nykh ploskokletochnymi kartsinomami golovy i shei. Sibirskii onkologicheskii zhurnal. 2013; (2): 62-6.
- Kakurina G.V., Kolegova E.S., Kondakova I.V. Adenilattsiklazaassotsiirovannyi protein 1: struktura, regulyatsiya i uchastie v kletochnykh protsessakh. Biokhimiya. 2018; 83(1): 127-36.
- Kakurina G.V., Shashova E.E., Cheremisina O.V., Choinzonov E.L., Kondakova I.V. Tsirkuliruyushchie aktin-svyazyvayushchie belki pri progressirovanii raka gortani i gortanoglotki. Sibirskii onkologicheskii zhurnal. 2020; 19(4): 88-93. https://doi.org/10.21294/1814-4861-2020-19-4-88-93.
- Klug C., Berzaczy D., Voracek M., Nell C., Ploder O., Millesi W., Ewers R. Preoperative radiochemotherapy in the treatment of advanced oral cancer: outcome of 276 patients. J Craniomaxillofac Surg. 2009; 37(6):344-7. https://doi.org/10.1016/j.jcms.2008.11.012.
- Yete S., Saranath D. MicroRNAs in oral cancer: Biomarkers with clinical potential. Oral Oncol. 2020; 110. https://doi.org/10.1016/j.oraloncology.2020.105002.
- Jia M., Yan X., Jiang X., Wu Y., Xu J., Meng Y., Yang Y., Shan X., Zhang X., Mao S., Gu W., Pavlidis S., Barnes P.J., Adcock I.M., Huang M., Yao X. Ezrin, a Membrane Cytoskeleton Cross-Linker Protein, as a Marker of Epithelial Damage inAsthma.Am J Respir Crit Care Med. 2019; 199(4):496-507. https://doi.org/10.1164/rccm.201802-0373OC.
- Li L., Liu M., Lin J.B., Hong X.B., Chen W.X., Guo H., Xu L.Y., Xu Y.W., Li E.M., Peng Y.H. Diagnostic Value of Autoantibodies against Ezrin in Esophageal Squamous Cell Carcinoma. Dis Markers. 2017. https://doi.org/10.1155/2017/2534648.


