Прогнозирование эффективности адъювантной лучевой терапии раннего эндометриоидного рака тела матки на основе полиморфизма генов, влияющих на окислительный стресс
Автор: Замулаева И.А., Мкртчян Л.С., Крикунова Л.И., Минаева Н.Г., Ткаченко Б.Э., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 3 т.34, 2025 года.
Бесплатный доступ
Рак тела матки (РТМ) занимает первое место среди злокачественных новообразований женской репродуктивной системы. Несмотря на высокую долю раннего выявления, эффективность адъювантной лучевой терапии остаётся вариабельной, что обусловливает необходимость поиска молекулярных прогностических маркеров. В настоящем исследовании оценена прогностическая значимость однонуклеотидных полиморфизмов (SNP) генов, регулирующих окислительный стресс, в контексте безрецидивной выживаемости (БВ) больных эндометриоидным РТМ I стадии, получивших комбинированное лечение. В исследование включены 93 пациентки, которым проведено хирургическое вмешательство и адъювантная лучевая терапия. Выполнено генотипирование распространённых полиморфных вариантов генов APOE (rs429358, rs7412), COMT (rs4680), HFE (rs1800562) и PON1 (rs662) методом ПЦР с последующей рестрикцией. Установлена статистически значимая ассоциация между генотипом rs662 гена PON1 и БВ (р=0,01), а также выраженные тенденции для полиморфизмов COMT rs4680 и HFE rs1800562. Модель множественной регрессии, включающая указанные SNP, продемонстрировала высокую корреляцию с БВ (R=0,99; p<0,00001). Однако дискриминантный анализ не выявил достаточной прогностической ценности модели для клинического использования. Полученные результаты указывают на потенциальную роль полиморфизмов генов, контролирующих окислительный стресс, в прогнозировании ответа на лучевую терапию у больных эндометриоидным РТМ I стадии после хирургического лечения, однако требуют подтверждения в более масштабных исследованиях.
Радиобиология, онкология и лучевая терапия, рак тела матки, прогноз эффективности лечения, окислительный стресс, активные формы кислорода, генетический полиморфизм, APOE, COMT, HFE, PON-1
Короткий адрес: https://sciup.org/170210839
IDR: 170210839 | УДК: 618.14-006.6-089-085.849.1-059:577.3-071-036.8 | DOI: 10.21870/0131-3878-2025-34-3-86-97
Текст научной статьи Прогнозирование эффективности адъювантной лучевой терапии раннего эндометриоидного рака тела матки на основе полиморфизма генов, влияющих на окислительный стресс
Рак тела матки (РТМ) в Российской Федерации занимает первое место среди злокачественных новообразований (ЗНО) женских половых органов [1]. Несмотря на то, что в 70,8% случаев РТМ диагностируется на I стадии заболевания, наблюдается неуклонная тенденция к увеличению показателей смертности, что и определяет актуальность исследований по повышению эффективности лечения. Учитывая, что примерно у 60% больных РТМ I стадии проводятся послеоперационные курсы лучевой терапии в виде дистанционного и/или внутриполостного облучения [2], представляется весьма актуальной разработка прогностических показателей эффективности радиационного воздействия.
Как известно, важнейшим фактором, который влияет на чувствительность клеток к ред-коионизирующему излучению, используемому в конвенциональных режимах лучевой терапии,
Замулаева И.А.* – зав. отд., д.б.н., проф.; Мкртчян Л.С. – зав. отд., д.м.н.; Крикунова Л.И. – г.н.с., д.м.н., проф.; Минаева Н.Г. – в.н.с., к.б.н.; Ткаченко Б.Э. – аспирант. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
является состояние антиоксидантной системы, контролирующей концентрацию активных форм кислорода (АФК) и, как следствие, эффекты непрямого действия радиации, связанные с окислительным стрессом (ОС). Маркеры ОС в ходе лечения (прежде всего 8-оксогуанин в плазме крови) позволяют успешно прогнозировать эффективность радиотерапии ЗНО различных локализаций и оценивать риск развития лучевых повреждений нормальных тканей [3-5]. РТМ не является исключением, поскольку АФК играют значительную роль в реализации эффектов лучевой терапии и в этом случае [6]. Важно, что индивидуальный ответ на ОС во многом детерминирован генетически, что делает принципиально возможной разработку предикторов клинических эффектов ещё до начала лечения. В частности, показан значительный однонуклетидный полиморфизм (SNP), обеспечивающий широкую индивидуальную вариабельность антиоксидантной защиты организма человека и, как следствие, коррелирующий с риском лучевых повреждений нормальных тканей у онкологических больных [7-11]. Более того, ряд авторов указывают на прогностическое значение герминальных мутаций/полиморфизмов в отношении радиочувствительности не только нормальных, но и опухолевых тканей (наряду с соматическими мутациями, возникающими в ходе развития и прогрессирования опухолевого процесса) [12], в том числе отмечено значение полиморфизма генов, контролирующих оксидативный стресс-ответ, для прогноза общей выживаемости больных раком прямой кишки после лучевой терапии [9]. Однако прогностическая ценность SNP генов ОС и антиоксидантной защиты у больных РТМ ранее не изучалась, несмотря на перспективность работы в этом направлении. В этой связи следует отметить, что взаимосвязь АФК/ОС и опухолевого процесса носит сложный и неоднозначный характер [13]. В частности, ОС участвует в развитии всех стадий опухолевого процесса: на ранних стадиях канцерогенеза АФК стимулируют сигнальные пути клеточного стресс-ответа, прямо индуцируют повреждения ДНК, генетические и эпигенетические изменения [14]. Кроме того, ОС может приводить к повреждениям ДНК через модуляцию активности ферментов, участвующих в ремоделировании хроматина, путём модификации гистоновых белков и изменения биогенеза микроРНК. Во время прогрессирования опухолевого процесса АФК играют заметную роль в усилении метастатического потенциала первичной опухоли, например, за счёт повышения экспрессии металлопротеиназ – ферментов, облегчающих инвазию опухолевых клеток. На более поздних стадиях опухолевые клетки приобретают повышенную способность противостоять ОС и сохранять жизнеспособность, усиливая механизмы антиоксидантной защиты, что снижает эффективность противоопухолевой терапии. Таким образом, АФК/ОС имеют двойственное значение: с одной стороны, оказывают неблагоприятное действие, участвуя в развитии и прогрессировании опухолевого процесса, а, с другой стороны, они необходимы для реализации благоприятных эффектов противоопухолевой терапии.
АФК оказывают существенное влияние на опухолевое микроокружение, которое, как известно, является одним из важнейших факторов, определяющих эффективность лучевой терапии [15-17]. Примечательно, что авторы последней работы предложили рассматривать микроокружение в качестве 7-го фактора R («reinforcement» – усиление), влияющего на результаты лучевой терапии, наряду с первыми шестью (репарация, реоксигенация, перераспределение по фазам клеточного цикла (redistribution), репопуляция, радиочувствительность, реактивация иммунного ответа). Можно предположить, что поскольку опухолевое микроокружение включает разнообразные нормальные клетки, герминальный полиморфизм генов-регуляторов ОС играет важную роль в их ответе на радиационное воздействие и, следовательно, в ответе злокачественных клеток/тканей на лучевую терапию. Целью данного исследования являлась проверка этого предположения путём оценки результатов комбинированного (хирургического и лучевого) лечения больных эндометриоидным РТМ I стадии в зависимости от полиморфизма генов APOE, COMT, HFE, PON-1. Выбор указанных генов основан на анализе данных литературы, полученных в основном in vitro и указывающих на важную роль полиморфизма выбранных генов в формировании оксидативного статуса и радиочувствительности клеток.
Материалы и методы
Группу исследования составляли 93 больные РТМ I стадии, которые проходили лечение в отделении лучевых и комбинированных методов лечения гинекологических заболеваний МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» с 2002 по 2023 гг. Диагноз был верифицирован гистологически у всех больных. Больным проведено комбинированное лечение, включающее тотальную гистерэктомию с двусторонней сальпингоовариоэктомией, с/без регионарной лимфаденэктомией и адъювантную лучевую терапию в виде эндовагинальной брахитерапии и/или дистанционной лучевой терапии. Средний возраст больных составил 58,3 года (36-77 лет), медиана наблюдения за больными – 138,4 мес. (8,9-273,7 мес.). Все больные находились под активным наблюдением по окончании лечения и проходили периодические осмотры в Центре. Факт рецидива заболевания устанавливался с помощью инструментальных визуализирующих методик (МРТ, КТ, ПЭТ-КТ), безрецидивная выживаемость (БВ) рассчитывалась как период от начала лечения до рецидива или окончания срока наблюдения для каждой больной.
Генотипирование распространённых полиморфных вариантов генов аполипопротеина Е ( АРОЕ , rs7412, rs429358), катехолметил-О-трансферазы ( COMT , rs4680), гемохроматоза ( HFE, rs1800562 и rs1799945), параоксоназы-1 ( PON-1 , rs662) проводили с помощью методики полимеразной цепной реакции с последующей обработкой специфическими рестриктазами и определением длин фрагментов рестрикции (ПЦР/ПДРФ). Для этого из образцов периферической крови, взятых в вакутейнеры с этилендиаминуксусной калиевой солью (К2ЭДТА) выделяли геномную ДНК с помощью набора «Wizard Genomic DNA Purification Kit» (Promega, USA) в соответствии с протоколом производителя. Концентрацию выделенной ДНК определяли с помощью спектрофотометра NanoDrop1000 (ThermoScientific, USA). ПЦР выбранных участков ДНК выполняли на ам-плификаторах Mastercycler nexus gradient и Mastercycler Personal (Еppendorf, Germany) с использованием HotStarTag полимеразы (Qiagen, Germany) и праймеров, синтезированных ЗАО Евроген (Россия):
-
- фрагмент APOE (310 пар оснований), включающий полиморфизмы rs7412, rs429358, прямой 5’-GAGACGCGGGCACGGCTGTCC и обратный 5’-GCACGCGGCCCTGTTCCACC;
-
- фрагмент COMT (169 пар оснований), включающий полиморфизм rs4680, прямой 5’-ACTGTGGCTACTCAGCTGTG и обратный 5’-CCTTTTTCCAGGTCTGACAA;
-
- фрагмент HFE (389 пар оснований), включающий полиморфизм rs1800562, прямой
5'-TGGCAAGGGTAAACAGATCC и обратный 5'-CTCAGGCACTCCTCTCAACC;
-
- фрагмент HFE (208 пар оснований), включающий полиморфизм rs1799945, прямой
5'-ACATGGTTAAGGCCTGTTGC и обратный 5'-GCCACATCTGGCTTGAAATT;
-
- фрагмент PON-1 (99 пар оснований), включающий полиморфизм rs662, прямой 5'-TATTGTTGCTGTGGGACCTGAG и обратный 5'-CACGCTAAACCCAAATACATCTC.
Для рестрикции ампликонов использовали эндонуклеазы рестрикции: APOE – Cfo1 (Promega, Madison, Wisconsin, USA); СОМТ – Hsp92II (Promega, Madison, Wisconsin, USA), FaeI
(СибЭнзайм, Новосибирск, Россия); HFE – RsaI (Promega, Madison, Wisconsin, USA) или BclI (SIGMA, Saint Louis, USA); PON-1 – AlwI (New England Biolabs, Ipswich, Massachusetts, USA). Продукты рестрикции фракционировали посредством электрофореза в 8% полиакриламидном геле в вертикальной камере. Гели окрашивали бромистым этидием и визуализировали с помощью УФ-трансиллюминатора (Vilber Lourmat, Marne-la-Vallée, France).
Статистическая обработка результатов исследования проводилась с применением программ SPSS Statistics версия 27.0 и Statistica 10.0. Использовались методы описательной статистики с расчётом следующих показателей: среднее и/или медиана и квартили с указанием стандартной ошибки (SE). Независимые данные сравнивались с помощью теста непараметрической статистики – U-тест Манна-Уитни (при отсутствии нормальности распределения), зависимые парные – критерия Уилкоксона. Сравнительный анализ дискретных бинарных переменных проводился с помощью точного теста Фишера. Различия считались значимыми при р<0,05. При сравнении БВ больных на различных сроках наблюдения использовался метод Каплан-Мейера, уровень значимости различий оценивался с помощью логарифмического рангового теста (Log Rank). Для выяснения ценности разработанной прогностической модели проводился расчёт чувствительности и специфичности с построением характеристической ROC-кривой (Receiver Operating Characteristic); количественная оценка площади под кривой АUC (Area Under Curve) отражала качество прогностического теста (AUC<0,6 – плохое (неудовлетворительное) качество;
AUC=0,6-0,7 – среднее качество; AUC=0,7-0,8 – хорошее качество). При изучении ассоциации молекулярно-генетических факторов с клиническим исходом заболевания использовался многомерный анализ методом множественной логистической регрессии.
Результаты и обсуждение
Проведено сравнение БВ в группах пациенток с различными генотипами APOE, COMT, HFE и PON-1 с помощью метода Каплана-Майера.
APOE. Как известно, белок аполипопротеина Е (АPOЕ) может существовать в 3 изоформах, которые кодируются тремя аллелями гена АРОЕ . Варианты гена APOE определяются двумя SNP (rs429358, rs7412), и известны как аллели ε2, ε3 и ε4. Соответственно существует шесть возможных комбинаций аллелей гена APOE (генотипов): ε2/2, ε2/3, ε3/3, ε4/2, ε4/3, ε4/4.
Генотип ɛ3/3 был выявлен у большинства пациенток – 57 случаев (61,3%), что хорошо согласуется с данными литературы [18]. Генотипы ɛ2/3 и ɛ3/4 встречались несколько реже – у 14 (15%) и 19 (20,4%) больных соответственно (табл. 1). Гомозиготное состояние аллеля ɛ4 (ɛ4/4) или одновременное присутствие аллелей ɛ2 и ɛ4 (ɛ2/4) встречалось у 1 (1,1%) и 2 (2,3%) пациенток соответственно.
Все больные были разделены на 3 подгруппы на основании антиоксидантной активности продуктов соответствующих аллелей: Е2˃Е3˃Е4 [19]:
-
1) носители аллеля ɛ2 (пациентки с генотипами ɛ2/3 и ɛ2/4) – 16 (17,2%) человек;
-
2) пациентки с гомозиготным генотипом ɛ3/3 – 57 (61,3%) человек;
-
3) носители аллеля ɛ4 (пациентки с генотипами ɛ3/4 и ɛ4/4) – 20 (21,5%) человек.
БВ в сравниваемых группах на конец периода наблюдения не отличалась, составляя 75,0±11,4, 75,4±6,2 и 85,0±8,7% соответственно (р=0,650). При этом следует отметить, что в группе № 3 носителей аллеля ɛ4, кодирующего белок с наименьшей антиоксидантной активностью, наблюдалась слабая тенденция к повышению БВ по сравнению с объединёнными группами
№ 2+3: 85,0±8,7% vs 75,3±6,1% (р=0,270). Отсутствие статистически значимых различий, возможно, объясняется небольшим размером выборки пациентов-носителей аллеля ɛ4 (генотипы ɛ3/4 и ɛ4/4).
Таблица 1
Частота встречаемости изучаемых генотипов APOE, СОМТ , HFE, PON-1
|
Ген, полиморфный сайт |
Генотип |
Число больных |
% |
|
ɛ3/3 |
57 |
61,3 |
|
|
ɛ2/3 |
14 |
15,0 |
|
|
APOE, rs429358, |
ɛ3/4 |
19 |
20,4 |
|
rs7412 |
ɛ4/4 |
1 |
1,0 |
|
ɛ2/4 |
2 |
2,3 |
|
|
Сумма |
93 |
100,0 |
|
|
А/А |
25 |
26,9 |
|
|
G/A |
45 |
48,4 |
|
|
СОМТ, rs4680 |
G/G |
22 |
23,6 |
|
Нет амплификации |
1 |
1,1 |
|
|
Сумма |
93 |
100,0 |
|
|
G/G |
83 |
89,3 |
|
|
G/A |
9 |
9,7 |
|
|
HFE, rs1800562 |
Нет амплификации |
1 |
1,0 |
|
Сумма |
93 |
100,0 |
|
|
А/А |
61 |
65,6 |
|
|
PON-1 , rs662 |
G/A G/G |
27 5 |
29,0 5,4 |
|
Сумма |
93 |
100,0 |
СОМТ. Ген, кодирующий COMT, содержит функциональный полиморфизм rs4680, который заключается в замене G (гуанина) на А (аденин) в 472-м положении кодирующей последовательности ДНК гена, что приводит к замене валина (Val) на метионин (Met) в 158-м положении молекулы белка. Такой полиморфизм приводит к трём возможным комбинациям:
-
- COMT G/G (Val/Val; H/H);
-
- COMT G/A (Val/Met; H/L);
-
- COMT A/A (Met/Met; L/L).
Известно, что генотип А/А свидетельствует о наибольшем снижении антиоксидантной активности фермента, при этом G/A приводит к умеренному снижению активности, а генотип G/G свидетельствует о высокой его активности [20]. В группе исследования генотип G/A был установлен у 45 (48,4%) пациенток, генотипы А/А и G/G встречались примерно с равной частотой 25 (26,9%) и 22 (23,6%) случаев соответственно. У 1 (1,1%) больной было установлено отсутствие амплификации (табл. 1).
БВ на конец период наблюдения составила 81,8±8,1% для генотипа G/G, 71,7±7,0% для G/A и 88,0±8,1% для А/А (р=0,347). Далее подгруппы больных-носителей аллеля G (генотипы G/G и G/A) были объединены и оказалось, что БВ в объединённой группе составляет 74,6±5,5% vs 88,0±8,1% в группе с генотипом A/A (р=0,134). Таким образом, тенденция к более благоприятному прогнозу БВ в зарегистрирована в подгруппе больных с генотипом А/А, белковые продукты которого характеризуются наименьшей антиоксидантной активностью.
HFE. Для гена HFE известно несколько функциональных SNP, связанных с развитием наследственного гемохроматоза, один из которых (rs1800562) изучался в данной работе. HFE G845A (rs1800562) – это замена гуанина (G) на аденин (A) в 845-й позиции гена, что приводит к замене аминокислоты: тирозин (Y) заменяется на цистеин (C) в 282-й позиции белка (C282Y). Генотип G/G дикого типа встречается в популяции у подавляющего числа людей (85-90%). Генотип G/A является промежуточным вариантом с точки зрения вероятности развития гемохроматоза и встречается достаточно редко – у 10-15%. Генотип A/A, несущий два мутантных аллеля, является основным генетическим вариантом наследственного гемохроматоза и встречается крайне редко – у 0,3-0,5% людей [20]. В группе исследования наиболее часто встречался генотип G/G – 83 (89,3%) пациентки. У 9 (9,7%) человек был выявлен гетерозиготный по мутантному аллелю генотип G/A, который характеризуется избыточным накоплением железа и, как следствие, усилением ОС [21]. Пациенток гомозиготных по мутантному аллелю не было обнаружено вовсе (табл. 1). Отмечалась выраженная тенденция к повышению БВ в подгруппе носителей мутантного аллеля (генотип G/А) по сравнению с таковой у остальных пациенток (генотип G/G): 100,0% vs 74,7±5,1% соответственно (р=0,097) (рис. 1).
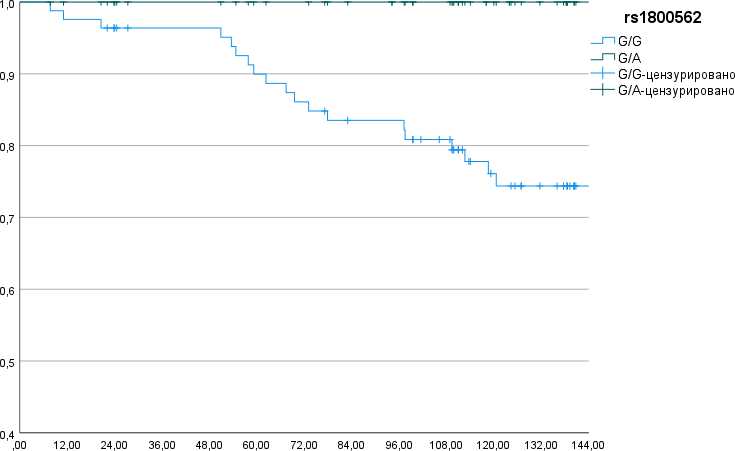
Месяцы
Рис. 1. Безрецидивная выживаемость больных эндометриоидным РТМ I стадии в зависимости от полиморфизма HFE G845A (rs1800562).
PON-1. Для гена PON-1 одним из наиболее изученных полиморфизмов является PON-1 rs662 (Gln192Arg) – однонуклеотидная замена аденина на гуанин, приводящая к замене глутамина на аргинин в белке. Соответственно для PON-1 rs662 существуют 3 варианта генотипов:
-
1) A/A (дикий тип, Gln/Gln);
-
2) A/G (гетерозигота, Gln/Arg);
-
3) G/G (гомозигота, Arg/Arg).
Генотип А/А является исходным и наиболее распространённым вариантом; он кодирует фермент PON-1 с низкой антиоксидантной активностью . Аллель G ассоциирован с большей антиоксидантной защитой [22]. Действительно, в группе исследования наиболее часто встречался генотип А/А (у 61 пациентки, что составляет 65,6%). Гетерозиготный генотип A/G обнаружен у 27 (29,0%) больных, а гомозиготный по мутантному аллелю G/G генотип – лишь у 5 (5,4%) больных (табл. 1). Установлена статистически значимая ассоциация полиморфизма PON-1 rs662 с БВ, которая составила 83,6±5,0% и 59,3±9,5% для генотипов A/A и G/A соответственно (р=0,01)
(рис. 2). БВ у 5 больных с генотипом G/G составила 100%, но ввиду малочисленности этой подгруппы в расчётах не учитывалась. Таким образом, БВ была выше у носителей аллеля А в гомозиготном состоянии, который кодирует фермент с низкой антиоксидантной активностью, способствующей формированию ОС, чем БВ у носителей аллеля G, связанного с высокой активностью PON-1 .
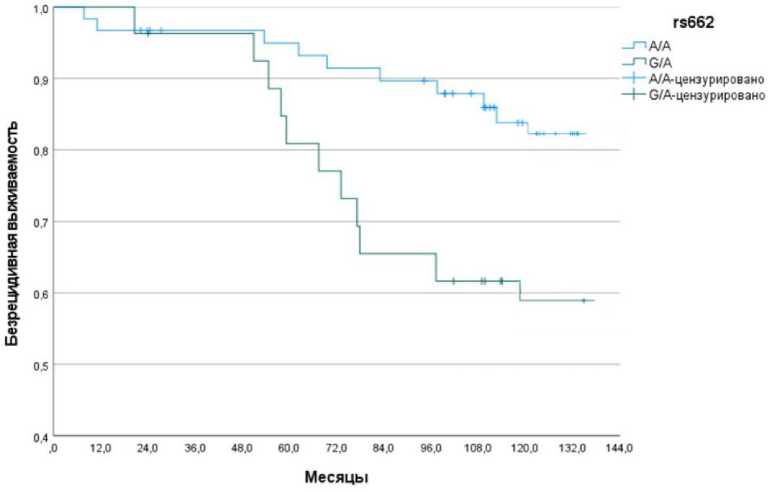
Рис. 2. Безрецидивная выживаемость больных эндометриоидным РТМ I стадии в зависимости от полиморфизма PON-1 rs662.
В целом, по результатам однофакторного анализа из 5 изученных полиморфизмов ( АРОЕ rs429358, rs7412; СОМТ rs4680; HFE rs1800562; PON-1 rs662) три продемонстрировали ассоциацию с БВ на уровне статистической значимости ( PON-1 rs662) или выраженной тенденции ( HFE rs1800562, COMT rs4680). Ещё для 2 полиморфизмов ( АРОЕ rs429358, rs7412) была показана слабо выраженная тенденция к такой ассоциации. Важно, что во всех случаях более высокая выживаемость была зарегистрирована в подгруппах больных-носителей аллелей, связанных с повышенным ОС.
Далее был выполнен множественный регрессионный анализ зависимости БВ от ряда возможных молекулярно-генетических предикторов, включая генотипы АРОЕ rs429358, rs7412; СОМТ rs4680; HFE rs1800562, PON-1 rs662. В результате такого анализа была построена модель зависимости БВ, включающая 3 из 5 изученных полиморфизмов (табл. 2), которые продемонстрировали наилучшую взаимосвязь с БВ в однофакторном анализе. Построенная модель характеризовалась высокой статистической значимостью (R=0,99; p<0,00001). Все 3 отобранных программой параметра были статистически значимо ассоциированы с БВ, включая и те два, которые при однофакторном анализе продемонстрировали взаимосвязь на уровне выраженной тенденции. В целом, результаты однофакторного анализа и множественного регрессионного анализа хорошо согласуются между собой.
Таблица 2
Результаты множественной регрессии для модели прогнозирования БВ больных эндометриоидным РТМ I стадии на основании молекулярно-генетических показателей
|
Предикторы |
Beta |
SE |
B |
SE |
Величина р для предиктора |
R |
Величина р для всей модели в целом |
|
Intercept HFE rs1800562 |
0,469 |
0,112 |
-0,245 0,473 |
0,124 0,113 |
0,0518 0,0001 |
0,99 |
<0,00001 |
|
PON-1 rs662 СOMT rs4680 |
0,300 0,235 |
0,078 0,098 |
0,299 0,238 |
0,079 0,099 |
0,0003 0,0180 |
Примечание: Beta – стандартизированный угловой коэффициент регрессии (в единицах SD); R – коэффициент множественной корреляции.
Вопрос о практическом применении установленных ассоциативных связей и закономерностей клинического исхода заболевания решался с помощью дискриминантного анализа. Была предпринята попытка прогнозирования БВ (нет/есть прогрессирование заболевания на конец периода наблюдения) по совокупности показателей полиморфизма изучаемых генов. В результате пошагового анализа в режиме Forward Stepwise была построена модель (R=0,28; р=0,140) для 3 отобранных программой переменных. Хотя правильная классификация достигалась в 78,0% случаев, специфичность (Sp) и чувствительность (Se) такого метода прогнозирования составили 1,0 и 0,0 соответственно, а величина AUC, характеризующая прогностическую ценность метода, была равна 0,50, т.е. недостаточно велика для практического использования этого метода.
Заключение
Результаты, полученные в ходе исследования, свидетельствуют о том, что изученные на текущем этапе генетические факторы не обладают достаточной мощностью, чтобы использовать их в качестве надёжных маркеров прогноза эффективности комбинированного лечения, включающего радиотерапию. Тем не менее, нам удалось выявить определённые связи между генетическими параметрами и эффективностью лечения как при проведении однофакторного анализа, так и при использовании множественного регрессионного анализа. Эти наблюдения подчёркивают необходимость дальнейших исследований, которые позволят углубить понимание роли полиморфизмов генов, контролирующих окислительный стресс, а также других генов, регулирующих индивидуальную радиочувствительность, в прогнозировании клинического исхода у больных ЗНО.


