Прогнозирование нарушения консолидации переломов длинных костей конечностей с помощью нейросетевого анализа
Автор: Мироманов А.М., Гусев К.А., Старосельников А.Н., Мудров В.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.31, 2025 года.
Бесплатный доступ
Введение. Нарушение репаративной регенерации костной ткани у пациентов с переломами является наиболее частым осложнением, в патогенезе которого ведущую роль играют иммуногенетические механизмы. Поиском «идеального» диагностического маркера занимаются многие исследователи. С этой целью все чаще используются нейросети, которые позволяют осуществлять не только прогноз различных патологических состояний, но и определяют достоверные варианты профилактики и лечения. Цель работы — оценить эффективность прогнозирования нарушения консолидации переломов длинных костей конечностей с помощью нейросетевого анализа данных. Материалы и методы. Обследовано 108 пациентов молодого возраста (по ВОЗ) с переломами длинных костей нижних конечностей. Группа клинического сравнения — 62 пациента без осложнений в возрасте 34,5 лет [18; 44]. Основная группа — 46 пациентов аналогичного возраста (36 [18; 44]) с развитием замедленной консолидации. Группа контроля — 92 практически здоровых человека. Критерии невключения: любые сопутствующие заболевания, другая локализация и характер травм, алкоголизм, недостаточное сопоставление костных отломков при репозиции, повторные операции. Исключены пациенты, получавшие антирезорбтивную терапию и препараты кальция на догоспитальном этапе. Лабораторные (генетические) исследования включали определение носительства полиморфных молекул TNFRSF11B-1181(G>C), IL6-174(C>G), TGFβ1-25(Arg>Pro), EGFR-2073(A>T) и VDR(BsmI283G>A). Амплификацию осуществляли с помощью наборов праймеров «Литех» — «SNP» (Россия). Оценку риска развития замедленной консолидации выполняли в программе SPSS Statistics Version 25.0 (модуль Neural Networks). Прогностические характеристики нейронной сети оценивали с помощью ROC-анализа. Результаты. При определении важности независимой переменной отмечена следующая градация: полиморфизм гена TGFβ1-25(Arg>Pro) — 100 %; полиморфизм гена TNFRSF11B-1181(G>C) — 97,1 %, полиморфизм гена VDR-BsmI283(G>A) — 34,7 %; полиморфизм гена IL6-174(C>G) — 31,5 %; полиморфизм гена EGFR-2073(A>T) — 15,3 %. Процент неверных предсказаний составил — 8,3 %. Площадь под кривой ROC-анализа (англ.: area under curve, AUC) = 0,91[0,85–0,98], p < 0,001. Специфичность полученной модели — 0,95 %, чувствительность — 0,87 %, точность — 91,7 %. Обсуждение. В настоящее время использование подобных технологических решений в практике ограничено отсутствием универсального программного обеспечения и начальными этапами цифровизации медицинской сферы. В ближайшем будущем при развитии исследований генетической предрасположенности к различным заболеваниям/осложнениям данная технология, на наш взгляд, будет иметь широкое распространение. Заключение. Применение нейронной сети для прогнозирования замедленной консолидации переломов с использованием данных носительства определенных полиморфизмов генов оказалось достаточно эффективным, поскольку обладает высокой степенью точности (91,7 %), что свидетельствует о перспективности внедрения нейросетевого анализа в травматологию и ортопедию.
Нарушение консолидации, генетические маркеры, полиморфизм, нейросетевой анализ, нейронная сеть
Короткий адрес: https://sciup.org/142245103
IDR: 142245103 | УДК: 004.8:616.718.4/.6-001.58:616-056.7 | DOI: 10.18019/1028-4427-2025-31-2-237-244
Текст научной статьи Прогнозирование нарушения консолидации переломов длинных костей конечностей с помощью нейросетевого анализа
Несмотря на достижения в хирургическом лечении пострадавших с травмами опорно-двигательной системы, процессы замедленной репарации костной ткани регистрируются достаточно часто, и около 10 % переломов завершаются несращением [1, 2, 3]. По-прежнему остается открытым вопрос возникновения нарушения репаративной регенерации у пациентов без системных и местных факторов риска. В настоящее время проведены исследования, указывающие на ведущую роль иммуногенетики человека при данном осложнении, а определенные варианты носительства полиморфных генов и их аномальная экспрессия могут являться решающими в механизме нарушения консолидации [4, 5, 6, 7]. Однако диапазон подобных изысканий по-прежнему не столь широк и требует дальнейшего изучения.
В современном мире отмечается возрастание роли инновационных технологий анализа получаемых данных. Использование нейросетей и искусственного интеллекта (ИИ) в современном здравоохранении позволяет решать многие задачи, в частности, осуществлять не только прогнозирование различных заболеваний/осложнений, но и определять достоверные варианты профилактики и лечения данных патологических состояний [8, 9, 10].
Цель работы — оценить эффективность прогнозирования нарушения консолидации переломов длинных костей конечностей с помощью нейросетевого анализа данных.
МАТЕРИАЛЫ И МЕТОДЫ
В работе с обследуемыми лицами соблюдены этические принципы, предъявляемые Хельсинкской Декларацией Всемирной Медицинской Ассоциации (поправки 1964, 2011 гг.).
Данная статья подготовлена в рамках комплексной научно-исследовательской работы РК 034(02, 03), регистрационный номер АААА-А16-116063010015-6.
Обследовано 108 пациентов молодого возраста (по ВОЗ) с переломами длинных костей нижних конечностей. Группу клинического сравнения составили 62 пациента без осложнений в возрасте 34,5 лет [18; 44], основную группу — 46 пациентов аналогичного возраста (36 [18; 44]) с развитием замедленной консолидации, в группу контроля включены 92 практически здоровых человека, сопоставимых по возрасту (35,0 [18; 44]) и полу.
Критериями невключения в исследование являлись любые сопутствующие заболевания, другая локализация и характер травм, алкоголизм, а также недостаточное сопоставление костных отломков при репозиции и повторные операции. Также исключены пациенты, получавшие антирезорбтивную терапию и препараты кальция на догоспитальном этапе.
Диагноз замедленной консолидации выставляли на основании шкалы оценки признаков консолидации RUST [11] и рентгенологических критериев, описанных в клинических рекомендациях. Лечение пациентов осуществляли в соответствии с клиническими рекомендациями, утвержденными Минздравом России (Переломы бедренной кости (кроме проксимального отдела бедренной кости), 2021; Переломы костей голени, 2021).
Материалом для молекулярно-генетического анализа служили образцы ДНК, выделенные из лейкоцитов периферической крови исследуемых. Для исследования SNV ( англ .: Single Nucleotide Variant — однонуклеотидный полиморфизм) выбраны точковые мутации рецептора тумор некротического фактора (TNFRSF11B) в позиции 1181 (G>C), интерлейкина-6 (IL6) в позиции 174 (C>G), трансформирующего фактора роста β 1 (TGF β 1) в позиции 25 (Arg>Pro), рецептора эпидермального фактора роста (EGFR) в позиции 2073 (A>T) и витамина D (VDR) (BsmI 283G>A). Амплификацию фрагментов генов выполняли в термоцикле модели «Бис» — М111 (ООО «Бис-Н», Новосибирск). В работе использовали наборы праймеров «Литех» — «SNP» (Россия). Визуализация продуктов амплификации выполнена с помощью электрофореза в 3 % агарозном геле с добавлением бромистого этидия в проходящем ультрафиолетовом свете. Полученные результаты трактовали согласно инструкциям фирмы производителя.
Оценку риска развития замедленной консолидации выполняли с помощью программы SPSS Statistics Version 25.0 (модуль Neural Networks). Прогностические характеристики нейронной сети оценивали с помощью ROC-анализа. При проведении статистического анализа авторы руководствовались принципами Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациями «Статистический анализ и методы в публикуемой литературе» (SAMPL) [12].
Для проверки значимости различий количественных параметров между группами применяли методы описательной статистики и ряд непараметрических критериев. Закон распределения признаков с учетом численности групп оценивали при помощи критерия Шапиро – Уилка. Анализ различий количественных параметров исследуемых выборок проводили с помощью U-критерия Манна – Уитни. Качественные данные описывали с указанием абсолютных ( n ) и относительных (%) значений.
Для сравнения номинальных данных двух групп исследования использовали критерий χ 2 Пирсона. Если количество ожидаемых наблюдений было менее 10, для сравнения использовали критерий χ 2 Пирсона с поправкой Йейтса на непрерывность, если менее 5 — точный критерий Фишера. Статистически значимым считали значение p < 0,05 [13].
РЕЗУЛЬТАТЫ
В модели прогноза использованы только генотипы исследуемых полиморфизмов генов ( TNFRSF11B, IL6, TGF β 1, EGFR, VDR ) (табл. 1, 2).
При анализе частоты носительства генотипов SNV у пациентов с замедленной консолидацией отмечено преобладание мутантного генотипа гена IL6(C174G), TGF β 1(A25P), EGFR(A2073T) и VDR (BsmI G>A) над группой клинического сравнения в 2,1, 10,1, 5,1 и 3,1 раза соответственно. Напротив, при определении частоты распределения генотипа полиморфизма гена TNFRSF11B(G1181C) в группе с замедленной консолидацией выявлено значимое преобладание нормального гомозиготного варианта в сравнении с первой группой в 4,3 раза (табл. 1, 2).
Таблица 1
Частота носительства исследуемых SNV среди здоровых лиц и групп пациентов с переломами длинных костей
|
Генотип |
Группа контроля ( n = 92) |
Группа клинического сравнения ( n = 62) |
Основная группа ( n = 46) |
|
|
TNFRSF11B-1181G>C |
Генотип GG OR [95 % CI] |
0,511 |
0,161 0,18 [0,08–0,41] |
0,696 2,19 [1,03–4,63] |
|
Генотип GC OR [95 % CI] |
0,326 |
0,452 1,7 [0,88–3,30] |
0,196 0.5 [0,22–1,17] |
|
|
Генотип CC OR [95 % CI] χ 2 р |
0,326 |
0,387 3,24 [1,53–6,88] 21,12 < 0,001 |
0,109 0,63 [0,21–1,84] 4,3 0,12 |
|
|
IL6-174C>G |
Генотип CC OR [95 % CI] |
0,326 |
0,323 0,98 [0,49–1,96] |
0,174 0,44 [0,18–1,05] |
|
Генотип CG OR [95 % CI] |
0,467 |
0,468 1,00 [0,53–1,91] |
0,391 0,37 [036–1,5] |
|
|
Генотип GG OR [95 % CI] χ 2 р |
0,207 |
0,210 1,02 [0,46–2,25] 0,00 1 |
0,435 2,96 [1,37–6,39] 8,63 0,01 |
|
|
TGF β 1-25Arg>Pro |
Генотип ArgArg OR [95 % CI] |
0,630 |
0,581 0,81 [0,42–1,57] |
0,282 0,23 [0,11–0,5] |
|
Генотип ArgPro OR [95 % CI] |
0,240 |
0,371 1,88 [0,93–3,79] |
0,196 0,77 [0,32–1,85] |
|
|
Генотип ProPro OR [95 % CI] χ 2 р |
0,130 |
0,048 0,34 [0,09–1,26] 4,91 0,09 |
0,522 7,27 [3,14–16,82] 25,47 < 0,001 |
|
|
EGFR-2073A>T |
Генотип АА OR [95 % CI] |
0,315 |
0,306 0,96 [0,48–1,93] |
0,13 0,33 [0,12–0,85] |
|
Генотип АТ OR [95 % CI] |
0,598 |
0,597 1,00 [0,52–1,92] |
0,37 0,39 [0,19–0,82] |
|
|
Генотип ТТ OR [95 % CI] χ 2 р |
0,087 |
0,097 1,13 [0,37–3,42] 0,05 0,98 |
0,5 10,5 [4,15–26,54] 30,48 < 0,001 |
|
|
VDR-BsmI283G>A |
Генотип GG OR [95 % CI] |
0,359 |
0,468 1,57 [0,82–3,03] |
0,196 0,43 [0,19–1,01] |
|
Генотип GA OR [95 % CI] |
0,446 |
0,435 0,96 [0,5–1,84] |
0,5 1,24 [0,61–2,53] |
|
|
Генотип AA OR [95 % CI] χ 2 р |
0,196 |
0,097 0,44 [0,16–1,18] 3,43 0,18 |
0,304 1,8 [0,8–4,05] 4,44 0,11 |
|
Примечание : р — статистическая значимость различий с группой контроля.
Таблица 2
Частота носительства исследуемых SNV среди групп пациентов с переломами длинных костей
|
Генотип |
I группа ( n = 62) |
II группа ( n = 46) |
χ 2 |
р |
OR [95 % CI] |
|
|
TNFRSF11B-1181G>C |
Генотип GG |
0,161 |
0,696 |
32,06 |
< 0,001 |
11,89 [4,72–29,92] |
|
Генотип GC |
0,452 |
0,196 |
0,3 [0,12–0,71] |
|||
|
Генотип СС |
0,387 |
0,109 |
0,19 [0,07–0,56] |
|||
|
IL6-174C>G |
Генотип CC |
0,323 |
0,174 |
6,99 |
0,03 |
0,44 [0,17–1,12] |
|
Генотип CG |
0,468 |
0,391 |
0,73 [0,34–1,59] |
|||
|
Генотип GG |
0,210 |
0,435 |
2,9 [0,89–6,75] |
|||
|
TGF β 1-25Arg>Pro |
Генотип ArgArg |
0,581 |
0,283 |
23,73 |
< 0,001 |
0,05 [0,01–0,17] |
|
Генотип ArgPro |
0,371 |
0,196 |
2,42 [0,99–5,92] |
|||
|
Генотип ProPro |
0,048 |
0,522 |
3,51 [1,55–7,95] |
|||
|
EGFR-2073A>T |
Генотип АА |
0,306 |
0,13 |
22,25 |
< 0,001 |
0,34 [0,12–0,94] |
|
Генотип AT |
0,597 |
0,37 |
0,4 [0,18–0,87] |
|||
|
Генотип TT |
0,097 |
0,5 |
9,33 [3,36–25,92] |
|||
|
VDR-BsmI 283 G>A |
Генотип GG |
0,468 |
0,196 |
11,94 |
0,003 |
0,28 [0,11–0,67] |
|
Генотип GA |
0,435 |
0,5 |
1,3 [0,6–2,79] |
|||
|
Генотип AA |
0,097 |
0,304 |
4,08 [1,43–11,67] |
|||
Примечание : p — статистическая значимость различий между группами.
Модель прогнозирования нарушения консолидации
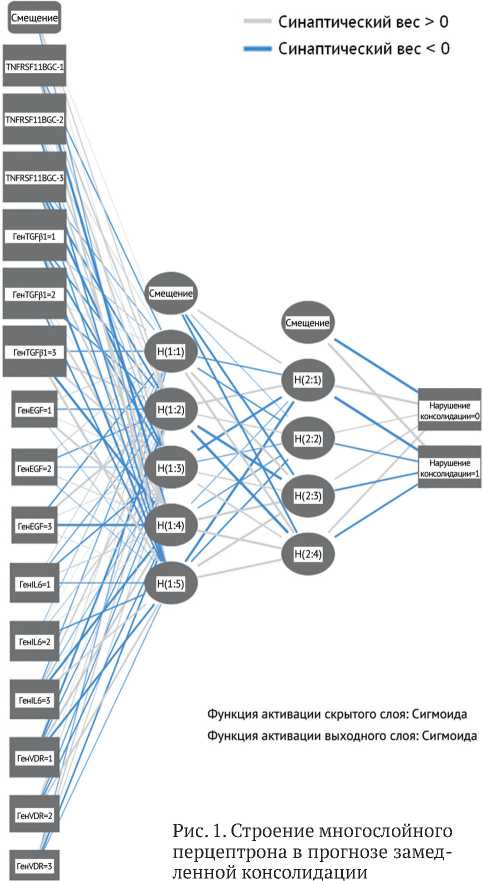
С целью проверки полученных результатов прогноза замедленной консолидации нами дополнительно выполнен нейросетевой анализ данных. В качестве модели использовали систему многослойного перцептрона, основанную на зависимой переменной (замедленная консолидация), которая определяется при анализе независимых данных (возможных предикторов). В качестве независимых переменных (15 входных нейронов) мы использовали генотипы исследуемых SNP, имеющие значимую прогностическую ценность. При расчете нейронная сеть показала архитектуру с оптимальным количеством скрытых слоев (5 и 4, соответственно), которые осуществляют прогноз (рис. 1). Создание взаимосвязи взвешенных сумм объектов с последующим слоем значений данных объектов в обоих скрытых слоях осуществляется с помощью активации сигмоидной функции. Аналогичная функция регистрируется и в выходном слое (0; 1), что соответствует исходному дизайну исследования. В качестве функции ошибки выступала сумма квадратов. Выходной слой содержал 1 целевую (зависимую) переменную (замедленная консолидация есть / нет) (рис. 1).
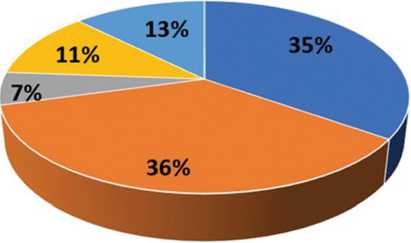
При определении важности независимой переменной отмечена следующая градация: полиморфизм гена TGF β 1-25(Arg>Pro) ; полиморфизм гена TNFRSF11B-1181(G>C) ; полиморфизм гена VDR-BsmI283(G>A) ; полиморфизм гена IL6-174(C>G) ; полиморфизм гена EGFR-2073(A>T ) (рис. 2).
При этом нормализованная важность составила 100 %, 97,1 %, 34,7 %, 31,5 % и 15,3 % соответственно. Процент неверных предсказаний составил 8,3 %.
Прогностическую ценность данной нейронной сети оценивали с помощью ROC-анализа (рис. 3).
-
■ TNFRSF11B ОС
-
■ Ген TGF^i
-
■ Ген EGF
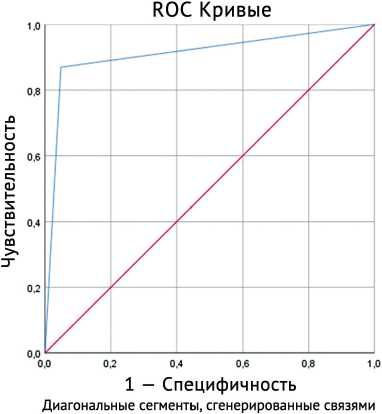
Рис. 3. ROC-анализ возможности развития замедленной консолидации на основе нейросетевого анализа данных
Ген IL6
■ Ген VDR
Рис. 2. Градация при определении важности независимой переменной
Площадь под кривой (AUC) = 0,91 (95 % ДИ = 0,85–0,98). Точность прогноза прогностической модели составила 91,7 %, чувствительность — 0,87 %, специфичность — 0,95 %. AUC — 0,91 (95 % ДИ = 0,85–0,98), p < 0,001.
ОБСУЖДЕНИЕ
Преобладание мутантного генотипа гена IL6(C174G), TGF β 1(A25P), EGFR(A2073T), VDR (BsmI G>A) и нормального гомозиготного варианта TNFRSF11B(G1181C) в группе с замедленной консолидацией свидетельствуют о высоком риске нарушения консолидации при их носительстве [4].
Учитывая результаты научных трудов последних десятилетий, можно отметить, что наследственные факторы имеют немаловажное место в развитии неправильной работы системы иммунитета. Запрограммированная, генетически пониженная или повышенная выработка белков в макроорганизме способствует возможности по-разному откликаться иммунной системе на патогены [4, 14]. В частности, доказана роль полиморфизма генов многих цитокинов как в развитии патологических состояний, так и в их протекторном действии [15, 16].
Однако данные исследования не столь широко представлены и недостаточно раскрывают иммуноге-нетические механизмы заболеваний и/или осложнений опорно-двигательной системы [4].
К настоящему времени имеются немногочисленные исследования, где в качестве «маркеров» риска нарушения консолидации выступают SNV генов. В частности, с развитием атрофического ложного сустава ассоциированы SNV гена транскрипционного фактора SMAD6 (T/T rs2053423) и гена белка-ингибитора некоторых морфогенетических белков NOGGIN (G/G rs1372857). Несращения диафиза бедренной и большеберцовой костей чаще наблюдают при носительстве гаплотипа А тромбоцитарного фактора роста (PDGF) (rs1800814, rs62433334, rs13309625; CCG). Предрасположенность к развитию воспалительного осложнения и нарушению процессов репарации костной ткани установлена при носительстве аллели T и C/T кодона 10 гена трансформирующего фактора роста- β (TGF- β ) и мутантного гена толл-подобного рецептора-4 (TLR4) W/1. Также к факторам риска нарушения консолидации относится носительство генотипа T/T гена IL1 β (rs2853550) и гена синтазы оксида азота NOS2 (rs2297514). Кроме того, нарушению нормальных процессов репаративной регенерации способствует носительство гаплотипа А гена морфогенетического белка BMP4 (rs2761884, rs17563, rs2071047, rs762642; GTAA), генотипа T/G гена ангиогенного индуктора, богатого цистеином CYR61 (rs3753793), а также C аллели гена рецептора фактора роста фибробластов FGFR1 (rs13317) [17].
В работе G. Zimmermann et al. показана роль экспрессии генов при нормальной консолидации перелома и ее нарушении. Так, избыточная экспрессия генов цистеиндиоксигеназы-1 (CDO1), белка олигомерного матрикса хряща (COMP), фибромодулина (FMOD), фибронектина 1 (FN1), кластерина (CLU), двухкомпонентной системы сигнальных путей (TCS22), актина (ACTA2) и белка, взаимодействующего с фосфодиэстеразой 4D (PDE4DIP), способствует дисбалансу в работе структуры и функции клеток при репаративной регенерации, что приводит к нарушению консолидации по типу несращения [18].
Экспериментальные исследования T. Waki et al. демонстрируют роль микроРНК (miRNA) в репаративной регенерации и ремоделировании костной ткани. Установлено, что при усилении экспрессии miR-31a-3p, miR-31a-5p, miR-146a-5p, miR-146b-5p и miR-223-3p регистрируется нарушение консолидации [19].
Напротив, в научной работе H. Wang et al. отмечено, что рецептор костного морфогенетического белка типа Ib (BMPR1b) является потенциальной мишенью miR-125b, ингибирует ее и способствует лучшему восстановлению дефектов костной ткани [20]. Таким образом, экспериментальным путем идентифицировано 11 miRNAs, которые могут способствовать нарушению процессов репаративной регенерации [21].
Имеются данные и о носительстве SNV, являющимся протективным (защитным). Установлено, что с благоприятным течением консолидации ассоциировано носительство генотипа G/T и G/G гена нейронного специфического индуцируемого ретиноевой кислотой (FAM5C (rs1342913)), генотипа G/G гена морфогенетического белка кости 6 (BMP6 (rs270393)) и генотипа G/G гена матриксной металлопепти-дазы 13 (MMP13 (rs3819089)) [22].
Тем не менее, с целью подтверждения значимой роли вышеуказанных SNV в процессах нарушения консолидации переломов вышеперечисленные данные требуют масштабирования исследований с большим количеством пациентов и строгими критериями включения / исключения в отношении сопутствующей патологии.
В настоящее время показано, что ИИ может выполнять ключевые задачи здравоохранения, в том числе по диагностике заболеваний. Математическая модель на основе выборочных данных (обучающих) строится с помощью алгоритмов машинного обучения (МО), что приводит к построению прогнозов и/или конкретных решений [23, 24, 25]. В частности, наиболее часто алгоритмы МО применяют в персонифицированной (персонализированной) медицине. Такие программы МО в обязательном порядке требуют контролируемого обучения с использованием переменной исхода [23].
Сейчас все чаще в медицине применяют сложные формы МО, — нейронные сети. Такие технологии также используют в диагностике (прогнозе) различных патологических состояний [26]. Что касается используемого в данной работе многослойного перцептрона, то его причисляют к сети прямого распространения (от слоя к слою). Окончательный результат расчета формируется в виде итога разности между ответами каждого слоя. Точность данной модели повышается при увеличении количества слоев перцептрона [27].
Таким образом, дальнейшее изучение персонифицированных иммуногенетических механизмов неблагоприятного течения травматической болезни при переломах длинных костей конечностей, в том числе и с применением современных цифровых систем, может послужить основой для обнаружения предиктора развития осложнений и позволит вносить необходимую профилактическую коррекцию в лечение, что будет способствовать значительному снижению неблагоприятных исходов.
В настоящее время использование в практике подобных технологических решений ограничено в связи с отсутствием универсального программного обеспечения и начальными этапами цифровизации медицинской сферы. Однако создание единого цифрового контура и внедрение ИИ, набирающее оборот в рамках федерального проекта «Цифровые сервисы здравоохранения», демонстрирует важность цифровизации научных медицинских технологий всех отраслей. В ближайшем будущем при развитии исследований генетической предрасположенности к различным заболеваниям/осложнениям данная технология, на наш взгляд, будет иметь широкое распространение.
Полученные нами данные носят предварительный характер. Мы надеемся, что дальнейшие полномасштабные исследования позволят обосновать внедрение иммуногенетических маркеров на основе цифровых сервисов в диагностику развития осложнений при патологии опорно-двигательной системы.
ЗАКЛЮЧЕНИЕ
Применение нейронной сети для прогнозирования замедленной консолидации переломов при использовании данных носительства определенных полиморфизмов генов оказалось достаточно эффективным, поскольку обладает высокой степенью точности (91,7 %), что свидетельствует о перспективности внедрения нейросетевого анализа в травматологию и ортопедию.


