Прогнозирование панкреатической фистулы после панкреатодуоденальной резекции с использованием машинного обучения
Автор: Суворов В.А., Панин С.И., Коваленко Н.В., Жаворонкова В.В., Постолов М.П., Толстопятов С.Е., Бубликов А.Е., Панова А.В., Попова В.О.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.22, 2023 года.
Бесплатный доступ
Цель исследования - провести анализ результатов панкреатодуоденальной резекции (ПДР) и выявить предикторы риска возникновения панкреатической фистулы (ПФ), используя возможности технологии машинного обучения (МО). Материал и методы. Проведено нерандомизированное исследование результатов лечения 128 пациентов, оперированных в объеме ПДР по поводу злокачественных опухолей периампулярной зоны на клинической базе ФГБОУ ВО «ВолгГМУ» Минздрава РФ - ГБУЗ «Волгоградский областной клинический онкологический диспансер» в 2018-2023 гг. Прогнозирование развития ПФ проводили с применением МО на основе многослойного перцептрона и бинарной логистической регрессии (БЛР) в SPSS Statistics v.26. Для оценки точности моделей применяли Receiver Operator Characteristics (ROC) анализ. Сравнение ROC-кривых выполняли тестом ДеЛонг.
Панкреатодуоденальная резекция, панкреатическая фистула, машинное обучение
Короткий адрес: https://sciup.org/140303555
IDR: 140303555 | УДК: 616.37-089.87-037 | DOI: 10.21294/1814-4861-2023-22-6-25-34
Текст научной статьи Прогнозирование панкреатической фистулы после панкреатодуоденальной резекции с использованием машинного обучения
Панкреатическая фистула (ПФ) является грозным осложнением панкреатодуоденальной резекции (ПДР) и может развиться даже в условиях «центров большого объема» после технически идеально выполненной операции [1]. Частота ПФ после ПДР достигает в среднем 22,3 % [2]. ПФ удлиняет госпитализацию, увеличивает стоимость лечения и вероятность летального исхода, отменяет или отдаляет начало адъювантной химиотерапии, ухудшая прогноз [3]. Факторы, способствующие развитию ПФ, являются предметом изучения большинства хирургов-панкреатологов и до сих пор остаются дискутабельными [4].
Машинное обучение (МО) – вид искусственного интеллекта (ИИ), который дополняет и улучшает себя, используя статистические подходы [5]. Применение МО в анализе данных на дооперационном этапе позволяет стратифицировать пациентов на группы риска [6]. С 1997 по 2021 г. опубликовано 587 работ по использованию ИИ в прогнозировании результатов лечения рака поджелудочной железы [7]. При этом остается неясным, может ли ИИ существенно увеличить точность прогнозирования развития ПФ после ПДР.
Цель исследования – провести анализ результатов панкреатодуоденальной резекции и выявить предикторы риска возникновения панкреатической фистулы, используя возможности технологий машинного обучения.
Материал и методы
На клинической базе ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России – ГБУЗ «Волгоградский областной клинический онкологический диспансер» – за 5 лет (с 1.09.2018 по 1.09.2023) проведено 128 ПДР (табл. 1). Возраст пациентов варьировал от 38 до 77 лет (медиана=63 года, Q1-Q3=58–68 лет). Среди
оперированных больных было 70 (54,7%) мужчин и 58 (45,3 %) женщин. Диагностику и лечение злокачественных опухолей периампулярной зоны проводили на основании клинических рекомендаций МЗ РФ: «Рак поджелудочной железы» (2021), «Нейроэндокринные опухоли» (2020), «Рак желчевыводящей системы» (2020).
Критерии включения больных: злокачественное новообразование головки поджелудочной железы, Фатерова сосочка, 12-перстной кишки, дистального отдела холедоха; функциональная операбельность пациента; возможность достижения R0-резекции. Критерии исключения: диссеминированный процесс; местно-нерезектабельная опухоль; доброкачественное новообразование периампулярной зоны.
Во всех случаях производили панкреатодуоденальную резекцию (операцию Whipple) лапаро-томным доступом без сохранения привратника. Консистенцию поджелудочной железы определял оперирующий хирург субъективно в ходе интраоперационной оценки на основе визуальных и пальпаторных характеристик. Регистрировали железу как «мягкую» при обнаружении нежной, легко повреждаемой панкреатической ткани, чаще всего желто-розового цвета. Во всех остальных случаях регистрировали в операционном журнале поджелудочную железу как «плотную».
Лимфодиссекцию выполняли в стандартном объеме, в соответствии с клиническими рекомендациями. Реконструктивный этап состоял в формировании анастомозов на 2 отдельных кишечных петлях по Ру. Панкреатикодигестивное соустье по типу «конец в бок» формировали прецизионно нитями PDS 3/0–4/0 отдельными узловыми швами с сопоставлением слизистой кишки и протока (техника «duct-to-mucosa»). В зависимости от предпочтений хирурга при формировании пан-креатикоэнтероанастомоза и диаметре вирсунгова
Таблица 1/table 1
|
Характеристики/Characteristics |
Значение/Meaning |
|
Пол/Gender |
|
|
Мужской/Male |
70 (54,7 %) |
|
Женский/Female |
58 (45,3 %) |
|
Возраст, лет/Age, years |
|
|
Среднее ± SD/Mean ± SD |
61,98 ± 8,13 |
|
Медиана [межквартильный размах]/Median [interquartile range] |
63 [58–68] |
|
Локализация опухоли/Localization of the tumor |
|
|
Головка поджелудочной железы/Head of the pancreas |
74 (57,8 %) |
|
Ампула Фатерова сосочка/The ampulla of Vater |
39 (30,5 %) |
|
12-перстная кишка/Duodenum |
12 (9,4 %) |
|
Дистальный отдел холедоха/Distal choledochus |
3 (2,3 %) |
|
Стадия (TNM8)/Stage (TNM8) |
|
|
Рак головки поджелудочной железы/Pancreatic head cancer |
|
|
IА |
6 (4,7 %) |
|
IB |
14 (10,9 %) |
|
IIA |
21 (16,4 %) |
|
IIB |
28 (21,9 %) |
|
III |
5 (3,9 %) |
|
Рак Фатерова сосочка/Cancer of the ampulla of Vater |
|
|
I |
9 (7 %) |
|
IIA |
12 (9,4 %) |
|
IIB |
15 (11,7 %) |
|
IIIA |
3 (2,3 %) |
|
Рак 12-перстной кишки/Cancer of the duodenum |
|
|
I |
3 (2,3 %) |
|
IIA |
5 (3,9 %) |
|
IIB |
4 (3,1 %) |
|
Рак дистального отдела холедоха/Cancer of the distal choledochus |
|
|
I |
2 (1,6 %) |
|
IIA |
1 (0,8 %) |
|
Гистологический тип/Histological type |
|
|
Рак головки поджелудочной железы/Pancreatic head cancer |
|
|
Протоковая аденокарцинома/Ductal adenocarcinoma |
68 (53,1 %) |
|
Солидно-псевдопапиллярная опухоль/Solid-pseudopapillary tumor |
4 (3,1 %) |
|
Недифференцированный рак/Undifferentiated cancer |
2 (1,6 %) |
|
Рак Фатерова сосочка/Cancer of the ampulla of Vater |
|
|
Аденокарцинома/Adenocarcinoma |
39 (30,5 %) |
|
Рак 12-перстной кишки/Cancer of the duodenum |
|
|
Аденокарцинома/Adenocarcinoma Недифференцированный рак/Undifferentiated cancer |
10 (8 %) 2 (1,6 %) |
|
Рак дистального отдела холедоха/Cancer of the distal choledochus |
|
|
Аденокарцинома/Adenocarcinoma |
2 (1,6 %) |
|
Перстневидноклеточный рак/Signet-ring cell cancer |
1 (0,8 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Основные характеристики пациентов
Main characteristics of patients
протока менее 3 мм применяли увеличительную оптику с микрохирургическим инструментарием. Гепатикоэнтероанастомоз по типу «конец в бок» формировали с применением однорядного непрерывного шва монофиламентной нитью 2/0–3/0 на одной петле кишки с панкреатикоэнтероанастомо-зом. Гастроэнтероанастомоз по типу «бок в бок» располагали на петле кишки, отключенной по Ру.
В послеоперационном периоде в ведении пациентов применяли элементы протокола fast track: раннее энтеральное питание, продленная эпиду- ральная аналгезия, ранняя активизация больных. Вмешательства выполнены на базе онкологического отделения хирургических методов лечения № 5 ГБУЗ «ВОКОД». Все больные оперированы по единообразной методике и с соблюдением общих правил периоперационного ведения пациентов. Панкреатодуоденальные резекции проведены: по поводу ЗНО головки поджелудочной железы – 74 (57,8 %) случая, Фатерова сосочка – 39 (30,5 %), 12-перстной кишки – 12 (9,4 %), дистального отдела холедоха – 3 (2,3 %) больных.
При регистрации осложнений после ПДР использовали градацию Clavien–Dindo [8]. Для оценки степени выраженности панкреатической фистулы применяли критерии International Study Group of Pancreatic Fistula [9]. Послеоперационную летальность регистрировали как смерть больного в течение 30 суток от ПДР.
Базу данных пациентов вели с помощью программы Microsoft Excel 2019. Статистический анализ данных проводился с использованием пакета SPSS версии 26 (SPSS Inc, Chicago, IL). Для оценки нормальности распределения непрерывных признаков использовали критерий Колмогорова– Смирнова. При нормальном распределении данных указывали среднее арифметическое значение и стандартное отклонение. Количественные признаки, распределение которых отличалось от нормального, описывали при помощи медианы (Me), 25-го и 75-го квартилей [Q1–Q3]. Для оценки качественных данных использовали абсолютные значения и процентные доли. Различия в группах определяли с помощью критерия χ2 Пирсона (при значениях ожидаемого явления более 10), точный критерий Фишера (при значениях ожидаемого явления менее 10). Для прогнозирования использовали бинарную логистическую регрессию (БЛР) и машинное обучение. Для идентификации предикторов риска развития ПФ проводили однофакторную логистическую регрессию по каждому из возможных параметров с оценкой отношений шансов (Crude Odds Ratio – COR) и 95 %-дове-рительных интервалов (95 %ДИ). Статистически значимые предикторы (p<0,05) включали в многофакторную модель, учитывающую взаимовлияние конфаундеров с оценкой скорректированных отношений шансов (Adjusted Odds Ratio – AOR) и 95 % ДИ. Определяли оптимальные граничные значения непрерывных данных с помощью ROC-анализа и формировали бинарные переменные. Для отбора предикторов в рамках многофакторной модели использовали обратный метод Вальда. Машинное обучение (МО) проводили с применением многослойного перцептрона. Для сравнительного анализа диагностической точности предиктивных моделей использовали тест ДеЛонг.
Результаты
Послеоперационные осложнения отмечены у 63 (49,2 %) пациентов (табл. 2). Среди осложнений преобладали панкреатическая фистула (по классификации ISGPF, grade B – у 16 (12,5 %), grade C – у 3 (2,3 %) больных), желчная фистула – у 16 (12,5 %) и гастростаз – у 12 (9,4 %) больных. Послеоперационная летальность составила 3,9 % (5 из 128 пациентов). При этом 2 (1,56 %) больных умерли от перитонита и полиорганной недостаточности на фоне несостоятельности панкреати-коэнтероанастомоза и гепатикоэнтероанастомоза, 2 (1,56 %) – от аррозивного кровотечения на фоне
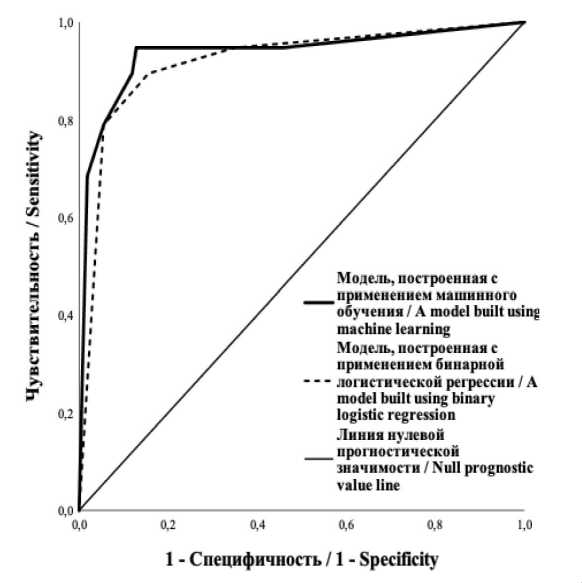
Рис. 1. Сравнительный анализ ROC-кривых вероятности развития панкреатической фистулы. Примечание: рисунок выполнен авторами
Fig 1. Comparative analysis of the ROC-curves for predictability of pancreatic fistula. Note: created by the authors панкреатической фистулы и 1 (0,78 %) пациентка – от тромбоза синтетического протеза воротной вены после ПДР с венозной реконструкцией.
При дальнейшем изучении результатов лечения периампулярных злокачественных опухолей установлено 7 параметров, присутствие которых влияет на шансы развития панкреатической фистулы в послеоперационном периоде (табл. 3). Указанные факторы проанализированы с помощью метода бинарной логистической регрессии и машинного обучения. При этом установлено, что модель, построенная с помощью БЛР, объясняет 58,6 % дисперсии изучаемого признака (развития ПФ), а модель, разработанная с применением машинного обучения, – 71,4 % дисперсии. Три предиктора статистически значимо увеличивают вероятность развития ПФ: диаметр главного панкреатического протока менее 3 мм, мягкая консистенция поджелудочной железы и скорректированный по возрасту индекс коморбидности Charlson более 7 баллов. Остальные 4 фактора значимы лишь в однофакторных моделях.
Диагностическая точность предиктивных моделей представлена в виде ROC-кривых на рис. 1. При этом большую площадь под ROC-кривой покрывала модель, построенная с помощью технологии машинного обучения. При сравнительном анализе установлена большая чувствительность, специфичность и диагностическая эффективность данной модели, чем при применении бинарной логистической регрессии (табл. 4).
Архитектура разработанной нейросети представлена на рис. 2. При нейросетевом анализе
|
Результаты панкреатодуоденальных резекций Pancreatoduodenectomy outcomes |
Таблица 2/table 2 |
|
Параметр/Parameter |
Значение/Meaning |
|
Интраоперационная кровопотеря, мл [Me, Q1-Q3]/Intraoperative blood loss, ml [Me, Q1-Q3] |
300 [100–700] |
|
Продолжительность операции, минуты [Me, Q1-Q3]/Surgery time, minutes [Me, Q1-Q3] |
210 [180–300] |
|
Послеоперационные осложнения/Postoperative complications |
63 (49,2 %) |
|
Осложнения Clavien–Dindo I–II степени/Grade I–II complications according to the Clavien–Dindo system |
25 (19,5 %) |
|
Гастростаз/Delayed gastric emptying |
12 (9,4 %) |
|
Воспаление послеоперационной раны/Inflammation of the postoperative wound |
7 (5,5 %) |
|
Пневмония/Pneumonia |
4 (3,1 %) |
|
Тромбоз глубоких вен нижних конечностей/Deep vein thrombosis of the lower extremities |
2 (1,56 %) |
|
Осложнения Clavien–Dindo III–V степени*/ |
38 (29,7 %) |
|
Grade III–V complications according to the Clavien–Dindo system* |
|
|
Панкреатическая фистула (всего)/Pancreatic fistula (total) |
19 (14,8 %) |
|
Панкреатическая фистула класса В/Pancreatic fistula grade B |
16 (12,5 %) |
|
Панкреатическая фистула класса С/Pancreatic fistula grade С |
3 (2,3 %) |
|
Желчная фистула/Bile fistula |
16 (12,5 %) |
|
Аррозивное кровотечение/Arrosive bleeding |
8 (6,25 %) |
|
Эвентрация раны/Wound eventration |
4 (3,1 %) |
|
Внутрибрюшной абсцесс/Intra-abdominal abscess |
1 (0,78 %) |
|
Тромбоз синтетического протеза воротной вены/Thrombosis of a synthetic portal vein prosthesis |
1 (0,78 %) |
|
Тромбоз артерий нижних конечностей/Thrombosis of the arteries of the lower extremities |
1 (0,78 %) |
|
Тромбоэмболия легочной артерии/Pulmonary embolism |
1 (0,78 %) |
|
Острый инфаркт миокарда/Acute myocardial infarction |
1 (0,78 %) |
|
Летальность/Mortality |
5 (3,9 %) |
|
Причины летальности/Causes of mortality |
|
|
Аррозивное кровотечение/Arrosive bleeding |
2 (1,56 %) |
|
Перитонит на фоне несостоятельности анастомозов/Peritonitis due to anastomosis failure |
2 (0,78 %) |
|
Тромбоз синтетического протеза воротной вены/Thrombosis of a synthetic portal vein prosthesis |
1 (0,78 %) |
Примечание: * – число осложнений превышает число пациентов, поскольку некоторые больные имели 2 и более осложнений в послеоперационном периоде; таблица составлена авторами.
Note: * – the number of complications exceeds the number of patients, since some patients had 2 or more complications in the postoperative period; created by the authors.
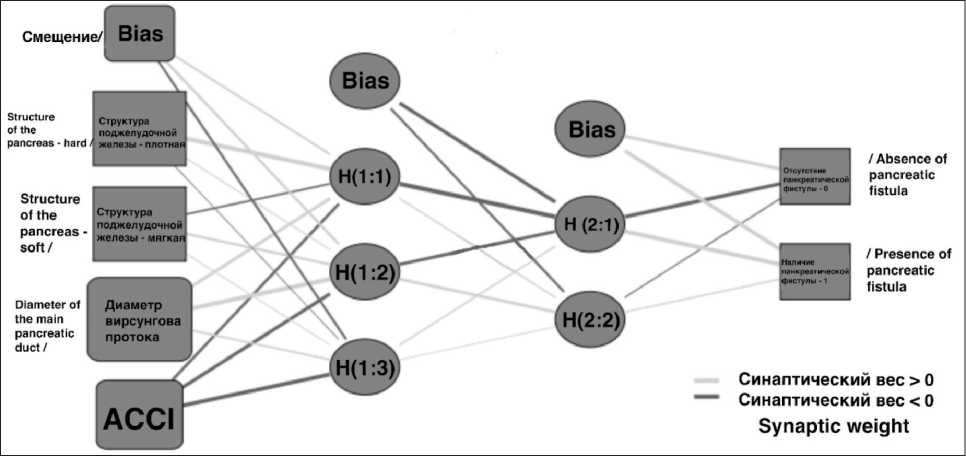
Рис. 2. Нейросетевая модель. Примечания: Смещение – вероятность ошибки, которую нейросеть предусматривает в расчетах; структура поджелудочной железы: 0 – твердая, 1 – мягкая; ACCI – скорректированный по возрасту индекс коморбидности Charlson; панкреатическая фистула: 0 – не прогнозируется, 1 – прогнозируется; рисунок выполнен авторами
Fig. 2. Neural network model. Notes: Bias – the probability of error that the neural network provides for in the calculations; structure of the pancreas: 0 – hard, 1 – soft; ACCI – age adjusted Charlson comorbidity index; pancreatic fistula: 0 – not predicted, 1 – predicted; created by the authors
Таблица 3/table 3
Оценка связи факторов с шансами развития панкреатической фистулы в послеоперационном периоде у пациентов с периампулярными злокачественными опухолями evaluation of the relationship of predictive factors with the development of postoperative pancreatic fistula in patients with periampullary cancer
|
Предиктор |
COR (95 % CI) |
Значение p/ p-value |
AOR (95 % CI) |
Значение p/ p-value |
|
Интраоперационная кровопотеря более 500 мл/ Intraoperative blood loss of more than 500 ml |
4,8 (2,4–7,1) |
0,02 |
– |
– |
|
Анемия перед операцией/Anemia before surgery |
6,53 (5,8–6,7) |
0,04 |
– |
– |
|
Длительность ПДР более 4 ч/ Duration of PD is longer than 4 hours |
13,5 (7,6–23,63) |
0,01 |
– |
– |
|
Ожирение (индекс массы тела более 30 кг/м2)/ Obesity (body mass index of more than 30 kg/m2) |
11,6 (5,4–21,3) |
0,02 |
– |
– |
|
ACCI более 7/ACCI more than 7 |
21,1 (5,6–78,7) |
<0,001 |
8,3 (5,3–8,9) |
0,001 |
|
Диаметр главного панкреатического протока менее 3 мм/ |
16,2 |
<0,001 |
7,6 |
<0,001 |
|
Main pancreatic duct diameter is less than 3 mm |
(4,4–59,9) |
(7,3–8,3) |
||
|
Мягкая консистенция поджелудочной железы/ |
46 |
<0,001 |
6,8 |
0,001 |
|
Soft texture of the pancreas |
(9,7–218,1) |
(4,2–9,5) |
||
|
Примечания: ACCI – скорректированный по возрасту индекс коморбидности Charlson; таблица составлена авторами. |
||||
Notes: ACCI – Age adjusted Charlson Comorbidity Index; created by the authors.
Таблица 4/table 4
|
Параметры сравнения/ Parameters of comparison |
Модель, построенная с применением бинарной логистической регрессии/ Binary logistic regression model |
Модель, построенная с применением машинного обучения/ Machine learning model |
|
Чувствительность/Sensitivity Специфичность/Specificity |
78,9 % (15/19) 94,5 % (103/109) |
84,2 % (16/19) 96,3 % (105/109) |
|
Диагностическая эффективность/ Diagnostic efficiency |
92,2 % (118/128) |
94,5 % (121/128) |
|
Площадь под кривой/Area under curve |
0,918 |
0,939 |
|
Значение p/p-value |
<0,001 |
<0,001 |
|
Стандартная ошибка/Standard error |
0,039 |
0,027 |
|
95 % доверительный интервал/ 95 % Confidence Interval |
0,842–0,994 |
0,859–0,998 |
|
Коэффициент детерминации R2/ Coefficient of determination R2 |
58,6 % |
71,4 % |
|
Значимость различий (тест ДеЛонг)/ Significance of differences (DeLong’s test) |
p=0,02 |
Примечание: таблица составлена авторами.
Note: created by the authors.
Сравнение моделей прогнозирования панкреатической фистулы
Comparison of pancreatic fistula prediction models
данные 90 (70,3 %) пациентов были использованы для обучения нейросети, а 38 (29,7 %) – для тестирования прогностической модели. Модель содержала 3 слоя нейронов: входной, скрытый и выходной. Входные нейроны модели представляли собой предикторы, установленные на этапе однофакторного регрессионного анализа. Выходные – 2 возможных варианта состояния прогнозируемой переменной (0 – отсутствие ПФ, 1 – развитие ПФ в послеоперационном периоде). Наличие скрытого слоя нейронов является отличительной особенностью метода нейросетевого анализа, отражая машинную логику прогнозирования. В обучающей выборке модель совершила 8,8 % неверных предсказаний, а в тестовой – 4,9 %. В структуру прогностической модели машинного обучения включены два скрытых слоя нейронов.
На рис. 3 отражена взвешенная важность каждого параметра, включенного в нейросетевую прогностическую модель. Каждый из включенных в модель предикторов вносил приблизительно равный вклад (синаптический вес нейронов) в прогнозирование развития панкреатической фистулы.
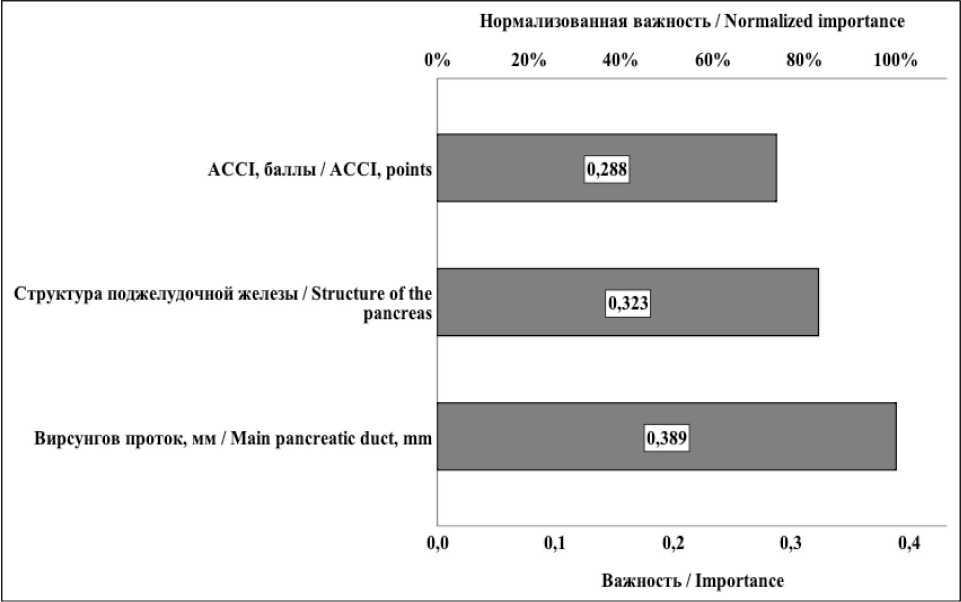
Рис. 3. Взвешенная важность параметров, включенных в прогностическую нейросетевую модель. Примечание: рисунок выполнен авторами
Fig. 3. Weighted importance of parameters included in prognostic neural network model. Note: created by the authors
Правильность анализа предиктивных моделей подтверждена результатами подгрупповых расчетов. При диаметре главного панкреатического протока менее 3 мм панкреатическая фистула развилась у 16/43 (37,2 %) больных, при диаметре вирсунгова протока 3 мм и более – у 3/85 (3,5 %) пациентов (χ2=25,6, p<0,001). При мягкой консистенции поджелудочной железы развитие панкреатической фистулы произошло у 17/34 (50 %) больных, при плотной структуре органа – у 2/94 (2,1 %) пациентов (χ2=45,3, p<0,001). При ACCI более 7 баллов панкреатическая фистула зарегистрирована у 16/46 (34,8 %) больных, при значении данного индекса 7 и менее – у 3/82 (3,7 %) пациентов (χ2=22,6, p<0,001).
Обсуждение
Летальность при ПДР в ведущих клиниках РФ и мира колеблется в интервале 2–9 % [10–13]. Клинически значимая ПФ возникает у 1/3 пациентов из группы высокого риска и ведет к смерти больного в 18–28 % случаев [14, 15]. Модели, прогнозирующие ПФ и использующие при этом алгоритмы МО, неоднократно предлагались авторами из разных стран. S.J. Yoon et al. разработали предиктивную платформу на основе МО и провели ее внешнюю валидацию. AUC модели с применением МО колебался от 0,585 до 0,672 [16]. P. Kambakamba et al. использовали МО для анализа плотности поджелудочной железы и прогнозирования ПФ. При этом AUC модели составила 0,95, чувствительность – 96 %, а точность – 98 % [17]. I.W. Han et al. предложили прогностическую модель на основе ИНС, которая учитывала 38 предикторов развития 221 ПФ
Список литературы Прогнозирование панкреатической фистулы после панкреатодуоденальной резекции с использованием машинного обучения
- Solodkiĭ V.A., Kriger A.G., Gorin D.S., Dvukhzhilov M.V., Akhaladze G.G., Goncharov S.V., Panteleev V.I., Shuinova E.A. Pankreatoduodenal'naya rezektsiya - rezul'taty i perspektivy (dvukhtsentrovoe issledovanie). Khirurgiya. Zhurnal im. N.I. Pirogova. 2023; (5): 13-21. https://doi.org/10.17116/hirurgia202305113.
- Khat'kov I.E., Domrachev S.A., Tsvirkun V.V., Izrailov R.E., Vasnev O.S., Kulezneva Yu.V., Les'ko K.A., Shchadrova V.V., Nikitin B.S., Starostina N.S., Tyutyunnik P.S., Baĭchorov M.E., Andrianov A.V., Mikhnevich M.V. Prognozirovanie pankreaticheskoi fistuly posle pankreatoduodenal'noi rezektsii s pomoshch'yu komp'yuternoi tomografii. Meditsinskaya vizualizatsiya. 2019; (1): 19-27. https://doi.org/10.24835/1607-0763-2019-1-19-27.
- Egorov S.V., Petrov R.V. Prostoi, nadezhnyi pankreatoenteroanastomoz. Khirurgiya. Zhurnal im. N.I. Pirogova. 2017; (11): 60-8. https://doi.org/10.17116/hirurgia20171160-68.
- Dalgatov K.D., Kurskov A.O., Khalbaginov A.A., Sazhin A.V. Sovremennye podkhody k pankreaticheskim anastomozam. Khirurgiya. Zhurnal im. N.I. Pirogova. 2021; (10): 81-6. https://doi.org/10.17116/hirurgia202110181.
- Singh G. Iskusstvennyi intellekt pri kolorektal'nom rake: obzor. Sibirskii onkologicheskii zhurnal. 2023; 22(3): 99-107. (in English). https://doi.org/10.21294/1814-4861-2023-22-3-99-107.
- Mel'nikov P.V., Dovedov V.N., Kanner D.Yu., Chernikovskiĭ I.L. Iskusstvennyi intellekt v onkokhirurgicheskoi praktike. Khirurgiya i onkologiya. 2020; 10(3-4): 60-4. https://doi.org/10.17650/2686-9594-2020-10-3-4-60-64.
- Yin H., Zhang F., Yang X., Meng X., Miao Y., Noor Hussain M.S., Yang L., Li Z. Research trends of artificial intelligence in pancreatic cancer: a bibliometric analysis. Front Oncol. 2022; 12: 1-13. https://doi.org/10.3389/fonc.2022.973999.
- Dindo D., Demartines N., Clavien P.A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004; 240(2): 205-13. https://doi.org/10.1097/01.sla.0000133083.54934.ae.
- Bassi C., Marchegiani G., Dervenis C., Sarr M., Abu Hilal M., Adham M., Allen P., Andersson R., Asbun H.J., Besselink M.G., Conlon K., Del Chiaro M., Falconi M., Fernandez-Cruz L., Fernandez-Del Castillo C., Fingerhut A., Friess H., Gouma D.J., Hackert T., Izbicki J., Lillemoe K.D., Neoptolemos J.P., Olah A., Schulick R., Shrikhande S.V., Takada T., Takaori K., Traverso W., Vollmer C.R., Wolfgang C.L., Yeo C.J., Salvia R., Buchler M.; International Study Group on Pancreatic Surgery (ISGPS). The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 Years After. Surgery. 2017; 161(3): 584-91. https://doi.org/10.1016/j.surg.2016.11.014.
- Kit O.I., Frantsiyants E.M., Katel'nitskaya O.V. Risk venoznykh tromboembolicheskikh oslozhnenii u bol'nykh zlokachestvennymi novoobrazovaniyami podzheludochnoi zhelezy. Sibirskii onkologicheskii zhurnal. 2022; 21(3): 24-32. https://doi.org/10.21294/1814-4861-2022-21-3-24-32.
- Kuchin D.M., Kolesnik Ya.I., Torgomyan G.G., Zagaĭnov V.E. Faktory, vliyayushchie na obshchuyu vyzhivaemost' pri protokovoi adenokartsinome golovki podzheludochnoi zhelezy. Opyt odnogo tsentra. Zlokachestvennye opukholi. 2021; 11(1): 20-8. https://doi.org/10.18027/2224-5057-2021-11-1-20-28.
- Nazarova D.V., Rasulov R.I., Zubrinskiĭ K.G., Songolov G.I. Evolyutsiya lecheniya raka bol'shogo sosochka dvenadtsatiperstnoi kishki. Sibirskii onkologicheskii zhurnal. 2021; 20(1): 141-8. https://doi.org/10.21294/1814-4861-2021-20-1-141-148.
- Bonsdorff A., Sallinen V. Prediction of postoperative pancreatic fistula and pancreatitis after pancreatoduodenectomy or distal pancreatectomy: A review. Scand J Surg. 2023; 112(2): 126-34. https://doi.org/10.1177/14574969231167781.
- Kabanov M.Yu., Glushkov N.I., Sementsov K.V., Koshelev T.E., Savchenkov D.K., Sizonenko N.A., Goloshchapova I.M. Sovremennye podkhody k profilaktike i lecheniyu posleoperatsionnykh oslozhnenii pri rake golovki podzheludochnoi zhelezy. Vestnik Natsional'nogo mediko-khirurgicheskogo Tsentra im. N.I. Pirogova. 2023; 18(2): 128-33. https://doi.org/10.25881/20728255_2023_18_2_128.
- Stoop T.F., Bergquist E., Theijse R.T., Hempel S., van Dieren S., Sparrelid E., Distler M., Hackert T., Besselink M.G., Del Chiaro M., Ghorbani P.; Collaborators. Systematic Review and Meta-analysis of the Role of Total Pancreatectomy as an Alternative to Pancreatoduodenectomy in Patients at High Risk for Postoperative Pancreatic Fistula: Is it a Justifiable Indication? Ann Surg. 2023; 278(4): 702-11. https://doi.org/10.1097/SLA.0000000000005895.
- Yoon S.J., Kwon W., Lee O.J., Jung J.H., Shin Y.C., Lim C.S., Kim H., Jang J.Y., Shin S.H., Heo J.S., Han I.W. External validation of risk prediction platforms for pancreatic fistula after pancreatoduodenectomy using nomograms and artificial intelligence. Ann Surg Treat Res. 2022; 102(3): 147-52. https://doi.org/10.4174/astr.2022.102.3.147.
- Kambakamba P., Mannil M., Herrera P.E., Müller P.C., Kuemmerli C., Linecker M., von Spiczak J., Hüllner M.W., Raptis D.A., Petrowsky H., Clavien P.A., Alkadhi H. The potential of machine learning to predict postoperative pancreatic fistula based on preoperative, non-contrastenhanced CT: A proof-of-principle study. Surgery. 2020; 167(2): 448-54. https://doi.org/10.1016/j.surg.2019.09.019.
- Han I.W., Cho K., Ryu Y., Shin S.H., Heo J.S., Choi D.W., Chung M.J., Kwon O.C., Cho B.H. Risk prediction platform for pancreatic fistula after pancreatoduodenectomy using artificial intelligence. World J Gastroenterol. 2020; 26(30): 4453-64. https://doi.org/10.3748/wjg.v26.i30.4453.
- Mu W., Liu C., Gao F., Qi Y., Lu H., Liu Z., Zhang X., Cai X., Ji R.Y., Hou Y., Tian J., Shi Y. Prediction of clinically relevant Pancreaticoenteric Anastomotic Fistulas after Pancreatoduodenectomy using deep learning of Preoperative Computed Tomography. Theranostics. 2020; 10(21): 9779-88. https://doi.org/10.7150/thno.49671.
- Ingwersen E.W., Stam W.T., Meijs B.J.V., Roor J., Besselink M.G., Groot Koerkamp B., de Hingh I.H.J.T., van Santvoort H.C., Stommel M.W.J., Daams F.; Dutch Pancreatic Cancer Group. Machine learning versus logistic regression for the prediction of complications after pancreatoduodenectomy. Surgery. 2023; 174(3): 435-40. https://doi.org/10.1016/j.surg.2023.03.012.


