Программа трансплантации печени в НИИ скорой помощи имени И.В. Склифосовского - этапы, достижения, перспективы
Автор: Новрузбеков Мурад Сафтарович, Гуляев Владимир Алексеевич, Луцык Константин Николаевич, Ахметшин Равиль Борисович, Олисов Олег Даниелович, Магомедов Кубай Магомедович, Казымов Бахтияр Исметович, Яремин Борис Иванович, Хубутия Могели Шалвович
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Общественное здоровье и здравоохранение
Статья в выпуске: 3 (45), 2020 года.
Бесплатный доступ
Реализация программы трансплантации печени в НИИ скорой помощи имени Н.В. Склифосовского имеет давнишнюю историю. За 20 лет работы центра оказана высокотехнологичная медицинская помощь методом трансплантации оказана более 700 пациентам.
Программа трансплантации печени
Короткий адрес: https://sciup.org/143172355
IDR: 143172355 | УДК: 616.36-089
Текст научной статьи Программа трансплантации печени в НИИ скорой помощи имени И.В. Склифосовского - этапы, достижения, перспективы
То cite: Novruzbekov M.S., Gulyaev V.A., Lutsyk K.N., Akhmetshin R.B., Olisov O.D., Magomedov K.M., Kazymov B.I., Yaremin B.I., Khubutiya M.Sh. Liver transplantation program at N.V. Sklifosovsky Research Institute of Emergency Medicine: stages, achievements, and outlooks H Bulletin of Medical University Reaviz. -2020. - № 3. - P. 162-173.
Предпосылки к реализации программы трансплантации печени в НИИ СП и её история
Успешной реализации программы трансплантации печени в НИИ скорой помощи им. Н.В. Склифосовского предшествовал интенсивный труд многих выдающихся учёных. В первую очередь, проблемы хирургии печени и интенсивной терапии, её критических состояний были освещены в работах школы С.С. Юдина, в частности, Б.А. Петрова, разрабатывавшего вопросы шва печени, оперативного лечения портальной гипертензии, экстракорпоральной перфузии печени в лечении её недостаточности (Э.И. Гальперин, П.А. Иванов, Е.А. Неклюдова). Колоссальный вклад в развитие экспериментальных вопросов трансплантологии внёс работавший в последние годы в НИИ СП В.П. Демихов [1].
Московский городской центр трансплантации печени в НИИ скорой помощи им. Н. В. Склифосовского был открыт по инициативе и при активном участии А.С. Ермолова и А.К. Ерамишанцева. После большой подготовительной работы 18 сентября 2000 г. выполнена первая трансплантация печени. Центр возглавляли: в 2000-2010 гг. профессор А.В. Чжао, в 2011-2012 гг. А.С. Чугунов, с 2012 по настоящее время - д-р мед. наук М.С. Новрузбеков. Врачи Центра являются высококвалифицированными специалистами, прошедшими специализацию по трансплантации печени Европы, Азии и США. хирургической работе Президент Института, в ведущих клиниках Активное участие в центра принимает академик РАН, д-р
мед. наук, профессор М.Ш. Хубутия.
Работа центра за 20 лет его существования претерпела ряд принципиальных изменений, которые коснулись как вопросов тактики, так и хирургической техники. Помимо внедрения современных методик хи- рургического лечения, коллективом центра разработан ряд оригинальных технических приёмов и подходов в лечении.
Общая характеристика пациентов в листах ожидания трансплантации печени
В листах ожидания трансплантации печени НИИ скорой помощи имени Н.В. Склифосовского состояло более 1200 человек. Если к 2011 году [2] процент выполнения трансплантаций пациентам в листе ожидания НИИ СП составлял 37 %, то в настоящее время он достигает 76 %, постоянно увеличиваясь. Борьба с летальностью в листе ожидания трансплантации печени основывается на своевременном полноценном лигировании варикознорасширенных вен пищевода, полноценной посиндромной терапии пациентов в листе ожидания, повышении доступности транс-плантологической помощи пациентам. Трансюгулярное внутрипечёночное портосистемное шунтирование выполнялось в предоперационном периоде у 2 % пациентов и, хотя его наличие достоверно не ухудшало клинических результатов, потенциальные преимущества от данного способа лечения не превышали технические сложности от выполнения оперативного вмешательства при наличии шунта в воротной вене.
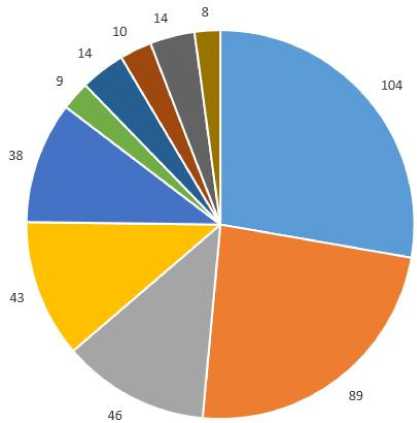
Нозологическая структура заболеваемости в листе ожидания НИИ СП претерпевает изменения (рис. 1). Уменьшается количество пациентов с хронической печеночной недостаточностью в исходе хронического вирусного гепатита С, так как подавляющее большинство пациентов своевременно проходит противовирусную терапию. Уменьшается и количество пациентов с алкогольной болезнью печени и неалкогольным стеатогепатитом. Отмечается устойчи- вый рост числа пациентов с гепатоцеллюлярным раком, чаще всего на фоне цирроза печени HCV-этиологии и алкогольной болезни печени. В настоящее время гепа тоцеллюлярный рак имеет место у 24 % пациентов, находящихся в листе ожидания трансплантации печени.
-
■ Цирроз печени в исходе гепатита В
-
■ Алкогольный цирроз печени
-
■ Цирроз печени в исходе ПСХ
Первичный билиарный цирроз печени
-
■ Аутоиммунный цирроз печени
-
■ Цирроз печени в исходе болезни Вильсон а-Коновалов а
-
■ Фульминантная печёночная недостаточнгсть
-
■ Криптогенный цирроз печени
-
■ Первичные нерезектабельные опухали печени
-
■ Болезнь Бадда-Киари
Рис. 1. Нозологическая структура пациентов, находящихся в листе ожидания трансплантации НИИ СП
Принятие решения в листе ожидания трансплантации печени НИИ СП основано на ряде принципов.
Критерии ургентности трансплантации определяются в соответствии с политиками UNOS. За время работы центра оперировано 14 пациентов, соответствовавших критерию UNOS 1А. Послеоперационная летальность составила у таких пациентов 44 %. Среднее время пребывания пациентов в ургентном листе ожидания составило 98 часов.
Вне ургентного листа критерием оценки тяжести пациента является система MELD в модификации политики UNOS 9.1.2D от января 2016 (с пересчётом на натрий и исключительные факторы). Калькулятор MELD по версии центра размещён в публичном доступе по адресу С учётом важности системы Child-Pugh и необходимости использования её для оценки в том числе нарушения белковосинтетической функции печени, она также используется в работе по листу ожидания.
Всем пациентам с гепатоцеллюлярной карциномой в обязательном порядке орга- низовывают консультацию онколога для решения вопроса о проведении bridge-терапии. Большую помощь в реализации программы трансплантации печени пациентам с гепатоцеллюлярным раком оказывают специалисты НМИЦ онкологии имени Н.Н. Блохина д-р мед. наук профессор В.В. Брёдер, в.н.с. И.А. Джанян. В настоящее время bridge-терапию получают 41 % пациентов с ГЦР в листе ожидания, невозможность проведения её определяется тяжестью состояния пациента в целом.
При оценке операбельности пациентов с ГЦР практика строгой необходимости со-тветствию какому-либо определенному критерию (Миланские, Калифорнийские критерии, критерий «ир-to-seven») не применяется. Так, по данным послеоперационной оценки среди оперированных с гепатоцеллюлярной карциномой пациентов Миланским критериям соответствует 40,2 % пациентов. Всем пациентам в обязательном порядке проводится расчёт прогноза выживаемости по Metroticket calculator [3]. Даже в случае развития позднейшего рецидива и его лечения у пациента увеличивается продолжительность жизни и её качество.
Серьезные проблемы у пациентов в предоперационном периоде возникают у пациентов с хроническим вирусным гепатитом В [4]. Во избежание реинфицирования трансплантата и развития неблагоприятных последствий пациенту периоперационно необходимо введение иммуноглобулина против гепатита В (HBIG) в дозе 24000 ЕД. Стоимость иммуноглобулина против гепатита В, доступного в РФ, при цене порядка за флакон 500 IU в 38000 рублей составляет 1 824 000 рублей, то есть сумму, превышающей квоту высокотехнологичной медицинской помощи в полтора раза. Отсутствие государственной поддержки в снабжении данным препаратом создает ограничение доступности трансплантации печени этой категории пациентов.
Среднее время пребывания пациентов в листе ожидания трансплантации печени ЦТП НИИ СП составляет 6 месяцев, что в два раза превышает соответствующее время в центрах США. Перспективной задачей представляется совершенствование математического аппарата определения приоритета выбора пациентов для уравнивания времени ожидания, в первую очередь пациентам с гепатоцеллюлярным раком и циррозами печени без злокачественных новообразований.
При включении пациентов в лист ожидания трансплантации печени жёстко ограничиваются противопоказания для того, чтобы не допускать неоправданных отказов в трансплантации печени, являющейся жизнеспасающей операцией [6]. Так, трансплантация печени выполнялась двум пациентам с ВИЧ-инфекцией, соответствующим критериям AASLD [7]. Не расценивается в качестве противопоказания к трансплантации наличие у пациента тромбоза воротной вены степеней lll-IV по Yerdel. В подавляющем числе случаев удаётся достичь перфузии портального русла трансплантата за счёт выполнения тромбинтим-эктомии из воротной вены или шунтирующей операции. Была включена в лист ожидания и успешно оперирована и пациентка с зеркальным расположением органов, - состоянием, ранее тавшимся противопоказанием ниютрансплантации.
внутренних также счи-к выполне-
Особенности донорского этапа трансплантации печени
Принципиальным подходом к снижению числа первично нефункционирующих трансплантатов печени в Центре трансплантации печени НИИ скорой помощи имени Н.В. Склифосовского является использование рутинной биопсии трансплантатов печени [5]. Крупнокапельный стеатоз, наблюдаемый не более чем в 50 % гепатоцитов трансплантата, не связан с увеличением числа центролобулярных некрозов и степенью тяжести реперфузионных повреждений, поэтому такие органы могут быть использованы. Мелкокапельный стеатоз не влияет ни на тяжесть реперфузионных повреждений, ни на последующие функциональные нарушения, и в оценке качества донорского органа участия не принимает. Результаты биопсии донорских органов используются также для определения дифференцированной логистической стратегии. При большей выраженности крупнокапельного стеатогепатоза принимаются меры по критическому уменьшению времени холодовой ишемии. Время холодовой ишемии трансплантата варьирует от 180 до 810 минут, средние показатели продолжительности холодовой ишемии у пациентов центра составляют 444 ± 108 минут.
Для оценки функциональных резервов планируемой к изъятию донорской печени в центре используется клиренс-тест с индоцианином зеленым (ИЦЗ). Заблаговременно до начала выполнения процедуры сохранения печени донору выполняют инъекцию красителя ИЦЗ из расчета 0,5 мг/кг массы тела. Оценивают показатели скорость плазменной элиминации (СПЭ) ИЦЗ (%/мин) и остаточную концентрацию (ОК) ИЦЗ на 15 мин исследования. ИЦЗ - водорастворимый инертный трикарбоцианин, который после внутривенного введения связывается с альбумином плазмы и селективно фиксируется гепатоцитами. Элиминация ИЦЗ происходит в неизмененном виде АТФ-зависимой транспортной системы через желчевыводящие пути. Таким образом, экскреция ИЦЗ в желчь отражает экскреторную функцию печени и её энергетический статус.
Необходимо считать перспективным внедрение функциональной оценки печеночного трансплантата во время выполнения ему машинной перфузии, которая станет возможной при внедрении в работу перфузионного машинного сохранения донорских органов.
Ещё одним направлением развития является более широкое использование сплит-резекции трансплантата печени. Для её реализации коллективом центра разработана оригинальная методика выполнения ex situ компьютерной томографии донорского органа с последующей трёхмерной компьютерной реконструкцией и построением расчётной плоскости выполнения split-резекции (рис. 2). Данную методику удалось реализовать только при активном участии в.н.с. Р.Ш. Муслимова.
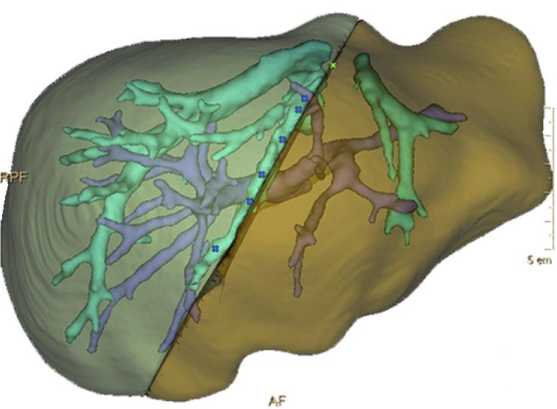
Рис. 2. Плоскость предполагаемого деления печени при выполнении split-резекции донорской печени
Технические особенности выполнения гепатэктомии
-
и кавальной реконструкции в центре
С 2012 года в подавляющем большинстве случаев при выполнении гепатэктомии и последующей кавальной реваскуляризации печёночного трансплантата используется техника, предложенная Jacques Belghiti (2012), с сохранением позадипечёночного отдела нижней полой вены. В центре данная методика претерпела ряд усовершенствований, которые внедрены с 2013 года. Модифицированная методика поэтапного выполнения гепатэктомии и кавальной реконструкции описана в таблице 1.
В то же время в случае опухолевой или паразитарной инвазии в нижнюю полую вену, наличия распространённого тромбоза нижней полой вены, наличия распространяющихся в НПВ трансюгулярных шунтов определяют необходимость выполнения гепатэктомии по классической методике, разработанной Т.Е. Starzl. В ряде случаев возможно выделение НПВ в пределах перикарда с последующим выполнением кавального анастомоза с правым предсердием. Внедрение указанной методики позволило снизить время вторичной тепловой ишемии до 44,6 ± 2 минут.
Таблица 1. Модифицированная методика выполнения гепатэктомии и кавальной реконструкции в НИИ СП имени Н.В. Склифосовского
•
•
•
•
•
•
•
•
Рассечение связочного аппарата печени по принципу слева-направо (серповидная связка - левая треугольная связка - малый сальник - правая треугольная связка)
Диссекция элементов ГДС по принципу слева-направо (левая печеночная артерия - общий желчный проток - правая печеночная артерия - воротная вена)
Диссекция элементов ГДС под постоянным мануальным контролем, позволяющая моментально осуществить Pringle-маневр
Мобилизация правой доли печени и отделение ее от НПВ с активным использованием автоматических клипаторов и биполярной коагуляции
Туннелизация пространства между правой и средней печеночными венами
В случае гипертрофии и деформации Si выполнение гепатэктомии через паренхиму I сегмента под зажимом с последующим иссечением тканей
Применение нити-держалки на Si донорской печени для увеличения угла обзора при формировании кавакавального анастомоза бок-в-бок
Применение нити-держалки на середине линии анастомоза, противоположной от хирурга
Восстановление портального кровотока
Наличие тромбозов воротной вены, в той или иной степени присутствовавших у 15,2 % в листе ожидания трансплантации печени, осложняет выполнение трансплантации и делает его сложным. Хирургическая тактика в центре при тромбозах воротной вены определяется выраженностью его по классификации М. Yerdel. При тромбозах I и II типа в качестве основного метода хирургической коррекции воротного кровотока использовали тромбэктомию. С этой целью, в процессе агепатического периода выделяли на достаточном протяжении основной ствол воротной вены реципиента, проксимальный отдел её ближе к головке поджелудочной железы пережимали Г-образным зажимом. Стенки воротной вены захватывали тремя атравматическими пинцетами DeBakey, таким образом разбортовывая их. Лопаточкой для эндартерэктомии начинали отделять тромб от стенки воротной вены по всему периметру. По мере отделения тромба от стенки вены выворачивали освободившиеся участки воротной вены по типу «чулка» - эверсионная тромбинтимэктомия. При тромбозах III степени для осуществления полноценного доступа к магистральным отделам спланхни- ческой венозной системы выделяли основной ствол воротной вены, выполняли мобилизацию головки поджелудочной железы по Кохеру, обнажали проксимальный сегмент верхней брыжеечной вены и ее кон-флюенса с селезеночной веной ниже брыжейки поперечной ободочной кишки. Воротную и верхнюю брыжеечные вены брали на «держалки» и выполняли полную сосудистую изоляцию. В ряде наблюдений, когда ретроградного доступа оказывалось недостаточно, рассекали ствол верхней брыжеечной вены и выполняли дополнительную тромбэктомию из данного доступа. Если в связи с протяженностью тромбоза последняя была неосуществима, выполняли резекцию воротной вены вместе с тромбом и ее замещение, как правило, донорской подвздошной веной. Процедура тромбэктомии не оказывает влияние на выживаемость пациентов в раннем и отдаленном послеоперационном периоде, что позволяет расширить показания к трансплантации печени у пациентов с тромбозами воротной вены без негативного влияния на выживаемость пациентов.
Тромбоз печёночных вен и его коррекция
Послеоперационное нарушение оттока по печёночным венам и острый синдром Бадда-Киари вызваны сдавлением печени и НПВ вен печени, длинной культей надпечёночного отдела полой вены донорской печени, неправильным расположением пече ни или же «чересчур» короткой культёй надпечёночного отдела нижней полой вены, деформирующей устье собственных печёночных вен. В случае необходимости коррекции венозного оттока после тромбоза печёночных вен в центре применяется оригинальная методика (рис. 3).
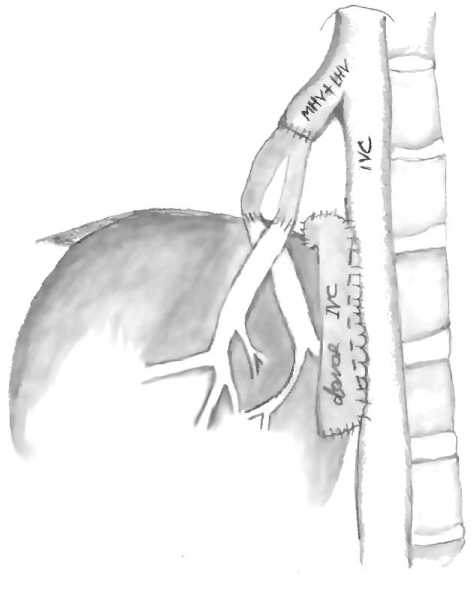
Рис. 3. Методика реконструкции при тромбозе печёночных вен
После релапаротомии максимально выделяли ушитую культю надпечёночного отдела нижней полой вены трансплантата печении, пережимали зажимом и снимали все швы. Открытую культю надпечёночного отдела нижней полой вены печени донора анастомозировали с фрагментом бифуркации нижней полой вены конец в конец. Для реваскуляризации использовали бифуркационный донорский венозный кондуит из развилки общей подвздошной вены. Правую браншу кондуита вшивали в устье правой печёночной вены реципиента, а левую браншу в общее устье левой и средней печёночных вен. Зажимом Сатинского пережимали кавальный анастомоз и зажимами ДеБейки пережимали правую или левую браншу сосудистого кондуита в зависимо сти от расположения тромба и выполняли венотомию. Через полученные отверстия с помощью катетера Фогарти удаляли тромбы из печеночных вен трансплантата. В зависимости от расположения тромба выполняли венотомию одной из бранш и с помощью катетера Фогарти удаляли тромбы из собственных вен печени. После получения хорошего кровотока отверстия на кондуите ушивали и снимали зажимы с устьев правой, левой и средней печёночных вены и кава-кавального анастомоза. Восстановленный отток крови как через кава-кавальный анастомоз, так и по вновь полученной реконструкции надпечёночного отдела нижней полой вены обеспечивал хороший кровоток и меньше был подвержен разным изменениям положения трансплан- тэта в брюшной полости после операции, так и деформациям устьев собственных вен трансплантата печени.
При тромбозе одной из печеночных вен трансплантата печени выделяли изолировано эту вену в кавальных воротах донорского отдела, выполняли тромбэктомию, затем использовали одну короткую вставку, полученную из подвздошной вены донора, которую анастомозировали или НПВ или одной из культей печночных вен реципиента. Таким образом, дополнительная реконструкция надпечёночного отдела НПВ трансплантата печени и открытый кава-кавальный анастомоз обеспечивали более надёжный кровоток даже при перегибе и пережатии первичного анастомоза. Основное преимущество представленного метода состоит в том, что он позволяет выполнять прямую тромбэктомию из собственных вен трансплантата печени, что невозможно сделать ни при какой иной методике.
Артериальная реконструкция при трансплантации печени
Артериальное русло печени в норме обладает значительной вариабельностью. При трансплантации печени варианты строения артерий встречаются чаще во второй степени, так как шанс встретить артериальную анатомию становится выше. Только у 29 % пациентов имелась «стандартная» хрестоматийная анатомия артерий. В случае множественной анатомии артериальных стволов возникала необходимость выполнения реконструкции на back table. Основной задачей при проведении артериальной реконструкции на этапе «back-table» было стремление к формированию единого источника кровоснабжения. С этой целью использовали левую желудочную, селезеночную или гастродуоденальную артерии, которые анастомозировали с абберантными или дополнительными артериями трансплантата. К артериализа-ции печеночного трансплантата приступали тотчас после венозной реперфузии и восстановления параметров гемодинамики, нарушенных в результате реперфузионного синдрома. При наличии благоприятных условий артериальный анастомоз стремились формировать с использованием воссозданной Каррелевской площадки, которую получали несколькими путями: формированием объединенной площадки из собственной печеночной артерии путем рассечения правой и левой долевых артерий реципиента, формированием объединенной площадки из общей печеночной артерии путем рассечения артерии на уровне отхождения гастродуоденальной артерии и перевязкой ее дистального участка. Аналогичным образом, тогда когда это было безопасно и технически осуществимо, формировали артериальную площадку со стороны печеночной артерии трансплантата. В печеночную артерию донора вводили раствор гепарина, после чего донорскую часть артерии пережимали мягким зажимом ДеБейки. Артериальный анастомоз формировали с использованием увеличительной оптики, при 2-4-х кратном увеличении, с использованием микрохирургического инструментария и не рассасывающейся полипропиленовой нити Prolene 7/0 или 8/0. В процессе формирования анастомоза артерию реципиента орошали раствором папаверина. При отсутствии соответствующей возможности (выраженный спазм, неудовлетворительное состояние собственного артериального русла реципиента, анатомические особенности донорской печени) артериальный анастомоз вынужденно формировали по типу конец-в-конец или выполняли непосредственные анастомозы с аортой.
Особенности билиарной реконструкции
В качестве способа билиарной реконструкции использовали билиобилиарный (ББА) анастомоз конец-в-конец у 85,9 % пациентов или гепатикоеюноанастомоз на петле тонкой кишки, изолированной по Ру у 14,1 %. При формировании билиобилиар-ного анастомоза предпочтение отдаётся наружному непрерывному шву. По наблю- дениям центра техника формирования анастомоза достоверно не влияла на частоту стенозов ББА, составляющую в среднем 9,8 %. Совершенствование техники формирования билиарной реконструкции, техники изъятия печени и артериальной реконструкции привели к снижению частоты билиарных осложнений в последние годы до 4,7 %. Пациенты с билиобилпарными стриктурами подвергались активному эндоскопическому лечению. Методы лечебной эндоскопии включали в себя диагностическую эндоскопическую ретроградную холангиографию (ЭРХГ), эндоскопическую папиллосфинктеротомию (ЭПСТ), билио-дуоденальное стентирование, назобилиар-ное дренирование, баллонную дилатацию. После селективной катетеризации желчных путей производилась ЭРХГ и окончательная оценка локализации и протяженности стриктуры. При невозможности ретроградной канюляции супрастенотического отдела гепатикохоледоха, выполнялось антеградное дренирование желчных путей, после чего в двенадцатиперстную кишку проводилась струна-проводник, которая захватывалась полипэктомической петлей и выводилась через канал эндоскопа наружу (методика «Rendez Vous»). У 32 % пациентов с анастомотическими стриктурами эндоскопических методов лечения оказалось недостаточно и пациенту была выполнена гепатикоеюностомия.
Ретрансплантация печени
За время работы центра ретрансплантация печени была выполнена у 4,7 %. Специфика работы центра трансплантации печени в Институте Склифосовского как стационара скорой медицинской помощи обусловила факт выполнения ретрансплантации печени срочной пациентке, поступившей с явлениями тяжёлой дисфункции трансплантата печени, оперированной ранее в другом центре трансплантации. За время работы центра имелся только один случай первично нефункционирования трансплантата.
При повторной трансплантации как от хирургов, так и анестезиологической бригады требуется еще более внимательный и осторожный подход, поскольку риск кровотечения, нестабильной гемодинамики, инфицирования повышается в разы. При релапаротомии в ранние сроки после первичной операции выделение элементов ГДС, нижней полой вены, непосредственно ге- патэктомия не
представляются сложными.
В ранние сроки более важным оказывается фактор генерализованной инфекции и по-лиорганной недостаточности, развивающихся к моменту предоставления донорского органа, поскольку результаты ретрансплантации будут в этом случае крайне неудовлетворительными.
Если показания к повторной трансплантации возникают в более поздние сроки в виду возврата заболевания, развития неанастомотических стриктур вследствие артериальных проблем, то состояние пациента конечно более стабильное. Однако, за счет выраженности спаечного процесса в брюшной полости особенно так называемого «перигепатита» выделение печени из ложа оказывается крайне затруднительным. Это обстоятельство требует от хирурга решительных действий, поскольку прецизионное выделение печени приведет как к удлинению операции, так и большей потери крови. В случае если первичная имплантация печени проводилась по типу кавального анастомоза бок в бок, то выделение ретро-печеночного отдела НПВ не представляется затруднительным, поскольку ранее были перевязаны на этапе «back-table» часть коротких вен печени и мобилизована НПВ донора. Боковое отжатие ретропеченочного отдела НПВ становится при ретрансплантации более удобным, чем при первичной трансплантации и выполнение повторной имплантации проводится бок в бок ретропеченочного отдела НПВ донорской печени в предыдущий донорский фрагмент НПВ. Выполнение анастомоза воротной вены аналогично первичной трансплантации. Выполнение же артериального анастомоза представляет некоторые трудности, поскольку или приходится прибегать к более проксимальному выделению артерииреци-пиента или же выполнять анастомоз непосредственно с аортой. Выполнение билиарной реконструкции чаще всего по типу БДА. В противном случае риск стриктур и несостоятельности крайне высок.
Особенности проводимой иммуносупрессивной терапии
Индукционная иммуносупрессия в центре проводится базиликсимабом в дозе 20 мг внутривенно на 0 и 4 сутки. Очевидно, off label характер назначения данного препарата, с соответствие с инструкцией по медицинскому применению в РФ использующийся только при трансплантации почки, должен быть легализован.
Основным препаратом для поддерживающей иммуносупресии при трансплантации печени в Институте Склифосовского является такролимус как в пролонгированной форме, так и в стандартной. Целевая концентрация препарата составляет 4-6 нг/мл. В качестве второго компонента используются микофенолаты или азатиоприн, отменяемые к 6 месяцу. У пациентов с острой почечной недостаточностью, предшествующими злокачестенными новообразованиями назначали в качестве второго компонента поддерживающей терапии эверолимус с целевой концентрацией 3-4 нг/мл. Третий компонент иммуносупрессивной терапии (метилпреднизолон) назначали в случае наличия у пациентов аутоиммунных заболеваний как причины развития поражения печени.
Для осуществления реверсивной терапии применяли пульс-терапию метилпреднизолоном, а также введение антитимоци-тарного глобулина.
Перспективным представляется исследование возможности последующей отмены иммуносупрессии у части пациентов, у которых развилась операционная толерантность, однако данный вопрос требует проведения дальнейших исследований.
Результаты работы центра и выживаемость
Общие данные по выживаемости пациентов представлены на рисунке 4.
Ранняя летальность не превышает в настоящее время 5 %. Необходимо отметить, что данный показатель является управляемым - он имеет более низкое значение в центрах низкого риска, не выполняющих трансплантации ургентным пациентам, пациентам с гепатоцеллюлярной карциномой вне Миланских критериев, пациентов с высокой степенью MELD.
Анализируя нозологические предикторы выживаемости, нужно подчеркнуть, что пятилетняя выживаемость реципиентов с циррозами в исходе алкогольной болезни печени, хроническими вирусными гепатитами на фоне противовирусной терапии была наилучшей и достигала 90-92 %. Традиционно наиболее сложная в плане выживаемости категория пациентов - со злокачественными новообразованиями. Пятилетняя выживаемость в этой группе составляет 67 %, что соответствует данным крупных центров, оперирующих пациентов вне миланских критериев операбельности.
Ранние осложнения трансплантации печени представлены внутибрюшными кровотечениями у 10,6 % пациентами, тромбозами артерий у 2,6 % пациентов. Тромбоз воротной вены отмечался у 5 % пациентов, ранние билиарные осложнения у 10,2 %. Острая почечная недостаточность, потребовавшая заместительной почечной терапии, развилась у 23,2 % пациентов после трансплантации. Нередкими были и лёгочные осложнения - пневмония у 21,4 % пациентов, гидроторакс у 10,2 %. Наличие предшествовавших поражений ЦНС, длительность печёночной энцефалопатии, нейротоксическое действие ингибиторов кальциневрина, общее растормаживающее действие глюкокортикостероидов приводит к развитию различной выраженности психозов (у 9,9 % пациентов), явлений периферических невритов у 2 % пациентов. Поздние осложнения, оказывающие влияние на исход, связаны с влиянием иммуносупрессивной терапии, инфекционными осложнениями, прогрессированием исходного заболевания. Эпизоды острого отторжения отмечались у 6,6 % пациентов, а обострение хронической цитомегаловирусной инфекции у 7,4 %, в большей части протекавшей бессимптомно.
Survival Function
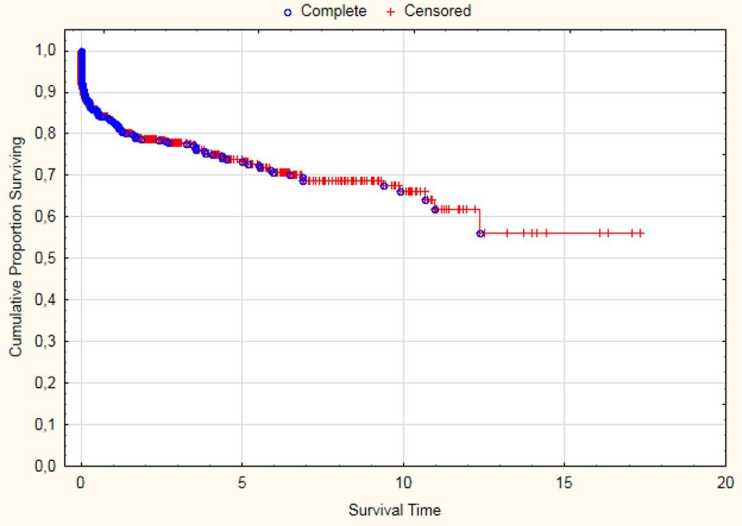
Рис. 4. Общая отдалённая выживаемость реципиентов печени, оперированных в Институте Склифо совского
Управление поздней выживаемостью представляется важной задачей, которую можно достичь в результате комплексной оценки состояния здоровья пациентов и управления причинами снижения выживаемости. Служба трансплантации органов Москвы должна замыкать полный техноло гический цикл, иметь единую логику организации и стратегию. Основой ее работы должно быть не достижение ранних коли чественных результатов, а достижение важнейшей цели - повышение доступности, качества и результативности медицинской помощи методом трансплантации.
Список литературы Программа трансплантации печени в НИИ скорой помощи имени И.В. Склифосовского - этапы, достижения, перспективы
- Ivanov Р.A. Istoricheskie predposylki k razvitiyu transplantacii pecheni v Rossii // Transplantologiya. - 2009. -№ 2. - S. 54-56. DOI: 10.23873/2074-0506-2009-0-2-54-56
- Chzhao A.V. Transplantaciya pecheni v Nil skoroj pomoshi im. N.V. Sklifosovskogo // Transplantologiya. - 2011. - № 1. - S. 65-67. 10.23873/2074-0506-2011 -0-1 -65-67 DOI: 10.23873/2074-0506-2011-0-1-65-67
- Mazzaferro V., Sposito C., Zhou J, et al. Metroticket 2.0 Model for Analysis of Competing Risks of Death After Liver Transplantation for Hepatocellular Carcinoma. Gastroenterology. 2018; 154(1 ): 128-139. DOI: 10.1053/j.gastro.2017.09.025
- Dindoost P., Jazayeri S.M., Alavian S.M. Hepatitis В immune globulin in liver transplantation prophylaxis: an update. Hepat Mon. 2012;12(3):168-176. DOI: 10.5812/hepatmon.832
- Morfofunkcionalnaya ocenka transplantatov pecheni, poluchennyh ot standartnyh donorov i donorov s rasshirennymi kriteriyami ocenki / M.Sh. Hubutiya, L.N. Zimina, I.E. Galankina i dr. // Transplantologiya. - 2018. - № 10 (2). -S. 87-97. DOI: 10.23873/2074-0506-2018-10-2-87-97
- Klinicheskij protokol vyyavleniya i obsledovaniya pacientov s pokazaniyami k transplantacii pecheni v regionah / M.S. Novruzbekov, B.l. Yaremin, A.A. Mironov i dr. // Vestnik medicinskogo instituta "Reaviz": reabilitaciya, vrach i zdorove. - 2019. - № 3 (39). https://cyberleninka.ru/article/n/klinicheskiy-protokol-vyyavleniya-i-obsledovaniya-patsientov-s-pokazaniyami-k-transplantatsii-pecheni-v-regionah (data obrash-eniya: 15.05.2020).
- Evaluation for Liver Transplantation in Adults: Practice Guideline by the AASLD and the AST (Enhanced Navigation). 2000
- Kotelnikov G.P., Kolsanov A.V., Yaremin B.l. Principy upravleniya klinicheskim ishodom v transplantacii - regionalnaya model // Transplantologiya. - 2017. - № 9 (3). - S. 264-267. DOI: 10.23873/2074-0506-2017-9-3-264-267
- Novruzbekov M.S., Olisov O.D. Sosudistye oslozhneniya posle ortotopicheskoj transplantacii pecheni // Transplantologiya. - 2017. - № 9 (1). - S. 35-50. DOI: 10.23873/2074-0506-2017-9-1-35-50
- Ot konservacii k apparatnoj perfuzionnoj reabilitacii donorskih organov / B.l. Yaremin, A.A. Mironov, V.V. Grebennikov i dr. // Vestnik medicinskogo instituta "Reaviz": reabilitaciya, vrach i zdorove. - 2017. - № 5 (29). URL: https://cyberleninka.ru/article/n/ot-konservatsii-k-apparatnoy-perfuzionnoy-reabilitatsii-donorskih-organov (data obrasheniya: 20.05.2020)


