Прогрессирование фибрилляции предсердий после неэффективной первичной процедуры радиочастотной изоляции легочных вен: рандомизированное сравнение повторной катетерной аблации и медикаментозного метода лечения
Автор: Лосик Денис Владимирович, Романов Александр Борисович, Шабанов Виталий Викторович, Байрамова Севда Афгановна, Якубов Акмаль Абдусаматович, Стенин Илья Геннадьевич, Покушалов Евгений Анатольевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 2 т.19, 2015 года.
Бесплатный доступ
Введение Лечение фибрилляции предсердий (ФП) антиаритмическими препаратами остается первой линией терапии. Радиочастотная аблация - альтернативный метод лечения, однако при рецидивах ФП после оперативного вмешательства пациенту приходится принимать антиаритмические препараты. Цель исследования -сравнение эффективности антиаритмической терапии и повторной аблации у пациентов с неэффективной первичной радиочастотной аблацией фибрилляции предсердий. Материал В проспективное рандомизированное исследование включены 154 пациента с сохраняющимися пароксизмами и методы ФП, которые через 3 месяца после первоначальной радиочастотной аблации рандомизированы на 2 группы: антиаритмическая терапия (I группа, n = 77) и повторная радиочастотная аблация (II группа, n = 77). Период наблюдения составил 3 года. Нарушения ритма оценивались с помощью имплантируемого кардиомонитора. Результаты В конце периода наблюдения 18 (23%) пациентов из I группы и 3 (4%) пациентов из II группы имели персистирующую форму ФП или процент ФП более 30 по сравнению с дооперационными данными (р
Фибрилляция предсердий, устройство непрерывного мониторирования экг, повторная радиочастотная изоляция легочных вен, антиаритмическая терапия
Короткий адрес: https://sciup.org/142140673
IDR: 142140673 | УДК: 616.12-008.313.2-089.168
Текст научной статьи Прогрессирование фибрилляции предсердий после неэффективной первичной процедуры радиочастотной изоляции легочных вен: рандомизированное сравнение повторной катетерной аблации и медикаментозного метода лечения
Фибрилляция предсердий (ФП) – одно из наиболее часто встречающихся нарушений сердечного ритма в общей популяции. При длительном анамнезе данная аритмия приводит к ухудшению гемодинамики, снижению толерантности к физической нагрузке и ухудшению качества жизни пациентов. По данным Фра-
Сравнительная характеристика пациентов обеих групп
|
Показатель |
Антиаритмическая терапия |
Повторная РЧА |
р |
|
Возраст, лет |
56±7 |
57±7 |
0,60 |
|
Пол (м/ж), n |
59/18 |
56/21 |
0,58 |
|
АГ, n (%) |
29 (38) |
24 (31) |
0,39 |
|
СД, n (%) |
7 (9) |
9 (12) |
0,59 |
|
Перенесенное ОНМК, n (%) |
6 (8) |
5 (6) |
0,75 |
|
ФВ ЛЖ, % |
58±5 |
57±6 |
0,38 |
|
Продолжительность ФП, лет |
4,2±2,1 |
4,7±1,9 |
0,09 |
|
Кол-во ААП до включения, n |
1,6±0,9 |
1,4±0,8 |
0,42 |
|
ХОБЛ, n (%) |
2 (1) |
0 |
0,32 |
|
Поражение коронарного русла, n (%) |
10 (13) |
8 (10) |
0,46 |
|
Гиперлипидемия, n (%) |
14 (18) |
17 (22) |
0,55 |
|
Индекс массы тела, кг/м2 |
28±6 |
28±5 |
0,83 |
|
Курильщики, n (%) |
42 (55) |
38 (49) |
0,52 |
|
CHADS2 score, баллы |
0,6±0,9 |
0,6±0,9 |
0,65 |
|
HATCH score, баллы |
0,5±0,8 |
0,4±0,8 |
0,42 |
|
Процент ФП, по данным Reveal, % |
15,6±5,2 |
14,2±4,9 |
0,11 |
|
Время до включения в исследование, мес. |
6,8±2,2 |
7,4±2,1 |
0,12 |
|
СД – сахарный диабет; ОНМК – острое нарушение мозгового кровообращения |
|||
мингемского исследования, распространенность ФП достигает 0,5% у пациентов в возрасте 50–59 лет, 4% – у пациентов старше 60 лет и до 15% у пациентов старше 70 лет [1].
В настоящее время разработаны методики интервенционного лечения ФП с использованием радиочастотной катетерной аблации (РЧА) [2–4]. Тем не менее средняя эффективность операции, по данным некоторых авторов, составляет от 45 до 75% [3], а с учетом количества повторных процедур – от 60 до 80%. Однако в 20–40% случаев процедура остается неэффективной. Рекомендаций, регламентирующих ведение пациентов с рецидивами ФП в подобных ситуациях, нет. В ряде случаев выполняется повторная процедура [6], особенно при ятрогенном левопредсердном трепетании, которое составляет, по разным данным, от 2 до 31% [7, 8]. Электрическая реконнекция одной или более легочных вен (ЛВ) определяется у пациентов с повторной аблацией ФП после неэффективной первичной процедуры [9]. Однако вопрос о повторном назначении антиарит-мической терапии (ААТ) или выполнении повторной процедуры радиочастотной аблации остается открытым. На сегодняшний день отсутствуют клинические маркеры и предикторы, которые могут указывать на наиболее целесообразный подход для лечения пациентов с рецидивом ФП.
Большинство исследователей в качестве показателя эффективности лечения ФП оценивают свободу от аритмии [9, 10]. Однако естественное течение ФП зачастую прогрессирует: в начале аритмия носит ма-лосимптомный характер, затем возникают более продолжительные симптомные пароксизмы и далее ФП приобретает персистирующую и длительно персистирующую формы.
Цель исследования: оценить эффективность медикаментозного метода лечения и повторной катетерной аблации в предотвращении прогрессирования ФП после неэффективной первичной процедуры радиочастотной изоляции легочных вен (ИЛВ) у пациентов с пароксизмальной формой ФП с использованием непрерывного мониторирования ЭКГ.
Материал и методы
Дизайн исследования
В период с 2009 по 2011 г. в одноцентровое проспективное рандомизированное исследование вошли 154 пациента после неэффективной первичной процедуры ИЛВ. Неэффективность первой процедуры оценивалась по истечении трехмесячного «слепого» периода, когда пароксизмы ФП сохранялись и были подтверждены данными устройства непрерывного мониторирования ЭКГ. Пациентов рандомизировали на две группы: в I группе (контрольная) продолжалась ААТ препаратами I–III классов согласно классификации Vaughan-Williams, во II группе (тестируемая) выполня- лась повторная ИЛВ. После включения в исследование пациенты наблюдались в течение 3 лет с помощью устройства непрерывного мониторирования ЭКГ.
Пациенты с низкой фракцией выброса (ФВ), признаками персистирующей ФП, диаметром левого предсердия более 6 см не включались в исследование. Сравнительная характеристика обеих групп пациентов представлена в таблице. У пациентов оценивались риски тромбоэмболических осложнений при помощи шкалы CHADS2 score и риск прогрессирования ФП – с использованием HATCH score [11]. Данная шкала оценивает риск возникновения прогрессирования ФП до персистирующей или постоянной форм на основе наличия у пациентов следующих признаков: артериальная гипертензия (АГ) – 1 балл, возраст старше 75 лет – 1 балл, инсульт или транзиторная ишемическая атака (ТИА) – 2 балла, хроническая обструкция легких (ХОБЛ) – 1 балл и хроническая сердечная недостаточность (ХСН) оценивается в 2 балла. При более 3 баллов риск прогрессирования ФП считается высоким. В среднем в обеих группах этот показатель составил 0,5±0,7 балла.
Первичной конечной точкой служило прогрессирование ФП по данным устройства непрерывного мониторирования ЭКГ. Критерием достижения конечной точки считалось развитие персистирующей формы ФП у пациентов в обеих группах (продолжительность ФП ≥ 7 суток или процент ФП <30 по данным устройства непрерывного мониторирования ЭКГ, которое расценивались как прогрессирование ФП). Вторичными точками в исследовании считались: свобода от ФП после повторной радиочастотной изоляции ЛВ (время до возникновения первого пароксизма), безопасность обоих методов (побочные действия препаратов и осложнения, связанные с процедурой, в том числе и ятрогенные аритмии), выявление предикторов прогрессирования ФП.
Повторная процедура радиочастотной изоляции легочных вен
Пациентам, рандомизированным в группу повторной радиочастотной аблации, перед процедурой выполнялась чреспищеводная эхокардиография (ЧП ЭхоКГ) для исключения предсердного тромбоза и трансторакальная ЭхоКГ – для исключения структурной патологии сердца. Пациентам также проводилась селективная коронарография для исключения гемодинамически значимых поражений коронарного русла при наличии факторов риска развития атеросклероза.
Пациентам выполнялась транссептальная пункция, после чего в левое предсердие помещался диагностический катетер Lasso (Biosense Webster) для оценки сохранности изоляции ЛВ после первой процедуры. Затем, под контролем диагностического катетера Lasso, с помощью аблационного катетера NaviStar (ThermoCool, Biosense-Webster Inc., Diamond Bar, CA) в местах неполной изоляции (прорывов) производилась реаблация. Характеристики радиочастотной энергии: температура 43 °С, мощность 35 W (на задней стенке левого предсердия мощность уменьшалась до 30 W), скорость орошения во всех случаях составляла 17 мл/мин. Каждое радиочастотное воздействие продолжалось не более 40 сек, до тех пор пока амплитуда на аблационном катетере не уменьшалась до 80% от исходного значения. После этого при помощи стимуляции с катетера Lasso и диагностического катетера в коронарном синусе подтверждалась изоляция всех легочных вен.
Антиаритмическая терапия
В контрольной группе ААТ проводилась согласно современным рекомендациям по лечению ФП. В большинстве случаев к моменту включения в исследование пациенты уже принимали ААТ, которая была неэффективной. Таким образом, с учетом эффективности предыдущей терапии в 68% случаев назначены ААП I класса, согласно классификации Vaughan-Williams (пропанорм, 579±205 мг/сут). В 11% случаев пациенты принимали ААП II класса, согласно упомянутой выше классификации (бета-блокаторы, 68±42 мг/сут). В 21% случаев использовались ААП III класса с бета-блоки-рующим эффектом, а именно соталол в средней дозе 210±76 мг/сут. После неэффективности данных препаратов 68 пациентам (88%) назначен кордарон – препарат III класса в средней дозе 287±112 мг/сут. В целом дозы АПП не превышали среднетерапевтических. При каждом визите помимо эффективности препаратов оценивалось наличие побочных действий, которые расценивались как осложнения приема медикаментозного лечения. В ряде случаев пропанорм использовался как «таблетки в кармане» только для купирования приступов ФП в дозе 300–450 мг одномоментно. У 6 пациентов пропанорм применялся в комбинации с бета-блокаторами для усиления антиаритмического эффекта.
Устройство непрерывного мониторирования ЭКГ
Устройство непрерывного мониторирования ЭКГ автоматически рассчитывает процент ФП относитель-
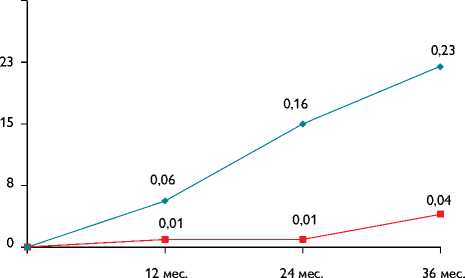
Рис. 1. Сравнительные результаты достижения конечной точки в обеих группах
ААТ
РЧА
Рис. 2. Сравнительная оценка процента фибрилляции предсердий за период наблюдения 36 мес.
но нормального синусового ритма – так называемую «нагрузку» ФП за исследуемый период. Во время визита можно оценить процент ФП за исследуемый период: чем больше параметр, тем более вероятно, что пациент имеет частые и продолжительные пароксизмы фибрилляции предсердий и склонность к прогрессированию нарушения ритма.
В исследовании для оценки прогрессирования фибрилляции предсердий и влияния предикторов на увеличение процента ФП мы использовали именно этот параметр. Процент ФП <30 и продолжительность фибрилляции предсердий <7 сут. при опросе считались конечной точкой исследования.
Статистический анализ
Объем выборки не оценивался в связи с отсутствием подобных исследований. Большинство результатов представлено как средние значения, абсолютные числа и процентные отношения. Сравнение количественных характеристик оценивалось с помощью t-критерия Стьюдента или ANOVA. Для сравнения качественных характеристик пациентов использовался метод χ 2. Метод Каплана – Майера применялся для оценки эффективности, где конечной точкой являлась свобода от ФП у пациентов обеих групп. Достоверность различий между обеими группами рассчитывалась при помощи Log-rank test. Методом логистической регрессии оце-
Месяцы
Пациенты с риском
|
ААТ |
77 |
43 |
25 |
21 |
15 |
13 |
9 |
|
РЧА |
77 |
62 |
58 |
53 |
49 |
46 |
45 |
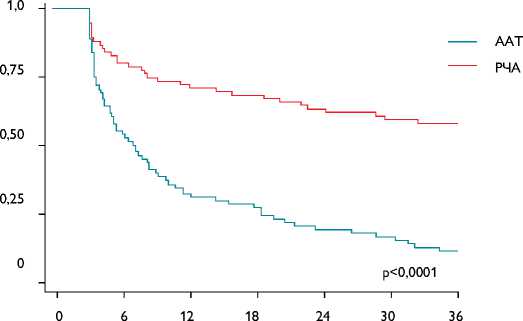
Рис. 3. Отдаленные результаты эффективности радиочастотной аблации (кривая Каплана – Майера)
нивались значимость предикторов прогрессирования ФП. Все различия считались достоверными при р<0,05. Статистические расчеты производились с помощью программы SPSS 13.0.
Результаты
К периоду наблюдения 36 мес. в I группе, по данным непрерывного мониторирования ЭКГ, у 18 (23%) пациентов наблюдалось прогрессирование ФП до персистирующей формы или был достигнут порог ФП 30%. Таким образом, в 23% случаев в I группе достигнута первичная конечная точка исследования. Во II группе прогрессирование ФП до персистирующей формы или достижение порога выше 30% отмечено всего у 3 (4%) пациентов, что значительно меньше, чем в группе контроля (р<0,01). Полученные результаты показали, что применение повторной изоляции ЛВ эффективнее, чем продолжение антиаритмической терапии (рис. 1). Таким образом, повторная ИЛВ значимо уменьшает прогрессирование ФП в сравнении с медикаментозной терапией.
Средний период наблюдения до прогрессирования ФП составил 18,1±5,8 мес. (от 10 до 35) в группе медикаментозной терапии и 16,1±9,1 мес. (от 4 до 33) – в группе повторной изоляции легочных вен. Время до прогрессирования значимо не различалось в обеих группах (р = 0,24).
К концу периода наблюдения (36 мес.), по данным устройства непрерывного мониторирования ЭКГ, в I группе средний процент ФП составил 18,8±11,4%, что значимо больше, чем в группе повторной процедуры 5,6±5,1% (р<0,01). Полученные данные свидетельствуют об эффективности повторной радиочастотной изоляции легочных вен в снижении прогрессирования ФП. Сравнительные данные за весь период наблюдения представлены на рис. 2.
К концу периода наблюдения у 45 (58%) из 77 пациентов группы повторной радиочастотной изоляции легочных вен, по данным устройства непрерывного мониторирования ЭКГ, не зарегистрировано пароксизмов фибрилляции и трепетания предсердий без приема антиаритмических препаратов. В группе медикаментозного лечения только у 9 (12%) из 77 пациентов не выявлено пароксизмов ФП (р<0,01). Полученные результаты представлены на рис. 3.
К концу периода наблюдения в обеих группах не зарегистрировано серьезных осложнений, которые могли бы привести к гибели пациента или его инвалидизации. В группе медикаментозной терапии осложнения преимущественно связаны с побочными действиями препаратов (23 эпизода). Суммарное количество пациентов с осложнениями составило 31% от общего числа пациентов, включенных в эту группу. В группе повторной радиочастотной изоляции общее количество осложнений составило 7% (6 человек), что достоверно меньше (p = 0,03). Во второй группе у 4 пациентов зафиксировано инцизионное трепетание, в 2 случаях отмечались явления гемоперикарда, которые разрешились после выполнения пункции перикарда.
Для оценки предикторов прогрессирования ФП использовали следующие признаки: продолжительность ФП в годах, возраст пациентов, наличие артериальной гипертензии, сахарного диабета, повторной процедуры изоляции ЛВ, гиперлипидемии, поражения коронарного русла и курения в анамнезе. Возраст пациентов разбит на три категории: младше 55, от 55 до 60 лет и старше 60 лет. Продолжительность ФП – менее года, от года до 2,5, от 2,5 до 5 лет и более 5 лет. Все остальные предикторы расценивались как наличие или отсутствие данного признака у пациента.
С помощью мультивариабельного регрессионного логистического анализа выявлено, что возраст пациентов более 60 лет (отношение шансов [ОШ] 2,1; 95% доверительный интервал [ДИ] 1,1–4,1; р = 0,04), анамнез ФП более 5 лет (ОШ 3,3; 95% ДИ 1,7–6,3; р<0,01), артериальная гипертензия (ОШ 3,1; 95% ДИ 1,5–6,3; р<0,01) и наличие сахарного диабета (ОШ 4,6; 95% ДИ 1,3–16,9; р = 0,02) – независимые предикторы прогрессирования ФП.
Обсуждение
Проведенное исследование включило сравнительную оценку антиаритмической терапии и повторной процедуры радиочастотной изоляции ЛВ в профилактике прогрессирования ФП. Согласно полученным результатам, повторная катетерная аблация уменьшает прогрессирование фибрилляции предсердий в отличие от использования медикаментозной терапии у пациентов после неэффективной первичной процедуры. Установлено, что процент ФП к концу периода наблюдения, по данным длительного мониторирования ЭКГ, значительно увеличился у пациентов, рандомизированных в группу антиаритмической терапии (79% пациентов), в сравнении с пациентами, которым выполнена повторная процедура радиочастотной изоляции легочных вен (25% пациентов). При этом процент ФП значительно увеличивался к концу периода наблюдения в группе медикаментозной терапии в сравнении с группой пациентов, которым выполнялась повторная процедура (18,8±11,4 против 5,6±9,5% соответственно). В группе медикаментозной терапии также выявлено большее число пациентов, у которых развилась персистирующая ФП, в сравнении с группой проведения повторной процедуры (23 против 4% соответственно).
В то время как у большинства пациентов с пароксизмальной формой ФП склонность к прогрессированию аритмии мала, в ряде исследований зарегистрирован переход к персистирующей и постоянной формам ФП у значительного количества больных. Данные канадского регистра ФП (CARAF) [12] свидетельствует о том, что 63% из 757 пациентов с пароксизмальной формой ФП испытывали рецидивы аритмий на протяжении 5 лет, причем у 25% наблюдалось прогрессирование заболевания до постоянной формы ФП.
В исследовании предпринята попытка разделить прием антиаритмической терапии и выполнение процедуры аблации, а также взглянуть на ее эффективность в предотвращении прогрессирования ФП. Выявлено, что конечная точка эффективности радиочастотной изоляции легочных вен отсутствие не только пароксизмов ФП, но и прогрессирования заболевания до персистирующей формы
Впервые о влиянии радиочастотной аблации на снижение прогрессирования ФП заявил итальянский электрофизиолог Pappone [8]. В исследовании 106 пациентов с впервые выявленной ФП 56 пациентам назначена антиаритмическая терапия первой линии. В 11 случаях выполнена радиочастотная изоляция легочных вен. В данной группе рецидивов фибрилляции предсердий спустя 5 лет не обнаружено. Однако в группе антиа-ритмической терапии у 16 пациентов ФП стала носить постоянный характер, а у 8 пациентов ФП прогрессировала до персистирующей к периоду наблюдения 5 лет. Таким образом, в исследовании впервые высказано предположение, что радиочастотная аблация способна остановить прогрессирование ФП. Однако нарушения ритма оценивались с помощью краткосрочной записи ЭКГ, что являлось ограничением данного исследования, и набор пациентов был крайне низким.
Другая группа авторов под руководством Jongnarangsin сообщили результаты одноцентрового ретроспективного исследования, в котором сравнивали влияние радиочастотной изоляции ЛВ и медикаментозной терапии у пациентов с пароксизмальной ФП на прогрессирование аритмии до персистирующей формы. В анализе участвовали 504 пациента в среднем возрасте 58±10 лет, которым ранее не выполнялась радиочастотная изоляция легочных вен, предшествующая эффективность антиаритмической терапии не оценивалась. Средний период наблюдения пациентов составил 25±12 мес. Среди 504 пациентов, включенных в исследование, 279 (55%) имели синусовый ритм в конце периода наблюдения, и лишь 44 (9%) пациента – в медикаментозной группе. Частота прогрессирования ФП до персистирующей формы составила 0,6% в год в группе радиочастотной аблации, что гораздо меньше, чем в группе медикаментозной терапии – 9% в год. Многофакторный анализ в исследовании показал, что возраст старше 75 лет, наличие сахарного диабета и анамнез ФП более 10 лет явились независимыми факторами прогрессирования ФП [13]. Исследование имеет ограничения, так как является ретроспективным и нерандомизированным, и контрольная группа взята из другого обсервационного исследования Euro Heart Survey [14]. Также некоторым пациентам выполнены 2 и более процедуры радиочастотной изоляции ЛВ. Таким образом, можно предположить, что пациентам с пароксизмальной фибрилляцией предсердий после неэффективной первичной процедуры радиочастотной изоляции легочных вен целесообразно выполнение повторной процедуры для профилактики прогрессирования ФП.
Для исключения субъективной оценки нарушений ритма и чтобы не пропустить асимптомные случаи аритмии, в исследовании использовали устройства непрерывного мониторирования ЭКГ. В итоге к периоду наблюдения 3 года обнаружено, что при выполнении повторной катетерной аблации у пациентов после первичной неэффективной процедуры отмечается на 46% больше пациентов, свободных от ФП, чем в группе медикаментозной терапии.
Mandeep Bhargava и коллеги в своем исследовании 1 400 пациентах показали, что при повторной радиочастотной аблации отмечается увеличение эффективности метода лечения до 90%, однако для диагностики рецидивов ФП использовались ЭКГ и ХМ ЭКГ, а также исследовании не было рандомизированным [15]. Таким образом, для объективной оценки прогрессирования ФП и эффективности первичной и повторной процедуры целесообразно использование имплантируемого устройства непрерывного мониторирования ЭКГ.
На сегодняшний день одним из наиболее эффективных способов оценки предикторов прогрессирования ФП является шкала HATCH [11]. В исследовании обнаружено, что ХСН, возраст, наличие перенесенных ОНМК, ХОБЛ и артериальной гипертензии – независимый предиктор прогрессирования ФП. Около 50% пациентов с 6–7 баллами по HATCH имели персистирующую ФП к первому году наблюдения. При наличии HATCH 0 баллов прогрессирование ФП до персистирующей составляло только 6%. В нашем исследовании мы обнаружили, что при HATCH более 2 баллов риск прогрессирования ФП и увеличения процента фибрилляции увеличивался независимо от метода лечения. Таким образом, можно сделать вывод, что большую роль в прогрессировании ФП играет наличие сопутствующей патологии независимо от применяемого метода лечения.
Возможно, шкала HATCH может быть активно применена при выборе тактики медикаментозной терапии для предотвращения прогрессирования ФП. Однако мы обнаружили, что HATCH не был независимым предиктором прогрессирования ФП до персистирующей формы. Важно отметить, что использование повторных аблаций как терапевтическая стратегия была также мощным отрицательный предиктором прогрессирования ФП, подтверждающие его превосходство по сравнению с альтернативным медикаментозным методом. С другой стороны, пациентов с показателем по шкале HATCH выше 2 баллов не так много, что является ограничением данной оценки.
Вопросом оценки предикторов прогрессирования ФП занимались различные авторы, так как часто это приводит к ухудшению течения основных заболеваний, таких как артериальная гипертензия, сердечная недостаточность и др. Мета-анализ исследований Danish Study, Abe (Osaka), CARAF, European Heart Survey, RECORD-AF [11, 15, 16, 17] показал, что прогрессирование зависит от возраста пациентов и периодов наблюдения, но по подсчетам превышает 77% пациентов с персистирующей ФП к 14 годам наблюдения. Приблизительно у 5% пациентов ежегодно пароксизмальная форма фибрилляции предсердий трансформируется в персистирующую и длительно персистирующую, за исключением молодых пациентов без выраженной сопутствующей патологии. В нашем исследовании в группе медикаментозного лечения процент пациентов с персистирующей ФП к концу 3-го года наблюдения составил 23 против 4% в группе повторной радиочастотной изоляции [19]. Полученные данные не отличались от результатов предыдущих исследований, однако в группе повторной процедуры зафиксировано достоверно низкое прогрессирование ФП. Также важно отметить, что наше исследование носило рандомизированный характер, тогда как вышеперечисленные исследования преимущественно были наблюдательными и ретроспективными. При выборе тактики лечения у пациентов с рецидивами ФП после первичной неэффективной процедуры необходимо учитывать выше описанные факторы.
На сегодняшний день выбор АПП не стандартизирован и в каждом конкретном случае осуществляется эмпирически. Согласно современным рекомендациям по лечению фибрилляции предсердий, врач может выбрать стратегию радиочастотной аблации ФП только в случае неэффективности ранее проводимой антиарит-мической терапии [2, 9, 20]. С другой стороны, при неэффективности радиочастотной изоляции легочных вен необходимо принимать решение о назначении антиа-ритмической терапии. Может быть, цель лечения ФП – не устранить пароксизмы, а остановить прогрессирование болезни? В нашем исследовании мы доказали, что применение повторной катетерной аблации эффективно предотвращает прогрессирование ФП и может быть рекомендовано пациентам с учетом различных сопутствующих факторов.
Ограничения исследования
Основное ограничение исследования – использование ранее неэффективной антиаритмической терапии. В 88% случаев после рандомизации назначались препараты, которые принимались пациентом до процедуры аблации. Это связано с небольшим арсеналом антиа-ритмических препаратов. В ряде случаев мы столкнулись с тем, что данные препараты были более эффективны, чем до радиочастотной изоляции ЛВ. В нашем исследовании мы не делали поправку на применение лекарственной терапии сопутствующих патологий (АГ, сахарного диабета), что, возможно, тоже влияет на эффективность того или иного метода лечения.
Для подтверждения эффективности процедуры радиочастотной аблации в предотвращении прогрессирования ФП требуются крупные рандомизированные исследования, длительностью наблюдения более 5 лет. В настоящий момент проводится крупное рандомизированное исследование CABANA (сравнение медикаментозного и интервенционного методов лечения), которое, возможно, даст окончательный ответ на вопрос, какая стратегия необходима для эффективного лечения ФП.
Список литературы Прогрессирование фибрилляции предсердий после неэффективной первичной процедуры радиочастотной изоляции легочных вен: рандомизированное сравнение повторной катетерной аблации и медикаментозного метода лечения
- Benjamin E.J., Levy D., Vaziri S.M., D’Agostino R.B., Belanger A.J., Wolf P.A. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study//Jama. 1994. Vol. 271. № 11. P. 840-844.
- Оганов Р.Г., Салимов В.А., Бокерия Л.А., и др. Клинические рекомендации по диагностике и лечению пациентов с фибрилляцией предсердий//Вестник аритмологии. 2010. № 59. С. 53-77.
- Артеменко С.Н., Романов А.Б., Шабанов В.В., Елесин Д.А., Стрельников А.Г., Камиев Р.Т., Лосик Д.В., Покушалов Е.А. Результаты радиочастотной изоляции устьев легочных вен в сочетании с аблацией ганглионарных сплетений у пациентов с пароксизмальной формой фибрилляции предсердий//Анналы аритмологии. 2011. Т. 8. № 4. С. 36-42.
- Артеменко С.Н., Романов А.Б., Туров А.Н., Шабанов В.В., Елесин Д.А., Якубов А.А., Стрельников А.Г., Камиев Р.Т., Лосик Д.В., Покушалов Е.А. Сравнительная оценка радиочастотной остиальной, антральной изоляции устьев легочных вен и аблации ганглионарных сплетений у пациентов с фибрилляцией предсердий//Вестник аритмологии. 2012. № 68. С. 14-20.
- Елесин Д.А., Романов А.Б., Туров А.Н., Шабанов В.В., Якубов А.А., Стенин И.Г., Лосик Д.В., Артеменко С.Н., Панфилов С.В., Покушалов Е.А. Радиочастотная аблация пароксизмальной и длительно персистирующей форм фибрилляции предсердий: 1-летний период наблюдения с помощью непрерывного подкожного мониторирования//Вестник аритмологии. 2011. №63. С. 5-11.
- Шабанов В.В., Романов А.Б., Артёменко С.Н., Елесин Д.А., Стрельников А.Г., Лосик Д.В., Байрамова С.А., Покушалов Е.А. Определение оптимального подхода в лечении пациентов с ранними рецидивами фибрилляции предсердий после первой процедуры аблации//Патология кровообращения и кардиохирургия. 2013. № 1. С. 39-43
- Gerstenfeld E.P., Marchlinski F.E. Mapping and ablation of left atrial tachycardias occurring after atrial fibrillation ablation//Heart Rhythm. 2007. Vol. 4. P. 65-72.
- Pappone C., Rosanio S., Augello G. et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized longterm study//J. Am. Coll. Cardiol. 2003. V.42. P.185-197.
- Calkins H., Kuck K.H., Cappato R., Brugada J., Camm A.J. et al. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design: a report of the Heart Rhythm Society (HRS) Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with the American College of Cardiology (ACC), American Heart Association (AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society of Thoracic Surgeons (STS). Endorsed by the governing bodies of the American College of Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society // Heart Rhythm. 2012. Vol. 9. P. 632-696.
- Pappone C., Augello G., Sala S., et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF Study//JACC. 2006. Vol. 48. P. 2340-2347.
- De Vos C.B., Pisters R., Nieuwlaat R., et al. Progression from paroxysmal to persistent atrial fibrillation clinical correlates and prognosis//J. Am. Coll. Cardiol. 2010. Vol. 55. P. 725-731.
- Kerr C.R., Humphries K.H., Talajic M., et al. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal AF: results from the Canadian Registry of AF//Am. Heart J. 2005. Vol. 149. P. 489-496.
- Jongnarangsin K., Suwanagool A., Chugh A., Crawford T., Good E., Pelosi F., Bogun F., Oral H., Morady F. Effect of catheter ablation on progression of paroxysmal atrial fibrillation//J. Cardiovasc. Electrophysiol. 2012. Vol. 23. P. 9-14.
- Nieuwlaat R., Prins M.H., Le Heuzey J.Y., et al. Prognosis, disease progression, and treatment of atrial fibrillation patients during 1 year: follow-up of the Euro Heart Survey on atrial fibrillation//Eur. Heart J. 2008. Vol. 29. P. 1181-9.
- Bhargava M., Di Biase L., et all. Impact of type of atrial fibrillation and repeat catheter ablation on long-term freedom from atrialfibrillation: results from a multicenter study//Heart Rhythm. 2009. Vol. 6. P. 1403-1412.
- Abe Y., Fukunami M., Yamada T., Ohmori M., Shimonagata T., Kumagai K., Kim J., Sanada S., Hori M., Hoki N. Prediction of transition to chronic atrial fibrillation in patients with paroxysmal atrial fibrillation by signal-averaged electrocardiography:a prospective study//Circulation. 1997. Vol. 96. P. 2612-2616.
- Kato T., Yamashita T., Sagara K., Linuma H., Fu L.T. Progressive nature of paroxysmal atrial fibrillation. Observations from a 14-year follow-up study//Circulation. 2004. Vol. 68. № 6. P. 568-72.
- Petersen P., Godtfredsen J. Embolic complications in paroxysmal atrial fibrillation//Stroke. 1986. Vol. 17. P. 622-626.
- Saksena S., Hettrick D., Koehler J., Grammatico A., Padeletti L. Progression of paroxysmal atrial fibrillation to persistent atrial fibrillation in patients with bradyarrhythmias//Am. Heart J. 2007. Vol. 154. № 5. P. 884-892.
- Kirchhof P., Breithardt G., Aliot E. et al. Personalized management of atrial fibrillation: Proceedings from the fourth Atrial Fibrillation competence NETwork/European Heart Rhythm Association consensus conference//Europace. 2013. Vol. 15. P. 1540-56.


