Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: предварительные результаты
Автор: Коротков В.А., Каприн А.Д., Иванов С.А., Степаненко В.Ф., Бирюков В.А., Борышева Н.Б., Колыженков Т.В., Ахмедова У.А., Богачева В.В., Петухов А.Д., Жарова Е.П.
Рубрика: Научные статьи
Статья в выпуске: 1 т.28, 2019 года.
Бесплатный доступ
Технология инструментальных in vivo измерений пространственного внутриполостного распределения поглощённой дозы в уретре и прямой кишке с применением автономных люминесцентных микродозиметров была разработана и применена в МРНЦ им. А.Ф. Цыба Минздрава России как часть программы обеспечения качества брахитерапии рака предстательной железы с использованием источника 192Ir и для принятия адекватных мер после радиотерапии в отношении возможных лучевых осложнений. По состоянию на конец 2018 г. in vivo измерения пространственного распределения поглощённых доз в уретре и прямой кишке были проведены у 50 пациентов (из них у 30 пациентов - в 2017 г.). В ближайшие сроки после радиотерапии у пациентов не было жалоб, специфичных при лучевых осложнениях. Через год после брахитерапии был проведён активный опрос 30 пациентов 2017 г. по поводу жалоб, относящихся к состоянию уретры и прямой кишки, в результате: к состоянию прямой кишки жалоб не было, а 6 пациентов предъявили жалобы к состоянию уретры. Эти жалобы (на момент опроса) можно интерпретировать как проявления позднего лучевого уретрита. Результаты in vivo измерений пространственного распределения поглощённых доз показывают, что величины измеренных доз хорошо согласуются с результатами планируемых (расчётных) доз в уретре и прямой кишке у тех пациентов, которые не предъявили жалоб. Между тем, у шести пациентов (из 30, прошедших брахитерапию), предъявивших через год после радиотерапии жалобы в отношении состояния уретры, имеет место значимое превышение измеренных доз по сравнению с планируемыми (расчётными). У этих шести пациентов максимальные величины измеренных поглощённых доз в уретре (простатический отдел уретры) находятся в пределах от 18 до 25 Гр при точности измерений в пределах 5%. Измеренные максимальные поглощённые дозы в rádix pénis, где расчётные (планируемые) дозы отсутствуют, находятся в пределах от 3 до 6 Гр при точности измерений около 5%.
In vivo дозиметрия, люминесцентная дозиметрия, внутриполостная дозиметрия, пространственное распределение поглощённых доз, тл-микродозиметры lif(mg, тл-микродозиметры гибкие микродозиметрические сборки, расчётные планируемые поглощённые дозы, брахитерапия, прямая кишка, уретра, поздний лучевой уретрит
Короткий адрес: https://sciup.org/170171473
IDR: 170171473 | УДК: 616.65-006.6-085.849.1-06:616.643-002-02 | DOI: 10.21870/0131-3878-2019-28-1-110-123
Текст научной статьи Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: предварительные результаты
В рекомендациях ВОЗ и МАГАТЭ [1-3] подчёркивается актуальность инструментальной in vivo дозиметрии для снижения риска посттерапевтических лучевых повреждений. Согласно публикации 97 МКРЗ [4] инструментальная дозиметрия необходима как часть программы обеспечения качества радиотерапии при брахитерапии с использованием источников с высокой мощностью дозы (в русскоязычной литературе часто используется термин «высокомощностная» брахитерапия).
Расхождения между расчётными (планируемыми) дозами облучения опухоли, здоровых органов и тканей и реальными дозами облучения могут иметь место не только вследствие возможных человеческих ошибок при дозиметрическом планировании радиотерапии [2, 3], но и в результате смещения органов и тканей пациента в ходе сеансов радиотерапии. А при брахитерапии, когда имеется большой градиент (перепад) поглощённой дозы между очагом и окружающими тканями, – расхождения возможны в результате индивидуального изменения положения источников излучения по сравнению с планом. Поэтому технология инструментального in vivo измерения пространственного внутриполостного распределения поглощённой дозы в уретре и прямой кишке при высокомощностной брахитерапии рака предстательной железы [5-9] с использованием 192Ir весьма актуальна, в том числе и для прогноза и принятия адекватных мер после радиотерапии в отношении возможных лучевых осложнений.
Следует отметить, что в литературе представлены предварительные результаты проявления позднего лучевого уретрита после проведения высокомощностной брахитерапии рака предстательной железы (РПЖ). Отмечено, что в поздние сроки (год и более) после брахитерапии стриктура уретры была отмечена у пациентов только с высокими дозами на уретру (величины доз и их пространственное распределение доз не указаны) [10]. В работе [11] сообщается, что поздние лучевые осложнения со стороны уретры, такие как стриктуры, имеют место в 4% случаев после стандартной высокомощностной (high dose rate) брахитерапии, а в случае высокомощностной брахитерапии с 4 фракциями по 9,5 Гр, отпускаемых в течение 48 ч, отмечается очень высокая частота поздних осложнений со стороны мочеполовой системы, что существенно влияет на качество жизни пациентов [12-15].
Имеющиеся публикации по онлайн внутриполостной дозиметрии с применением диодных или люминесцентных онлайн дозиметров позволяют получить информацию о величине дозы облучения в одной точке (месте расположения дозиметра), но не в состоянии обеспечить получение информации о целостной картине пространственного распределения дозы, к тому же эти методы требуют кабельного соединения с регистрирующей системой, что создаёт трудности как для пациентов, так и для персонала [16, 17].
Материалы и методы
Измерения интенсивности радиационно-обусловленного люминесцентного свечения в микродозиметрах проводили методом термостимулированной люминесценции (ТЛ) с применением системы регистрации модели “Harshow 3500” [18]. При измерениях использовали по пять навесок микродозиметров, отобранных в каждой из измеряемых точек по глубине расположения микродозиметров при их внутриполостном размещении внутри катетеров (с массой 10 мг для каждой навески). Основной задачей являлось клиническое применение разработанных микродозиметров для принятия решений о прогнозе возможных лучевых осложнений.
Результаты
Исследование дозиметрических характеристик природных микрокристаллов морской соли (NaCl) в терапевтическом диапазоне доз
Дозиметрические характеристики кристаллов NaCl, оцененные методом ОСЛ (оптически стимулированная люминесценция) для целей ретроспективной дозиметрии в диапазоне малых доз (<<1 Гр), были продемонстрированы в работе [19] и применены для измерения накопленных доз внешнего облучения в окружающей среде на территориях вокруг аварийной АЭС Фуку- сима-1 [20]. В нашем исследовании методом ТЛ (термостимулированная люминесценция), а не ОСЛ изучены основные дозиметрические характеристики NaCl в терапевтическом диапазоне доз: от 1 до 20 Гр (с перспективой применения для инструментальной дозиметрии при брахитерапии). Специалисты МРНЦ им. А.Ф. Цыба владеют как методом ТЛ, так и методом ОСЛ. Однако, выбор именно ТЛ-варианта измерений был обусловлен тем, что все три материала (NaCl, AL2O3:C и LiF:(Mg,Ti)) (табл. 1) могут быть исследованы этим методом. LiF:(Mg,Ti) из-за особенностей своих свойств не может быть исследован методом ОСЛ. После просеивания в специальных лабораторных ситах использовали для исследований фракцию микрокристаллов с размерами 0,106-0,150 мм (рис. 1).

Рис. 1 . Пример: Фото под микроскопом микрокристаллов NaCl после сортировки на специальных лабораторных ситах (размеры кристаллов около 100 мкм). Эти природные кристаллы были использованы для наших дозиметрических исследований.
Кривые радиационно-обусловленного термостимулированного высвечивания люминесценции
На рис. 2 показана типичная зависимость интенсивности радиационно-индуцированного ТЛ-сигнала (кривая высвечивания) от температуры нагрева микрокристаллов NaCl (с размерами около 100 мкм) после облучения, поглощённая доза 1 Гр.
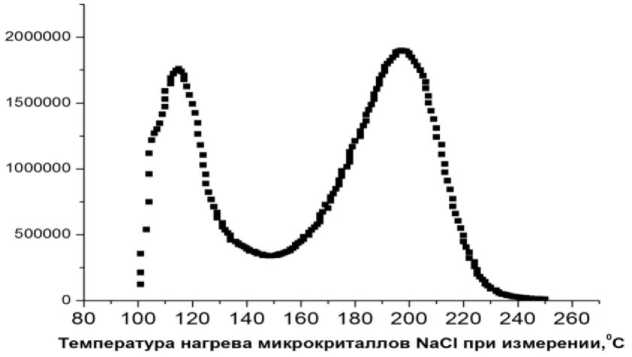
Рис. 2. Типичная зависимость интенсивности радиационно-индуцированного ТЛ-сигнала (кривая высвечивания) от температуры нагрева микрокристаллов NaCl (размеры около 100 мкм) после облучения (поглощённая доза 1 Гр). Температура предварительного отжига перед облучением 600 оС (1 ч). По оси ординат – интенсивность ТЛ-высвечивания (I), произвольные единицы; по оси абсцисс – температура нагрева микрокристаллов во время измерения, оС.
Установленные параметры ТЛ-измерений NaCl, LiF:(Mg,Ti) и Al2O3:C
В табл. 1 приведены установленные в результате исследования параметры ТЛ-измерений.
Таблица 1
Параметры ТЛ-измерений микродозиметров NaCl, LiF:(Mg,Ti) и Al 2 O 3 :C с размерами около 100 мкм
|
Тип дозиметра |
Температура отжига, оС |
Продолжительность отжига, ч |
Скорость нагрева, оС/с |
|
NaCl (морская соль) |
600 |
1 |
1 |
|
LiF:(Mg,Ti) |
400 |
1 |
5 |
|
Al 2 O 3 :С |
500 |
3 |
2 |
Зависимости интенсивности радиационно-обусловленного термолюминес центного сигнала микрокристаллов NaCl и LiF:(Mg,Ti) от дозы облучения в терапевтическом диапазоне (калибровочные зависимости)
Для дальнейших сравнительных исследований использовали микрокристаллы NaCl и LiF(Mg,Ti). От дальнейшего систематического применения синтетических кристаллов AL2O3:C пришлось отказаться, поскольку для получения микрокрочастиц они нуждались в предвари- тельном дроблении с последующей сортировкой, что весьма трудозатратно. На рис. 3 в сравнительном плане показаны установленные дозовые калибровочные зависимости для микрокристаллов NaCl и LiF:(Mg,Tii) в терапевтическом диапазоне доз – от 1 до 20 Гр. Очевидна линейная зависимость показаний исследуемых микродозиметров от поглощённой дозы. Погрешность приведённых точек на зависимостях не превышает 5% (2 SD). Видно, что исследуемый NaCl существенно чувствительнее LiF:(Mg:Ti).
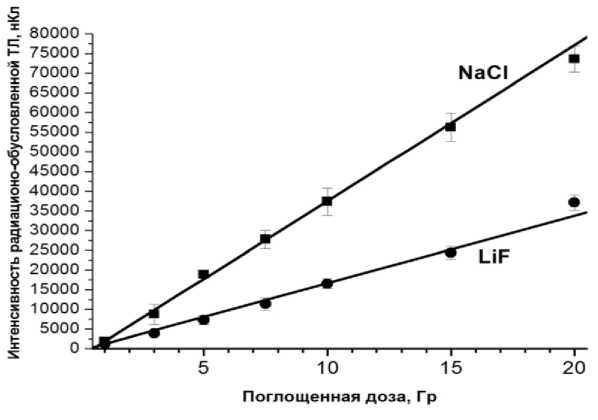
Рис. 3. Калибровочные зависимости для природных микрокристаллов соли (NaCl) и синтетических микрокристаллов LiF:(Mg,Ti). Размеры микрокристаллов – около 100 мкм. Диапазон доз 1-20 Гр (ось абсцисс). Ось ординат – интенсивность радиационно-обусловленного ТЛ-сигнала, нКл. Указанные погрешности не превышают 5% (2 SD). Параметры аппроксимации: NaCl – R=0,9975; N=7; P<0,0001; LiF:(Mg,Ti) – R=0,9955, N=7, P<0,0001.
Разработка технологии изготовления герметичных тканеэквивалентных гибких сборок миллиметрового диаметра из изученных микродозиметров для введения этих сборок в медицинские катетеры с целью внутриполостного измерения пространственного распределения поглощённых доз при брахитерапии источником ионизирующего излучения с высокой мощностью поглощённой дозы 192Ir (при высокомощностной брахитерапии) и апробация разработанной технологии в клинических условиях
В данном разделе приведены результаты разработки и апробации в клинических условиях технологии внутриполостной in vivo дозиметрии при высокомощностной брахитерапии рака предстательной железы с применением 192Ir. Разработанная технология позволяет проводить измерения поглощённых доз во многих точках тела пациента при внутриполостном размещении микродозиметров в автономном режиме, т.е. при отсутствии кабельных соединений с регистрирующими системами. Испытание разработанной технологии in vivo дозиметрии проводили в клинике МРНЦ им. А.Ф. Цыба (отдел онкологии репродуктивных органов) в процессе высокомощностной брахитерапии рака предстательной железы с применением 192Ir.
Проведённые исследования дозиметрических характеристик микродозиметров (около 100 мкм) различной природы (NaCl – кристаллов природной морской соли, и искусственных (синтетических) микрокристаллов – LiF:(Mg.Ti), Al 2 O 3 :C)) показали, что наиболее пригодными для поставленных целей явились NaCl и LiF:(Mg,Ti). Микродозиметры первых двух типов являются люминесцентными, радиационно-индуцированные сигналы от которых регистрируются после термической стимуляции люминесценции. Установлены калибровочные зависимости для этих типов дозиметров, которые характеризуются высокой степенью линейности и точности в диапазоне поглощённых доз от 1 до 20 Гр. NaCl отличается от LiF:(Mg,Ti) существенно меньшей стоимостью (в тысячи раз). Для дальнейших исследований были выбраны NaCl и LiF:(Mg,Ti).
Для того, чтобы обеспечить измерение пространственного распределения поглощённых доз при внутриполостном введении, была разработана следующая технология. Микродозиметры (размером около 100 мкм) герметично фиксировали внутри гибких тканеэквивалентных трубок с внешним диаметром менее 1 мм, которые, в свою очередь, размещали внутри медицинских катетеров в условиях электронного равновесия при облучении терапевтическим источником 192Ir. Использовали катетеры того же типа и размеров, что применялись и для введения источника 192I. Онколог-радиолог размещал медицинские катетеры с находящимися в них микродозиметрами в «зонах интереса» перед операцией. При брахитерапии рака предстательной железы такими зонами являлись уретра и толстый кишечник. Катетеры вводили через уретру и в просвет прямой кишки во время операции под контролем УЗИ, так что сама по себе эта процедура не была инвазивной. Ввиду автономности детекторов кабельные соединения с регистрирующими системами не требовались (рис. 4).
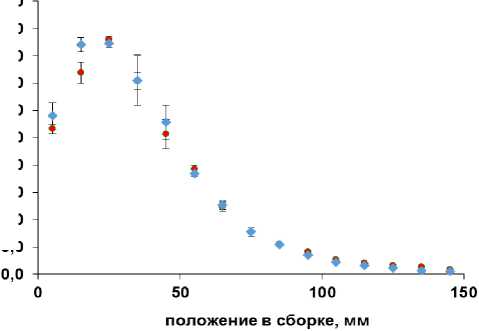
По результатам исследований в клинических условиях МРНЦ была проведена апробация in vivo дозиметрии с применением NaCl в сравнении с результатами in vivo дозиметрии с искусственными микродозиметрами LiF:(Mg,Ti). Проведено сравнение пространственного распределения дозы в толстом кишечнике при параллельных измерениях обоими микродозиметрами (рис. 5). Микродозиметры в гибких герметичных тканеэквивалентных миниатюрных сборках были размещены на УЗИ-датчике в ректальной области.

Рис. 4. Общий вид операционного поля, где на УЗИ-датчике видны катетеры, в которых находятся микродозиметры.
20000,0
18000,0
16000,0
14000,0
12000,0 i—
50000,0
"8000,0
^бООО.О
4000,0
2000,0
LiF
♦ Sea Salt (NACI)
Рис. 5. Пример измерения пространственного распределения поглощённых доз в толстом кишечнике. Измерения проведены люминесцентными дозиметрами из природных микрокристаллов морской соли (NaCl) и из синтетических микрокристаллов LiF:(Mg,Ti). Указанные погрешности соответствуют 2 SD.
Из представленных на рисунке данных следует хорошее совпадение двух наборов измерений различными типами дозиметров.
Отслеживание осложнений у пролеченных больных в сопоставлении с измеренными дозами с целью принятия адекватных решений при наличии лучевых осложнений
Как было отмечено выше, в МРНЦ in vivo дозиметрия при высокомощностной терапии РПЖ рассматривается как часть программы обеспечения качества радиотерапии [1, 3, 4], а именно, брахитерапии рака предстательной железы [5-9] с использованием 192Ir, для профилактики постлучевых осложнений. В период сравнительных исследований дозиметрических свойств микрокристаллов NaCl мы применяли микрокристаллы NaCl и LiF:(Mg,Ti). Первые «пилотные» испытания были начаты в 2016 г. В дальнейшем исследования были продолжены с микрокристаллами LiF:(Mg,Ti) для поддержания единообразности используемых в клинике мик- родозиметров. Однако в ближайшее время мы планируем более углублённое изучение микродозиметров на основе NaCl, поскольку они в тысячи раз дешевле синтетических микрокристаллов. Разработанный способ и последовательность размещения микродозиметров в медицинских катетерах для последующего внутриполостного введения с целью in vivo дозиметрии при высокомощностной брахитерапии рака предстательной железы источниками 192Ir описан нами в [21, 22].
«Области интереса» для инструментальных оценок доз, определённые онкологом-радиологом:
-
- в уретре, в области мочевого пузыря – катетер с размещёнными в нем микродозиметрами, вводимый через уретру;
-
- периферическая (ректальная) область – при введении катетера с размещёнными в нём микродозиметрами в просвете прямой кишки.
Введение медицинских катетеров предусмотрено технологией высокомощностной брахитерапии. Наличие дозиметров внутри катетеров не мешает проведению всех необходимых медицинских процедур – в силу миниатюрности дозиметров. Все процедуры по размещению микродозиметров проводятся онкологом-радиологом под контролем УЗИ.
Дозиметрические измерения были проведены у 50 пациентов, через год после брахитерапии были активно опрошены 30 пациентов по поводу жалоб, относящихся к состоянию уретры и прямой кишки. Эти данные могут представлять значительный интерес, несмотря на их предварительный характер. В отношении прямой кишки жалоб предъявлено не было. Шесть из 30 опрошенных пациентов жаловались на нарушение мочеиспускания. Эти жалобы (на момент опроса) можно интерпретировать как возможные проявления лучевого уретрита. Пациенты приглашены для более детальных обследований и решения вопроса о возможных осложнениях и соответствующем лечении.
На рис. 6-7 приведены примеры результатов измерений доз в сравнении с расчётными данными для опрошенных пациентов.
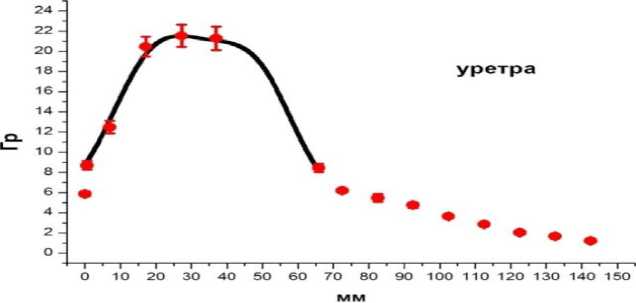
Рис. 6. Пациент Z. Пример сравнения пространственного распределения измеренных и расчётных поглощённых доз при размещении люминесцентных микродозиметров внутри медицинского катетера по глубине в уретре. По оси абсцисс – расстояние в мм от максимальной глубины расположения микродозиметров до входа в уретру. По оси ординат – поглощённая доза, Гр. Расчётные дозы обозначены чёрной кривой. Измеренные дозы обозначены кружком с указанием неопределённостей измерений. Неопределённость измерений соответствует 2 SD.
Максимальные величины поглощённых доз соответствуют области расположения очага.
Через год после проведения брахитерапии жалоб не отмечено.
О 10 20 30 40 50 60 70 80 90 100 11O 120 130 140 150 160
ММ
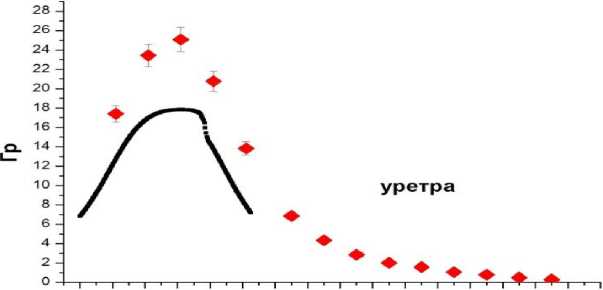
Рис. 7. Пациент С. Пример сравнения пространственного распределения измеренных и расчётных поглощённых доз при размещении люминесцентных микродозиметров внутри медицинского катетера по глубине в уретре. По оси абсцисс – расстояние в мм от максимальной глубины расположения микродозиметров до входа в уретру. По оси ординат – поглощённая доза, Гр. Расчётные дозы обозначены в виде черной кривой. Измеренные дозы обозначены ромбом с указанием неопределённостей измерений. Неопределённость измерений соответствует 2 SD.
Максимальные величины поглощённых доз соответствуют области расположения очага.
В данном случае отмечено существенное превышение измеренных доз по сравнению с расчётными. Через год после лечения отмечены жалобы, которые интерпретируются как возможные проявления лучевого уретрита.
Заключение
Успешная апробация в клинических условиях разработанной технологии внутриполост-ной автономной in vivo люминесцентной дозиметрии с использованием микрокристаллов LiF:(Mg,Ti) при высокомощностной брахитерапии РПЖ показала её применимость для получения инструментальной информации о пространственном распределении поглощённой дозы в уретре и прямой кишке.
Сравнение данных in vivo дозиметрии при высокомощностной брахитерапии РПЖ с расчётными (планируемыми) дозами показывает, что, как правило, измеренные дозы хорошо согласуются с расчётными. Однако, измеренные дозы в уретре в некоторых случаях превышают расчётные.
Имеющиеся расхождения между расчётными и измеренными дозами могут быть обусловлены рядом причин: различиями в положении источников при планировании и их реальном положении при сеансах облучения; изменениями конфигурации и положения органов за счёт движений (дыхания) пациента при облучении; возможным несовершенством программы расчёта доз (например, для пениального отдела уретры, т.е. вне тела пациента, программа вообще не обеспечивает возможности расчётов доз).
Проведённые исследования показывают полезность и актуальность использования внут-риполостной in vivo люминесцентной дозиметрии при высокомощностной брахитерапии РПЖ источником 192Ir, когда имеет место большой пространственный градиент дозы в зависимости от расстояния «очаг – орган интереса (риска)». Это актуально не только для совершенствования дозиметрического планирования брахитерапии, но и для принятия адекватных мер при наличии возможных лучевых осложнений. Пациенты с отслеженными возможными поздними лучевыми осложнениями приглашены для детального обследования и проведения необходимого лечения. Совершенствование технологии внутриполостной инструментальной дозиметрии [21, 22], а также исследование возможностей её применения при иных локализациях злокачественных опухолей продолжаются [9, 21-23].
Список литературы Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: предварительные результаты
- WHO. Radiotherapy Risk Profile WHO/IER/PSP/2008.12. Geneva: WHO, 2008. 51 р. [Электронный ресурс]: URL: http://www.who.int/patientsafety/activities/technical/ radiotherapy_risk_profile.pdf (дата обращения 15.12.2018).
- IAEA. Lessons learned from accidental exposures in radiotherapy. IAEA Safety Report Series 17. Vienna: IAEA, 2000. 96 р. [Электронный ресурс]. URL: http://www-pub.iaea.org/mtcd/publications/pdf /pub1084_web.pdf (дата обращения 19.04.2017).
- IAEA. IAEA Human Health Reports No. 8. Development of Procedures for In Vivo Dosimetry in Radiotherapy. Vienna: IAEA, 2013. 178 p. [Электронный ресурс]. URL: http://www-pub.iaea.org/books/ IAEABooks/8962/Development (дата обращения 19.04.2018).
- ICRP, 2005. Prevention of High-dose-rate Brachytherapy Accidents. ICRP Publication 97 //Ann. ICRP. 2005. V. 35, N 2. P. 1-52.
- Каприн А.Д., Галкин В.Н., Иванов С.А. Роль брахитерапии в лечении локализованных форм рака предстательной железы //Biomedical Photonics. 2015. Т. 4, № 4. C. 21-26.
- Иванов С.А. Брахитерапия как метод радикального лечения при раке предстательной железы: дис. ... д.м.н. М., 2011. 265 c.
- Иванов С.А., Каприн А.Д., Миленин К.Н., Альбицкий И.А., Иваненко К.В. Результаты применения низкодозной брахитерапии в качестве радикального лечения при раке предстательной железы //Диагностическая и интервенционная радиология. 2015. Т. 5, № 1. C. 73-76.
- Каприн А.Д., Паньшин Г.А., Альбицкий И.А., Миленин К.Н., Цыбульский А.Д. Брахитерапия локализованного рака предстательной железы (медицинская технология). [Электронный ресурс]. URL: http://www.rncrr.ru/nauka/new-technology/brakhiterapiya-lokalizovannogo-raka-predstatelnoy-zhelezy (дата обращения 25.01.2018).
- Каприн А.Д., Мардынский Ю.С. Брахитерапия. Обнинск: МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2017. 245 с.
- Merrick G.S., Butler W.M., Wallner K.E., Galbreath R.W., Anderson R.L., Allen Z.A., Adamovich E. Risk factors for the development of prostate brachytherapy related urethral strictures //J. Urol. 2006. V. 175, N 4. P. 1376-1381.
- Moltzahn F., Dal Pra A., Furrer M., Thalmann G., Spahn M. Urethral strictures after radiation therapy for prostate cancer //Investig. Clin. Urol. 2016. V. 57, N 5. P. 309-315.
- Viswanathan A.N., Yorke E.D., Marks L.B., Eifel P.J., Shipley W.U. Radiation dose-volume effects of the urinary bladder //Int. J. Radiat. Oncol. Biol. Phys. 2010. V. 76, N 3 (Suppl.). P. S116-S122.
- Herschorn S., Elliott S., Coburn M., Wessells H., Zinman L. SIU/ICUD Consultation on Urethral Strictures: Posterior urethral stenosis after treatment of prostate cancer //Urology. 2014. V. 83, N 3 (Suppl.). P. S59-S70.
- Astrom L., Pedersen D., Mercke C., Holmang S., Johansson K.A. Long-term outcome of high dose rate brachytherapy in radiotherapy of localised prostate cancer //Radiother. Oncol. 2005. V. 74, N 2. P. 157-161.
- Toye W., Das R., Kron T., Franich R., Johnston P., Duchesne G. An in vivo investigative protocol for HDR prostate brachytherapy using urethral and rectal thermoluminescence dosimetry //Radiother. Oncol. 2009. V. 91, N 2. P. 243-248. DOI: 10.1016/j.radonc.2008.08.016.
- Therriault-Proulx F., Briere T.M., Mourtada F., Aubin S., Beddar S., Beaulieu L. A phantom study of an in vivo dosimetry system using plastic scintillation detectors for real-time verification of 192Ir HDR brachytherapy //Med. Phys. 2011. V. 38, N 5. P. 2542-2551. DOI: 10.1118/1.3572229.
- Andersen C.E., Nielsen S.K., Greilich S., Helt-Hansen J., Lindegaard J.C., Tanderup K. Characterization of a fiber-coupled A^O3:C luminescence dosimetry system for online in vivo dose verification during 192Ir brachytherapy //Med. Phys. 2009. V. 36, N 3. P. 708-718. DOI: 10.1118/1.3063006.
- Степаненко В.Ф., Бирюков В.А., Карякин О.Б., Каприн А.Д., Галкин В.Н., Иванов С.А., Мардын-ский Ю.С., Колыженков Т.В., Петухов А.Д., Богачева В.В., Ахмедова У.А., Яськова Е.К., Лепили-на О.Г., Санин Д.Б., Скворцов В.Г., Иванников А.И., Хайлов А.М., Анохин Ю.Н. Локальные поглощённые дозы облучения медицинского персонала при брахитерапии рака предстательной железы микроисточниками 125I российского производства //Радиация и риск. 2017. Т. 26, № 1. C. 44-59.
- Bernhardsson C., Christiansson M., Raaf C., Mattsson S. OSL in household salt (NaCl) for environmental, occupational and medical dosimetry //Medical Physics in the Baltic States 7: Proceedings of the International Conference, 9-10 October, 2009, Kaunas, Lithuania. P. 65-68.
- Christiansson M. Household salt as an emergency radiation dosemeter for retrospective dose assessments using optically stimulated luminescence. Doctoral Thesis. Lund: Lund University, 2014. 136 p.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Борышева Н.Б., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Обухов А.А., Иванников А.И., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Анохин Ю.Н. «In vivo» дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: сравнение распределения планируемых и измеренных доз при внутриполостном размещении автономных люминесцентных микродозиметров //Радиация и риск. 2018. T. 27, № 1. C. 77-85.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Иванников А.И., Борышева Н.Б., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Обухов А.А., Анохин Ю.Н. Внутриполостная автономная «in vivo» дозиметрия при высокомощностной брахитерапии рака предстательной железы c применением 192Ir: разработка технологии и первые результаты //Радиация и риск. 2017. T. 26, № 2. С. 72-82.
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко Ю.С. Синтез фундаментальных и прикладных исследований - основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику //Радиация и риск. 2017. Т. 26, № 2. С. 26-40.


