Пролиферативная активность и клеточный цикл лимфоцитов периферической крови (ЛПК) человека в отдалённые сроки после хронического радиационного воздействия
Автор: Маркина Т.Н., Аклеев А.В., Веремеева Г.А.
Рубрика: Научные статьи
Статья в выпуске: 1 т.20, 2011 года.
Бесплатный доступ
Сверочные точки клеточного цикла осуществляют контроль генетической стабильности клетки. Воздействие ионизирующей радиации приводит к задержке клеточного цикла и снижению пролиферативной активности облучённых клеток, имеющих разнообразные повреждения ДНК. Ранее в экспериментах на животных при хроническом облучении в диапазоне доз 0,01-0,5 Гр/сут выявлено угнетение гемопоэза, изменение продолжительности клеточного цикла и пролиферации кроветворных клеток. В настоящей работе отмечено увеличение количества ЛПК с задержкой клеточного цикла у людей в отдалённые сроки (спустя 60 лет) после начала хронического радиационного воздействия (средняя накопленная доза облучения красного костного мозга составила 1,15 Гр). Предполагается, что наблюдаемый эффект может быть связан с нестабильностью генома стволовых кроветворных клеток (СКК). В отдалённые сроки у облучённых людей также отмечено повышение числа пролиферирующих ЛПК.
Хроническое облучение, пролиферация, клеточный цикл
Короткий адрес: https://sciup.org/170170028
IDR: 170170028
Текст научной статьи Пролиферативная активность и клеточный цикл лимфоцитов периферической крови (ЛПК) человека в отдалённые сроки после хронического радиационного воздействия
Анализ данных, полученных при длительном наблюдении за жителями прибрежных сёл р. Теча, подвергшихся хроническому низкоинтенсивному облучению, выявил угнетение гемопоэза у отдельных лиц в ранние сроки облучения. Наличие стойких выраженных изменений в гемопоэзе (цитопения, гипоплазия костного мозга) в сочетании с неврологическими и иммунологическими изменениями позволило диагностировать у лиц, облучённых в дозе 0,7 Гр и более, хроническую лучевую болезнь (ХЛБ). Гибель и задержка дифференцировки гранулоцитарных предшественников на ранних этапах облучения людей были главными причинами ранней лейкопении. По результатам текущих медицинских осмотров у 8 % облучённых жителей прибрежных сёл р. Теча, лейкопения регистрируется и в настоящие время (через 60 лет от начала облучения) [1, 6].
Кроме того, в отдалённые сроки у облучённых людей, проживающих в прибрежных сёлах р. Теча, сохраняется повышенная частота мутаций в гене Т-клеточного рецептора (TCR) [5], а также нестабильных (дицентриков, кольцевых хромосом) и стабильных хромосомных аберраций (транслокаций) [6].
Представлялось интересным оценить особенности клеточного цикла у жителей прибрежных сёл р. Теча в период формирования отдалённых цитопений, когда мощность дозы облучения не превышала допустимой. Единичные экспериментальные данные указывают на снижение пролиферативной активности Т-лимфоцитов мышей в отдалённый период хронического облучения в малых дозах [2].
Таким образом, цель данного исследования – оценить состояние клеточного цикла и пролиферацию лимфоцитов периферической крови человека в отдалённые сроки после хронического радиационного воздействия.
Методы исследования
В результате сброса отходов радиохимического производства ПО «Маяк» в речную систему Теча-Исеть-Тобол с 1950 по 1956 гг., население прибрежных сёл р. Теча (более 30 тыс. человек) подверглось облучению в широком диапазоне доз (максимальная доза облучения ККМ в соответствии с TRDS-2009 достигала 9 Гр) [8]. Наибольшая мощность дозы наблюдалась в первые 6 лет, при этом максимальная эквивалентная доза комбинированного внешнего и внутреннего облучения ККМ достигала 0,4-0,5 Зв/год в сёлах верхнего течения р. Теча. Около 87 % накопленной дозы внутреннего облучения приходилось на долю остеотропного 90Sr [5]. Данный факт позволяет рассматривать костную ткань и ККМ в качестве органов-мишеней радиационного воздействия у жителей прибрежных сёл р. Теча.
Состояние клеточного цикла и пролиферативную активность ЛПК оценивали у 136 жителей прибрежных сёл р. Теча, подвергшихся хроническому облучению. Контрольную группу составили 59 человек, проживающих на незагрязнённых территориях и имеющих нормальный клеточный состав крови. Средняя накопленная доза на ККМ в группе облучённых лиц составила 1,15 Гр (максимальные индивидуальные значения достигали 4,46 Гр). Средний возраст в сравниваемых группах, на время обследования, составил 68,8 лет. Группы были сходны по национальному составу и полу. Из исследования исключались лица, принимавшие антибиотики, цитостатики, проходившие рентгеновское обследование в течение последних 6 месяцев. Среди обследованных облучённых людей были выделены 2 подгруппы жителей, которые имели изменения со стороны гемопоэза в ранний и отдалённый периоды от начала облучения (группа лю- дей, перенесших ХЛБ и группа облучённых людей с лейкопенией). Группа людей, перенесших ХЛБ, включала 31 человека, а группа людей с отдалённой лейкопенией – 30 человек. Критерием отбора людей с лейкопенией было устойчивое снижение абсолютного количества лейкоцитов периферической крови - менее 4,0х109/л.
Объектом исследования были выбраны ЛПК. Это обусловлено доступностью материала, высокой концентрацией клеток (106/л) в периферической крови, синхронностью фаз клеточного цикла (клетки находятся в G0-фазе), а также степенью радиочувствительности, близкой к радиочувствительности стволовых кроветворных клеток (СКК) [9]. ЛПК выделяли по стандартной методике на градиенте фиколл-урографина [10]. Полученную суспензию клеток делили на 5 равных частей, 2 из которых были предназначены для оценки спонтанного (исходного) уровня пролиферирующих клеток и клеток с задержкой клеточного цикла. Следующие 3 части предназначались для анализа исследуемых параметров после инкубации культуры ЛПК. Клетки инкубировали по стандартной методике [3] в культуральной среде с добавлением ФГА. Для оценки пролиферативной активности клеток (доли/процент/ клеток, ответивших на митогенный стимул), культуру лимфоцитов инкубировали при 37 ° С 42 часа [20]. Для выявления клеток с задержкой клеточного цикла в сверочной точке G1/S, культуру лимфоцитов инкубировали при 37 ° С 24 часа. Еще одну пробирку с культурой ЛПК культивировали 22 часа [20], затем подвергали у -облу-чению в дозе 1 Гр, и снова инкубировали еще 2 часа для накопления клеток с задержкой клеточного цикла.
Для оценки пролиферативной активности лимфоцитов периферической крови использовали маркер пролиферации – белок ki-67 [14, 16]. По литературным данным, большинство клеток, подвергшихся воздействию у -излучения, останавливаются в G1- или G2-фазе [17, 19]. Поэтому для исследования клеточного цикла была выбрана первая сверочная точка G1/S, маркером активации которой является белок Chk2 [11, 12, 17, 19].
Белки (ki-67 и Chk2) окрашивали по методике иммунофлюоресцентного окрашивания внутриклеточных белков [14] с применением FITC-меченных моноклональных антител anti-Chk2 (Beckton Dickenson, США) и anti-ki-67 (Beckton Dickenson, США). Анализ проводили на проточном цитофлуориметре серии EPICS XL-MCL (аргоновый лазер 488 нм мощностью 15 мВт). Статистический анализ результатов проводили с использованием пакета программ «Micrsoft Excel» и «Statistica 6.0».
Результаты исследования
Исследование пролиферативной активности ЛПК облучённых людей. Анализ пролиферативной активности ЛПК показал (табл. 1), что в отдалённые сроки от начала облучения у лиц, подвергшихся воздействию ионизирующей радиации, исходный уровень пролиферирующих ЛПК в среднем составил 2,86 %. В группе сравнения данный показатель был равен 2,32 %. Полученные значения пролиферирующих клеток соответствовали описанной в литературных источниках норме [16]. В группе облучённых лиц, перенесших ХЛБ, доля пролиферирующих клеток была выше значений контроля (3,68 %), но не достигала статистической значимости. Тогда как у облучённых людей с лейкопенией доля пролиферирующих клеток была достоверно выше контроля – 4,20 % (p=0,02).
Таблица 1
Доля (%) лимфоцитов периферической крови , экспрессирующих белок ki-67, у облучённых и необлучённых людей
|
Группы |
Спонтанный уровень |
Инкубация 42 часа |
|
M±m |
M±m |
|
|
Облучённые люди n=88 |
2,81±0,33 (0,08-12,62) |
12,82±0,90 (2,56-39,82) |
|
Люди , перенесшие ХЛБ n=22 |
3,68±0,90 (0,22-12,12) |
13,65±2,51 (2,56-36,60) |
|
Облучённые люди с лейкопенией n=25 |
4,20±0,70 (0,08-12,65) p=0,02 |
15,14±2,0 (4,08-37,46) p=0,1 |
|
Контроль ( необлучённые люди ) n=20 |
2,32±0,65 (0,05-11,83) |
10,83±1,71 (0,94-26,42) |
Примечание: р – различия с контролем.
После инкубации культуры лимфоцитов с митогеном (ФГА) доля пролиферирующих лимфоцитов увеличилась во всех изучаемых группах. Так, у облучённых людей доля пролиферирующих лимфоцитов составила 12,82 %, а в группе сравнения – 10,83 %. Несмотря на увеличение доли пролиферирующих клеток у людей, перенесших ХЛБ (13,65 %), по сравнению с контролем (10,83 %), достоверных различий отмечено не было. Только у людей с лейкопенией наблюдалась тенденция к увеличению доли пролиферирующих клеток (15,14 %, p=0,1) по сравнению с контролем.
Исследование клеточного цикла облучённых людей. Анализ уровня ЛПК, экспрессирующих белок Chk2, выявил увеличение доли клеток с блоком клеточного цикла у облучённых людей (0,75 %, p=0,02) по сравнению с контролем (0,40 %). Еще более высокий процент таких клеток был отмечен у облучённых лиц с лейкопенией (1,06 %, p=0,01). Несмотря на превышение доли клеток с блоком клеточного цикла у людей, перенесших ХЛБ (0,71 %), при сравнении с группой контроля достоверных различий не отмечено. Результаты исследования представлены в таблице 2.
Таблица 2 Доля (%) лимфоцитов периферической крови , экспрессирующих белок Chk2, у облучённых и необлучённых людей
|
Исследуемые группы |
Исходный уровень |
Инкубация 24 ч |
Инкубация 22 ч + облучение + инкубация 2 ч |
|
M±m |
M±m |
M±m |
|
|
Облучённые люди n=136 |
0,75±0,09 (0-6,37) p=0,02 |
2,87±0,43 (0,27-17,80) |
3,08±0,28 (0,14-16,75) |
|
Люди , перенесшие ХЛБ n=31 |
0,71±0,20 (0,03-5,42) |
2,90±0,51 (0,36-11,36) |
2,82±0,42 (0,14-9,64) |
|
Облучённые люди с лейкопенией n=30 |
1,06±0,23 (0,04-5,82) p=0,01 |
4,12±0,75 (0,29-17,0) |
2,94±0,56 (0,54-11,38) |
|
Контроль ( необлучённые люди ) n=59 |
0,40±0,05 (0-1,65) |
3,19±0,48 (0,15-13,12) |
3,36±0,52 (0,22-15,84) |
Примечание: р – различия с контролем.
После стимуляции клеток к делению и инкубации отмечено увеличение количества клеток с блоком G1/S в среднем на 2,5 %, но достоверных различий при сравнении всех групп облучённых людей (перенесших ХЛБ и имеющих лейкопению) с группой контроля получено не было. Аналогично, не выявлено различий между группами облучённых людей (перенесших ХЛБ и имеющих лейкопению) и контрольной группой после стандартного дополнительного γ -облуче-ния культуры лимфоцитов в дозе 1 Гр.
Проведённый статистический анализ зависимости «доза-эффект» как у облучённых людей с лейкопенией и перенесших ХЛБ, так и у облучённых лиц с нормальными показателями крови, не выявил линейной зависимости между дозой облучения ККМ и изучаемыми параметрами.
Зависимость абсолютного количества лейкоцитов периферической крови облучённых людей от пролиферативной активности и состояния клеточного цикла. Проведённый корреляционный анализ не выявил зависимости между абсолютным количеством лейкоцитов периферической крови и абсолютным количеством спонтанно пролиферирующих лимфоцитов в группе всех облучённых лиц (r=0,006; p=0,9). Отмечена положительная линейная зависимость между абсолютным количеством лейкоцитов периферической крови у облучённых людей и абсолютным количеством пролиферирующих лимфоцитов после их инкубации с ФГА (r=0,25; p=0,02) (рис. 1).
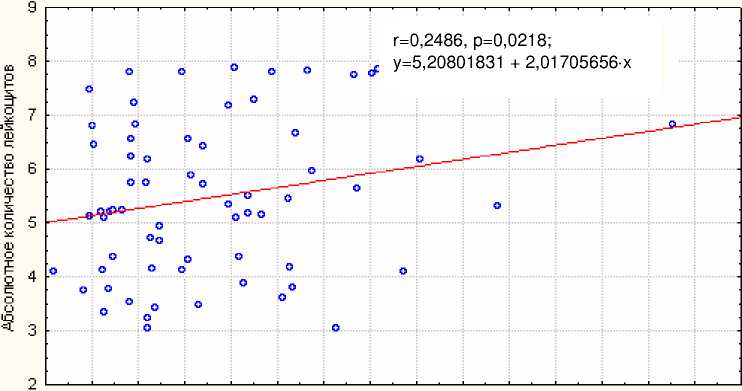
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0
Абсолютное количество пролиферирующих ЛПК (109/ л ) после инкубации с ФГА
Рис . 1. Зависимость абсолютного количества лейкоцитов периферической крови облучённых людей в отдалённый период (от начала облучения) от абсолютного количества пролиферирующих ЛПК (109/л) после инкубации с ФГА.
У людей с лейкопенией корреляционный анализ не выявил зависимости абсолютного количества лейкоцитов от абсолютного количества пролиферирующих лимфоцитов (r=0,3; p=0,2). Также не обнаружено зависимости между абсолютным количеством пролиферирующих лимфоцитов и абсолютным количеством лейкоцитов периферической крови облучённых людей, перенесших ХЛБ (r=0,4; p=0,2).
Корреляционный анализ также не позволил отметить зависимости абсолютного количества лейкоцитов периферической крови от абсолютного количества ЛПК с задержкой клеточного цикла у всех облучённых людей (r=0,06; p=0,4), у лиц, перенесших ХЛБ (r=0,1; p=0,5), и у облучённых людей с лейкопенией (r=0,1; p=0,6).
Обсуждение
Исследование ЛПК, экспрессирующих белок Chk2, у облучённых людей в отдалённый период от начала воздействия ионизирующего излучения, позволило отметить увеличение доли клеток с блоком клеточного цикла, которое, вероятно, является результатом повреждения ДНК. Наибольшее количество клеток с задержкой клеточного цикла наблюдалось у людей с отдалённой лейкопенией.
Увеличение доли клеток с повреждением ДНК (оцененное по уровню белка Chk2) у облучённых людей в отдалённый период после начала облучения может свидетельствовать о нестабильности генома кроветворных клеток, включая СКК. Это предположение подтверждается данными in vitro, полученными в культурах клеток, свидетельствующими о радиационно-индуцированной нестабильности генома, возникающей у потомков облучённых клеток в отдалённые сроки после радиационного воздействия [4, 15]. В пользу этого предположения свидетельствуют ранее полученные результаты по оценке уровня нестабильных геномных мутации и хромосомных аберраций у хронически облучённых жителей прибрежных сёл р. Теча. Как отмечалось выше, в этих исследованиях было показано увеличение уровня мутаций в гене Тр53 [5], соматических мутаций (TCR) [5], хромосомных аберраций [6] у облучённых людей в отдалённый период от начала облучения.
Несмотря на достоверное увеличение доли клеток с блоком клеточного цикла (исходном уровне) у облучённых людей, после митогенной стимуляции культуры лимфоцитов и митогенной стимуляции совместно с облучением, доля клеток с блоком G1/S оставалась на уровне контрольных значений. Данный факт позволяет сделать заключение о нормализации процессов репарации у облучённых людей.
Исследование пролиферативной активности ЛПК облучённых людей в отдалённые сроки от начала облучения не выявило количественных изменений пролиферирующих клеток при сравнении со значениями у необлучённых людей. Однако значимое увеличение доли пролиферирующих ЛПК было отмечено у облучённых людей с лейкопенией. Тенденция к увеличению клеток, экспрессирующих белок ki-67, у облучённых людей с лейкопенией сохранилась после инкубации культуры лимфоцитов с ФГА. Вероятно, увеличение доли пролиферирующих кроветворных клеток обусловлено компенсаторными реакциями организма в ответ на снижение количества форменных элементов крови.
Обнаружена зависимость между абсолютным количеством лейкоцитов периферической крови облучённых людей и абсолютным количеством клеток, ответивших на митогенную стимуляцию делением (пролиферативный потенциал). Этот факт позволяет предположить, что абсолютное количество лейкоцитов крови у хронически облучённых людей зависит от пролиферативного потенциала СКК. Однако, у людей с лейкопенией такой зависимости не наблюдалось, что позволяет предположить снижение пролиферативного потенциала кроветворных клеток у этих лиц.
Проведённый статистический анализ зависимости «доза-эффект» у облучённых людей с отдалённой лейкопенией, и у людей, перенесших ХЛБ, а также у облучённых людей с нормальными показателями крови не выявил корреляции между дозой облучения ККМ и изучаемыми параметрами.
Таким образом, данные, полученные в результате проведённого исследования, позволяют предположить, что увеличение доли клеток с блоком клеточного цикла и их элиминация могут быть одной из причин развития лейкопении (вследствие возникающего дефицита клеток). Также увеличение пролиферативной активности ЛПК повышает вероятность малигнизации клеток и, как следствие, повышает риск развития лейкозов.
Выводы
-
1. В отдалённые сроки после хронического радиационного воздействия у облучённых жителей прибрежных сёл р. Теча (средняя накопленная доза облучения ККМ составила 1,15 Гр) выявлено увеличение относительного количества лимфоцитов периферической крови с задержкой клеточного цикла на стадии G1/S.
-
2. Наибольшее увеличение относительного количества лимфоцитов периферической крови с задержкой клеточного цикла отмечено у облучённых людей с лейкопенией в отдалённые сроки после хронического радиационного воздействия.
-
3. У облучённых людей с лейкопенией в отдалённые сроки после хронического радиационного воздействия отмечено увеличение спонтанно пролиферирующих лимфоцитов периферической крови.
Список литературы Пролиферативная активность и клеточный цикл лимфоцитов периферической крови (ЛПК) человека в отдалённые сроки после хронического радиационного воздействия
- Аклеев А.В., Варфоломеева Т.А. Состояние гемопоэза в условиях многолетнего облучения костного мозга у жителей прибрежных сёл р. Теча//Радиационная биология. Радиоэкология. 2007. Т. 47, № 3. С. 307-321.
- Жербин Е.А., Чухловин А.Б. Радиационная гематология. М.: Медицина, 1989. 176 с.
- Клаус Д. Лимфоциты. Методы. М.: Мир, 1990. 377 с.
- Мазурик В.К., Михайлов В.Ф. Радиационно-индуцируемая нестабильность генома: феномен, молекулярные механизмы, патогенетическое значение//Радиационная биология. Радиоэкология. 2001. Т. 41, № 3. С. 272-289.
- Медико-биологические и экологические последствия радиоактивного загрязнения реки Теча/Под ред. А.В.Аклеева, М.Ф.Киселева. М., 2001. 532 с.
- Медико-биологические эффекты хронического радиационного воздействия/Под. ред. А.В.Аклеева. Челябинск: Изд-во Фрегат, 2005. Т. 1. 380 с.
- Муксинова К.Н., Мушкачева Г.С. Клеточные и молекулярные основы перестройки кроветворения при длительном радиационном воздействии/Под. ред. А.К.Гуськовой. М.: Энергоатомиздат, 1990. 153 с.
- Ретроспективная оценка и мониторинг индивидуальных доз внутреннего облучения от долгоживущих радионуклидов у населения Уральского региона. Ретроспективная оценка поступления 90Sr и 137Cs в организм жителей прибрежных сёл реки Теча. Отчет НИР/УНПЦРМ; Инв. № 293. Челябинск, 2009. 70 с.
- Севанькаев А.В. Дозовая зависимость выхода аберраций хромосом в культуре лимфоцитов человека после γ-облучения в высоких дозах//Радиобиология. 1984. Т. 24, № 6. С. 67-69.
- Хейфец Л.Б., Абалакин В.А. Разделение форменных элементов крови человека в градиенте плотности верографин-фиколл//Лабораторное дело. 1973. № 10. С. 579-581.
- Bartek J., Lukas J. Chk1 and Chk2 kinases in checkpoint control and cancer//Cancer cell. 2003. N. 3. P. 421-429.
- Chu-Xia Deng. Survey and summary BRCA1: cell cycle checkpoint, genetic instability, DNA damage response and cancer evolution//Nucleic Acids Research. 2006. V. 34. P. 1416-1426.
- Kadhim M.A., Lorimore S.A., Hepburn M.D. et al. Alpha-particle-induced chromosomal instability in human bone marrow cells//Lancet. 1994. V. 344. P. 987-988.
- Kubbutat M.H., Key G., Duchrow M., Schluter C., Flad H.D., Gerdes J. Epitope analysis of antibodies recognising the cell proliferation associated nuclear antigen previously defined by the antibody Ki-67 (Ki-67 protein)//J. Clin. Pathol. 1994. V. 47, N 6. P. 524-528.
- Little J.B. Radiation-induced genomic instability//Int. J. Radiat. Biol. 1998. V. 74, N 6. P. 663-671.
- Lopez F., Belloc F., Lacombe F., Dumain P., Reiffers J., Bernard P., Boisseau M.R. Modalities of synthesis of Ki67 antigen during the stimulation of lymphocytes//Cytometry. 1991. V.12. P. 42-49.
- Nyberg K.A., Michelson Rh.J., Putnam C.W., Weinert T.A. Toward maintaining the genome: DNA Damage and Replication Checkpoints//Annual Review of Genetics. 2002. V. 36. P. 617-656.
- Prussin C., Metcalfe D. Detection of intracytoplasmic cytokine using flow cytometry and directry conjugated anti-cytokine antibodies//Immunol. Meth. 1995. N 188. P. 117-128.
- Zhou B.B., Elledge S.J. The DNA damage response: putting checkpoints in perspective//Nature. 2000. N 408. P. 433-439.
- IAEA. International Atomic Energy Agency Technical Reports Series No. 405.Cytogenetic Analysis for Radiation Dose Assessment: A Manual. 2001. P. 10-12.


