Протеасомная и кальпаиновая протеолитические системы при различных молекулярных подтипах рака молочной железы
Автор: Шашова Елена Евгеньевна, Дорошенко Артем Васильевич, Бондарь Людмила Николаевна, Слонимская Елена Михайловна, Кондакова Ирина Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.16, 2017 года.
Бесплатный доступ
Изучены показатели кальпаиновой и протеасомной систем при различных молекулярных подтипах рака опухолей молочной железы (РМЖ). В исследование был включен операционный материал от 147 больных раком молочной железы T1-3N0-2M0 стадии, не получавших неоадъювантной терапии. Выявлены изменения химотрипсинподобной активности протеасом, а также различные корреляционные взаимосвязи между показателями протеасомной и кальпаиновой систем, характерные для различных молекулярных подтипов РМЖ. Не обнаружено ярко выраженных, специфических для различных молекулярных подтипов РМЖ изменений в активности кальпаинов и в содержании субъединиц протеасом. Полученные результаты показывают, что работа протеамсоной системы претерпевает изменения в зависимости от экспрессии рецепторов опухолевыми клетками, и этот аспект нуждается в дальнейшем исследовании.
Молекулярные подтипы рака молочной железы, активность протеасом, активность кальпаинов, субъединичный состав протеасом
Короткий адрес: https://sciup.org/140254118
IDR: 140254118 | УДК: 618.19-006.6:577.112 | DOI: 10.21294/1814-4861-2017-16-3-33-39
Текст научной статьи Протеасомная и кальпаиновая протеолитические системы при различных молекулярных подтипах рака молочной железы
При диагностике рака молочной железы (РМЖ) в настоящее время используются клеточные маркеры, которые характеризуют определенный молекулярный подтип опухоли, что важно для индивидуализации лекарственного лечения и прогнозирования исхода заболевания. К таким маркерам относят: экспрессию рецепторов эстрогенов, прогестерона, HER-2/neu и маркер пролиферативной активности Ki67.
Одним из основных путей регуляции уровня и активности рецепторов, компонентов сигнальных путей, факторов транскрипции, участвующих в формировании РМЖ, является протеолиз, опосредуемый убиквитин-протеасомной и кальпаи-новой системами. Протеасома представляет собой мультикаталитический мультисубъединичный комплекс, состоит из каталитической сердцевины (конститутивные альфа- и бета-субъединицы), к которой присоединен определенный регуляторный комплекс, и обладает тремя основными протеоли- тическими активностями: химотрипсинподобной (ХПА), трипсинподобной и каспазаподобной (КПА) [1]. Если к коровой части протеасом присоединяется регулятор РА28, то формируется 20S протеасома, в которой происходит расщепление коротких полипептидов. Если в роли активаторной частицы выступает 19S регуляторный комплекс, то формируется 26S протеасома, которая принимает участие в деградации основной массы клеточных белков. Также может произойти формирование модифицированных форм протеасом, благодаря замене конститутивных субъединиц на иммунные, или путем присоединения различных регуляторов, что может сопровождаться изменением активности протеасом [2].
Кальпаины представляют собой кальцийза-висимые цитозольные цистеиновые протеиназы, которые не деградируют белок полностью, а лишь изменяют его структуру и выполняют частичный протеолиз [3] . Субстратами для кальпаиновой си-
стемы являются некоторые онкобелки, продукты онкосупрессоров, актин-связывающие белки [4].
В ряде исследований продемонстрировано участие убиквитин-протеасомной и кальпаиновой систем в развитии опухолей различных локализаций, причем эти изменения разнонаправленные. В частности, развитие рака эндометрия связано с повышением ХПА активности протеасом, увеличением содержания LMP2, LMP7, PA28 субъединиц и снижением экспрессии α1α2α3α5α6α7 субъединиц протеасом [5]. При раке щитовидной железы с метастазами в регионарные лимфоузлы, а также при раке толстой кишки с лимфогенными и гематогенными метастазами выявлено увеличение ХПА активности протеасом [6, 7]. В то же время при плоскоклеточном раке головы и шеи высокая ХПА активность протеасом является благоприятным прогностическим признаком и ассоциируется с более высокими показателями общей 2-летней выживаемости [8]. У больных эпителиальным раком яичников III стадии со сниженной активностью внутриклеточных протеаз обнаружено прогрессирование заболевания после лечения и достигнутой стабилизации [9]. У больных раком почки отмечается изменение активности кальпаинов и протеасом в опухоли после лечения эверолимусом и ингибиторами тирозинкиназ [10, 11]. При РМЖ с обширными лимфогенными метастазами наблюдается значительное угнетение активности протеасом, что в дальнейшем может рассматриваться в качестве неблагоприятного прогностического признака [12]. При трижды негативном РМЖ продемонстрировано, что высокое содержание кальпаина-2 связано с более низкими показателями общей выживаемости [13].
Для рака молочной железы показано, что взаимодействие эстрогеновых рецепторов с сигнальными путями, реализуемыми через рецепторы эпидермального фактора роста (EGFR), играет существенную роль в развитии резистентности опухоли к эндокринному воздействию [14, 15]. В литературе имеются данные о том, что протеасо-мы принимают участие в регуляции доступности эстрогеновых рецепторов и, кроме того, в разрушении рецепторов прогестерона, в снижении экспрессии рецепторов EGFR и HER-2/neu, деградации рецепторов инсулиноподобных факторов роста гормонов, а также ряда транскрипционных факторов [16–19]. В то же время была показана связь наличия эстрогеновых рецепторов с изменением химотрипсинподобной активности протеасом при РМЖ [20]. Эти результаты указывают на то, что при РМЖ изменение показателей протеасомной системы может быть обусловлено наличием или отсутствием рецепторов эстрогенов (РЭ), прогестерона (РП), HER-2/neu.
Целью исследования явилось изучение показателей кальпаиновой и протеасомной систем при различных вариантах рака молочной железы.
Материал и методы
Всего в исследование было включено 147 пациенток с РМЖ T1-3N0-2M 0 стадии, в возрасте от 28 до 70 лет (средний возраст – 54,7 ± 9,9 года). У 67 пациенток диагностирован люминальный А РМЖ, у 54 – люминальный В, у 19 пациенток – трижды негативный, у 7 – НЕR-2 позитивный рак молочной железы. Все пациентки получали комбинированное лечение: радикальная операция с адъювантной химио-, гормоно- или лучевой терапией по показаниям. Неоадъювантное лечение не проводилось. Материалом для исследования явилась опухолевая и условно не измененная ткань (взятая на расстоянии не менее 1 см от границы опухоли) молочной железы, полученная после оперативного вмешательства.
Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан (Указ Президента РФ от 24.12.93, № 2288), на основании разрешения локального комитета по биомедицинской этике НИИ онкологии Томского НИМЦ.
Оценка состояния протеасомной и кальпаи-новой систем проводилась путем определения общей активности кальпаинов, химотрипсиноподобной и каспазаподобной активностей протеасом флуориметрическим методом. На первом этапе для определения активности протеасом из изучаемых тканей получали осветленные гомогенаты. Гомогенат центрифугировали 60 мин при 10 000g и 4оС.
Определение активности протеасом и каль-паинов. Химотрипсиноподобную активность протеасом (ХПА), каспазаподобную активность протеасом (КПА) и активность кальпаинов (АК) определяли в осветленных гомогенатах опухолевой ткани по гидролизу специфичных флуорогенных олигопептидов. Для определения химотрипсинпо-добной активности протеасом в качестве олигопептида использовали Suc-LLVY-AMC (Sigma, США), который утилизируется химотрипсинподобными центрами протеасом [21]. Для оценки каспаза-подобной активности протеасом в качестве олигопептида использовали Cbz-LLG-AMC (Sigma, США). Реакцию проводили при 37ºС в течение 20 мин. Для исключения вклада примесных протеолитических активностей в пробы добавляли 7 мкМ MG132 (Sigma, США), ингибитора активности протеасом. Активность кальпаинов определяли по методу S. Sandmann в модификации [22]. Для определения активности кальпаинов в качестве субстрата использовали Suc-LLVY-AMC (Sigma, США). Реакцию проводили при 25°С в течение 30 мин в присутствии или в отсутствие 10 мМ CaCl2 и 0.4 мкМ специфического ингибитора каль-паинов N-ацетил-Leu-Leu-норлейцинал (Sigma). Образовавшиеся продукты регистрировали на флуориметре при длине волны возбуждения 380 нм и эмиссии 440 нм. Окончательные расчеты про- водили по разнице между полной и остаточной активностями в присутствии соответствующих ингибиторов. За единицу активности протеасом или кальпаинов принимали количество фермента, при котором гидролизуется 1 нмоль соответствующего субстрата в течение 1 мин. Удельную активность протеасом и кальпаинов выражали в единицах активности на 1мг белка. Содержание белка определяли по методу Лоури.
Определение экспрессии субъединиц протеасом . Экспрессия субъединиц протеасом (α1α2α3α5α6α7, LMP2, LMP7, РА28в, Rpt6) оценивалась с помощью метода Вестерн-блоттинг с применением первичных антител к субъединицам протеасом в разведении 1:500 и к в—актину (1:1500), вторичными антителами goat anti-mouse IgG-horseradish peroxidase (HRP) и goat ani-rabbit IgG-HRP (Santa Cruz Biotechnology, США). За 100 % был принят уровень субъединиц протеасом в неизмененной ткани. Проводилась стандартизация значений субъединичного состава на содержание β-актина. Результаты выражали в процентах от содержания субъединиц протеасом в неизмененной ткани.
Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 8.0. Достоверность различий между группами определяли с помощью непараметрического критерия Манна - Уитни для независимых выборок. Также был проведен дисперсионный анализ с использованием непараметрического критерия Краскол – Уоллиса (F). Рассчитывался коэффициент ранговой корреляции Спирмена для оценки взаимосвязи признаков. В таблицах все результаты представлены как медиана, разброс значений - как 25-75 % квартиль. Различия считались значимыми при р<0,05.
Результаты и обсуждение
При изучении активности протеасомной и кальпаиновой внутриклеточных протеолитических систем в опухолевой ткани методом дисперсионного анализа было выявлено значимое изменение химотрипсинподобной активности протеасом при различных молекулярных подтипах опухоли (H=8,02; p=0,04).
При попарном сравнении исследуемых групп показано, что более низкие значения ХПА активности были для НЕR-2 позитивного РМЖ по сравнению с другими молекулярными подтипами опухоли (p<0,05) (таблица). При трижды негативном РМЖ ХПА активность была в 1,3 раза выше по сравнению с люминальным А раком (p<0,05).
Значимых изменений КПА и АК в зависимости от молекулярного типа опухоли обнаружено не было. При этом следует отметить, что наименьшие медианные значения активности КПА и АК были зарегистрированы для НЕR-2 позитивного РМЖ, при люминальном В РМЖ была отмечена максимальная КПА активность протеасом, а наиболее высокие значения активности кальпаинов были получены при трижды негативном РМЖ.
Вероятно, изменение активности протеасом может быть связано с их субъединичным составом. Именно поэтому на следующем этапе исследования проводилась оценка особенностей субъединичного состава протеасом при различных молекулярных подтипах РМЖ. При различных молекулярных подтипах опухоли было зарегистрировано изменение экспрессии PA28β регуляторной субъединицы 20S протеасом методом дисперсионного анализа (Н=6,82; p=0,04).
При попарном сравнении значимые изменения были зарегистрированы для а1а2а3а5а6а7 субъединиц тотального пула протеасом и РА28В субъединиц. Так, при люминальном А раке выявлено повышение содержания субъединиц α1α2α3α5α6α7 в 1,7 раза по сравнению с люминальным В раком. Содержание РА28ß субъединицы было выше в 2,6 раза при люминальном А РМЖ, в 3 раза – при люминальном В и в 1,7 раза при HER-2 позитивном РМЖ по сравнению с больными, имеющими трижды негативный фенотип опухоли (р<0,05) (рис. 1).
Таблица
Изменение активности протеасомной и кальпаиновой внутриклеточных протеолитических систем в опухолевой ткани при различных молекулярных подтипах рака молочной железы
|
Молекулярный подтип РМЖ |
Химотрипсиноподобная активность протеасом |
Каспазаподобная активность протеасом |
Активность кальпаинов |
|
Люминальный А (n=67) |
37,7* |
47,4 |
71,3 |
|
(16,5–81,9) |
(21,3–183,6) |
(36,1–171,6) |
|
|
Люминальный В (n=54) |
45,7* |
94,4 |
77,3 |
|
(19,8-83,2) |
(30,8–298,4) |
(55,9–111,9) |
|
|
Трижды негативный (n=19) |
50,6* ** |
51,4 |
99,9 |
|
(34,9-113,4) |
(35,3-151,5) |
(92,7-163,3) |
|
|
НЕR-2 позитивный (n=7) |
15,8 |
12,5 |
64,7 |
|
(9,6-16,9) |
(25,4-132,9) |
(43,5-142,7) |
Примечание: * – значимость различий с группой НЕR-2 позитивный рак молочной железы, p<0,05; ** – значимость различий с группой люминальный А рак молочной железы, p<0,05.
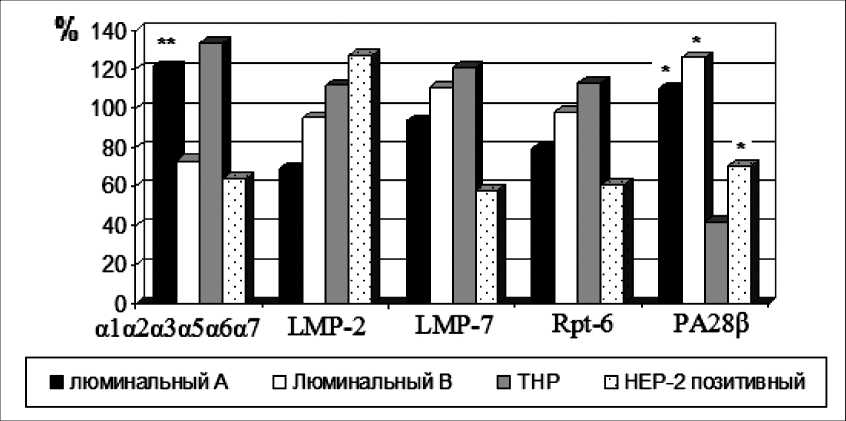
Рис. 1. Субъединичный состав протеасом в опухолевой ткани больных различными молекулярными подтипами рака молочной железы. Примечание: за 100 % принят уровень субъединиц в неизмененной ткани;
* – значимость различий с группой трижды негативного РМЖ, p<0,05;
** – значимость различий с группой люминальный В рак молочной железы, p<0,05
Обобщая данные об активности и содержании внутриклеточных протеолитических систем при различных молекулярных подтипах РМЖ, следует отметить, что для люминального А рака были характерны умеренные значения ХПА, КПА активности протеасом и активности кальпаинов в опухоли. Особенностью субъединичного состава протеасом люминального А РМЖ является высокое содержание РА28ß – регуляторных субъединиц 20S протеасом и α1α2α3α5α6α7 субъединиц тотального пула протеа-сом. Люминальный В подтип РМЖ характеризуется высокой каспазаподобной активностью протеасом, высоким содержанием РА28ß субъединиц при умеренных значениях ХПА активности протеасом, активности кальпаинов, содержании регуляторных Rpt-6 субъединиц 26S протеасом, иммунных субъединиц и субъединиц тотального пула. Для трижды негативных опухолей была характерна высокая активность кальпаинов, умеренная ХПА и КПА активности протеасом и наименьшее содержание регуляторных субъединиц 20S протеасом при сравнительно высоком содержании регуляторных Rpt-6 субъединиц, иммунных субъединиц LMP-2, LMP-7 и α1α2α3α5α6α7 субъединиц. В опухолевой ткани пациентов с НЕR-2 позитивным РМЖ выявлены наименьшие значения активности протеасомной и кальпаиновой внутриклеточных протеолитических систем. Содержание субъединиц протеасом было сравнительно низким, за исключением содержания иммунных LMP-2 субъединиц. Вероятно, низкая активность изучаемых внутриклеточных протеолитических систем при НЕR-2 позитивном раке является отражением агрессивного поведения опухоли и, вероятно, может быть характерной особенностью данного типа опухолей.
Список литературы Протеасомная и кальпаиновая протеолитические системы при различных молекулярных подтипах рака молочной железы
- Шарова Н.П. Протеасомы в судьбе злокачественной опухоли. Природа. 2008; 5: 20-26.
- Grigoreva T.A., Tribulovich V.G., Garabadzhiu A.V., Melino G., Barlev N.A. The 26S proteasome is a multifaceted target for anti-cancer therapies. Oncotarget. 2015; 6 (28): 28. DOI: 10.18632/oncotarget.4619
- Sorimachi H., Hata S., Ono Y. Calpain chronicle an enzyme family under multidisciplinary characterization. Proc Jpn Acad Ser B Phys Biol Sci. 2011; 87 (6): 287-327.
- Storr S.J., Carragher N.O., Frame M.C., Parr T., Martin S.G. The calpain system and cancer. Nat Rev Cancer. 2011 May; 11 (5): 364-74. DOI: 10.1038/nrc3050
- Спирина Л.В., Кондакова И.В., Коломиец Л.А., Чернышова А.Л., Асадчикова О.Н., Шарова Н.П., Коваль В.Д. Активность протеасом и их субъединичный состав при гиперпластических процессах и раке эндометрия. Опухоли женской репродуктивной системы. 2011; 4: 64-68.


