Протекторные свойства водорастворимых полимерных композиций и их твердофазной модификации при предпосевной обработке инокулированных семян сои Glycine max (L.) Merr
Автор: Лактионов Ю.В., Косульников Ю.В., Дудникова Д.В., Яхно В.В., Кожемяков А.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биопрепараты и биозащита
Статья в выпуске: 5 т.54, 2019 года.
Бесплатный доступ
Водорастворимые полимеры в качестве прилипателей и пленкообразователей обеспечивают лучшую адгезию бактерий на семенах (по типу многокомпонентных формуляций при производстве современных химических протравителей). В этом качестве испытывались альгинат натрия низкой и высокой молекулярной массы (FMC полимер), гидроксипропилметилцеллюлоза (HPMC) (Colorcon®, «Colorcon, Inc.», США), полиэтиленгликоль (ПЭГ, PEG), карбомер (карбопол), поливиниловый спирт (PVA) и поливинилпирролидон (повидон, PVP). Более того, как оказалось, полимеры также способны удлинять период хранения биопрепаратов, повышать их совместимость с химическими средствами защиты, устойчивость к УФ-излучению, перепадам температур, высыханию, увеличивать выживаемость на поверхности семени, что позволяет производить обработку заблаговременно. Требования к создаваемым полимерным композициям - их бóльшая эффективность по сравнению с однокомпонентными при экономичности в производстве и технологичности в применении. В настоящей работе нами впервые показано, что твердофазный компонент (активированный уголь) улучшает протективные свойства полимерной композиции при предпосевной бактериальной инокуляции семян, а из исследованных полимеров выделен поливинилпирролидон как самый эффективный протектор ризобий, применение которого позволяет увеличить допустимый интервал между инокуляцией семян и их посевом. Цель работы заключалась в комплексном исследовании водорастворимых полимеров - поливинилпирролидона, поливинилового спирта, альгината натрия и карбоксиметилцеллюлозы как добавок к инокулянту для сои на основе штамма 634б Bradyrhizobium japonicum . Инокуляции и обработке полимерными композициями подвергали семена сои сорта Белгородская 7. По результатам исследования 10 % раствор поливинилпирролидона определен как наиболее эффективный среди исследованных полимеров. Его использование позволяет увеличить выживаемость клубеньковых бактерий на семенах более чем в 10 раз через 10 сут после инокуляции семенного материала. Варианты с различными концентрациями карбоксиметилцеллюлозы и альгината натрия не способны обеспечивать выживаемость бактерий на семенах более 3 сут. Возможно создание улучшенной полимерно-угольной композиции со сниженной концентрацией поливинилпирролидона (7,5 % PVP и 5,0 % активированного угля). Эффективность такой композиции выше, чем при использовании поливинилпирролидона без угля, и на 20-30 % уменьшает гибель бактерий на инокулированных семенах после первых 5-7 сут хранения семян.
Симбиотические азотфиксаторы, биопрепараты, инокуляция, соя, поливинилпирролидон, поливиниловый спирт, альгинат натрия, карбоксиметилцеллюлоза
Короткий адрес: https://sciup.org/142226255
IDR: 142226255 | УДК: 633.34:631.461.52:579.64 | DOI: 10.15389/agrobiology.2019.5.1052rus
Текст научной статьи Протекторные свойства водорастворимых полимерных композиций и их твердофазной модификации при предпосевной обработке инокулированных семян сои Glycine max (L.) Merr
Соя относится к ценным бобовым культурам и имеет большое продовольственное, кормовое и агротехническое значение (1-3). Семена сои богаты легко усваиваемым белком (содержание в семенах 39-42 %) и ценным маслом (содержание в семенах 18-23 %), а ее зеленая масса, убранная не позднее фазы налива бобов, — питательный (22-23 корм. ед. на 100 кг зеленой массы) и богатый витаминами (50-60 мг каротина на 1 кг зеленой массы) корм (4, 5). Благодаря интенсивной азотфиксации и высокой агротехнике возделывания соя играет положительную средообразующую роль в севооборотах и значительно повышает урожай сопутствующих культур (6, 7). Соя считается хорошим предшественником для зерновых, пропашных и кормовых культур. С агротехнологической точки зрения соя очень пластична, ее (в зависимости от агро- и почвенно-климатических условий) можно возделывать и как зерновую, и как пропашную культуру, в широких
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (Соглашение ¹ 14.607.21.0178, RFMEFI60717X0178).
пределах варьируя нормы внесения удобрений и средств защиты (8, 9). Большое разнообразие сортов с разной скороспелостью и требовательностью к факторам роста позволяет легко адаптировать сою к условиям выращивания. Все перечисленное позволяет рассматривать сою как универсальную культуру (10).
Важная агробиологическая особенность сои заключается в способности к формированию азотфиксирующего бобово-ризобиального симбиоза (11, 12). Такой симбиоз полностью обеспечивает потребности растений в азоте (13), однако столь интенсивная азотфиксация возможна лишь в оптимальных условиях, в частности при наличии в почве активных вирулентных бактерий-симбионтов сои, причем в количестве, достаточном для образования эффективного симбиоза (14, 15). Как правило, добиться этого можно лишь при условии искусственной предпосевной инокуляции семян сои биопрепаратами клубеньковых бактерий (16, 17). Важно не только правильно подобрать штамм бактерий, который будет наиболее эффективен в соответствующих почвенно-климатических условиях, но также качественно инокулировать семена таким препаратом, что для применяемых в настоящее время инокулянтов подразумевает, помимо прочего, обязательную заделку обработанных семян в день обработки (18).
На практике именно такое требование вызывает у крупных хозяйств наибольшие трудности, потому именно им зачастую и пренебрегают. Как правило, это приводит к значительному снижению эффекта от применения инокулянта, что выражается в образовании маломощной клубеньковой системы, последующем азотном голодании и в итоге в значительном недоборе урожая. В связи с этим внимание исследователей в последнее время направлено на разработку способов, позволяющих увеличить число клубеньковых бактерий на инокулированном семени на момент его заделки в почву. Одним из наиболее перспективных направлений считается сочетание полимерных растворов, выступающих в роли прилипа-телей, пленкообразователей и протекторов ризобий на обработанных семенах, с инокулянтом (19, 20). Полимерные растворы должны, во-первых, фиксировать бактерии в полимерных пленках, сохраняя тем самым как можно большее число бактерий на обрабатываемых семенах, во-вторых, повышать устойчивость бактерий к неблагоприятным факторам среды, таким как высыхание, воздействие солнечного света, перепад температур и выделение семенем токсичных для ризобий экссудатов. В совокупности такие свойства полимеров способствуют увеличению срока между инокуляцией семян и их посевом (21, 22).
Наибольшее распространение в качестве полимерных прилипателей в сельскохозяйственной практике получили поливинилпирролидон (повидон), поливиниловый спирт, альгинат натрия и карбоксиметилцеллюлоза (23), однако их эффективность как протекторов ризобий в целом малоизу-чена. Особенно остро стоит вопрос об эффективности того или иного полимера и его оптимальных концентрациях, а также о рекомендациях по его применению в качестве протектора бактерий для конкретной пары штамм ризобий—сорт.
В настоящей работе, проанализировав эффект ряда водорастворимых полимеров, мы выделили в качестве наиболее эффективного протектора ризобий поливинилпирролидон (его применение позволяет увеличить допустимый интервал между инокуляцией семян и их посевом) и впервые показали, что твердофазный компонент (активированный уголь) улучшает протективные свойства полимерной композиции при предпосевной бактериальной инокуляции семян.
Цель работы заключалась в оценке временн о й динамики количества жизнеспособных ризобий на инокулированных семенах сои под влиянием ряда полимеров в разных концентрациях, в составе смесей различных компонентов и при оптимизации полимерных протекторов активированным углем.
Методика . Для получения биопрепарата Bradyrhizobium japonicum штамм 634б (Ведомственная коллекция полезных микроорганизмов сельскохозяйственного назначения ФГБНУ ВНИИСХМ) выращивали в жидкой полусинтетической среде в течение 1 нед при 28 ° С с аэрацией (на шейкере) (24).
В качестве полимерных добавок к инокулянту использовали водорастворимые полимеры — поливинилпирролидон («Sigma-Aldrich», США), поливиниловый спирт PVA марки 4-98, 4-88 («Sigma-Aldrich», США), альгинат натрия («Xiamen Huaxuan Gelatin Co., Ltd», Китай) и карбоксиме-тилцеллюлозу (ЗАО «Карбокам», Россия), в качестве твердофазного компонента для полимерных протекторов — порошок активированного угля (марка ОУ-А, ОАО «Сорбент», Россия). Семена сои сорта Белгородская 7 инокулировали биопрепаратом следующим образом. Навески семян (25 г) помещали в чашки Петри и вносили 0,25 мл 20 % суспензии штамма B. japonicum 634б. Чашки с инокулированными семенами хранили при комнатной температуре в темноте, периодически отбирая пробы для приготовления смывов (первый раз — через 1 ч после инокуляции, затем через 27, 72, 124, 168 и 240 ч.
При определения числа жизнеспособных бактерий на 1 семени сои 8 инокулированных семян, взятых из чашки Петри, помещали в пробирку с 8 мл стерильной воды и встряхивали на вортексе в течение 1 мин. Готовили серию последовательных 10-кратных разведений полученного смыва с последующим посевом на чашки Петри с агаризованной питательной средой (K 2 HPO 4 — 0,5 г/л, MgSO 4 •7H 2 O — 0,2 г/л, NaCl — 0,1 г/л, дрожжевой экстракт — 1,0 г/л, маннит — 10,0 г/л, агар-агар — 16 г/л; рН = 6,8-7,2), инкубировали при 28 ° С и подсчитывали образовавшиеся колонии. На основании определения титра бактерий в смыве определяли их число в расчете на 1 инокулированное семя. Опыт выполняли в 4-кратной биологической повторности.
Статистическую обработку данных проводили с использованием программы Microsoft Excel 10. На рисунках и в таблицах представлены средние ( M ) и стандартные ошибки средних (±SEM). Различия оценивали по t -критерию Стьюдента и считали статистически значимыми при р < 0,05. Дисперсионный анализ полученных результатов выполнен по Б.А. Доспе-хову (25). В вариантах с применением в качестве протектора поливинил-пирролидона разница с контролем превышала значения НСР05 и была статистически значимой.
Результаты . Поверхность семян сои представляет собой неблагоприятную среду для B. japonicum (рис. 1, А). На том же рисунке изображена кривая сокращения (КС) числа живых ризобий, полученная при обработке семян сои раствором бактериальной суспензии с добавлением поли-винилпирролидона в концентрации 100 г/л. Выбор поливинилпирролидо-на в качестве основы протектора обусловлен результатами ряда работ, приписывающих поливинилпирролидону такие свойства, как высокая адгезивность и водоудержание, а также способность защищать бактерии от токсичных семенных экссудатов и повышать общую жизнеспособность бактерий на инокулированных семенах (22).
Мы показали, что добавление поливинилпирролидона значительно повышает выживаемость ризобий сои на инокулированных семенах. Так, в контрольном варианте (КВ) число жизнеспособных бактерий на семенах пересекает необходимый для эффективного симбиоза порог (около 40000 КОЕ на 1 семени) за 72 ч. С поливинилпирролидоном КС за 1 сут падает до стабильного уровня в 500000 КОЕ на 1 семени и не претерпевает заметного падения в течении, как минимум, 10 сут.
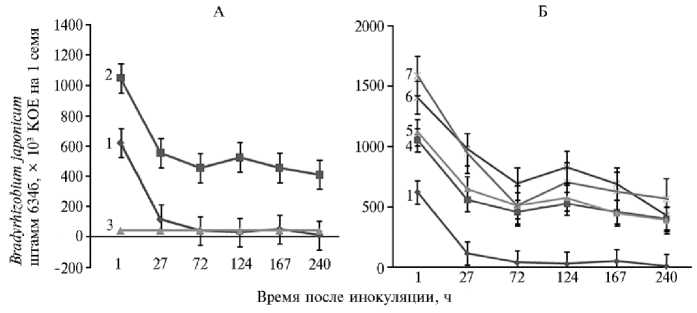
Рис. 1. Сохранность бактерий Bradyrhizobium japonicum штамм 634б на инокулированных семенах сои сорта Белгородская 7 в присутствии поливинилпирролидона (А) и при его сочетании с активированным углем в составе повидон-угольных композиций (Б) : 1 — контроль, 2 — поли-винилпирролидон (100 г/л), 3 — количество жизнеспособных ризобий на одном семени, необходимое для образования эффективного симбиоза, 4 — поливинилпирролидон (100 г/л) + активированный уголь (0 г/л), 5 — поливинилпирролидон (100 г/л) + активированный уголь (25 г/л), 6 — поливинилпирролидон (100 г/л) + активированный уголь (50 г/л), 7 — поливинилпирролидон (100 г/л) + активированный уголь (75 г/л) (лабораторный опыт).
Успешная практика модификации полимерных растворов описана, в частности, в работе, посвященной влиянию добавок ZnO и MgO на действие карбоксиметилцеллюлозы как соединения, способствующего увеличению выживаемости клубеньковых бактерий сои при хранении в жидкой культуре (26). В нашем исследовании добавление к раствору поливинил-пирролидона твердофазного наполнителя (активированный уголь) также позволило несколько повысить эффективность композиции на основе по-ливинилпирролидона (см. рис. 1, Б). Оптимальное количество угля в итоговом растворе составило 50 г/л.
Аналогичным образом подобрали оптимальную концентрацию по-ливинилпирролидона (75 г/л) в сочетании с активированным углем (50 г/л) в составе повидон-угольной композиции (рис. 2).
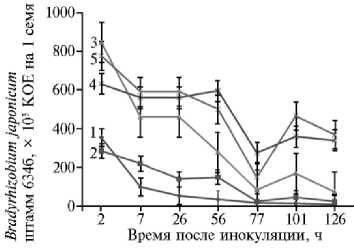
Рис. 2. Сохранность бактерий Bradyrhizobium ja-ponicum штамм 634б на инокулированных семенах сои сорта Белгородская 7 в зависимости от состава повидон-угольных композиций: 1 — контроль, 2 — поливинилпирролидон (25 г/л) + активированный уголь (50 г/л), 3 — поливинилпирролидон (50 г/л) + активированный уголь (50 г/л), 4 — по-ливинилпирролидон (75 г/л) + активированный уголь (50 г/л), 5 — поливинилпирролидон (100 г/л) + активированный уголь (50 г/л) (лабораторный опыт).
Таким образом, результаты наших экспериментов показали высокую эффективность поливинилпирролидона в качестве полимерной основы протектора ризобий, однако его сравнительно высокая стоимость существенно ограничивает возможности промышленного производства протектора на его основе. В связи с этим мы сравнили ряд дешевых полимеров-аналогов, получивших распространение в сельском хозяйстве в качестве прилипателей и потенциально способных заменить (полностью или частично) дорогой по-ливинилпирролидон в составе полимер-угольной композиции.
Один из таких аналогов — поливиниловый спирт, который описан как инкапсулирующий семена полимер, способствующий повышению устойчивости клубеньковых бактерий к стресс-факторам (27). Поливиниловые спирты обоих марок изучили по аналогичной для поливинилпир-ролидона методике (табл. 1). Как оказалось, поливиниловый спирт, хотя и увеличивает выживаемость ризобий на семенах, значительно уступает в эффективности поливинипирролидону.
1. Сохранность бактерий Bradyrhizobium japonicum штамм 634б на инокулированных семенах сои сорта Белгородская 7 в присутствии поливинилового спирта (103 КОЕ на 1 семя, N = 4, лабораторный опыт)
|
Время после инокуляции, ч |
Вариант |
|||||
|
контроль |
50 г/л |
75 г/л 1 |
100 г/л |
200 г/л |
НСР 05 |
|
|
Поливинил |
овый спирт |
PVA 4-98 |
||||
|
1 |
255±12,1 |
300±13,4 |
470±18,2 |
580±23,6 |
845±31,7 |
35,40 |
|
19 |
25±1,1 |
25±1,2 |
30±1,7 |
55±2,1 |
105±4,2 |
5,08 |
|
66 |
0 |
0 |
0 |
5±0,9 |
20±1,4 |
2,45 |
|
93 |
0 |
15±0,7 |
0 |
0 |
0 |
0 |
|
Поливинил |
овый спирт |
PVA 4-88 |
||||
|
3 |
85±3,3 |
180±4,2 |
255±6,7 |
305±7,4 |
425±9,5 |
8,97 |
|
50 |
0 |
0 |
0 |
0 |
30 |
0 |
|
76 |
0 |
0 |
0 |
0 |
10 |
0 |
В качестве полимерных протекторов мы также протестировали кар-боксиметилцеллюлозу и альгинат натрия. Выбор этих полимеров был обусловлен сообщениями об их благоприятном влияние на жидкую культуру клубеньковых бактерий в процессе хранения (23). Для альгината натрия показана способность поддерживать жизнеспособность ростостимулирующих бактерий на инокулированных стеклянных шариках в течение более 14 лет (28). Однако в наших опытах эффект от применения карбоксиметилцел-люлозы и альгината натрия как протекторов для бактерий оказался весьма незначительным (табл. 2).
2. Сохранность бактерий Bradyrhizobium japonicum штамм 634б на инокулированных семенах сои сорта Белгородская 7 в присутствии карбоксиметилцел-люлозы и альгината натрия (103 КОЕ на 1 семя, N = 4, лабораторный опыт)
|
Время после |
Вариант |
|||||
|
контроль |
карбоксиметилцеллюлоза |
альгинат натрия |
НСР 05 |
|||
|
инокуляции, ч |
25 г/л |
50 г/л |
25 г/л |
50 г/л |
||
|
3 |
105±3,7 |
155±4,6 |
175±4,2 |
215±8,4 |
478±11,7 |
10,58 |
|
50 |
25±3,4 |
98±6,9 |
150±8,4 |
200±12,1 |
153±9,8 |
20,26 |
|
76 |
0 |
5±0,9 |
34±1,7 |
9±1,2 |
71±3,1 |
1,04 |
Кроме того, отметим, что альгинат натрия и в особенности кар-боксиметилцеллюлоза загущают растворы гораздо сильнее, чем поливи-нилпирролидон в тех же концентрациях, следовательно, эти полимеры не только неэффективны как протекторы ризобий, но и значительно менее технологичны. В работе других авторов также показано, что альгинат натрия и карбоксиметилцеллюлоза, успешно поддерживающие жизнеспособность бактерий в жидкой культуре в процессе хранения, оказались неэффективными протекторами на семенах (23). В этом же исследовании по-ливинилпирролидон был исключительно эффективным полимерным протектором ризобий на семенах, но угнетал бактерий в процессе хранения в жидкой культуре (23). В то же время сообщалось, что в концентрации 4 % поливинилпирролидон успешно защищает клетки Azotobacter vinelandii в жидкой культуре при долгом хранении (29), описано благотворное влияние поливинилпирролидона на хранящуюся культуру клубеньковых бактерий (30), что может указывать на видовую (штаммовую) специфичность действия полимера на бактериальные культуры.
Учитывая высокую стоимость поливинилпирролидона, мы изучили возможность его хотя бы частичного замещения альгинатом натрия и кар-боксиметилцеллюлозой в составе полимер-угольной композиции (рис. 3).
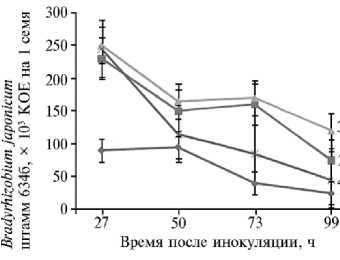
Рис. 3. Сохранность бактерий Bradyrhizobium ja-ponicum штамм 634б на инокулированных семенах сои сорта Белгородская 7 в вариантах с частичным замещением поливинилпирролидона в составе по-видон-угольных композиций на карбоксиметилцел-люлозу и альгинат натрия: 1 — контроль, 2 — поли-винилпирролидон (25 г/л) + активированный уголь (50 г/л), 3 — поливинилпирролидон (25 г/л) + активированный уголь (50 г/л) + карбоксиметил-целлюлоза (50 г/л), 4 — поливинилпирролидон (25 г/л) + активированный уголь (50 г/л) + альгинат натрия (50 г/л) (лабораторный опыт).
Добавление альгината натрия в повидон-угольную композицию несколько снизило эффект последней, а карбоксиметилцеллюлоза практически не изменила ее эффективности, что указывает на невозможность даже частичной замены поливинилпирролидона в составе повидон-угольной композиции иным полимером.
Итак, поверхность семян сои представляет собой неблагоприятную среду для штамма 634б Bradyrhizobium japonicum : число этих бактерий в расчете на одно инокулированное семя падает с 620 тыс. (1 ч после обработки) до 115 тыс. (27 ч после обработки). Гибель бактерий можно существенно замедлить, применяя полимерные добавки к инокулянту. Самым эффективным протектором ризобий среди исследованных полимеров был поливинилпирролидон: при его применении в концентрации 100 г/л на одном семени сохранялось 500 тыс. жизнеспособных ризобий на протяжении 10 сут. Полимерную основу этого протектора можно модифицировать активированным углем, что усиливает действие повидон-угольной композиции в 1,5-2,0 раза (оптимальная концентрация повидона в композиции — 75 г/л, активированного угля — 50 г/л). Возможные полные или частичные заменители повидона (поливиниловый спирт, альгинат натрия, карбоксиметилцеллюлоза) в предлагаемой композиции не проявили эффективности.
Список литературы Протекторные свойства водорастворимых полимерных композиций и их твердофазной модификации при предпосевной обработке инокулированных семян сои Glycine max (L.) Merr
- Regar M.K., Meena R.H., Jat G., Mundra S.L. Effect of different rhizobial strains on growth and yield of soybean [Glycine max (L.) Merrill]. International Journal of Current Microbiology and Applied Sciences, 2017, 6(11): 3653-3659 ( ). DOI: 10.20546/ijcmas.2017.611.427
- Вавилов П.П., Посыпанов Г.С. Бобовые культуры и проблема растительного белка. М., 1983.
- De Micco V., Buonomo R., Paradiso R., De Pascale S., Aronne G. Soybean cultivar selection for Bioregenerative Life Support Systems (BLSSs): theoretical selection. Advances in Space Research, 2012, 49: 1415-1421 ( ). DOI: 10.1111/plb.12056
- Lamptey S., Ahiabor B.D.K., Yeboah S., Asamoah C. Response of soybean (Glycine max) to rhizobial inoculation and phosphorus application. Journal of Experimental Biology and Agricultural Sciences, 2014, 2(1): 72-77.
- Агафонов Е.В., Гужвин С.А. Резервы увеличения сбора белка при возделывании сои на черноземе обыкновенном. Кормопроизводство, 2004, 11: 14-16.
- Завалин А.А., Благовещенская Г.Г., Кожемяков А.П. Вклад бобовых культур в поступление биологического азота и органического вещества в почвы России. В сб.: Инновационно - технологические основы развития земледелия. Курск, 2006: 312-315.
- Кокорина А.Л., Кожемяков А.П. Бобово-ризобиальный симбиоз и применение микробиологических препаратов комплексного действия - важный резерв повышения продуктивности пашни. СПб, 2010.
- Argaw A. Response of soybean to inoculation with Bradyrhizobium spp. in saline soils of Shinille Plains, Eastern Ethiopia. East African Journal of Sciences, 2014, 8(2): 79-90.
- Синеговская В.Т., Гайдученко А.Н. Влияние приемов агротехники на продуктивность сои. Земледелие, 2010, 5: 27-29.
- Vollmann J. Soybean versus other food grain legumes: a critical appraisal of the United Nations International Year of Pulses 2016. Die Bodenkultur: Journal of Land Management, Food and Environment, 2016, 67(1): 17-24 ( ).
- DOI: 10.1515/boku-2016-0002
- Проворов Н.А. Происхождение и эволюция бобово-ризобиального симбиоза. Изв. АН СССР, сер. Биол., 1991, 1: 77-87.
- Dart P.J., Wani S.P., Giller K.E., Kipe-Nolt J., Day J.M., Avalakki J.M., Upadhyya M.N., Hebbar P., Chandrapalaiah S.C. Nitrogen fixation associated with sorghum and pearl millet. In: Australia Institute of Agricultural Science AIAS Occasional Publication No. 12: Proc. of the Seventh Australian Legume Nodulation Conference. Sydney, 1984: 111-113 ( ).
- DOI: 10.13140/2.1.1790.3368
- Unkovich M.J., Pate J.S. An appraisal of recent measurements of symbiotic N2 fixation by annual legumes. Field Crops Research, 2000, 65(2-3): 211-228 (
- DOI: 10.1016/S0378-4290(99)00088-X)
- Hardy R.W.F., Bums R.C., Holstein R.D. Application of the acetylene reduction assay for measurement of nitration. Soil Biology and Biochemistry, 1973, 5: 47-81.
- Patra R.K., Pant L.M., Pradhan K. Response of soybean to inoculation with rhizobial strains: effect on growth, yield, N uptake and soil N status. World Journal of Agricultural Sciences, 2012, 8(1): 51-54.
- Clúa J., Roda C., Zanetti M.E., Blanco F.A. Compatibility between legumes and rhizobia for the establishment of a successful nitrogen-fixing symbiosis. Genes (Basel), 2018, 9(3): 125 ( ).
- DOI: 10.3390/genes9030125
- Al-Falih A.M.K. Factors affecting the efficiency of symbiotic nitrogen fixation by Rhizobium. Pakistan Journal of Biological Sciences, 2002, 5(11): 1277-1293 ( ).
- DOI: 10.3923/pjbs.2002.1277.1293
- Вashan Y., Bashan L., Prabhu S.R., Hernandez J. Advances in plant growth-promoting bacterial inoculant technology: formulations and practical perspectives (1998-2013). Plant and Soil, 2014, 378: 1-33 ( )
- DOI: 10.1007/s11104-013-1956-x
- Гришечкин В.В., Головина Е.В. Использование нового органического пленкообразователя (ППО) для сохранения жизнеспособности ризобий при инокуляции семян сои и влияние их на клубенькообразование и урожайность. Зернобобовые и крупяные культуры, 2014, 1(9): 41-44.
- Ступина Л.А., Мосина А.С. Влияние карбоксиметилированных препаратов и ризоторфина на микробиологическую активность черноземов Приобской лесостепи и симбиотическую активность сои. Вестник КрасГАУ, 2016, 3: 84-89.
- Głodowska M., Schwinghamer T., Husk B., Smith D. Biochar based inoculants improve soybean growth and nodulation. Agricultural Sciences, 2017, 8(9): 1048-1064 ( ).
- DOI: 10.4236/as.2017.89076
- Tittabutr P., Payakapong W., Teaumroong N., Singleton P., Bookerd N. Growth, survival and field performance of Bradyrhizobial liquid inoculant formulations with polymeric additives. ScienceAsia, 2007, 33: 69-72 ( ).
- DOI: 10.2306/scienceasia1513-1874.2007.33.069
- Rivera D., Obando M., Barbosa H., Rojas-Tapias D., Bonilla Buitrago R. Evaluation of polymers for the liquid rhizobial formulation and their influence in the Rhizobium-Cowpea interaction. Universitas Scientiarum, 2014, 19(3): 265-275 ( ).
- DOI: 10.11144/Javeriana.SC19-3.eplr
- Косульников Ю.В., Лактионов Ю.В. О факторах, влияющих на токсичность протравителей семян для симбиотических азотфиксаторов в составе биопрепаратов. Сельскохозяйственная биология, 2018, 53(5): 1037-1044 ( ).
- DOI: 10.15389/agrobiology.2018.5.1037rus
- Доспехов Б.А. Методика полевого опыта. М., 2012.
- Paulo I., Fernandes J., Tiago G., Oliveira P., Ribeiro G.X., Rumjanek N.G. Polymers as carriers for rhizobial inoculant formulations. Pesquisa Agropecuária Brasileira, 2009, 44(9): 1184-1190 ( ).
- DOI: 10.1590/S0100-204X2009000900017
- Damasceno R., Roggia I., Pereira C., Sá E. Rhizobia survival in seeds coated with polyvinyl alcohol (PVA) electrospun nanofibres. The Canadian Journal of Microbiology, 2013, 59(11): 716-719 ( ).
- DOI: 10.1139/cjm-2013-0508
- Bashan Y., Gonzalez L.E. Long-term survival of the plant-growth-promoting bacteria Azospirillum brasilense and Pseudomonas fluorescens in dry alginate inoculant. Applied Microbiology and Biotechnology, 1999, 51(2): 262-266 ( ).
- DOI: 10.1007/s002530051391
- Mounika N., Muralidhara Rao D., Uma A., Ali S. Effect of different chemical additives on growth of Azotobacter vinelandii. International Journal of Scientific Research and Management, 2018, 6(03): B-2018-24-26 ( ).
- DOI: 10.18535/ijsrm/v6i3.b03
- Sehrawat A., Suneja S., Yadav A., Anand R.C. Influence of different additives on shelf life of Rhizobial inoculants for mungbean (Vigna radiata L.). International Journal of Recent Scientific Research, 2015, 6(5): 4338-4342.


