Протеолитическая регуляция экспрессии ростовых факторов и HIF-1 при раке эндометрия
Автор: Спирина Л.В., Юнусова Н.В., Кондакова И.В., Коломиец Л.А., Коваль В.Д., Чернышова А.Л., Шпилева О.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (50), 2012 года.
Бесплатный доступ
Проведено исследование связи химотрипсинподобной активности протеасом и содержания ИФР-I, ИФР-II, PAPP-A, VEGF и HIF-1 в тканях рака эндометрия. Показано, что тотальная активность протеасом и активность 20S и 26S пулов протеасом в злокачественных опухолях значительно выше, чем в неизмененном эндометрии. Обнаружены корреляционные связи между ак- тивностью пулов протеасом и экспрессией ИФР-I и HIF-1 в опухолевой ткани, которые свидетельствуют о возможной регуляции содержания ростового и транскрипционного факторов протеасомами. Поскольку считается, что основной пул ИФР-I находится во внеклеточном пространстве, то, вероятно, в регуляции содержания ИФР-I также принимают участие внеклеточные протеасомы. Положительные корреляционные связи между содержанием ИФР- I, HIF-1, VEGF и металлопротеиназой PAPP-A дают основание считать, что этот протеолитический фермент является другим важным регулятором содержания ростовых и транскрипционного факторов. Представленные данные показывают возможность протеолитической регуляции ростовых и ядерных факторов, что может играть важную роль в патогенезе злокачественных новообразований.
Инсулиноподобные факторы роста, фактор роста эндотелия сосудов, протеасома, рак эндометрия
Короткий адрес: https://sciup.org/14056202
IDR: 14056202
Текст научной статьи Протеолитическая регуляция экспрессии ростовых факторов и HIF-1 при раке эндометрия
Особенности роста, развития и метастазирования злокачественных опухолей определяются ростовыми и транскрипционными факторами, среди которых одними из наиболее значимых являются активируемый гипоксией транскрипционный фактор (HIF-1), HIF-индуцируемые инсулиноподобные факторы роста (ИФР) и фактор роста эндотелия сосудов (VEGF). В настоящее время сформировано понятие об ИФР-системе, в которую входят ИФР-I и ИФР-II, рецептор ИФР первого типа, а также 6 белков, связывающих инсулиноподобные факторы роста (IGFBPs). Кроме того, функционально с этой системой связаны протеиназы, расщепляющие IGFBPs, среди которых важное значение отводят белку, ассоциированному с беременностью – PAPP-A (pregnancy-associateds plasma protein) [2].
Все компоненты ИФР-системы продуцируются стромальными клетками нормального, гиперплазированного и малигнизированного эндометрия, а также рядом опухолей эпителиального происхождения [2, 8, 14, 16]. Другим важнейшим ростовым фактором, участвующим в развитии и прогрессии рака эндометрия является VEGF. Семейство сосудистых эндотелиальных факторов роста представлено 5 членами: VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарным ростовым фактором. Процесс неоангиогенеза обеспечивает фактор VEGF-A, который и называют VEGF [17].
Ростовые факторы, в том числе и ИФР, индуцируют активируемый гипоксией транскрипционный фактор – HIF-1, так называемый независимый от гипоксии путь активации HIF-1 [7, 11]. На примере клеточной линии глиобластомы показана возможность инактивации сигнального пути ИФР-STAT3-HIF1 при использовании ингибиторов рецептора ИФР [12]. C другой стороны, ИФР-II, IGFBP-2, -3 и VEGF являются HIF-индуцируемыми генами [11, 22]. HIF-1 является гетеродимером, состоящим из α- и β-субъединиц. β-cубъединицы фактора являются конститутивными, активность фактора зависит от экспрессии и посттрансляционных модификаций α-субъединиц. При гидроксилировании остатков пролина и аспарагина наблюдается связывание HIF-1α с белком фон Хиппель-Линдау (pVHL), что сопровождается прикреплением цепочки убиквитина к белку и его последующей деградацией в протеасоме [22, 26]. В условиях гипоксии происходит стабилизация HIF-1α и формирование функционально активных гетеродимеров с HIF-1β с повышением ДНК-связывающей активности транскрипционного фактора.
Необходимо отметить, что регуляторным этапом многих физиологических и патологических процессов является внутриклеточная деградация белков в протеасомах. Основным компонентом убиквитин-протеасомной системы являются про-теасомы – мультисубъединичные комплексы, включающие каталитическое ядро 20S, к которому присоединена одна или две регуляторные частицы. Если по крайней мере одной из этих частиц является РА700 (19S регуляторная частица), то образуется 26S протеасома, осуществляющая, главным образом, АТФ- и убиквитин-зависимый протеолиз большинства клеточных белков. Если же в роли регуляторной частицы выступает другой белковый комплекс (РА28, РА200), то такая ассоциация представляет собой активированную 20S протеасому, которая деградирует малые, аномальные и коротко живущие белки [5]. 20S протеасомы представлены иммунными и конститутивными формами, образующимися при сочетании конститутивных (α1α2α3α4α5α6α7) или иммунных (LMP 2, LMP 7, MECL-1) протеолитических субъединиц. Замена конститутивных субъединиц на иммунные приводит к образованию модифицированных форм протеасом и сопровождается изменением их специфичности, вследствие чего они продуцируют иммуногенные пептиды для их презентации главным комплексом гистосовместимости. В то же время известно, что иммунные протеасомы могут выполнять неиммунные функции. Встроенные иммунные субъединицы приводят к изменению активности протеасом [3]. Относительное содержание протеасом в клетке, их состав и активность изменяются в соответствии с потребностями клетки и условиями, в которых она находится, что становится возможным благодаря взаимодействию протеасом с большим количеством белков, а также благодаря механизмам регуляции на уровне транскрипции, которые на данный момент остаются мало изученными [5].
Другой аспект протеолитической регуляции экспрессии ряда белков связан с металлопротеиназами, действующими в основном экстраклеточно. Металлопротеиназа PAPP-A относится к подсемейству паппализинов, и ее основной функцией является ИФР-зависимый протеолиз, главным образом IGFBP-4, но также IGFBP-5 и IGFBP-2. Таким образом, PAPP-A участвует в регуляции биодоступности ИФР. Единственным ингибитором PAPP-A является проформа большого основного белка эозинофилов (pro-MBP) [14]. В настоящее время очень мало известно о молекулярной регуляции IGFBP-4 протеазной системы, однако есть данные о сочетанном повышении экспрессии PAPP-A и снижении pro-MBP в клеточных линиях при инкубации с трансформирующим фактором роста бета. Другим регулятором этой системы является ИФР-II, действующий на посттрансляционном уровне [19].
Имеется определенная взаимосвязь между HIF-1, ростовыми факторами и активностью протеасом в клетках. Передача сигнала с активированного рецептора ИФР осуществляется через вну- триклеточные субстраты инсулинового рецептора (IRS), а уровень протеасомной деградации IRS-2 влияет на степень активации ИФР-зависимого сигнального пути [21]. Также было выявлено, что разрушение самого рецептора ИФР происходит в протеасомах [13]. Показано, что в опухолях достаточно много факторов регулируют стабилизацию HIF-1α, однако роль протеасом в этом процессе также существенна [22]. Так, снижение деградации HIF-1α при использовании ингибиторов протеа-сом или при гипоксии приводит к значительному повышению экспрессии как мРНК VEGF, так и самого белка в опухолевых клетках [17, 25]. Таким образом, возможно опосредованное участие про-теасом в механизмах развития опухоли через изменение активности транскрипционных факторов и соответствующее изменение синтеза ростовых факторов. В настоящее время протеолитическая регуляция экспрессии ростовых факторов и HIF, их взаимное влияние в злокачественных опухолях человека изучены недостаточно. Проведение таких исследований особенно актуально в отношении рака эндометрия, так как ИФР и VEGF играют в развитии и прогнозе данной патологии ведущую роль [2, 8, 17].
Целью исследования явился сравнительный анализ содержания компонентов системы ИФР, VEGF, HIF-1α, тотальной активности протеасом, активности их пулов и определение возможного регуляторного влияния отдельных компонентов системы вне- и внутриклеточного протеолиза на экспрессию ростовых и транскрипционного факторов.
Материал и методы
В исследование вошли больные с морфологически верифицированным раком эндометрия (РЭ) I–II стадии (n=49, средний возраст 56,8 ± 1,5 года), из них Iа стадию заболевания имели 13 больных, Ib – 24 , Iс – 3 пациентки, II стадию – 9 больных. Объемы диагностики и лечения больных раком эндометрия соответствовали рекомендуемым алгоритмам объемов диагностики и лечения злокачественных новообразований, утвержденным Министерством здравоохранения и социального развития РФ. Проведение данной работы одобрено этическим комитетом НИИ онкологии СО РАМН. При оценке тканевого уровня ИФР, IGFBPs и PAPP-A была сформирована группа сравнения из 20 больных с гиперпластическими процессами эн- дометрия (ГПЭ). У 5 больных гистологически была подтверждена атипичная гиперплазия эндометрия, у 15 – сложная типичная гиперплазия эндометрия. Средний возраст этих больных составил 52,8 ± 4,5 года. Образцы гиперплазированного эндометрия получали при выполнении гистероскопии с биопсией или радикальной операции. Материалом для исследования протеасом явились образцы опухолевой и гистологически не измененной ткани, находящиеся на расстоянии не менее 1 см от границы опухолей, полученные при выполнении радикального оперативного вмешательства, которые после взятия замораживались и хранились при –80 оС.
Получение осветленных гомогенатов. Замороженную ткань (100 мг) гомогенизировали в жидком азоте, затем ресуспендировали в 300 мкл 50 мМ трис-HCl буфера (pH=7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10000g и 4оС.
Фракционирование протеасом. Все процедуры проводили при 4°С. Белки осветленных гомогенатов фракционировали с помощью сульфата аммония в два этапа. Фракцию, обогащенную 26S-протеасомами, получали добавлением сульфата аммония до 40 % насыщения, фракцию 20S-протеасом – добавлением сульфата аммония до 70 % насыщения [1]. В полученных фракциях определяли активность протеасом.
Определение активности протеасом. Химо-трипсинподобную активность тотального пула протеасом, 26S и 20S пулов протеасом определяли в осветленных гомогенатах опухолевых и неизмененных тканей, а также во фракциях протеасом, по гидролизу флуорогенного олигопептида N-Succi-nyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, утилизирующегося химотрипсинподобными центрами протеасом [6], на флуориметре «Hitachi-850» (Япония) при длине волны возбуждения 380 нм и эмиссии 440 нм. Реакционная смесь для определения активности 20S протеасом содержала 20 мМ трис-HCl (pH=7,5), 1 мМ дитиотреитол, 30 мкМ N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcou-marin. Для определения активности 26S протеасом в реакционную смесь дополнительно вводили 5 мМ хлорида магния и 1 мМ АТФ. Реакцию проводили при 37°С в течение 20 мин и останавливали 1 % додецил сульфатом натрия. Для оценки активности примесных протеаз в образцах применяли специфический ингибитор протеасом – MG132. Удельную активность протеасом выражали в единицах активности на 1 мг белка. Содержание белка определяли по методу Лоури.
Определение содержания ИФР, связывающих их белков, PAPP-A, VEGF и HIF-1α. Образцы осветленных гомогенатов опухолей использовались для определения тотального (внутриклеточного и внеклеточного) пула свободных ИФР-I, ИФР-II, а также IGFBP-3, IGFBP-4, VEGF и металлопротеиназы PAPP-A с использованием наборов для твердофазного иммуноферментного анализа (R&D Systems, DSL, США) на ИФА-анализаторе «Anthos 2020». Экспрессию HIF-1α субъединиц определяли с помощь наборов Caymanchem (США), ELISA. Приготовление и очистка ядерных экстрактов тканевого гомогената проводились в соответствии с рекомендациями фирмы-производителя. Уровень белка в гомогенатах и ядерных экстрактах определялся по Лоури. Результаты определения содержания ростовых факторов, связывающих их белков и PAPP-A выражали в нг/мг белка, а HIF-1α – в условных единицах на мг белка в лунке.
Статистическая обработка. Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 6.0. В зависимости от вида распределения результаты представлены как M±m, где М-среднее выборочное, m – ошибка среднего или как медиана с интерквартильным размахом (25-й и 75-й процентили). Значимость различий исследовали с помощью t-критерия Стьюдента или критерия Манна-Уитни. Корреляционный анализ был проведен с использованием непараметрического критерия Спирмена.
Результаты и обсуждение
При изучении уровня ИФР, IGFBPs и PAPP-A в опухолях эндометрия и в гиперплазированном эндометрии выявлено, что уровень обоих ростовых факторов и IGFBP-4 был статистически значимо ниже в опухолевой ткани по сравнению с гиперплазированной (таблица). Анализируя полученные результаты, можно отметить, что в литературе отсутствуют сравнительные данные об уровне параметров ИФР-системы, за исключением экспрессии рецептора ИФР первого типа, при гиперпластических процессах и раке эндометрия. Имеются лишь данные о сходном уровне ИФР-I и его рецептора в опухолях эндометрия и соответствующей нетранс-формированной ткани [2]. Снижение уровня обоих ИФР и IGFBP-4 в опухолях эндометрия может быть обусловлено либо снижением синтеза этих факторов, повышением их деградации или увеличением фракций, связанных с IGFBPs ИФР.
Содержание другого ростового фактора (VEGF) коррелировало с глубиной инвазии опухоли в миометрий. У больных с инвазией в пределах слизистой и с инвазией опухоли до середины миометрия уровень ростового фактора составил 153,9 ± 40,1 пг/мг белка, а у больных с Iс стадией заболевания – 321,0 ± 60,1 пг/мг белка. При этом уровень экспрессии HIF-1α не зависел от стадии процесса и глубины инвазии опухоли в миометрий и составил в среднем 17,2 ± 3,3 УЕ/мг белка в лунке.
Выявлено, что в ткани рака эндометрия происходит увеличение тотальной активности про-теасом в 2,7 раза по сравнению с неизмененной тканью (164,1 ± 25,6 × 103 МЕ/мг белка и 59,5 ± 5,0 х 103 МЕ/мг белка соответственно). Активность пула 26S протеасом повышалась в 1,9 раза по сравнению с неизмененной тканью, активность пула 20S протеасом увеличивалась в 2,6 раза (рис. 1). Вероятно, увеличение активности про-теасом в опухоли по сравнению с неизмененными тканями связано с тем, что при опухолевом росте все процессы, происходящие в клетке, очень интенсивны. Опухолевый рост сопровождается
Уровень инсулиноподобных факторов роста, связывающих их белков и РАРР-А в гиперплазированном и малигнизированном эндометрии, Me (25–75%)
Таблица
|
Группы больных |
ИФР-I, нг/мг белка |
ИФР-II, нг/мг белка |
IGFBP-3, нг/мг белка |
IGFBP-4, нг/мг белка |
PAPP-A, нг/мг белка |
|
ГПЭ |
0,53 (0,29–1,25) |
8,49 (4,92–17,74) |
3,14 (1,02–11,1) |
1,11 (0,39–1,46) |
5,93 (2,00–10,9) |
|
РЭ |
0,32 (0,16–0,55)* |
5,05 (3,66–7,36)* |
3,80 (1,90–6,98) |
0,51 (0,22–0,83)* |
6,42 (1,38–11,3) |
Примечание: * – различия статически значимы по сравнению с группой больных с ГПЭ, p<0,05. СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2012. № 2 (50)
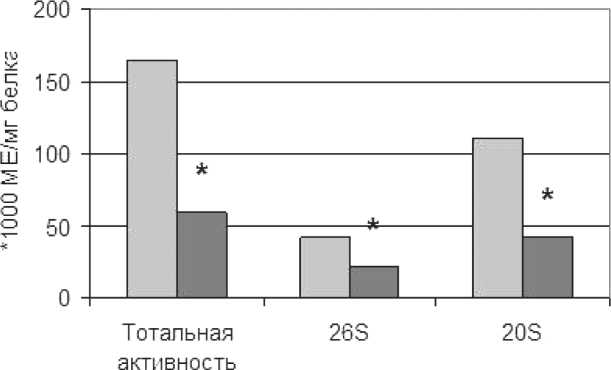
□ опухолевая ткань ■ неизмененная ткань
Рис. 1. Активность протеасом в ткани рака эндометрия и неизмененной ткани. Примечание: * – различия статистически значимы по сравнению с неизмененной тканью (р<0,05)
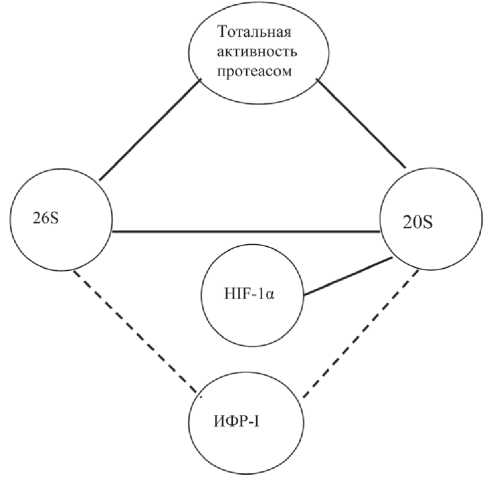
Рис. 2. Предполагаемая схема регуляции экспрессии HIF-1 и ИФР протеасомами при раке эндометрия. Примечание: 20S и 26S – пулы протеасом; ИФР- I – инсулиноподобные факторы роста-I;
HIF-1 – активируемый гипоксией транскрипционный фактор нарушением клеточного цикла, усилением пролиферации, ингибированием апоптоза. Несомненно, чтобы клетке продолжать свое существование, необходимо усилить систему, занимающуюся деградацией выполнившего свою функцию белкового и пептидного материала.
При проведении корреляционного анализа в опухолях эндометрия были выявлены взаимосвязи между активностью всех основных пулов про-теасом: между 20S и 26S пула протеасом (r=0,60; p<0,05), между тотальной протеасомной активностью и 20S пула протеасом (r=0,77; p<0,05), между тотальной протеасомной активностью и 26S пула протеасом (r=0,59; p<0,05). Активность 20S пула протеасом коррелировала с экспрессией HIF-1α (r=0,39; p<0,05). Таким образом, в опухолях эндометрия увеличение активности протеасом приводит к повышению экспрессии HIF-1α. Также получены отрицательные корреляционные взаимосвязи между экспрессией ИФР-I и активностью 20S и 26S пула протеасом (r1=–0,47; r2=–0,49; p<0,05) соответственно (рис. 2).
Выявленная прямая корреляционная зависимость между активностью пулов 26S и 20S протеа-сом при раке эндометрия может быть объяснена как через активацию транскрипции, так и с помощью внегеномных механизмов регуляции протеолиза. Влияние белков, участвующих в сборке протеасом и в контроле протеасом-зависимого протеолиза, обусловлено воздействием многих факторов и распространяется на оба пула протеасом [24]. Известно, что протеасомы принимают участие в pVHL-зависимой деградации HIF-1α. В условиях гипоксии происходит стабилизация HIF-1α, снижение степени деградации фактора и формирование функционально активных гетеродимеров с HIF-1β с повышением ДНК-связывающей активности транскрипционного фактора, с чем часто связывают повышение экспрессии HIF-1-индуцированных генов в опухолях. Однако при раке эндометрия имеет место сочетанное повышение тотальной протеасомной активности и ее пулов и повышение экспрессии HIF-1α. При этом необходимо отметить существование так называемого независимого от гипоксии пути активации HIF-1. Стабилизация HIF-1 и, соответственно, увеличение количества HIF-1α в ядерных экстрактах могут происходить при активации рецепторных тирозинкиназ при связывании с соответствующими ростовыми факторами, прежде всего с эпидермальным фактором роста и ИФР [22]. Также есть литературные данные о наличии альтернативных протеасом-независимых путей деградации HIF-1α другими протеолитическими системами, прежде всего кальпаин-опосредованной [26]. Вероятно, при раке эндометрия активация HIF-1α происходит преимущественно альтернативным путем.
Экспрессия ИФР является как HIF-1, так и NF-kappaB-зависимой. С учетом полученных собственных результатов и данных литературы об отсутствии повышенной экспрессии IGFBPs
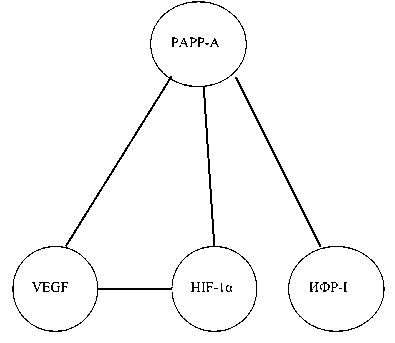
Рис. 3. Предполагаемая схема регуляции экспрессии ростовых факторов и HIF-1 металлопротеиназой PAPP-A при раке эндометрия. Примечание: ИФР- I – инсулиноподобный фактор роста-I; PAPP-A (pregnancy-associateds plasma protein-A) – протеиназа, расщепляющая IGFBP-2, -4 и -5; HIF-1α – α-субъединица активируемого гипоксией транскрипционного фактора; VEGF – фактор роста эндотелия сосудов в опухолях эндометрия, о повышении в опухолях эндометрия тотальной протеасомной активности и ее пулов с параллельным повышением экспрессии HIF-1 и снижении экспрессии NF-kappaB (p65) [4], об активации NF-kappaB при использовании ингибиторов протеасом в клеточных линиях рака эндометрия [10] можно сделать предположение о NF-kappaB-зависимом снижении синтеза обоих ИФР в опухолях эндометрия.
Выявленные отрицательные корреляционные взаимосвязи между экспрессией ИФР-I и активностью 20S и 26S пула протеасом, по-видимому, не могут считаться прямыми, поскольку действие протеасом на ростовые факторы и связывающие их белки, по данным большинства авторов, опосредуется через транскрипционные факторы, в том числе и через NF-kappaB и HIF-1 [9, 20]. В то же время существуют данные о присутствии протеасом, представленных, главным образом, 20S пулом, во внеклеточных средах организма. Поскольку остается открытым вопрос о наличии таких протеасом в различных тканях, их строении и функциях за пределами клетки, нельзя исключать участие внеклеточного пула протеасом в деградации экстраклеточного пула ИФР-I [15, 23].
Экспрессия HIF-1α в опухолях эндометрия была взаимосвязана не только с активностью пула протеасом, но и с экспрессией металлопротеиназы
PAPP-A (r=0,72; p<0,05). HIF-1α-зависимая экспрессия VEGF также была связана с экспрессией PAPP-A. Кроме того, выявлена корреляция между экспрессией PAPP-A и ИФР-I, r=0,52; p<0,05 (рис. 3).
Положительная корреляционная связь между содержанием ИФР-I и металлопротеиназой PAPP-A дает основание считать, что этот протеолитический фермент является другим важным регулятором содержания ростового фактора, осуществляя расщепление белков, связывающих ИФР- I, и тем самым повышая его содержание в тканях. Предполагаемая регуляция экспрессии HIF-1 и VEGF металлопротеиназой PAPP-A практически не изучена. Однако появились работы, в которых обсуждается ИФР-независимый антиангиоген-ный и противоопухолевый эффект IGFBP-4 [18]. C учетом того, что доминирующим субстратом PAPP-A является IGFBP-4 [14], становится понятной взаимосвязь PAPP-A с уровнем экспрессии VEGF в опухолях эндометрия. Кроме того, в исследованиях M.S. Moreno et al. (2006) показано, что IGFBP-4 является ингибитором ангиогенных эффектов VEGF и других ростовых факторов [18]. Интересно, что в образцах опухолей эндометрия не выявлено статистически значимых связей между экспрессией PAPP-A и ИФР-II. В то же время в культуре остеобластов, продуцирующих значительные количества ИФР, IGFBP-4 и PAPP-A, выявлено регулирующее влияние ИФР-II на протеолитическую активность PAPP-A [19].
Заключение. Таким образом, впервые проанализированы взаимосвязи содержания ИФР, VEGF и HIF-1α с химотрипсинподобной активностью про-теасом и экспрессией металлопротеиназы PAPP-A. Установлено, что протеасомы могут играть важную роль в регуляции содержания HIF-1α и ИФР-I в тканях рака эндометрия. Следует отметить, что если на фактор транскрипции протеасомы оказывают непосредственное регулирующее влияние, то на ИФР- I оно, вероятно, опосредовано через NF-kappaB и HIF-1. Нельзя исключить также расщепление ИФР-I во внеклеточных протеасомах. Другим важным протеолитическим регулятором содержания ИФР-I, VEGF, а возможно и HIF-1, в клетках является металлопротеиназа PAPP-A. Поскольку HIF-1 и ИФР-I являются патогенетически значимыми факторами рака эндометрия, то изучение регуляции их содержания необходимо для четкого понимания механизмов развития заболевания и поиска эффективных противоопухолевых средств при молекулярно-направленной терапии. Полученные данные свидетельствуют о возможности использования ингибиторов протеасом в таргетной терапии рака эндометрия. Необходимы дальнейшие исследования протеасомной системы в контексте прогрессии и клинического течения рака эндометрия для выяснения ее возможной роли в метастазировании злокачественных опухолей и использовании для поиска новых маркеров прогноза течения заболевания.
Работа выполнена при финансовой поддержке Федеральной целевой программы (ФЦП) «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 годы (Гос. контракт № П-320).


