Протез корня аорты с перикардиальными створками в модификации «Русский кондуит»: экспериментальное исследование
Автор: Базылев В.В., Батраков Павел Александрович, Хадиев Д.М., Егоров А.А., Еремин Н.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4 т.25, 2021 года.
Бесплатный доступ
Цель. Изучить в эксперименте гидродинамические характеристики и долговечность протеза корня аорты с перикардиальными створками и различными вариантами формирования комиссур. Методы. Сформировали 9 кондуитов с перикардиальными створками согласно технике, описанной S. Ozaki. Разделили на группы по 3 образца: I группа - без дополнительного укрепляющего шва в области верхушек комиссур, II группа - с дополнительным швом без прокладки, III группа - с дополнительным швом и встречной перикардиальной прокладкой. Закрепили на стенде для гидродинамических испытаний искусственных клапанов сердца. Полученные гидродинамические характеристики сравнили с показателями биологического каркасного клапана «МЕДИНЖ-БИО» (ЗАО НПП «МедИнж», Пенза, Россия). Провели тест на долговечность протезов, макроскопически изучили возникшие механические дефекты перикардиальных створок. Результаты. Два образца II группы досрочно сняли с испытаний на отметке 11 х 106 циклов (приблизительно 3,5 мес. нормальной работы сердца) из-за разрывов створок, которые полностью нарушили запирательную функцию протезов. Семь состоятельных кондуитов сняли для осмотра на отметке 32 х 106 циклов (около 9,6 мес. нормальной работы сердца). Каждый образец описали отдельно. Выводы. Гидродинамика в исследуемых группах и на каркасном биологическом протезе «МЕДИНЖ-БИО» сопоставима. Дополнительные П-образные швы в области комиссур перикардиальных створок не увеличивали функциональную долговечность протеза, а, напротив, повышали риск дефектов створок. Имплантация перикардиальных створок в сосудистый протез, по-видимому, приводит к иному распределению динамического стресса по сравнению с оригинальной неокуспидализацией аортального клапана, которая сохраняет корень аорты. Об этом можно косвенно судить по характеру и локализации механических дефектов створок в тесте на долговечность.
Аортальный клапан, корень аорты, перикард, протезирование створок
Короткий адрес: https://sciup.org/142230820
IDR: 142230820 | DOI: 10.21688/1681-3472-2021-4-97-105
Текст научной статьи Протез корня аорты с перикардиальными створками в модификации «Русский кондуит»: экспериментальное исследование
П.А. Батраков,
Д.М. Хадиев, А.А. Егоров, Н.А. Еремин,
С 60-х гг. прошлого века «золотым стандартом» лечения пороков аортального клапана независимо от этиологии являются иссечение измененных створок и имплантация в аортальную позицию искусственного клапана. При нормальных размерах корня и восходящей аорты эта процедура проста в исполнении и имеет предсказуемый результат. Однако механические протезы аортального клапана требуют антикоагулянтной терапии, вызывающей тромботические и геморрагические осложнения. Каркасные и бескаркасные биологические протезы, включая гомо- и ксенографты, подвержены дегенерации створок, которая значительно быстрее развивается в молодом возрасте. Все эти факторы могут привести к неблагоприятному течению послеоперационного периода и необходимости повторного хирургического вмешательства. Накопленный негативный опыт применения протезов клапанов сердца обусловливает стремление максимально сохранить природную гемодинамику на аортальном клапане при минимальном использовании инородных материалов.
Неокуспидализация аортального клапана, предложенная S. Ozaki, отвечает данным условиям [1]. Зарубежные и отечественные авторы демонстрируют положительные результаты процедуры [2–4]. Однако ее выполнение оправданно при нормальных размерах корня аорты. При аневризмах и расслоении корня аорты общепринятое хирургическое решение — протезирование клапаносодержащим кондуитом с реимплантацией устьев коронарных артерий по методике, предложенной в 1968 г. H. Bentall и A. De Bono [5]. Тем не менее и эта операция не лишена недостатков, связанных с наличием искусственного аортального клапана.
Для хирургического лечения пациентов с аневризматическим поражением корня аорты предложены операции, которые, по мнению авторов, сочетают преимущества процедур Bentall – De Bono и Ozaki [6; 7]. Данные методики заключаются в протезировании корня аорты синтетическим кондуитом с имплантированными аутоперикардиальными створками, обработанными и выкроенными по методике Ozaki, и различаются лишь техникой имплантации створок. Авторы демонстрируют блестящие непосредственные послеоперационные результаты, но эффективность в отдаленном периоде не изучена.
Мы провели экспериментальное стендовое испытание протеза корня аорты с перикардиальными створками, подобное предложенным ранее Russian conduit [7] и Penza autograft. Эксперимент направлен на расширение базы доклинических исследований протезов корня аорты данного типа.
Цель — изучить гидродинамические характеристики и долговечность протеза с различными вариантами формирования комиссур.
Методы
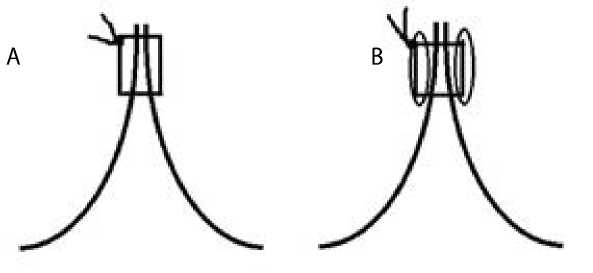
Сформировали 9 протезов корня аорты на основе сосудистого протеза Gelweave № 28 (Vascutek Ltd., Инчиннан, Великобритания). Створки выкраивали по шаблону S. Ozaki № 27 из ксеноперикардиальной пластины производства ООО «Кардиоплант» (Пенза, Россия) и имплантировали в сосудистый протез полипропиленовой нитью 4/0 согласно технике S. Ozaki [8]. Бычий перикард выбрали как стандартизованный и близкий к перикарду человека материал. Верхушки комиссур формировали нитью 4/0 с выколом наружу сосудистого протеза и завязывали на прокладке. Таким образом создали 3 образца. В следующих 3 протезах нитью 5/0 выполнили дополнительный укрепляющий вертикальный П-образный шов в области верхушек комиссур (рис. 1A). В 3 оставшихся экземплярах данный укрепляющий шов накладывали нитью 5/0 со встречной прокладкой, которую вырезали из той же ксеноперикардиальной пластины (рис. 1B).
Рис. 1. Дополнительные П-образные швы в области верхушек комиссур: без прокладки (A); со встречной перикардиальной прокладкой (B)
Функциональные характеристики протезов корня аорты
|
Показатель |
I группа |
II группа |
III группа |
«МЕДИНЖ-БИО» |
|
Средний ударный объем, см3 |
185,13 ± 12,10 |
203,93 ± 14,80 |
185,13 ± 11,70 |
221,15 |
|
Средний обратный переток, см3 |
5,66 ± 0,70 |
8,28 ± 0,90 |
9,30 ± 1,00 |
3,15 |
|
Среднее время открытия створок, мс |
40,00 ± 7,00 |
56,30 ± 7,60 |
44,60 ± 7,20 |
52,00 |
|
Среднее время закрытия створок, мс |
14,30 ± 5,30 |
8,00 ± 3,70 |
12,30 ± 4,50 |
3,00 |
Примечание. Данные представлены как M ± SD.
Протезы формировал один хирург с опытом клинического выполнения неокуспидализации аортального клапана. Образцы с комиссурами без дополнительного шва выделили в I группу, с дополнительным П-образным швом без прокладки в области комиссур — во II, с дополнительным П-образным швом и перикардиальной прокладкой в области комиссур — в III. Кондуиты закрепили на стенде – пульс-дупликаторе для гидродинамических испытаний искусственных клапанов сердца (ЗАО НПП «МедИнж», Пенза, Россия). Испытания проводили по условиям межгосударственного стандарта ГОСТ 26997-2002 «Клапаны сердца искусственные. Общие технические условия» (Поправка, ИУС № 6-2004) (введен в действие постановлением Госстандарта России от 29 апреля 2003 г. № 135-ст с 1 января 2004 г.).
После оценки гидродинамических характеристик устанавливали образцы на стенд для испытаний на долговечность (ЗАО НПП «МедИнж», Пенза, Россия) с частотой работы 23 Гц. Испытательной средой был стерильный физиологический раствор с добавлением антибиотика (гентамицина). Возникавшие механические дефекты перикардиальных створок изучали макроскопически. Полученные на стенде – пульс-дупликаторе гидродинамические показатели представляли в виде среднеарифметических значений ± стандартное отклонение.
Результаты
Гидродинамические показатели представлены в таблице . Для сравнения привели стандартную гидродинамику на каркасном биологическом протезе клапана сердца «МЕДИНЖ-БИО» АЛБ 29 мм (ЗАО НПП «МедИнж», Пенза, Россия), предоставленную производителем.
На рис. 2 представлена динамика давления на искусственных клапанах во время цикла «открытие – закрытие». Гидродинамические показатели
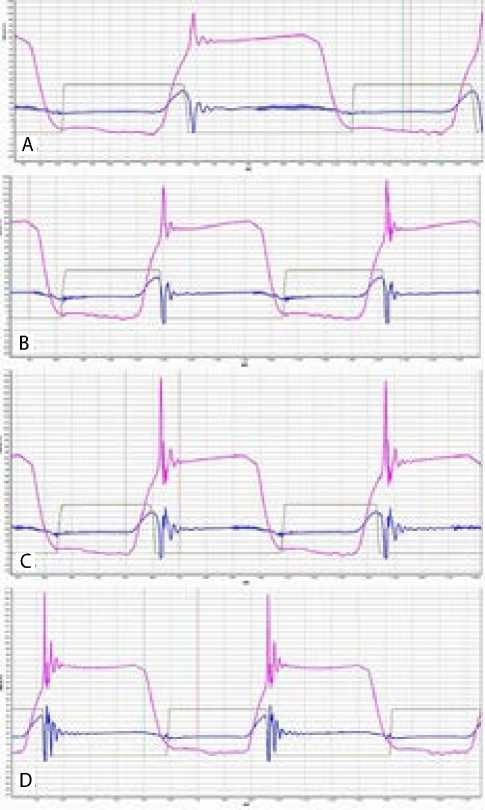
Рис. 2. Динамика давления, зафиксированная на стенде – пульс-дупликаторе: I группа (A); II группа (B); III группа (C); протез «МЕДИНЖ-БИО» (D)
Примечание. Розовой кривой обозначено давление на выходе клапана; синей — на входе; коричневой — лазерный датчик открытия клапана.
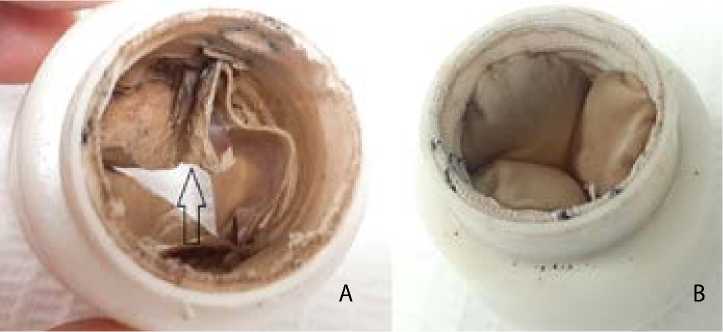
Рис. 3. I группа, образец 1: выпускная (А) и впускная (В) сторона кондуита.
Стрелкой указан дефект створки
в группах сопоставимы. По пропускной способности и времени открытия створок исследуемые группы сопоставимы между собой и с протезом «МЕД-ИНЖ-БИО».
Дополнительные швы в области комиссур незначительно, но негативно влияли на скорость открытия створок клапана. Скорость закрытия в группах была ниже, чем у клапана «МЕДИНЖ-БИО», что являлось причиной более значимого объема обратного перетока в начале диастолы в группах. Дополнительные комиссуральные швы несколько увеличивали объем обратного перетока.
В отличие от образца «МЕДИНЖ-БИО», у протезов групп при полном закрытии наблюдалась вибрация створок, вероятно, связанная с их избыточной высотой, что является особенностью хирургической технологии. Дополнительные комиссуральные швы снижали интенсивность этой вибрации, но она оста- валась выраженной по сравнению с протезом «МЕД-ИНЖ-БИО».
После оценки состоятельности провели испытание механической прочности клапанов. Во II группе два образца исключили на отметке 11 × 106 циклов, что составило приблизительно 3,5 мес. нормальной работы сердца. Причина — значительное разрушение створок, которое полностью нарушило запирательную функцию протеза. Остальные экземпляры оставались состоятельными и были сняты для осмотра на отметке 32 × 106 циклов (около 9,6 мес. нормальной работы сердца).
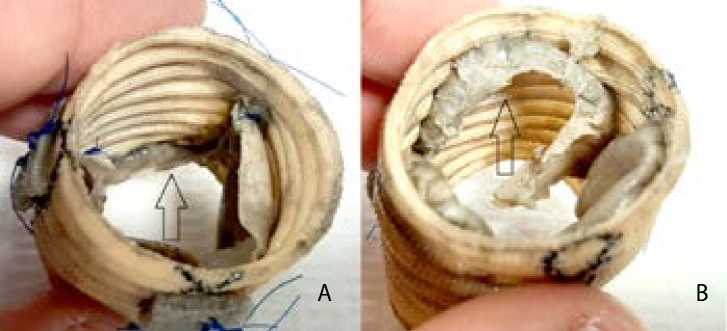
В I группе у образца 1 наблюдали значительный разрыв одной створки по центру, комиссуры не изменены (рис. 3). У образца 2 — разрыв свободного края по центру одной створки, комиссуры не изменены (рис. 4). У образца 3 створки и комиссуры не изменены.
Рис. 4. I группа, образец 2: выпускная (А) и впускная (В) сторона кондуита. Стрелкой указан дефект створки
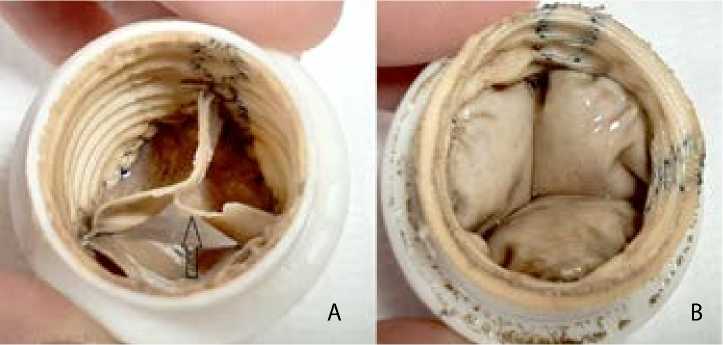
Рис. 5. II группа, образец 1: выпускная (А) и впускная (В) сторона кондуита. Стрелками указана разрушенная створка
A
B
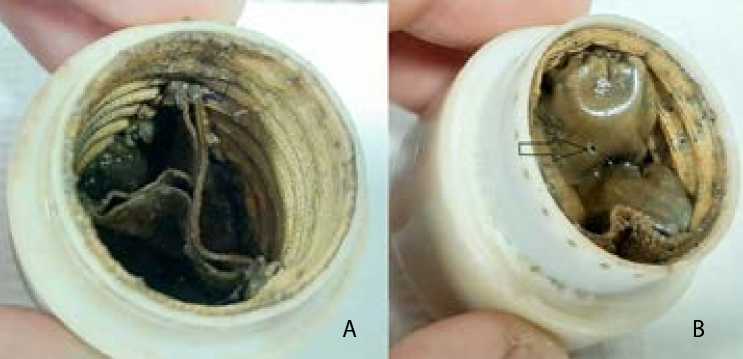
Во II группе досрочно выбыли из испытаний образец 1 из-за практически полного разрушения одной створки (рис. 5) и образец 2 ввиду разрыва в центре створки, который привел к выраженной регургитации (рис. 6). Образец 3 состоятелен, створки и комиссуры не изменены.
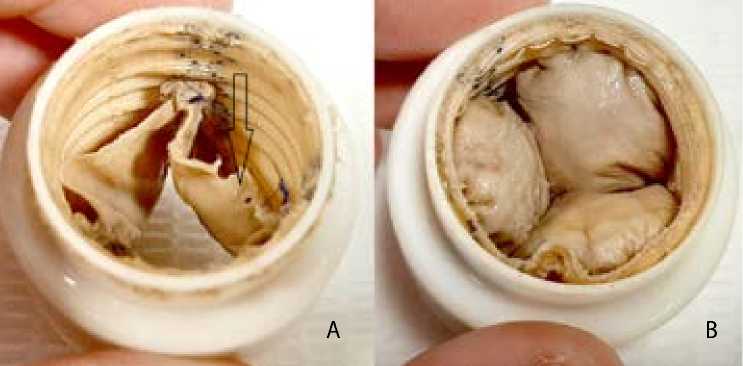
В III группе у образца 1 наблюдалась перфорация створки в проекции дополнительного комиссурального шва, в остальном створки и комиссуры не изменены (рис. 7). У образца 2 — перфорация створки в области дополнительного комиссурального шва, разрыв по центру той же створки, комиссуры не изменены (рис. 8). У образца 3 — дефекты свободного края двух створок по центру, не повлиявшие на запирательную функцию клапана на момент окончания испытаний, комиссуры не изменены.
Обсуждение
Описан успешный опыт выполнения неокуспи-дализации аортального клапана в азиатской популяции за более чем 12-летний период наблюдения [2]. Российские клиники также демонстрируют положительные ближайшие послеоперационные результаты этой методики [3; 4]. Долговременная состоятельность реконструкции может быть связана с практически полным сохранением динамической анатомии и функции корня аорты, а также отсутствием инородных материалов [9]. Альтернативные успешные способы протезирования створок аортального клапана ксеноперикардом также сохраняют анатомию и функцию нативного корня аорты [10].
Авторы, описывающие имплантацию аутоперикардиальных створок в синтетический протез корня аорты, предполагают, что отдаленные результаты
Рис. 6. II группа, образец 2: выпускная (А) и впускная (В) сторона кондуита. Стрелкой указан дефект створки
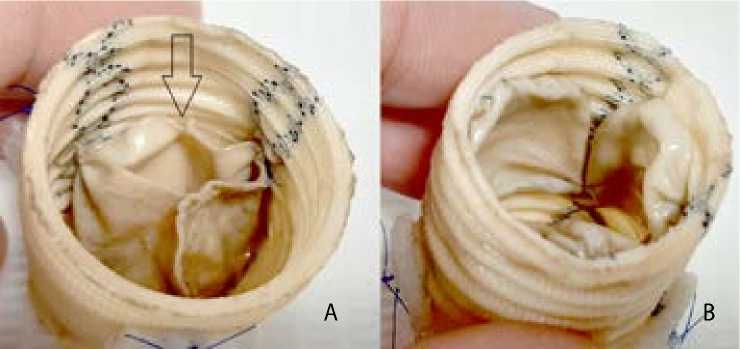
Рис. 7. III группа, образец 1: выпускная (А) и впускная (В) сторона кондуита. Выраженное окрашивание створок из-за контакта среды с резиновыми элементами стенда.
Стрелкой указана перфорация створки
A
B
будут сравнимы с результатами оригинальной нео-куспидализации аортального клапана [6; 7]. Однако синтетические протезы корня аорты не способны изменять форму в течение сердечного цикла. В нашем исследовании гидродинамика на таких кондуитах была сопоставима с гидродинамикой на каркасном биологическом протезе, который имеет фиксированный размер. Неясно, насколько надежна и долговременна интеграция искусственного материала сосудистого протеза и аутоперикарда, выполняющего функцию запирательного аппарата клапана. Описаны единичные случаи протезирования корня аорты синтетическим кондуитом с имплантированными аутоперикардиальными створками [6; 7]. Эффективность таких операций в отдаленном периоде не изучена. Считаем необоснованным приводить положительные отдаленные результаты неокуспидализации аортального клапана для описания перспектив комбинированных протезов корня аорты. Возможно, стоит рассматривать операции Russian conduit и Penza autograft независимо от операции Ozaki и самостоятельно определять показания и ограничения данных методик.
С начала применения перикарда для протезирования створок аортального клапана возникал вопрос, достаточна ли механическая прочность неостворок для долговременного функционирования. Ряд исследований показывает, что перикард человека, обработанный глутаровым альдегидом, а также обработанный перикард животных по прочности превосходят нативные створки аортального клапана — как неизмененные, так и пораженные кальцинозом [11–14]. Однако в клинической практике значительная часть дисфунк-
Рис. 8. III группа, образец 2: выпускная (А) и впускная (В) сторона кондуита. Стрелкой указаны перфорация и дефект свободного края створки
ций аортального клапана после протезирования створок перикардом обусловлена структурными дефектами створок [9; 15]. В случаях, не связанных с инфекционным эндокардитом, дефекты возникают в тех зонах, где створки реконструированного клапана испытывают наибольший динамический стресс. Эти данные соответствуют результатам исследования причин дисфункции промышленных биологических протезов аортального клапана [16]. Для повышения прочности сформированных комиссур, испытывающих наибольший механический стресс, в этой зоне применяют дополнительные укрепляющие швы. Их влияние на гемодинамику аортального клапана и долговечность реконструкции неясно.
Изучение этих аспектов модификаций неокуспида-лизации аортального клапана легло в основу настоящего экспериментального исследования. В нем не учтены многие биологические факторы, несомненно, имеющие большое значение in vivo , такие как иммунный ответ, кальцинация, эндотелизация. Тем не менее механические факторы, которые влияют на протезированный корень аорты, смоделированы достаточно тщательно.
Даже небольшой период испытания образцов позволяет предположить, что дополнительные швы в области комиссур увеличивают риск несостоятельности реконструированного аортального клапана. Предположение основано на том, что все протезы, досрочно выбывшие из испытаний, имели дополнительные швы в области комиссур. Перфорация створок также наблюдалась только в образцах с дополнительными комиссуральными швами.
В ФГБУ «ФЦССХ» Минздрава России (г. Пенза) проведено 21 повторное вмешательство по поводу несостоятельности аортального клапана после неокуспидализации, однако практически никогда не наблюдались разрывы свободного края створок по центру, как в настоящем исследовании. Разрывы почти всегда были локализованы в области неокомиссур, створки по центру были интактны. В исследовании S. Ozaki дефекты створок различной локализации в основном были связаны с инфекционным эндокардитом [9]. В нашем эксперименте локализация дефектов створок косвенно позволяет судить о распределении стресса во время функционирования протеза корня аорты с перикардиальными створками и предположить, что он распределяется иначе по сравнению с операциями, сохраняющими динамическую анатомию корня аорты.
Заключение
Гидродинамика на протезе корня аорты с перикардиальными створками сравнима с гидродинамикой на каркасном биологическом протезе «МЕДИНЖ-БИО». Дополнительные П-образные швы в области комиссур перикардиальных створок не увеличивают функциональную долговечность протеза, а, напротив, повышают риск дефектов створок. Имплантация перикардиальных створок в сосудистый протез, по-видимому, приводит к иному распределению динамического стресса по сравнению с оригинальной неокуспидализацией аортального клапана, которая сохраняет корень аорты. Об этом можно косвенно судить по характеру и локализации механических дефектов створок в тесте на долговечность.
Список литературы Протез корня аорты с перикардиальными створками в модификации «Русский кондуит»: экспериментальное исследование
- Ozaki S., Kawase I., Yamashita H., Uchida S., Nozawa Y., Matsuyama T., Takatoh M., Hagiwara S. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interact Cardiovasc Thorac Surg. 2011;12(4):550-553. PMID: 21273254. https://doi. org/10.1510/icvts.2010.253682
- Ozaki S. Ozaki procedure: 1,100 patients with up to 12 years of follow-up. Turk Gogus Kalp Damar Cerrahisi Derg. 2019;27(4):454. PMID: 32082907; PMCID: PMC7018167. https://doi.org/10.5606/tgkdc.dergisi.2019.01904
- Россейкин Е.В., Базылев В.В., Батраков П.А., Карнахин В.А., Расторгуев А.А. Непосредственные результаты протезирования створок аортального клапана аутоперикардом по методике Ozaki. Патология кровообращения и кардиохирургия. 2016;20(3):26-30. [Rosseykin E.V., Bazylev V.V., Batrakov P.A., Karnakhin V.A., Rastorguev A.A. Immediate results of aortic valve reconstruction by using autologous pericardium (Ozaki procedure). Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2016;20(3):26-30. (In Russ.)] http://doi.org/10.21688/1681-3472-2016-3-26-30
- Комаров Р.Н., Чернявский С.В., Исмаилбаев А.М., Симонян А.О. Аутоперикардиальная неокуспидизация аортального клапана: как это делать? Патология кровообращения и кардиохирургия. 2021;25(1):120-127. [Komarov R.N., Chernyavskii S.V., Ismailbaev A.M., Simonyan A.O. How to do it: autopericardial neocuspidisation of the aortic valve. Patologiya krovo-obrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2021 ;25(1):120-127. (In Russ.)] http://doi. org/10.21688/1681-3472-2021-1-120-127
- Bentall H., De Bono A. A technique for complete replacement of the ascending aorta. Thorax. 1968;23(4):338-339. PMID: 5664694; PMCID: PMC471799. https://doi.org/10.1136/thx.23.4338
- Комаров Р.Н., Катков А.И., Пузенко Д.В., Одинокова С.Н., Николенко В.Н. Хирургия корня аорты и аортального клапана: история и современность. Патология кровообращения и кардиохирургия. 2019;23(4):9-25. [Komarov R.N., Katkov A.I., Puzenko D.V., Odinokova S.N., Nikolenko V.N. Aortic root and aortic valve surgery: History and modernity. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2019;23(4):9-25. (In Russ.)] http://doi.org/10.21688/1681-3472-2019-4-9-25
- Komarov R., Chernov I., Enginoev S., Sa M.P.B.O., Tarasov D. The Russian Conduit - combining Bentall and Ozaki procedures for concomitant ascending aorta replacement and aortic valve neocuspidization. Braz J Cardiovasc Surg. 2019;34(5):618-623. PMID: 31719014; PMCID: PMC6852441. https://doi. org/10.21470/1678-9741-2019-0329
- Ozaki S., Kawase I., Yamashita H., Uchida S., Nozawa Y., Takatoh M., Hagiwara S. A total of 404 cases of aortic valve reconstruction with glutaraldehyde-treated autologous pericardium. J Thorac Cardiovasc Surg. 2014;147(1):301-306. PMID: 23228404. https://doi.org/10.1016/j. jtcvs.2012.11.012
- Ozaki S., Kawase I.,Yamashita H., Uchida S.,Takatoh M., Kiyohara N. Midterm outcomes after aortic valve neocuspidization with glutaraldehyde-treated autologous pericardium. J Thorac Cardiovasc Surg. 2018;155(6):2379-2387. PMID: 29567131. https://doi.org/10.1016/jj.jtcvs.2018.01.087
- Несмачный А.С., Карева Ю.Е., Рузматов Т.М., Чернявский А.М. Пластика створок аортального клапана ксе-ноперикардиальным лоскутом с использованием удерживающего устройства как альтернатива протезированию аортального клапана. Патология кровообращения и кардиохирургия. 2016;20(2):58-65. [Nesmachnyy A.S., Kareva Yu.E., Ruzmatov T.M., Chernyavskiy A.M. Truly stentless xenopericardial aortic valve replacement as an alternative to standard aortic valve replacements. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2016;20(2):58-65. (In Russ.)] http://doi. org/10.21688/1681-3472-2016-2-58-65
- Straka F., Schornik D., Masin J., Filova E., Mirejovsky T., Burdikova Z., Svindrych Z., Chlup H., Horny L., Daniel M., Machac J., Skibova J., Pirk J., Bacakova L. A human pericardium biopolymeric scaffold for autologous heart valve tissue engineering: cellular and extracellular matrix structure and biomechanical properties in comparison with a normal aortic heart valve. JBiomaterSciPolymEd. 2018;29(6):599-634. PMID: 29338582. https://doi.org/10.1080/09205063.2018.1429732
- Yamashita H., Ozaki S., Iwasaki K., Kawase I., Nozawa Y., Umezu M. Tensile strength of human pericardium treated with glutaraldehyde. Ann Thorac Cardiovasc Surg. 2012;18(5):434-437. PMID: 22572232. https://doi.org/10.5761/atcs.oa.11.01804
- Sung H.W., Chang Y., Chiu C.T., Chen C.N., Liang H.C. Crosslinking characteristics and mechanical properties of a bovine pericardium fixed with a naturally occurring crosslinking agent. J Biomed Mater Res. 1999;47(2):116-126. PMID: 10449623. https://doi.org/10.1002/(sici)1097-4636(199911)47:2-116::aid-jbm2-3.0.co;2-j
- Aguiari P., Fiorese M., Iop L., Gerosa G., Bagno A. Mechanical testing of pericardium for manufacturing prosthetic heart valves. Interact Cardiovasc Thorac Surg. 2016;22(1):72-84. PMID: 26489665. https://doi.org/10.1093/icvts/ivv282
- Al Halees Z., Al Shahid M., Al Sanei A., Sallehuddin A., Duran C. Up to 16 years follow-up of aortic valve reconstruction with pericardium: a stentless readily available cheap valve? Eur J Cardiothorac Surg. 2005;28(2):200-205; discussion 205. PMID: 16039963. https://doi.org/10.1016/j.ejcts.2005.04.041
- Барбараш Л.С., Рогулина Н.В., Рутковская Н.В., Овчаренко Е.А. Механизмы развития дисфункций биологических протезов клапанов сердца. Комплексные проблемы сердечно-сосудистых заболеваний. 2018;7(2):10-24. [Barbarash L.S., Rogulina N.V., Rutkovskaya N.V., Ovcharenko E.A. Mechanisms underlying bioprosthetic heart valve dysfunctions. Complex Issues of Cardiovascular Diseases. 2018;7(2):10-24. (In Russ.)] https://doi.org/10.17802/2306-1278-2018-7-2-10-24


