Противоопухолевая цитотоксическая активность лимфокин-активированных киллеров
Автор: Велижева Н.П., Жукова О.С., Лебединская О.В., Шубина И.ж, Лебединская Е.А., Киселевский М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 (25), 2008 года.
Бесплатный доступ
Изучена цитотоксическая активность лимфокин-активированных киллеров (ЛАК) по отношению к различным опухолевым линиям. Показано, что ЛАК обладают действием, подобным натуральным киллерам, и способны избирательно воздействовать на опухолевые клетки. Они обладают высокой киллерной способностью и широким спектром цитотоксической активности к различным видам трансформированных клеток. Эти данные имеют значение как для расширения области применения ИЛ-2/ЛАК терапии при различных нозологических формах, так и для подтверждения целесообразности использования её в биотерапии злокачественных новообразований.
Лимфокин-активированные киллеры, мононуклеарные клетки периферической крови, клетки опухолевых линий, цитотоксическая активность
Короткий адрес: https://sciup.org/14054826
IDR: 14054826 | УДК: 615.277.3:
Текст научной статьи Противоопухолевая цитотоксическая активность лимфокин-активированных киллеров
Цитотоксические лимфоциты и натуральные киллеры (НК) играют ключевую роль в системе противоопухолевого иммунитета. НК относятся к неспецифическому звену иммунитета и не требуют каскада реакций антигенной презентации в отличие от Т-киллеров. Характерным признаком натуральных киллеров является то, что они могут действовать независимо от наличия специфического антигена и молекул главного комплекса гистосовместимости (Major Histocompatibility Complex – МНС) на мембране измененной клетки. Сигналом на киллинг может быть изменение или отсутствие экспрессии молекул МНС либо их ассоциация с чужеродным белком (в случае вирус-индуцированной трансформации клетки). С одной стороны, имеются сведения о способности избирательного действия НК на опухолевые клетки, но с другой – существуют данные о возможности этих клеток поражать неизменённый эндотелий [1, 2].
К сожалению, высокоактивная субпопуляция натуральных киллеров малочисленна. Киллер-ная активность этих эффекторов иммунобиологического надзора может быть существенно повышена различными модулирующими факторами. С этой целью успешно применяется интерлейкин-2 (ИЛ-2) [4, 5, 7–9]. Генерация ex vivo лимфокин-активированных киллеров (ЛАК) – клеток с высокой степенью цитотоксичности – позволяет преодолеть природную малочисленность НК [1, 6, 11]. Адоптивная иммунотерапия с использованием ЛАК-клеток в настоящее время находит все более широкое применение [7, 10].
В связи с этим целью данной работы явилась оценка специфики лизиса различных клеточных опухолевых линий лимфокин-активированными киллерами и оценка степени их цитотоксической активности.
Материал и методы
Культивирование клеток опухолевых линий.
В качестве объекта исследования использовали линии опухолевых клеток человека: немелкоклеточный рак легкого А549, карцинома яичников человека линии SCOV3, рак молочной железы человека MCF7 и эритробластный лейкоз человека К562 (American Type Culture Collection).
Выделение мононуклеарных лейкоцитов (МЛ). Мононуклеарные лейкоциты выделяли из стабилизированной гепарином (25 ед/мл) периферической крови 30 здоровых доноров на одноступенчатом градиенте фиколла (Pharmacia, плотностью 1,077 г/см3) центрифугированием при 400 g в течение 30 мин. Мононуклеарные клетки (МНК), образовавшие интерфазное кольцо, собирали пипеткой и трехкратно отмывали в среде 199 (Институт полиомиелита и вирусных энцефалитов РАМН, Москва). После каждой отмывки в 10-кратном объёме среды клетки осаждали центирифугированием при 200 g.
Генерация ЛАК. Выделенные из периферической крови МНК ресуспендировали в полной культуральной среде (среда RPMI 1640, 10 % эмбриональной телячьей сыворотки, глютамин, гентамицин) в концентрации 1х106 в 1 мл среды. Затем добавляли ИЛ-2 (Proleukine, Chiron, Голландия) в концентрации 10000 МЕ/мл. Клетки инкубировали при 4,5 % СО2 и 37°С в течение 11 сут.
Определение цитотоксической активности – MTT тест. Цитотоксическую активность лимфоцитов определяли на NK-чувствительной линии клеток эритробластного лейкоза человека К-562, немелкоклеточного рака легкого А-549, рака яичника SKOV-3, нормальных клетках легкого эмбриона теленка VER и на фибробластах, полученных из фрагментов кожи донора в тесте восстановления 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида. Опухолевые и нетрансформированные аллогенные клетки (1x104 в 1 мл) инкубировались в культуральной среде с МНК (в соотношениях клетки-мишени/ эффекторы 1:5; 1:2; 1:1 и 1:0,5) в плоскодонных 96-луночных микропланшетах (Costar, Франция) 18 ч. Затем в лунки добавлялся витальный
Таблица
Цитотоксическая активность мононуклеарных клеток крови и лимфокин-активированных киллеров по отношению к клеткам различных опухолевых линий (%)
|
Соотношение кл.мишень / кл.эффектор |
Немелкоклеточный рак легкого А-549 |
Эритробластный лейкоз человека К-562 |
Рак яичника SKOV-3 |
Рак молочной железы человека MCF7 |
||||
|
МНК (контр.) |
ЛАК |
МНК (контр.) |
ЛАК |
МНК (контр.) |
ЛАК |
МНК (контр.) |
ЛАК |
|
|
1:5 |
58 ± 4,5 |
77 ± 5,8* |
68 ± 9,7 |
86 ± 5,1* |
28 ± 9,2 |
51,5 ± 10,1* |
10 ± 5,2 |
62,5 ± 5,8* |
|
1:2 |
53 ± 5,2 |
60 ± 6,4 |
41 ± 5,3 |
69 ± 6,3* |
25 ± 8,9 |
40 ± 9,2* |
7,5 ± 2,4 |
35,5 ± 4,6* |
|
1:1 |
42 ± 3,1 |
58 ± 6,2 |
33 ± 3,4 |
57 ± 2,7* |
20 ± 5,4 |
30 ± 7,6 |
6 ± 3,1 |
27 ± 6,7* |
Примечание: * – достоверность различий между МНК и ЛАК (p < 0,05)
краситель МТТ (Sigma, США) и по оптической плотности, измеряемой на мультискане МСС-340 (Labsystem, Финляндия), рассчитывался процент лизиса опухолевых клеток (процент цитотоксичности).
Морфо-гистохимическое исследование. Через 5 сут после начала культивирования из центрифугата надосадочной жидкости культур, содержащих мононуклеарные клетки крови донора, активированные ИЛ-2, делали мазки, которые окрашивали азуром II-эозином по Романовскому-Гимза.
Анализ фенотипа ЛАК. Фенотип генерированных клеток исследовали с использованием моноклональных антител (Caltag Laboratories, США) против соответствующих антигенов. Клетки отмывали холодным фосфатно-солевым буфером (ФСБ) и окрашивали FITC-(флюорес-циинизотиоционат) и P- (фикоэритрин) мечеными антителами согласно инструкции производителя. Результаты учитывали на проточном цитометре FacsCalibur (Becton Dickinson). Гейт (окно) популяции клеток устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывали 10000 событий в гейте. Статистическая обработка материала проведена при помощи программного пакета WINMDI 2.8.
Результаты и обсуждение
Как следует из данных, представленных в таблице, лимфокин-активированные киллеры обладают высокой степенью цитотоксичности по отношению к трансформированным клеточным линиям рака яичника SKOV-3, немелкоклеточного рака легкого А-549, рака молочной железы человека MCF7 и эритробластного лейкоза К-562. При этом уровень цитотоксической активности достоверно повышается при уменьшении соотношения клетка-мишень/клетка-эффектор. Максимальные значения киллерной активности (63, 77 и 86 % соответственно) по сравнению со спонтанной цитотоксической активностью МЛ (58–68 %) достигаются при соотношении мишень–эффектор 1:5. Рис. 1–3 наглядно демонстрируют активный лизис клеток различных опухолевых линий под действием активированных ИЛ-2 мононуклеарных лейкоцитов.
В наших предыдущих исследованиях [3] при цитологическом изучении мазков, полученных из взвеси МЛ, активированных ИЛ-2, показано, что на 5-е сут инкубации существенно возрастает количество лимфоцитов на фоне резкого уменьшения содержания гранулярных лейкоцитов. В эти сроки наблюдается большое количество бластных форм с преобладанием крупных клеток типа пролимфоцитов (рис. 4). В культуре часто встречаются клетки в состоянии митотического деления, что говорит об их высокой пролиферативной активности.
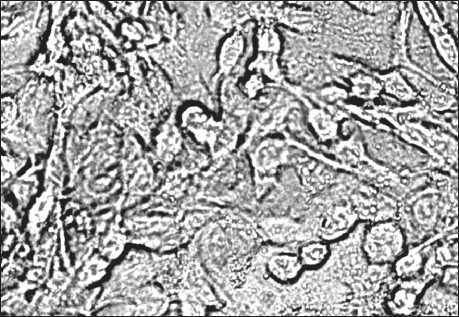
а
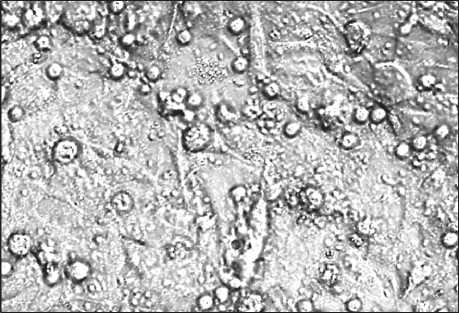
б
Рис. 1. Клетки немелкоклеточного рака легкого А-549 в культуре до (а) и после (б) добавления лимфокин-активированных киллеров. Соотношение клетка-мишень/клетка-эффектор – 1:5. Микрофотографии культуральной взвеси. Фазовоконтрастная микроскопия в светлом поле. Ок. 10, об. 20
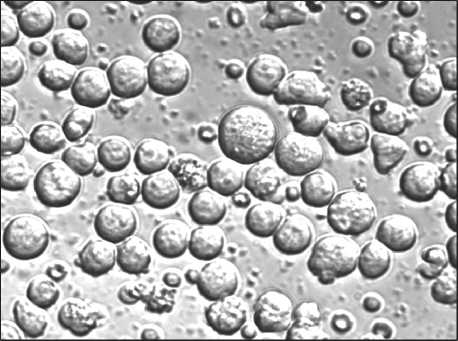
а
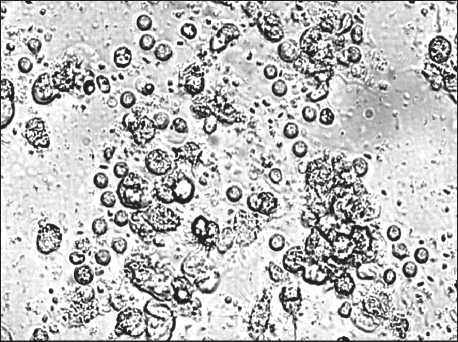
б
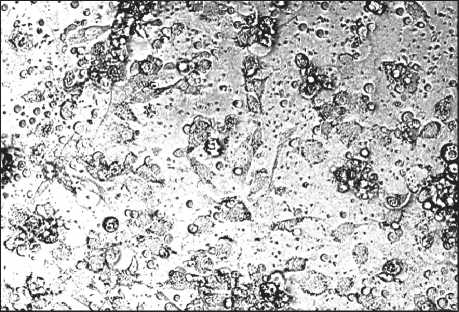
Рис. 2. Клетки эритробластного лейкоза К-562 в культуре до (а) и после (б) добавления лимфокин-активированных киллеров.
Соотношение клетка-мишень/клетка-эффектор – 1:5. Микрофотографии культуральной взвеси. Фазовоконтрастная микроскопия в светлом поле. Ок. 10, об. 20
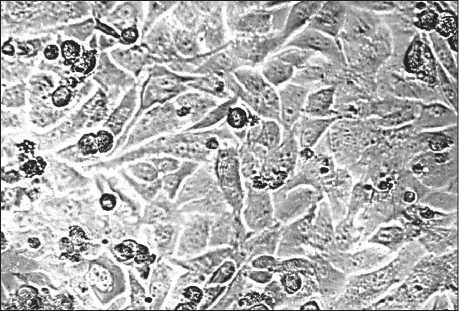
б
Рис. 3. Клетки рака яичника SKOV-3 в культуре до (а) и после (б) добавления лимфокин-активированных киллеров.
Соотношение клетка-мишень/клетка-эффектор – 1:5.
Микрофотографии культуральной взвеси. Фазовоконтрастная микроскопия в светлом поле. Ок. 10, об. 20
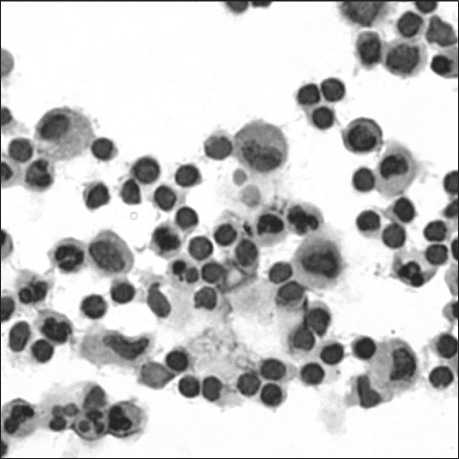
Рис. 4. Лимфокин-активированные киллеры, генерированные из мононуклеарных лейкоцитов периферической крови здоровых доноров (5-й день инкубации). Микрофотография ЛАК в мазке культуральной взвеси. Окраска азуром II-эозином. Ок. 10, об. 40
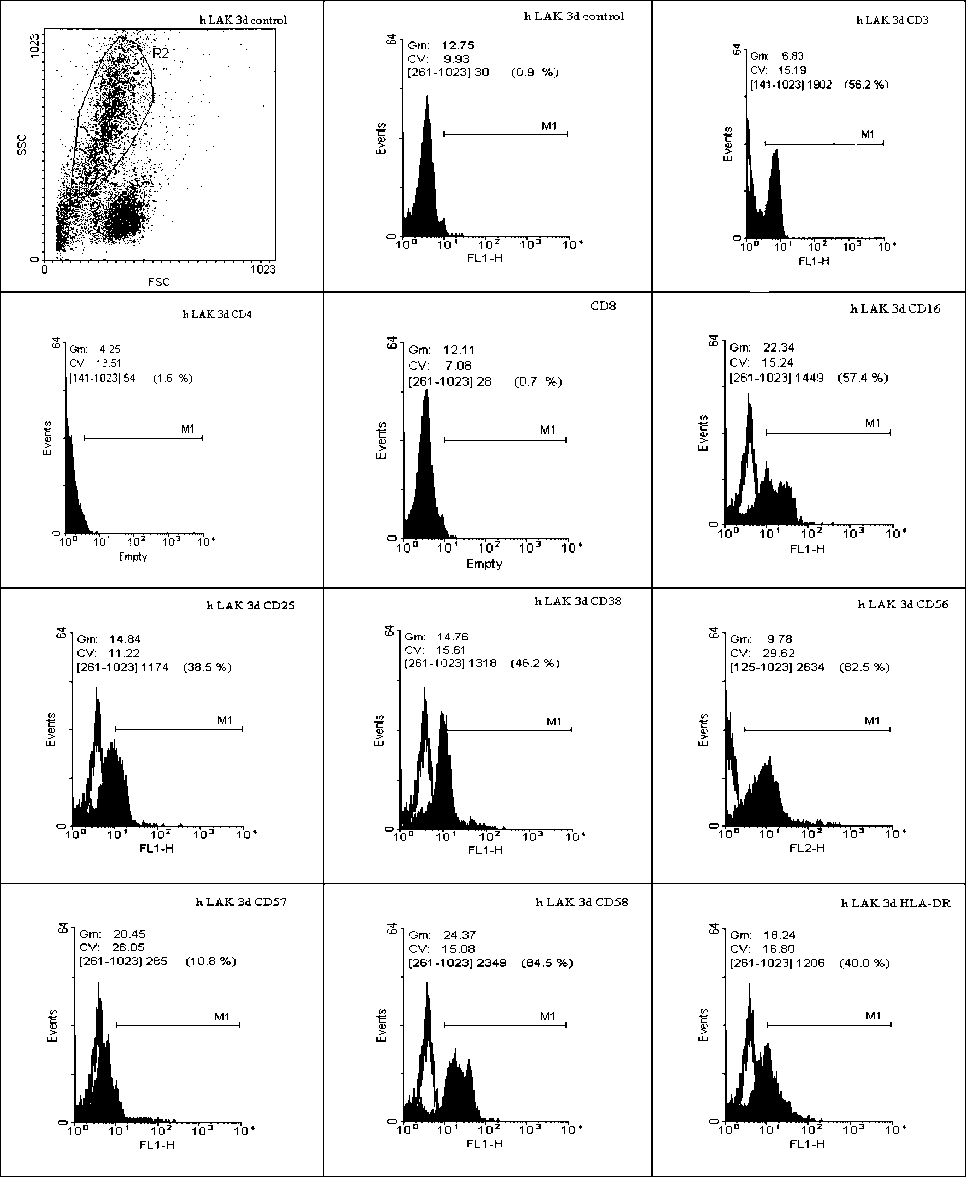
Рис. 5. Гистограммы, отражающие уровень экспрессии поверхностных молекул (кластеров детерминации) лимфокин-активированных киллеров (ЛАК), генерированных из мононуклеарных лейкоцитов периферической крови доноров (3-и сут инкубации с ИЛ-2).
Верхний ряд, дотплот – светорассеяние (популяция ЛАК-клеток в очерченной области), на гистограммах левый пик – аутофлюоресценция клеток при использовании изотипического контроля, правый – флюоресценция (FITC – флюоресциинизотиоционат и R-PE фикоэритрин) после окрашивания соответствующими антителами.


