Противоопухолевые свойства ядерных эритроидных клеток
Автор: Козлов В.А., Селедцова Г.В., Доржиева А.Б., Иванова И.П., Селедцов В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Целью исследования явилось изучение супрессорной и/или цитотоксической активности ядерных эритроидных клеток (ЯЭК) в отношении опухолевых клеток различного происхождения. Материал и методы. В работе использованы мыши линии С57Bl/6, клетки опухолевых линий Р815, l1210, В16 и l929. «Фенилгидразиновые» ЯЭК получали от мышей с индуцированной гемолитической анемией. «Эритропоэтиновые» ЯЭК выделяли из «фенилгидразиновой селезенки» и далее культивировали в присутствии эритропоэтина. Еще одним источником ЯЭК были селезенки новорожденных мышей, клетки фетальной печени человека и мыши и клетки костного мозга мыши, прокультивированные с эритропоэтином. Цитостатический эффект ЯЭК или их супернатантов регистрировали по снижению пролиферации линий Р815, l1210, B16, llc, l929 Результаты. Обнаружено наличие выраженной прямой противоопухолевой активности как у ЯЭК, так и у продуктов их культивирования в отношении клеток различных опухолевых линий. Супрессорный эффект неспецифичен. Заключение. Учитывая цитостатическую активность ЯЭК, их существенное численное преобладание во время развития эмбриона над всеми другими ростками кроветворения, можно предположить возможность участия эритробластов в процессе создания противоопухолевой защиты плода в этот период жизни.
Ядерные эритроидные клетки, эритробласты, противоопухолевая активность
Короткий адрес: https://sciup.org/140295078
IDR: 140295078 | УДК: 616.155.14:616-006:612.017 | DOI: 10.21294/1814-4861-2022-21-3-42-49
Текст научной статьи Противоопухолевые свойства ядерных эритроидных клеток
В процессе эмбриогенеза эритробласты (ядер-ные эритроидные клетки, ЯЭК) являются наиболее массовым клеточным продуктом размножения полипотентных стволовых кроветворных клеток, которые впервые появляются в желточном мешке эмбриона и затем мигрируют в печень эмбриона, которая и становится основным гемопоэтическим органом на протяжении всего периода внутриутробного развития [1]. В эмбриональной печени на ранних этапах развития обнаруживаются только В-лимфоциты при полном отсутствии Т-лимфоцитов до момента созревания тимуса [2].
В многочисленных исследованиях было показано, что эритробласты обладают способностью подавлять функции Т- и В-клеточного звена иммунитета [3, 4]. Иммуносупрессивной активностью обладали эритробласты, выделенные из эмбриональной печени человека и мышей, клеток селезенки новорожденных животных и селезенок мышей, подвергнутых воздействию гипоксии или гемолитического яда – фенилгидразина [5]. При этом наибольшим супрессивным эффектом обладали ЯЭК из эмбриональной печени, по сравнению с клетками из других источников [4]. Что касается механизмов иммуносупрессивного действия ЯЭК, было выяснено, что эти клетки, по всей вероятности, продуцируют целый ряд цитокинов, таких как IL-4, IL-10, IFN-γ, TNF-α, TGF-β, из которых три последних могут иметь отношение к подавлению активности В-клеток [6]. Получены данные о том, что эритробласты обладают способностью повреждать мембраны клеток селезенки мышей при их совместном культивировании. Повреждение целостности мембран клеток оценивали по уровню выхода из клеток 3Н-уридина [5]. Результаты этих исследований позволили предположить, что эритробласты могут обладать и цитотоксической активностью в отношении других клеточных элементов, включая опухолевые клетки.
Во взрослом организме костный мозг является местом с наиболее высокой пролиферативной активностью клеток, поэтому логично пред- положить, что основные механизмы контроля пролиферативных процессов сосредоточены и реализуются именно здесь. Популяционный состав костного мозга представлен незрелыми клетками всех ростков кроветворения, однако доля клеток, относящихся к эритроидному ряду, значительно превышает все остальные ростки и достигает 30 %. Мы полагаем, что именно ЯЭК задействованы в реализации программ, обеспечивающих стабильность популяционного состава костного мозга путем ограничения размножения как нормальных клеток, вовлеченных в гемопоэз, так и возникающих из них опухолевых клеток.
Целью исследования явилось изучение возможной супрессорной и/или цитотоксической активности ЯЭК в отношении опухолевых клеток различного происхождения.
Материал и методы
Животные
Мыши С57Bl/6 (В6) получены из питомника НИИФиРМ им. Е.Д. Гольдберга Томский НИМЦ.
Линии опухолевых клеток
Клетки Р815 (мастоцитома), L1210 (лимфома), В16 (меланома), L929 (трансформированная соединительная ткань) сохраняли пассированием in vitro в среде RPMI 1640, содержащей 10 % фетальной сыворотки коров (FCS), L-глютамин и антибиотики.
Культуральные среды и реагенты
Среда RPMI 1640, НЕРЕS, L-глютамин, гентамицин (Sigma-Aldrich, США)), рекомбинантный эритропоэтин (ЭПО) (Cilag, Швейцария), Кон А (Pharmacia Biotechnology, Швеция), [H-3]-тимидин (НПО «Изотоп», С-Петербург). Клетки костного мозга, селезенки и фетальной печени получали посредством мягкого выдавливания клеток из ткани стромы органа. Полученные клеточные суспензии отстаивали 7 мин для удаления крупных недиссо-циированных конгломератов. Выделенные из тканей органов клетки культивировали в RPMI 1640 в присутствии 10мМ НЕРЕS, 2мМ L-глютамина, меркаптоэтанола, 30 мкг/мл гентамицина и 10 % FCS.
Источники и методы получения ядросодержащих эритроидных клеток «Фенилгидразиновые» ЭК. Гемолитический яд фенилгидразин вводили мышам внутрибрюшинно в дозе 1,2 мг/мышь 3 раза с интервалами в 12 и 20 ч для индукции гемолитической анемии. Через 48 ч после последней инъекции у мышей забирали селезенки и использовали их в качестве источника ЯЭК. ЯЭК, присутствующие в спленоцитах, отделяли от эритроцитов центрифугированием при 400 g в градиенте перколла (плотность 1,076) в течение 30 мин. Из полученной суспензии методом «пэннинга» получали популяцию эритроидных бластных клеток, для чего суспензию клеток, предварительно обработанных анти-CD3+ антителами, помещали в пластиковую культуральную чашку с предварительно адсорбированными на ней кроличьими АТ к Ig-G мыши. Процедуру «пэннинга» проводили согласно методу, описанному ранее [7]. В результате этой процедуры макрофаги прикреплялись к пластиковой поверхности чашки за счет неспецифического связывания, Т- и В-лимфоциты – за счет Ig-рецепторного взаимодействия с сорбированными на пластиковой поверхности чашки иммуноглобулинами кролика. Чистоту удаления Т- и В-лимфоцитов контролировали иммуноф-люоресцентным анализом. После пэннинга не-прикрепившиеся к пластику клетки отмывали и обрабатывали 15 мМ лейцин-метиловым эфиром в течение 30 мин. Полученная в результате обработок клеточная популяция на 95 % состояла из ЯЭК. Выделенные из «фенилгидразиновой селезенки» ЭК культивировали далее в присутствии 2–5 Ед/мл эритропоэтина (ЭПО) (или без него в контроле) в бессывороточной среде Искова, содержащей 0,5% бычьего сывороточного альбумина, 4мМ L-глютамина, 5х10 -5 меркаптоэтанола, 30 мкг/мл гентамицина. Полученная в результате такого культивирования клеточная популяция на 97 % состояла из разной степени зрелости бластных эритроидных клеток.
«Новорожденные» ЯЭК. В наших экспериментах источником клеток были селезенки новорожде-ных мышей. ЯЭК выделяли методом «пеннинга», полученная популяция на 95 % была представлена ЯЭК, подавляющее большинство клеток имело базофильную цитоплазму.
ЯЭК, выделенные из костного мозга мышей, фетальной печени человека или мыши. Клетки фетальной печени человека получали из органа при процедуре аборта (срок гестации 10–12 нед). Клетки фетальной печени мышей получали из печени плодов мыши на стадии 15–17 дней беременности. Клетки костного мозга мышей получали из эпифизов бедренных костей взрослых животных. Полученные из костного мозга клетки в концентрации 5 млн/мл культивировали с 2 ед/мл эритропоэтина в течение 3 сут, далее клетки отмывали от стимулятора и использовали в экспериментах.
Получение культуральных супернатантов. ЯЭК, полученные из различных источников, в концентрации 4 × 106/мл культивировали в бес-сывороточной среде Искова, с добавлением 4мМ L-глютамина в течение 24 ч. По окончании культивирования супернатанты отделяли от клеток центрифугированием и использовали в различных концентрациях в экспериментах.
Оценка противоопухолевой активности ЯЭК и полученных из них супернатантов. Клетки опухолевых линий Р815, L1210, B16, LLC, L929 в соотношении 1:15 и 1:30 (1 × 105 кл/лунка опухолей культивировали в присутствии различных концентраций ЯЭК – 15 × 105 и 30 × 105 клеток/лунка или без них в контроле) или в присутствии 30–50 % супернатанта ЯЭК в течение 72 ч, далее оценивали пролиферацию опухолевых клеток по включению в клетки 3Н-тимидина или колориметрически с помощью МТТ-теста. Пролиферативную активность отображали в имп/мин, при использовании радиоактивного метода, или единицах оптической плотности, при использовании МТТ-теста. В этом случае опухолевые клетки культивировали с ЯЭК в течение 72 ч. По окончании культивирования планшеты центрифугировали 5 мин при 1000 × g, 4 °C , затем удаляли надосадок и в каждую лунку добавляли 50 мкл МТТ-реагента (набор MTT-assay kit (cell proliferation), Abcam). После культивирования в течение 3 ч в условиях CO2-инкубатора к пробам добавлялся растворитель МТТ. Через 15 мин пребывания планшета на орбитальном шейкере степень окрашивания лунок регистрировалась с помошью планшетного ридера при длине волны 590 нм. Интенсивность окрашивания была пропорциональна количеству клеток в лунках.
Процент супрессорной активности вычисляли следующим образом:
% цитотоксичности =
= (100 ×(контроль - опыт)) / контроль.
Полученные результаты были проанализированы и графически представлены с помощью программы GraphPadPrizm8. Для оценки достоверности различий использовали тест one-way и two-way ANOVA программы GraphPadPrizm8. Достоверность различий экспериментальных данных представлена на рисунках. Данные на графиках представлены в виде среднего значения и стандартной ошибки.
Все исследования проводились согласно протоколу гуманности, отраженному в директивах Европейского сообщества и Хельсинкской декларации, согласно «Правилам проведения работ с экспериментальными животными».
Результаты
В работе исследованы противоопухолевые свойства ядерных эритроидных клеток, полученных из различных источников: из клеток селезенок новорожденных мышей, из клеток фетальной печени
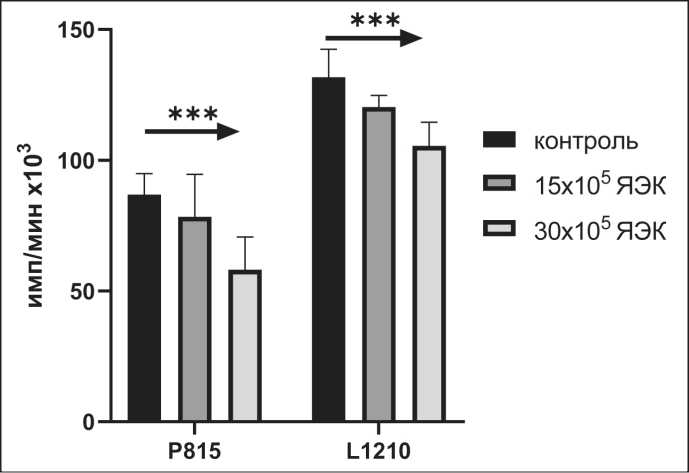
Рис. 1. Влияние различных концентраций ЯЭК, полученных из клеток селезенок новорожденных мышей, на пролиферацию клеток опухолевых линий Р815 и L1210. Концентрация опухолевых клеток 1 × 105 кл/лунка (n=8).
Примечания: * – различия статистически значимы (р<0,01);
*** – различия статистически значимы (р<0,001)
Fig. 1. The effect of different concentrations of NEC obtained from newborn mouse spleen cells on the proliferation of P815 and L1210 tumor cell lines. Concentration of tumor cells 1 × 105 cells/well (n=8).
Note: * – significant differences (р<0.01), *** – significant differences (р<0.001)
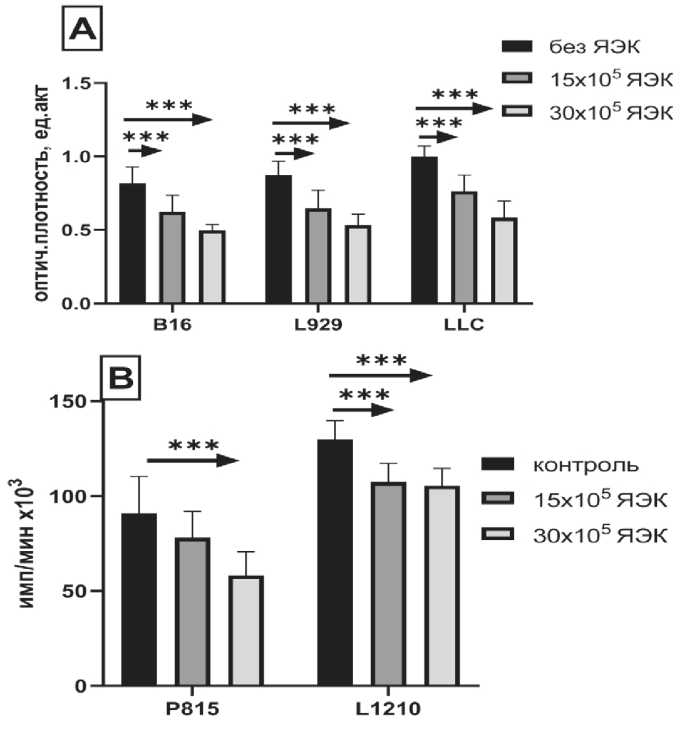
Рис. 2. Влияние различных концентраций ЯЭК, полученных из клеток фетальной печени мыши (А) или человека (В), на пролиферацию клеток опухолевых линий В16, L929 и LLC, Р815 и L1210. Концентрация опухолевых клеток 1 × 105 кл/лунка (n=8).
Примечания: * – различия статистически значимы (р<0,01);
*** – различия статистически значимы (р<0,001)
Fig. 2. The effect of various concentrations of NEC obtained from mouse (A) or human (B) fetal liver cells on the proliferation of tumor cell lines B16, L929 and LLC, P815 and L1210. Concentration of tumor cells 1 × 105 cells/well (n=8).
Note: * – significant differences (р<0.01), *** – significant differences (р<0.001)
мыши и человека, из клеток костного мозга мышей и из селезенок анемичных мышей. Cелезенка новорожденных мышей является основным источником кроветворения. Выделенную из селезенки методом «пеннинга» популяцию ЯЭК в концентрации 15 × 105 кл/лунка и 30 × 105 клеток помещали в лунки 96-луночного культурального планшета и совместно с клетками лейкозных опухолевых линий Р815 и L1210 в концентрации 1 × 105 кл/лунка культивировали в течение 72 ч. Показано дозо-зависимое увеличение цитостатической активности ЯЭК в отношении двух лейкозных линий как Р815 (>30 %), так и L1210 (>20 %) (рис. 1). Во время внутриутробного развития печень является основным источником кроветворения, в ее клеточном составе преобладают клетки эритроидного ростка кроветворения, составляя до 80 % ее клеточного состава. Далее в эксперименте были использованы клетки фетальной печени мышей 15–20 дней гестации (рис. 2А) или клетки печени плода человека (рис. 2В) 10–12 нед гестации, полученные после прерывания беременности по медицинским показаниям. Клетки фетальной печени мышей были добавлены к опухолевым клеткам линии меланомы В16, карциномы LLC и соединительнотканой опухолевой линии L929 в концентрации 15 × 105 кл/лунка и 30 × 105 клеток в лунку планшета. Показано дозо-зависимое, значимое снижение пролиферации 3 опухолевых линий, наиболее выраженное при концентрации добавленных клеток в 30 × 105 через 24 ч совместного культивирования (рис. 2А). Аналогично показан дозо-зависимый, неспецифический супрессорный эффект клеток
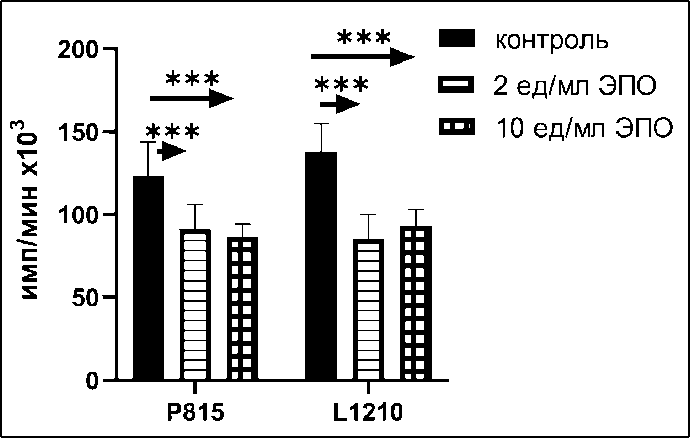
Рис. 3. Пролиферация клеток опухолевых линий Р815 и L1210 в присутствии клеток костного мозга мышей, активированных в течение 48 ч различными концентрациями эритропоэтина (n=8).
Примечания: * – различия статистически значимы (р<0,01);
*** – различия статистически значимы (р<0,001)
Fig. 3. Proliferation of P815 and L1210 tumor cell lines in the presence of mouse bone marrow cells activated for 48 h with various concentrations of erythropoietin (n=8). Note: * – significant differences (р<0.01), *** – significant differences (р<0.001)
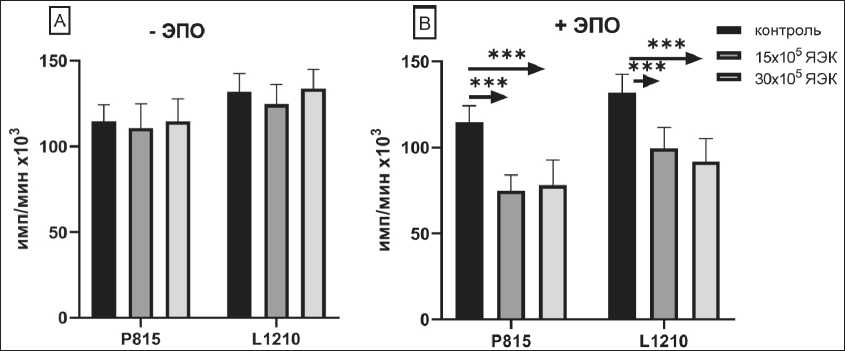
Рис. 4. Влияние различных концентраций ЯЭК , полученных из селезенок мышей с гемолитической анемией (А) и после культивирования с 2,5 ед/мл ЭПО (В), на пролиферацию клеток опухолевых линий Р815 и L1210 (n=8).
Примечания: * – различия статистически значимы (р<0,01);
*** – различия статистически значимы (р<0,001)
Fig. 4. Effect of different concentrations of NEC obtained from the spleens of mice with hemolytic anemia (A) and after cultivation with
2.5 U/ml EPO (B) on the proliferation of P815 and L1210 tumor cell lines (n=8).
Note: * – significant differences (р<0.01), *** – significant differences (р<0.001)
фетальной печени человека на пролиферацию Р815 и L1210 (рис. 2В). Клетки костного мозга взрослого организма содержат до 30 % клеток эритроидного ряда различной зрелости. Культивирование их с эритропоэтином (ЭПО) увеличивает концентрацию ЯЭК среди этих клеток в несколько раз. В серии экспериментов была оценена супрессорная способность клеток костного мозга, прокультивированных с ЭПО в течение 3 сут. Культивирование клеток костного мозга мышей с 2 ед/мл ЭПО более чем в 2 раза повышало супрессорную противоопухолевую активность клеток костного мозга (рис. 3). Для подтверждения участия клеток эритроидного ряда в супрессии пролиферации клеток различных опухолевых линий была получена популяция незрелых эритроидных клеток в модели индуцированной гемолитической анемии. Выделенные из селезенки мышей C57BL/6 методом позитивной селекции ЯЭК использовали в эксперименте по влиянию на пролиферацию опухолевых клеток in vitro. Мы не обнаружили супрессорного эффекта ЯЭК, полученных из селезенки мышей с гемолитической анемией (рис. 4), однако 48 ч культивирования этих ЯЭК с 2 ед/мл эритропоэтина (ЭПО) восстанавливало их супрессорную активность. (рис. 4). Таким образом, мы подтвердили наличие выраженной прямой противоопухолевой активности у незрелых клеток эритроидного ряда как в отношении клеток лейкозных линий, так и в отношении клеток солидных опухолей. Супрессорный эффект был неспецифичен, поскольку регистрировался в отношении клеточных линий разного гаплотипа и не был рестриктирован по HLA. Неспецифичность супрессорного действия ЯЭК позволила предположить наличие гуморальной составляющей противоопухолевого эффекта ЯЭК. Показана дозо-зависимая супрессорная ак- тивность как супернатанта, полученного от чистой культуры ядерных эритроидных клеток, так и от супернатанта, полученного от 24 ч культивирования клеток фетальной печени мыши (табл. 1, 2) .Таким образом, в наших экспериментах показана прямая неспецифическая супрессорная противоопухолевая активность ЯЭК, полученных из различных источников. Эта супрессия опосредована растворимыми продуктами самих клеток.
Обсуждение
Таким образом, полученные результаты свидетельствуют, прежде всего, о том, что ЯЭК, полученные из эмбриональной печени мышей и человека, из селезенки новорожденных мышей и животных, обработанных фенилгидразином, оказывают прямой цитостатический эффект на опухолевые клетки различного происхождения. При этом следует особо подчеркнуть, что цитостатические эффекты эритробластов различного тканевого происхождения регистрировались при полном отсутствии клеток-профессиональных убийц опухолевых клеток, таких как NK клетки, макрофаги, цитотоксические CD8+ лимфоциты [8]. Говоря о возможных механизмах эффекта ЯЭК, прежде всего, можно было бы думать об участии в процессе цитокинов, продуцируемых этими клетками, таких как эритроидный диффе-ренцировочный регулятор (Erdr1) [9, 10], ИЛ-10, TGF-β и IFN-α [3, 9]. Эти цитокины обладают противоопухолевым эффектом, тормозя рост опухолевых клеток при определенных условиях и на определенной стадии развития опухоли. При иных ситуациях, иных условиях и TGF-β, и TNF-α могут способствовать выживанию опухолевых клеток и их активному росту, супрессируя противоопухолевые Т-клеточные реакции [3, 11]. Показано, что
Таблица 1/table 1
Влияние эритроидного супернатанта, полученного от ЯЭк анемичных мышей, на пролиферацию опухолевых линий Р815 и l1210, выраженное в % супрессорной активности (n=8)
effect of erythroid supernatant obtained from nec of anemic mice on the proliferation of p815 and l1210 tumor lines, expressed as % suppressor activity (n=8)
|
Супернатант/ Supernatant, % |
7,5 |
15 |
30 |
|
Р815 |
5,0 ± 2,7 |
40,0 ± 4,3** |
47,0 ± 2,1** |
|
L1210 |
4,0 ± 3,5 |
18,0 ± 1,6 |
27,0 ± 1,8* |
Примечания: * – различия статистически значимы (р<0,01); ** – различия статистически значимы (р<0,001).
Note: * – significant differences (р<0.01), ** – significant differences (р<0.001).
Таблица 2/table 2
Влияние эритроидного супернатанта, полученного от 24 ч культивирования клеток фетальной печени мышей, на пролиферацию опухолевых линий В16 , l929 и llc , выраженное в % супрессорной активности (n=8)
effect of erythroid supernatant obtained from 24-hour cultivation of mouse fetal liver cells on the prolifera tion of B16, l929 and llc tumor lines, expressed as % suppressor activity (n=8)
|
Супернатант/ Supernatant, % |
30 |
50 |
|
В16 |
21,0 ± 2,4 |
41,0 ± 1,5** |
|
L929 |
11,0 ± 3,5 |
33,0 ± 1,8* |
|
LLC |
12,0 ± 2,6 |
31,0 ± 2,1** |
Примечание: * – различия статистически значимы (р<0,01), ** – различия статистически значимы (р<0,005).
Note: * – significant differences (р<0.01), ** – significant differences (р<0.005).
эритроидные клетки экспрессируют молекулы не классического HLA-G класса I. Имеются данные об ингибирующем влиянии этих HLA-G молекул на активность NK клеток и цитотоксических Т-лимфоцитов, а также на пролиферацию Т-клеток [12–14]. Можно предположить, что в наших экспериментах эти же молекулы оказывают цитостатический эффект и на опухолевые клетки. Нельзя исключить, что это еще один возможный механизм цитостатического действия ЯЭК. Данные литературы свидетельствуют о том, что эритроидные клетки экспрессируют фермент аргиназу-2 с последующим снижением в окружении содержания аргинина, что негативно сказывается на активности иммунокомпетентных клеток [15, 16]. Учитывая данные о том, что опухолевые клетки используют для внутриклеточных целей внеклеточный аргинин, можно думать, что аргинин также необходим для жизнедеятельности опухолевых клеток, и при недостаточном поступлении его в опухолевые клетки пролиферативная активность последних снижается. Об этом эффекте аргинина свидетельствуют данные о значительном подавлении роста опухоли в условиях его сниженного содержания в среде, окружающей опухолевые клетки. Более того, подход, основанный на увеличении уровня метаболизма аргинина, успешно используется в противоопухолевой терапии [17, 18].
С уровнем экспрессии аргиназы-2 на ЯЭК, возможно, связаны наши данные об отсутствии цитостатического эффекта у ЯЭК, полученных от взрослых мышей, обработанных фенлигидразином.
Было показано, что CD71+TER119+ эритробласты от взрослых анемичных мышей не обладают иммуносупрессорной активностью на фоне резко сниженной экспрессии аргиназы-2 в клетках [15]. Можно думать, что обработка эритропоэтином эритробластов стимулирует экспрессию аргиназы-2, реверсируя у них способность оказывать цитостатический эффект на рост опухолевых клеток.
Нельзя исключить возможное участие в цитостатическом эффекте ЯЭК в отношении опухолевых клеток белка р15Е – продукта гена env, контролирующего синтез оболочечных белков вируса. По крайней мере, было показано, что обработка эритроидных клеток антителами против белка р15Е отменяла их способность подавлять пролиферацию лимфоцитов [19].
Можно согласиться с мнением S. Elahi о возможной иммуносупрессивной роли эритробластов в начальный период онтогенеза, которая заключается в подавлении возможной чрезмерной реакции иммунной системы воспалительного характера на поступление в организм множества микроорганизмов через кишечник [20]. Данные, полученные J. Michaelsson et al., свидетельствуют об активности у эмбрионов CD4+CD25high Treg, которые также несут ответственность за подавление активности Т-клеток эффекторов у эмбрионов [21]. Исходя из этого, можно предположить, что во время эмбрионального периода развития,формируется содружество 2 популяций клеток с иммуносупрессивной активностью – ЯЭК и Treg клеток. Можно предположить, что такой жесткий контроль за активностью Т-клеток-эффекторов необходим для предотвращения малейшей возможной активности этих клеток против собственных антигенов с целью оптимального развития тканей и органов с их оригинальными антигенными характеристиками. Следовательно, супрессорная активность эритроидных клеток и Treg подавляет возможное развитие у эмбрионов аутоиммунной патологии. С другой стороны, чтобы не формировались опухолевые процессы на фоне подавленной активности Т-клеток эффекторов, у эритробластов формируется способность противостоять развитию опухолевого процесса. Если принять во внимание тот факт, что во время эмбрионального развития крайне редко регистрируется развитие опухолевого процесса, и, учитывая цитостатическую активность ЯЭК и их существенное численное преобладание во время развития эмбриона над всеми потенциальными убийцами опухолевых клеток (NK, цитотоксические Т-лимфоциты, макрофаги и др.), следует признать возможность участия эритробластов в процессе противоопухолевого иммунитета в течение эмбрионального развития организма. В принципе, у эмбриона, как и во взрослом организме, складывается ситуация, когда при нормальном функционировании иммунной системы не отмечается развитие аутоиммунной патологии и опухолевого процесса.
Список литературы Противоопухолевые свойства ядерных эритроидных клеток
- GaoX., Xu C., Asada N., FrenetteP.S. The hematopoietic stem cell niche: from embryo to adult. Development. 2018; 145(2). doi: 10.1242/ dev.139691.
- Osmond D.G. The ontogeny and organization of the lymphoid system. J Invest Dermatol. 1985; 85(1): 2-9. doi: 10.1111/1523-1747. ep12275397.
- Grzywa T.M., Justyniarska M., Nowis D., Golab J. Tumor Immune Evasion Induced by Dysregulation of Erythroid Progenitor Cells Development. Cancers (Basel). 2021; 13(4): 870. doi: 10.3390/can-cers13040870.
- Цырлова И.Г., Чеглякова В.В., Козлов В.А. Иммунодепрес-сивный эффект популяций клеток с различной эритропоэтической активностью у зародышей и новорожденных. Онтогенез 1985; 16(2): 143-51. [TsyrlovaI.G., Cheglyakova V.V., Kozlov V.A. Immunosuppressive effect of cell populations with different erythropoietic activity in embryos and newborns. Ontogenesis 1985; 16 (2): 143-151. (in Russian)].
- Grzywa T.M., Nowis D., Golab J. The role of CD71+ erythroid cells in the regulation of the immune response. Pharmacol Ther. 2021; 228: 107927. doi: 10.1016/j.pharmthera.2021.107927.
- Sennikov S.V., Krysov S.V., Unjelevskaya T.V., Silkov A.N., Kozlov V.A. Production of cytokines by immature erythroid cells derived from human embryonic liver. Eur Cytokine Net. 2001; 12(2): 274-9.
- SamarinD.M., Seledtsova G.V., Seledtsov V.I., Taraban V.Ya., Ko-zlov V.A. Suppressive Effect of Immature Erythroid Cells on the B-Cell Proliferation. Bull Exp Biol Med. 1997; 123: 57.
- Seledtsov V.I., Seledtsova G.V., Samarin D.M., Senyukov V.V., Poveschenko O.V., Felde M.A., Kozlov V.A. Erythroid cells in suppressing leukemia cell growth. Leuk Lymphoma. 2005; 46(9): 1353-6. doi: 10.1080/10428190500160207.
- Lee J., Jung M.K., Park H.J., Kim K.E., Cho D. Erdr1 Suppresses Murine Melanoma Growth via Regulation of Apoptosis. Int J Mol Sci. 2016; 17(1): 107. doi: 10.3390/ijms17010107.
- Jung M.K., Park Y., Song S.B., Cheon S.Y., Park S., Houh Y., Ha S., Kim H.J., Park J.M., Kim T.S., Lee W.J., ChoB.J., Bang S.I., ParkH., Cho D. Erythroid differentiation regulator 1, an interleukin 18-regulated gene, acts as a metastasis suppressor in melanoma. J Invest Dermatol. 2011; 131(10): 2096-104. doi: 10.1038/jid.2011.170.
- Mercogliano M.F., Bruni S., Mauro F., Elizalde P. V., Schillaci R. Harnessing Tumor Necrosis Factor Alpha to Achieve Effective Cancer Immunotherapy. Cancers (Basel). 2021; 13(3): 564. doi: 10.3390/can-cers13030564.
- 12.Marchal-Bras-GoncalvesR., Rouas-FreissN., ConnanF., Choppin J., Dausset J., Carosella E.D., Kirszenbaum M., Guillet J. A soluble HLA-G protein that inhibits natural killer cell-mediated cytotoxicity. Transplant Proc. 2001; 33(3): 2355-9. doi: 10.1016/s0041-1345(01)02020-6.
- Riteau B., Rouas-Freiss N., Menier C., Paul P., Dausset J., Carosella E.D. HLA-G2, -G3, and -G4 isoforms expressed as nonmature cell surface glycoproteins inhibit NK and antigen-specific CTL cytolysis. J Immunol. 2001; 166(8): 5018-26. doi: 10.4049/jimmunol.166.8.5018.
- Lila N., Rouas-Freiss N., Dausset J., Carpentier A., Carosella E.D. Soluble HLA-G protein secreted by allo-specific CD4+ T cells suppresses the allo-proliferative response: a CD4+ T cell regulatory mechanism. Proc Natl Acad Sci U S A. 2001; 98(21): 12150-5. doi: 10.1073/ pnas.201407398.
- Grzywa T.M., SosnowskaA., Rydzynska Z., LazniewskiM., Plew-czynskiD., KlickaK., Malecka-GieldowskaM., Rodziewicz-Lurzynska A., Ciepiela O., JustyniarskaM., Pomper P., GrzybowskiM.M., BlaszczykR., WegrzynowiczM., Tomaszewska A., Basak G., Golab J., Nowis D. Potent but transient immunosuppression of T-cells is a general feature of CD71+ erythroid cells. Commun Biol. 2021; 4(1): 1384. doi: 10.1038/s42003-021-02914-4.
- Elahi S., Vega-López M.A., Herman-Miguel V., Ramírez-Estudillo C., Mancilla-Ramírez J., Motyka B., West L., Oyegbami O. CD71+ Erythroid Cells in Human Neonates Exhibit Immunosuppressive Properties and Compromise Immune Response Against Systemic Infection in Neonatal Mice. Front Immunol. 2020; 11: 597433. doi: 10.3389/ fimmu.2020.597433.
- Fultang L., Vardon A., De Santo C., Mussai F. Molecular basis and current strategies of therapeutic arginine depletion for cancer. Int J Cancer. 2016; 139(3): 501-9. doi: 10.1002/ijc.30051.
- Zou S., WangX., Liu P., Ke C., Xu S. Arginine metabolism and deprivation in cancer therapy. Biomed Pharmacother. 2019 0ct;118:109210. doi: 10.1016/j.biopha.2019.109210.
- Chernukhin I.V., Khaldoyanidi S.K., Gaidul K.V. Endogenous retroviral envelope peptide expression in involved in a regulation of lymphocyte and hematopoietic precursor activity. Biomed Pharmacother, 1995; 49(2): 145-51. doi: 10.1016/0753-3322(96)82608-4.
- Elahi S. New insight into an old concept: role of immature eryth-roid cells in immune pathogenesis of neonatal infection. Front Immunol. 2014; 5: 376. doi: 10.3389/fimmu.2014.00376.
- Michaelsson J., Mold J.E., McCune J.M., NixonD.F. Regulation of T cell responses in the developing human fetus. J Immunol. 2006; 176(10): 5741-8. doi: 10.4049/jimmunol.176.10.5741.


