Противотуберкулезная активность на фоне лекарственной устойчивости возбудителя в эксперименте как основа перспективы использования препарата тиозонид
Автор: Савченко А. Ю., Буренков М. С., Байдин П. С., Раменская Г. В., Перова Н. В., Кукес В. Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.35, 2020 года.
Бесплатный доступ
Цель исследования: экспериментальная оценка эффективности и переносимости терапии множественного лекарственно-устойчивого туберкулеза (МЛУ ТБ) инновационным препаратом тиозонид in vitro и in vivo.Материал и методы. Проведены исследования на культурах М. tuberculosis, чувствительных к терапии и устойчивых к изониазиду и рифампицину. Поставлены серии экспериментов на мышах линии С57Bl/6, зараженных М. tuberculosis, устойчивой к полихимиотерапии (ПХТ). Проведена оценка эффективности лечения экспериментального полирезистентного ТБ с применением стандартных схем ПХТ и с включением в них препарата тиозонид.Результаты. Показана противотуберкулезная активность тиозонида in vitro, в том числе в отношении штаммов М. tuberculosis, устойчивых к изониазиду и рифампицину. Показана способность тиозонида повышать выживаемость мышей, зараженных МЛУ ТБ, по сравнению с выживаемостью на фоне традиционной ПХТ. По рассчитанному индексу эффективности (ИЭ) химиотерапии, в том числе с применением противотуберкулезного препарата (ПТП) тиозонид, выявлена способность последнего увеличивать эффективность лечения экспериментального МЛУ ТБ. Отмечен рост массы подопытных животных на фоне терапии тиозонидом, что может говорить о хорошей переносимости препарата.Выводы. Тиозонид при включении в схему ПХТ экспериментального МЛУ ТБ увеличивает эффективность традиционного лечения и хорошо переносится подопытными животными, что позволяет рассматривать его в качестве перспективного лекарственного агента для лечения ТБ с множественной устойчивостью возбудителя к ПТП.
Противотуберкулезная активность, м. tuberculosis с множественной устойчивостью к препаратам, полихимиотерапия в эксперименте
Короткий адрес: https://sciup.org/149126159
IDR: 149126159 | УДК: 616.24-002.5:615.281.015.8] | DOI: 10.29001/2073-8552-2020-35-1-125-132
Текст научной статьи Противотуберкулезная активность на фоне лекарственной устойчивости возбудителя в эксперименте как основа перспективы использования препарата тиозонид
–132
Каждый год около 10 млн человек во всем мире заболевают туберкулезом (ТБ). По данным Всемирной организации здравоохранения (ВОЗ), примерно четверть населения мира являются носителями M. tuberculosis. Даже в сравнительно благополучной Германии, где заболеваемость ТБ снижалась в течение нескольких десятилетий, в 2015 г. она выросла до 7,3 новых случаев на 100 тыс. человек [1]. По данным ВОЗ, в 2018 г. было отмечено около полумиллиона новых случаев рифампицин-устойчивого ТБ, из которых 78% с множественной лекарственной устойчивостью (МЛУ ТБ) [2]. В России удалось стабилизировать ситуацию с ТБ: в целом за последние 10 лет заболеваемость в стране снизилась на 43,2%; заболеваемость ТБ детей от 0 до 14 лет – на 36,6%; смертность – на 63,7%. При этом, к сожалению, в период с 2014 по 2016 г. на 52,3% возросло число пациентов с ТБ с широкой лекарственной устойчивостью возбудителя (ШЛУ ТБ). ШЛУ ТБ характеризуется высокой летальностью (от 28 до 43%), более высокой стоимостью и длительностью лечения не только по сравнению с терапией лекарственно-чувствительного ТБ, но и МЛУ ТБ, а также дополнительной устойчивостью к препаратам второго ряда – некоторым фторхинолонам [3, 4]. Среди причин возникновения устойчивости возбудителя называют длительные курсы терапии, развитие нежелательных побочных реакций на фоне лечения [5]. Но, вероятно, одной из причин роста МЛУ ТБ является замедленное внедрение в практику новых противотуберкулезных препаратов (ПТП), эффективных в отношении МЛУ микобактерий ТБ (МБТ). Среди новых ПТП превалируют зарубежные: бедаквилин (Janssen), деламанид (Otsuka), претоманид (Mylan) [6, 7]. Из отечественных оригинальных препаратов, разрешенных к применению, можно назвать только перхлозон (производитель АО «Фармасинтез») [8]. В этой связи оправдан активный поиск новых противотуберкулезных средств, одним из которых является препарат из группы диарилхинолинов с рабочим названием тиозо-нид (производитель АО «Фарм-Синтез»), инновационное лекарственное средство, показавшее специфическую противотуберкулезную активность в доклиническом исследовании [9], что обусловило изучение противотуберкулезных свойств препарата тиозонид в эксперименте с использованием модели лекарственно-устойчивой формы возбудителя заболевания.
Материал и методы
Изучаемый препарат тиозонид по химической структуре представляет собой -{1R,2S+1S,2R}-1-(6-Бром-2-хлорхинолил-3-ил)-4-(диметиламино)-2-(нафталин-1-ил)-1-фенилбутан-2-ол (порошок белого или белого с желтоватым оттенком цвета, нерастворим в воде, не растворим в изотоническом растворе, 1 г/л растворим в метаноле, 10 г/л – в хлороформе (раствор облучают на ультразвуковой бане в течение 10 мин [10].
Согласно поставленным задачам, были проведены следующие экспериментальные исследования. Изучалась противотуберкулезная активность тиозонида с использованием лабораторного штамма М. tuberculosis H37Rv, чувствительного ко всем ПТП, штамма М. tuberculosis MS-115 с множественной лекарственной устойчивостью (устойчив к рифампицину, изониазиду, стрептомицину, этамбутолу и пиразинамиду), штамма М. tuberculosis CN-40 с устойчивостью к изониазиду. Была определена бактериостатическая активность (концентрации, ингибирующие рост субстанции) препарата тиозонид по росту МБТ на агаризированной среде Дюбо ускоренным методом по цветной реакции Грисса на 10-й день после посева. Кроме того, исследовано воздействие тиозонида на рост культуры МБТ в динамике на жидкой питательной среде Дюбо по изменению оптической плотности среды при 600 нм. Противотуберкулезную активность исследуемого препарата тиозонид исследовали в сравнении с аналогичными показателями роста МБТ на фоне изолированно применяемых препаратов изониазид или рифампицин.
Была оценена эффективность экспериментальной терапии тиозинидом и ее переносимость у нелинейных мышей-самцов, зараженных МЛУ ТБ. Для заражения использовали клинический изолят МБТ № 5419 СПБНИИФ, устойчивый к изониазиду (10 мкг/мл), рифампицину (40 мкг/мл), стрептомицину (10 мкг/мл), этионамиду (30 мкг/мл), выделенный от больного со впервые выявленным ТБ легких. Микобактериальную суспензию для заражения мышей готовили ех tempore из трехнедельного штамма второй генерации, культивируемого на карто-фельно-глицериновой среде Павловского. Заражающая доза составляла 1 × 107 колониеобразующих единиц (КОЕ) в 0,2 мл физиологического раствора. Суспензию МБТ вводили мышам в латеральную хвостовую вену (0,2 мл). Распределение лабораторных животных в эксперименте представлено в таблице 1. Содержание животных осуществлялось в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986) [11].
Мониторинг развития туберкулезного процесса осуществляли, начиная с 8-го дня после заражения, путем визуального осмотра легких при ежедневном вскрытии 23 мышей. На 17-й день после инфицирования, когда в легких были макроскопически подтверждены (по результатам контрольных вскрытий) множественные субмилиарные (менее l мм) и единичные милиарные (более l мм) очаги специфического воспаления, зараженные мыши были распределены на группы в зависимости от терапии (см. табл. 1).
Таблица 1. Распределение мышей в эксперименте по определению эффективности терапии тиозонидом туберкулеза с МЛУ МБТ
Table 1. The distribution of mice in the experiment to determine the effectiveness of treatment of multidrug-resistant tuberculosis with thiosonide
|
№ группы N of group |
Наименование группы Group name |
Получаемая терапия (противотуберкулезные препараты, дозы, способ введения) Therapy received (anti-TB drugs, doses, route of administration) |
Количество животных Number of animals |
|
1 |
Контроль заражения МЛУ ТБ MDR TB infection control |
Мыши без лечения Mice without treatment |
8 |
|
2 |
Контроль полихимиотерапии без включения тиозонида (ПХТ) Control of polychemotherapy without thio-sonide (PCT) |
Изониазид 2 (25 мг/кг) + амикацин 2 (30 мг/кг) + этамбутол 1 (50 мг/кг) + левофлоксацин 1 (20 мг/кг) -Isoniazid2 (25 mg/kg) + amikacin2 (30 mg/kg) + etham-butol1 (50 mg/kg) + levofloxacin1 (20 mg/kg) - control of polychemotherapy |
14 |
|
3 |
Полихимиотерапия с включением тиозонида 25 мг/кг (ПХ + Т25) Polychemotherapy with thiosonide 25 mg/kg |
Тиозонид 1 (25 мг/кг) + изониазид 2 (25 мг/кг) + амикацин 2 (30 мг/кг) + этамбутол 1 (50 мг/кг) + левофлоксацин 1 (20 мг/кг) Thiosonide1 (25 mg/kg) + isoniazid2 (25 mg/kg) + amikacin2 (30 mg/kg) + ethambutol1 (50 mg/kg) + levofloxacin1 (20 mg/kg) |
14 |
|
4 |
Полихимиотерапия с включением тиозонида 100 мг/кг (ПХТ + Т100) Polychemotherapy with thiosonide 100 mg/kg |
Тиозонид 1 (100 мг/кг) + изониазид 2 (25 мг/кг) + амикацин 2 (30 мг/кг) + этамбутол 1 (50 мг/кг) + левофлоксацин 1 (20 мг/кг) Thiosonide1 (100 mg/kg) + isoniazid2 (25 mg/kg) + amikacin2 (30 mg/kg) + ethambutol1 (50 mg/kg) + levofloxacin1 (20 mg/kg) |
14 |
Примечание: способ введения препарата:1 - внутрижелудочно;2 - подкожно.
Note: routes of drug administration: 1 – intragastric; 2 – subcutaneous.
Лечение во всех подопытных группах наблюдения начинали с 17-го дня после заражения, курс лечения – 8 нед. Базовая полихимиотерапия (ПХТ) составлена из четырех ПТП в высших терапевтических дозах согласно массе тела – изониазид, амикацин, этамбутол и левофлоксацин.
Оценивали переносимость терапии подопытными животными. В течение исследования регистрировали общие поведенческие реакции мышей, потребление ими кормов и воды в баллах. Еженедельно осуществляли мониторинг динамики массы тела животных, для взвешивания использовали электронные весы с точностью взвешивания ± 0,1 г.
Индекс поражения легких устанавливали по совокупности экссудативных и продуктивных изменений в условных единицах – баллах. Биометрические показатели – коэффициенты массы (КМ) легких и селезенки - определяли по формуле: КМ = масса органа (г)/масса тела животного (г) × 100%.
Бактериологический показатель (число колоний МБТ в посевах дозированного гомогената легких на среду Ле-венштейна – Йенсена) подсчитывали через три недели инкубации в термостате при температуре +37 °C.
Также была проведена оценка терапевтического эффекта исследуемого препарата. Для этого вычисляли средний суммарный показатель (ССП), составленный из суммы частных величин: КМ легких и селезенки, индекса поражения легких и бактериологического показателя. Дополнительно был рассчитан индекс эффективности (ИЭ) лечения - долевая разница показателей тяжести течения туберкулезной инфекции в контрольных группах и в группах животных, получавших исследуемую субстанцию, по формуле: ИЭ = ( nk - no )/ nk ) х 100%, где nk и no -средние значения показателей в контрольной и опытной группах соответственно.
Полученные данные подвергались статистической обработке при помощи программы STATISTICA 6.0 for Windows [12]. Количественные показатели представлены в виде М ± SE, где М - среднее значение, а SE- стандартная ошибка среднего. Для показателей, характеризующих качественные признаки, указывалась частота в процентах. Для проверки значимости различий качественных переменных применяли критерий хи-квадрат. Использовали непараметрический критерий Краскела– Уоллиса (сравнение данных в экспериментах in vitro и in vivo), метод Каплана – Мейера и критерий Манте-ля - Кокса для презентации и сравнительной оценки выживаемости животных. Если достигнутый уровень значимости различий не превышал 0,05, их считали статистически значимыми [13, 14].
Результаты
В таблице 2 представлены данные изучения противотуберкулезной активности препарата тиозонид in vitro . Они свидетельствуют о высокой бактериостатической активности препарата как в отношении лекарственно-чувствительного штамма М. tuberculosis H37Rv, так и штаммов с лекарственной устойчивостью к изониазиду CN-40 и множественной лекарственной устойчивостью МЛУ к препаратам первого ряда MS-115.
Анализ показателей минимальных ингибирующих концентраций (МИК) с использованием критерия Кра- скела - Уоллиса показал, что они эквивалентны в отношении лекарственно-чувствительной культуры H37Rv в эксперименте на агаризованной среде Дюбо. В случае культур МБТ с различными типами лекарственной устойчивости значения МИК были неоднородны за счет значимо более низких МИК препарата тиозонид. В жидкой среде Дюбо спектр значений МИК показал неоднородность за счет более высокого значения МИК препарата тиозонид по сравнению с таковым для препаратов изониазид или рифампицин. Рост возбудителя MS-115 на агаризованной среде тиозонид ингибировал более эффективно, нежели изолированно применяемые препараты изониазид или рифампицин.
Гибель мышей в результате прогрессирования экспериментального МЛУ ТБ в группе контроля заражения началась на 26-й день от момента инокуляции инфекта, и к 68-му дню летальность составила 100% (рис. 1).
Таблица 2. Сравнительная характеристика минимальных ингибирующих концентраций противотуберкулезных препаратов (мкг/мл) для различных штаммов M. tuberculosis
Table 2. Comparative characteristics of the minimum inhibitory concentrations of anti-TB drugs (μg/mL) for different strains of M. tuberculosis
|
Препараты Drug |
Значения МИК на агаризованной среде Дюбо MIC values on the Dubos agar medium |
Значения МИК на жидкой среде Дюбо MIC values on the Dubos liquid medium |
||||
|
H37Rv |
CN-40 |
MS-115 |
H37Rv |
CN-40 |
MS-115 |
|
|
Изониазид Isoniazid |
0,190 |
50,000 |
200,000 |
0,050 |
12,50 |
> 50,000 |
|
Рифампицин Rifampicin |
0,190 |
0,190 |
> 200,000 |
0,050 |
0,050 |
> 50,000 |
|
Тиозонид Thiosonide |
0,190 |
0,190 |
0,190 |
3,125 |
3,125 |
3,125 |
|
Уровень значимости различий, критерий Краскела – Уоллиса Significance of differences level, Kruskall-Wallis test |
Н = 2,0; р = 0,37 |
Н = 14,0; p = 0,0009 |
Н = 14,0; p = 0,0009 |
Н = 14,0; p = 0,0009 |
Н = 14,0; p = 0,0009 |
Н = 11,0; p = 0,0041 |
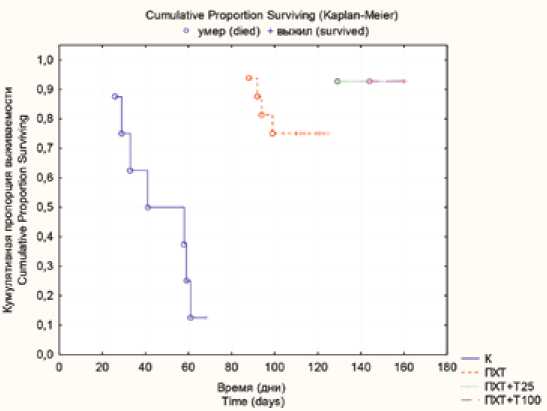
Рис. 1. Сравнительная характеристика выживаемости подопытных животных в группах изучения экспериментальной терапии множественного лекарственноустойчивого туберкулеза
Примечание: К - контроль заражения, ПХТ – полихимиотерапия, ПХТ + Т25 – полихимиотерапия + тиозонид
25 мг/кг, ПХТ + Т100 – полихимиотерапия + тиозонид 100 мг/кг.
Fig. 1. Comparative characteristics of the experimental animal survival in the study groups of experimental treatment for multidrug-resistant tuberculosis
Note: K - infection control, ПХТ - polychemotherapy, ПХТ + T25 – polychemotherapy + thiosonide 25 mg/kg, ПХТ + T100 - polychemotherapy + thiosonide 100 mg/kg.
Сравнительный анализ выживаемости подопытных животных с использованием теста Мантеля - Кокса показал значимые различия этого показателя в группах животных, получавших тиозонид в дозе 25 мг/кг или
100 мг/кг по сравнению с таковым в группе мышей, получавших ПХТ без включения тиозонида. В группах животных, леченных ПХТ в комбинации с тиозонидом в дозе 25 мг/кг или 100 мг/кг, погибли двое мышей из 28 (по одному животному в группе) после 125-го дня наблюдения (7,1%).
Наблюдалось протективное действие изучаемого препарата: оно проявлялось в виде положительной динамики массы тела больных животных. До заражения масса тела мышей в среднем составляла 22,4 ± 0,2 г, в процессе экспериментального ТБ после заражения МЛУ МБТ она снизилась в среднем до 17,6 ± 0,1 г. Затем после 125-дневной ПХТ с применением тиозонида в дозе 25 мг/кг или 100 мг/кг масса тела увеличилась почти до начальных значений (до 21,6 ± 0,1 и 21,3 ± 0,2 соответственно; Н = 20,3; р < 0,001 в случае дозировки тиозо-нида 25 мг/кг и Н = 19,6; р < 0,001 – в случае дозировки тиозонида 100 мг/кг).
Тиозонид в дозе 25 мг/кг и 100 мг/кг на фоне базовой ПХТ, включавшей изониазид (25 мг/кг), амикацин (30 мг/кг), этамбутол (50 мг/кг), левофлоксацин (20 мг/кг), приводил к росту ИЭ лечения: +7,6% ( р < 0,05) и 12,2% ( р < 0,01) соответственно (табл. 3).
Таблица 3. Оценка терапевтического эффекта у мышей, зараженных МЛУ МБТ, с применением тиозонида в различных дозах через 8 недель полихимиотерапии
Table 3. Evaluation of the therapeutic effect of thiosonide in various doses after 8 weeks of chemotherapy in mice infected with multidrugresistant Mycobacterium tuberculosis
|
Контроль, ПХТ без |
ПХТ + |
ПХТ + |
|
включения |
тиозонид 100 |
тиозонид 25 |
|
Показатели тиозонида, |
мг/кг, n = 14 |
мг/кг, n = 14 |
|
Indicators n = 14 |
PCT + Thio- |
PCT + Thio- |
|
PCT control |
sonide 100 |
sonide 25 |
|
without thio- |
mg/kg |
mg/kg |
|
sonide |
|
Коэффициент массы легких, усл. ед. Lung mass coeffi cient (conv. un.) |
1,31 ± 0,1 |
1,15 ± 0,08 р 1-2< 0,01 ИЭ + 12,2% IE + 12,2% |
1,21 ± 0,09 ИЭ + 7,6% IE + 7,6% |
|
Коэффициент массы |
0,75 ± 0,07 |
1,27 ± 0,28 |
|
|
селезенки, усл. ед. |
0,86 ± 0,07 |
р 1-2< 0,01 |
ИЭ 47,67 IE 47,67% |
|
Spleen mass coeffi- |
ИЭ + 12,8% |
||
|
cient (conv. un.) |
IE + 12,8% |
||
|
Индекс поражения |
2,55 ± 0,13 |
2,52 ± 0,13 |
|
|
легких, усл. ед. |
2,75 ± 0,09 |
р 1-2< 0,05 |
р 1-3< 0,05 |
|
Index of lung lesions |
ИЭ + 7,27 |
ИЭ + 8,36 |
|
|
(conv. un.) |
IE + 7,27% |
IE + 8,36% |
|
|
Высев МБТ из селезенки, КОЕ |
150,0 ± 17,7 |
150,0 ± 17,7 ИЭ = 0 IE = 0% |
95,8 ± 4,43 р1-3< 0,01 |
|
Seeding MBT from |
ИЭ + 36,13 |
||
|
the spleen (CFU) |
IE + 36,13% |
||
|
ССП |
38,73 |
38,61 |
25,2 |
|
AT |
Примечание: ПХТ - полихимиотерапия; ИЭ - индекс эффективности; ССП – средний суммарный показатель; оценка значимости различий при помощи критерия Краскела – Уоллиса.
Note: PCT – polychemotherapy; IE – efficiency index; AT – average total. Evaluation of the significance of differences was done using the Kruskall – Wallis test.
Тиозонид в дозе 100 мг/кг значимо снижал индекс поражения легких и селезенки, не изменял число КОЕ МБТ при высеве из селезенки. Тиозонид в дозе 25 мг/ кг способствовал уменьшению высева МБТ из селезенки на фоне ПХТ, снижал индекс поражения легких.
Обсуждение
Необходимость разработки новых активных препаратов для борьбы с МЛУ ТБ усугубляется появлением ТБ с широкой лекарственной устойчивостью (ШЛУ ТБ) [15], определяемого как МЛУ ТБ с дополнительной устойчивостью к фторхинолонам и хотя бы одному из препаратов второго ряда. Кроме того, описаны случаи тотального лекарственно-устойчивого ТБ были отмечены в Китае, Индии, Африке и Восточной Европе, при котором МБТ устойчивы ко всем доступным терапевтическим средствам [16].
Анализируя полученные результаты, можно заключить, что тиозонид обладает антимикобактериальной активностью. Особую важность имеют результаты, демонстрирующие высокую активность в отношении лекарственно-устойчивых штаммов МБТ, что еще раз подчеркивает перспективность изученного соединения в свете роста лекарственной устойчивости патогена с МЛУ и ШЛУ Подобные эффекты отмечены у сравнительно недавно зарегистрированных лекарственных средств для терапии МЛУ ТБ бедаквилина и деламанида [17, 18].
Препарат тиозонид при исследовании in vitro показал выраженную антимикобактериальную активность: он ингибировал рост культуры лекарственно-чувствительного лабораторного штамма M. tuberculosis H37Rv, культуры штамма M. tuberculosis CN-40 с моноустойчивостью к изониазиду и культуры штамма M. tuberculosis MS-115 с МЛУ в жидкой и агаризованной среде Дюбо. Учитывая, что эффект наблюдался при относительно низких концентрациях, тиозонид может рассматриваться как перспективный препарат для терапии устойчивых форм ТБ, включая МЛУ возбудителя.
На основании данных, полученных в эксперименте по изучению противотуберкулезной активности препарата тиозонид in vivo на модели экспериментального генерализованного МЛУ ТБ, можно сделать заключение, что изучаемый препарат является перспективным для дальнейших клинических исследований. Он значимо увеличивает выживаемость мышей, зараженных МЛУ ТБ, в условиях терапии с применением тиозонида в дозировке 25 мг/кг и 100 мг/кг. Помимо увеличения выживаемости на фоне приема тиозонида отмечен прирост массы подопытных животных, что, вероятно, может свидетельствовать в пользу хорошей переносимости тиозонида.
Таким образом, проведенные исследования показали хорошую переносимость тиозонида животными, а также его способность повышать эффективность терапии экспериментального ТБ, устойчивого к изониазиду, рифампицину, стрептомицину и этионамиду. Эти результаты позволяют сделать заключение о безусловной перспективности дальнейшего изучения тиозонида в качестве ПТП, учитывая высокую потребность фтизиатрии в разработке эффективных технологий лечения больных ТБ с множественной лекарственной устойчивостью возбудителя.
Список литературы Противотуберкулезная активность на фоне лекарственной устойчивости возбудителя в эксперименте как основа перспективы использования препарата тиозонид
- Suarez I., Fünger S.M., Kröger S., Rademacher J., Fätkenheuer G., Ryb-niker J. The diagnosis and treatment of tuberculosis. Dtsch. Arztebl. Int. 2019;116(43):729—735. DOI: 10.3238/arztebl.2019.0729.
- Global Tuberculosis Report. Executive summary 2019. URL: https:// www.who.int/tb/publications/global_report/GraphicExecutiveSum-mary.pdf?ua=1.
- Нечаева О.Б. Эпидемическая ситуация по туберкулезу в России. Туберкулез и болезни легких. 2018;96(8):15-24. DOI: 10.21292/ 2075-1230-2018-96-8-15-24.
- Стерликов С.А., Русакова Л.И., Сон И.М. Исходы случаев лечения туберкулеза с широкой лекарственной устойчивостью: результаты трехлетнего наблюдения. Современные проблемы здравоохранения и медицинской статистики. 2018;2:14-26. URL: https:// cyberleninka.ru/article/n/ishody-sluchaev-lecheniya-tuberkulyoza-s-shirokoy-lekarstvennoy-ustoychivostyu-rezultaty-tryohletnego-nablyudeniya (дата обращения: 05.08.2019).
- Филинюк О.В., Фелькер И.Г., Янова Г.В., Буйнова Л.Н., Колоколо-ва О.В. Факторы риска неэффективной химиотерапии больных туберкулезом с множественной лекарственной устойчивостью. Туберкулез и болезни легких. 2014;(1):20-26. DOI: 10.21292/20751230-2014-0-1-20-26.
- Li Y., Sun F., Zhang W. Bedaquiline and delamanid in the treatment of multidrug-resistant tuberculosis: Promising but challenging. Drug Dev. Res. 2019;80(1):98-105. DOI: 10.1002/ddr.21498.
- Keam S.J. Pretomanid: First Approval. Drugs. 2019;79(16):1797-1803. DOI: 10.1007/s40265-019-01207-9.
- 8 Яблонский П.К., Виноградова Т.И., Левашев Ю.Н., Павлова М.В., Зильбер Э.К., Старшинова А.А. и др. Доклинические и клинические исследования нового противотуберкулезного препарата «Перхлозон». Клиническая микробиология и антимикробная химиотерапия. 2016;18(1):42-48.
- Бочарова И.В., Буренков М.С., Лепеха Л.Н., Смирнова Т.Г., Черноусова Л.Н., Демихова О.В. Доклинические исследования специфической активности нового противотуберкулезного препарата тиозонида. Туберкулез и болезни легких. 2014;6:46-50. DOI: 10.21292/2075-1230-2014-0-6-46-50.
- Меньшикова Л.А. Фармакокинетическое исследование оригинального лекарственного средства тиозонида: дис. ... канд. фармацевт. наук. М.; 2016:117.
- Rozemond H. Laboratory animal protection: the European Convention and the Dutch Act. Vet. Q. 1986;8(4):346-349. DOI: 10.1080/01652176.1986.9694067.
- Боровиков В.П., Боровиков И.П. Статистический анализ и обработка данных в среде Windows. М.: Филинъ; 1997:608.
- Harris M., Taylor G. Medical statistics made easy. London: Taylor and Francis; 2006:114.
- Шарашова Е.Е., Холматова К.К., Горбатова М.А., Гржибовский А.М. Применение анализа выживаемости в здравоохранении с использованием пакета статистических программ SPSS. Наука и здравоохранение. 2017;5:5-28.
- Esposito S., D'Ambrosio L., Tadolini M., Schaaf H.S., Caminero Luna J., Marais B. et al. ERS/WHO Tuberculosis Consilium assistance with extensively drug-resistant tuberculosis management in a child: case study of compassionate delamanid use. European Respiratory Journal. 2014;44(3):811-815. DOI: 10.1183/09031936.00060414.
- Klopper M., Warren R.M., Hayes C., Gey van Pittius N.C., Streicher E.M., Müller B. et al. Emergence and spread of extensively and totally drug-resistant tuberculosis, South Africa. Emerg. Infect. Dis. 2013;19(3):449-455. DOI: 10.3201//EID1903.120246.
- GlerM.T.,SkripconokaV.,Sanchez-GaravitoE.,XiaoH.,Cabrera-RiveroJ.L., Vargas-Vasquez D.E. et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N. Engl. J. Med. 2012;366(23):2151-2160. DOI: 10.1056/NEJMoa1112433.
- Cohen J. Infectious disease. Approval of novel TB drug celebrated -with restraint. Science. 2013;339(6116):130. DOI: 10.1126/sci-ence.339.6116.130.


