Противовирусные агенты. II. Синтез производных 1- [5-(фенокси) пентил] урацила
Автор: Парамонова М.П., Бабков Д.А., Озеров А.А., Солодунова Г.Н., Новиков М.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 2 (30), 2011 года.
Бесплатный доступ
Конденсацией эквимолярных количеств 2,4-бис(триметилсилилокси)пиримидина и 1-бром-5-(арилокси)пента-на был осуществлен синтез 1-[5-(арилокси)пентил]-производных урацила, выход которых составил 62-83 %. Изучены физико-химические и спектральные свойства синтезированных соединений. Данные соединения представляют интерес в качестве потенциальных противовирусных агентов.
Синтез, урацил, 4-бис(триметилсилилокси)пиримидины, потенциальные противовирусные агенты
Короткий адрес: https://sciup.org/142148891
IDR: 142148891 | УДК: 615.3:547.854.4
Текст научной статьи Противовирусные агенты. II. Синтез производных 1- [5-(фенокси) пентил] урацила
Вирус иммунодефицита человека (ВИЧ) является этиологическим агентом синдрома приобретенного иммунодефицита человека (СПИД). Согласно данным
Всемирной организации здравоохранения (ВОЗ), на конец 2009 г. число ВИЧ-инфицированных превышало 33,4 млн человек. Несмотря на все усилия ВОЗ по профилактике и лечению СПИДа, в некоторых регионах, в том числе и в России, наблюдается рост заболевания [1]. В частности, в некоторых регионах России темпы распространения ВИЧ с 2006 г. выросли на 700 %. Кроме того, СПИД обостряет демографическую проблему России. Поэтому эффективная терапия ВИЧ-инфекции является одним из самых актуальных вопросов современной медицины [2].
Современный способ лечения ВИЧ-инфекции (высокоэффективная антиретровирусная терапия) способен существенно замедлить прогресс ВИЧ-инфекции и переход ее в стадию СПИД, позволяя ВИЧ-инфицированному человеку жить полноценной жизнью. Это достигается применением комбинации нескольких препаратов. В качестве мишеней высокоэффективной антиретровирусной терапии служат вирусные ферменты: обратная транскриптаза (ОТ) и вирусная протеаза [10].
Наиболее хорошо изучена как мишень ОТ ВИЧ. Этот фермент осуществляет следующие каталитические функции: (а) РНК-зависимую ДНК полимеризацию, приводящую к образованию РНК:ДНК-гибрида; (б) деградацию цепи РНК в РНК:ДНК-гибриде; (в) ДНК-зависимую ДНК полимеризацию, приводящую к образованию провирусной ДНК [6].
В настоящее время известны два класса ингибиторов ОТ: нуклеозидные ингибиторы ОТ ВИЧ-1 (НИОТ) и ненуклеозидные ингибиторы ОТ ВИЧ-1 (ННИОТ).
НИОТ по своему механизму действия являются терминаторными субстратами. Они сходны в строении с природными нуклеозидами и нуклеотидами. Однако для того чтобы НИОТ были активны против ВИЧ, необходимо, чтобы активное вещество проникло в клетку, подверглось там фосфорилированию клеточными ки- назами до 5“-трифосфатной формы, связалось с полимеразным центром и проявило себя как имитатор субстрата, который мог бы быть включен в вирусную ДНК при помощи вирусной ОТ. После включения НИОТ в 3“-конец цепи ДНК происходит блокирование дальнейшей элонгации. Данные процессы останавливают синтез ДНК, что приводит к остановке репродукции вируса. Однако НИОТ, являясь аналогами природных нуклеозидов, также подвергаются фосфорилированию до трифосфатов, конкурируя с нормальными нуклеозидами. Происходит уменьшение количества трифосфатных форм природных нуклеозидов, а количество трифосфатов НИОТ возрастает, что вызывает неблагоприятные последствия в организме. Главным побочным эффектом приема НИОТ является нарушение картины крови, выражающееся в острых лейкопении и гранулоцитопении, анемии и т. д. [4].
ННИОТ ВИЧ-1, в отличие от нуклеозидных, попадая в клетку, не участвуют в клеточных метаболических процессах, обладают заметно меньшей токсичностью, их использование сопровождается минимумом побочных эффектов. ННИОТ ВИЧ-1 являются высокоспецифичными в отношении вирусного фермента. Они связываются с гидрофобным «карманом» ОТ ВИЧ-1, расположенным в 10А от полимеразного сайта фермента, и аллостерически блокируют его активность. Закрепление ингибитора изменяет структуру активного участка ОТ и инактивирует фермент, что блокирует включение нуклеотидов в состав провирусной ДНК.
В настоящее время для лечения ВИЧ-инфекции и СПИД в клинике используются четыре препарата: невирапин, делавердин, эфавиренц и недавно введенный в практику этравирин (рис. 1).
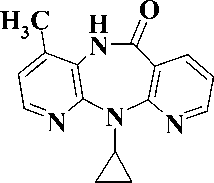
Невирапин
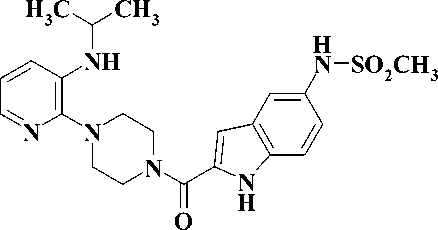
Делавердин
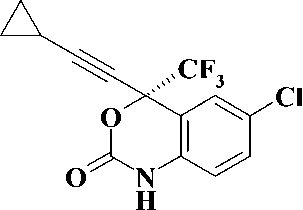
Эфавиренц
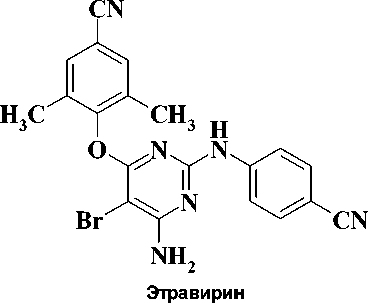
Рис. 1. Ненуклеозидные ингибиторы ОТ ВИЧ-1, применяемые в клинике
Однако главным недостатком ННИОТ ВИЧ-1 является быстрое формирование к ним резистентности вируса. Для возникновения резистентности достаточно одной мутации — замены аминокислотного остатка в гидрофобном «кармане» вирусного фермента, что способствует механизму «потери контакта» и стерическим препятствиям связывания ННИОТ с ОТ ВИЧ-1. Причем чаще всего наблюдается кросс-резистенция. Поэтому наличие в составе молекулы пространственно подвижного мостка, связывающего арильный фрагмент и остаток урацила, может благоприятно влиять на связывание ННИОТ с ОТ ВИЧ-1 и препятствовать развитию резистентности.
Соединения данного ряда до настоящего времени в литературе описаны не были. По этой причине они являются интересным и многообещающим классом соединений, способных ингибировать репродукцию ВИЧ-1 как дикого штамма, так его клинически важные мутантные изоляты.
ЦЕЛЬ РАБОТЫ
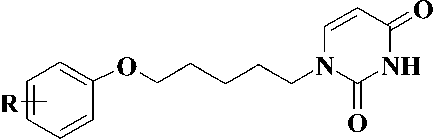
Синтез 1-[5-(фенокси)пентил]-производных урацила, являющихся потенциальными противовирусными агентами (рис. 2).
O
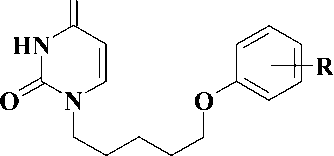
Рис. 2. R = H, CH3, t-Bu, Br, CN
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker DRX-500» (500 МГц) в ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Silufol UV-254», проявление в парах йода. В качестве элюента использовали этилацетат. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp3.0» (Laboratory Devices Inc., США).
1-Бром-5-(фенокси)пентан (1) . Кипятили 15 г фенола (0,159 моль), 33 г (0,239 моль) безводного карбоната калия и 90 мл (0,658 моль) дибром-пентана в 200 мл метилэтилкетона в течение 25 часов. Осадок отфильтровывали, промывали на фильтре небольшим количеством этилацетата, фильтрат упаривали при пониженном давлении и остаток разгоняли в вакууме. Собирали фракцию, кипящую при 149—154 оС (5 мм рт. ст.). Получили 30,7 г (выход 79%) бесцветной маслянистой жидкости. 1Н ЯМР спектр (CCl4) δ , м.д., J (Гц): 1,57 п (2Н, J = 6,3, СН2); 1,74 п (2Н, J = 6,3, СН2); 1,87 п (2Н, J = 6,8, СН2); 3,32 т (2Н, J = 6,3, СН2); 3,85 т (2Н, J = 6,6, СН2); 6,69-6,80 м (3Н, ароматические Н); 7,09-7,14 м (2Н, ароматические Н).
Соединения 2-8 получали аналогично.
1-Бром-5-(2-Метилфенокси)пентан (2) . Ткип = 137—141 оС (5 мм рт. ст.); выход 49%; 1Н ЯМР спе.ктр (CCl4) δ , м.д., J (Гц): 1,60 п (2Н, J = 6,9, СН2); 1,78 п (2Н, J = 7,5, СН2); 1,89 п (2Н, J = 7,2, СН2); 2,12 с (3Н, СН3); 3,33 т (2Н, J = 6,9, СН2); 3,87 т (2Н, J = 6,0, СН2); 6,59-6,69 м (2Н, ароматические Н); 6,936,97 м (2Н, ароматические Н).
1-Бром-5-(3-Метилфенокси)пентан (3) . Ткип = 143—148 оС (5 мм рт. ст.); выход 75%; 1Н ЯМР спе.ктр (CCl4) δ , м.д., J (Гц): 1,55 п (2Н, J = 6,3 СН2); 1,71 п (2Н, J = 6,3, СН2); 1,86 п (2Н, J = 6,8, СН2); 2,20 с (3Н, СН3); 3,31 т (2Н, J = 6,6, СН2); 3,81 т (2Н, J = 6, СН2); 6,59 д (2Н, J = 8,4, Н-3, Н-5); 6,89 д (2Н, J = 8,1, Н-2, Н-6).
1-Бром-5-(4-Метилфенокси)пентан (4) . Ткип = 145—151 оС (5 мм рт. ст.); выход 68%; 1Н ЯМР спе.ктр (CCl4) δ , м.д., J (Гц): 1,54 п (2Н, J = 6,9, СН2); 1,72 п (2Н, J = 6, СН2); 1,85 п (2Н, J = 6,8, СН2); 3,31 т (2Н, J = 6,6, СН2); 3,81 т (2Н, J = 6,3, СН2); 6,62 д (2Н, J = 9,6, Н-3, Н-5); 7,23 д (2Н, J = 8,4, Н-2, Н-6).
1-Бром-5-(3,5-Диметилфенокси)пентан (5) . Ткип = 146—151 оС (5 мм рт. ст.); выход 63%; 1Н ЯМР спе.ктр (CCl4) δ , м.д., J (Гц): 1,55 п (2Н, J = 6,3, СН2); 1,71 п (2Н, J = 6,6, СН2); 1,86 п (2Н, J = 7,2, СН2); 2,19 с (6Н, СН3); 3,31 т (2Н, J = 6,9, СН2); 3,81 т (2Н, J = 6,6, Н2); 6,31 с (2Н, Н-2, Н-6); 6,39 с (1Н, Н-4).
1-Бром-5-(4-Трет-бутилфенокси)пентан (6) . Ткип = 190—192 оС (5 мм рт. ст.); выход 75%; 1Н ЯМР спе.ктр (CCl4) δ , м.д., J (Гц): 1,17 c (9H, CH3), 1,24 к (2H, J = 7, CH2), 1,60 к (2H, J = 7, CH2), 1,66 к (2H, J = 7,2, CH2), 3,63 т (2H, J = 7, NCH2), 3,84 т (2H, J = 6,2, OCH2), 6,81 д (2H, J = 8,4, H-3’, H-5’), 7,25 д (2H, J = 8,4, H-2’, H-6’).
1-Бром-5-(4-Бромфенокси)пентан (7) . Ткип = 188—190 оС (5 мм рт. ст.); выход 76%; 1Н ЯМР спе.ктр (CCl4) δ , м.д., J (Гц): 1,54 п (2Н, J = 6,9, СН2); 1,72 п (2Н, J = 6 СН2); 1,85 п (2Н, J = 6,8, СН2); 3,31 т (2Н, J = 6,6, СН2); 3,81 т (2Н, J = 6,3, СН2); 6,62 д (2Н, J = 9,6, Н-3, Н-5); 7,23 д (2Н, J = 8,4, Н-2, Н-6).
1-Бром-5-(4-Цианофенокси)пентан (8) . Ткип.= 210—212 оС (5 мм рт. ст.); выход 68%; 1Н ЯМР спект.р (CCl4) δ , м.д., J (Гц): 1,58 п (2Н, J = 6,5 СН2); 1,71 п (2Н, J = 6,2, СН2); 1,85 п (2Н, J = 6,5, СН2); 3,33 т (2Н, J = 6,2, СН2); 3,93 т (2Н, J = 6,2, СН2); 6,83 д (2Н, J = 9, Н-3, Н-5); 7,45 д (2Н, J = 8,4, Н-2, Н-6).
1-[2-(Фенокси)пентил]урацил (9). В круглодонной колбе объемом 100 мл кипятили 1,5 г (13,38 ммоль) урацила и 0,2 (3,74 ммоль) хлорида аммония в 15 мл ГМДС без доступа влаги до образования прозрачного раствора. Избыток силилирую-щего агента удаляли при пониженном давлении. Полученное силилированное основание урацила нагревали с 3,3 (13,57 ммоль) 1-бром-5-(фенокси)пента-ном (1) при 160 оС без доступа влаги в течение 1 часа и оставляли на ночь при комнатной температуре. Затем реакционную массу обрабатывали 40 мл этилацетата и гидролизовали 10 мл изопропилового спирта. Через 30 минут полученную смесь упарили досуха при пониженном давлении. Остаток перекристаллизовывали из смеси 30 мл пропанол-2, 15 мл ДМФА и 40 мл воды. Получили 2,41 г белого мелкокристаллического продукта, выход которого составил 83 %, Тпл = 151—152,5 оС. 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 1,39 к (2H, J = 5,3, CH2); 1,63 к (2H, J = 7,2, CH2); 1,72 к (2H, J = 7,2, CH2); 3,67 т (2H, J = 7,2, NCH2); 3,93 т (2H, J = 6,5, OCH2); 5,55 дд (1H, J = 7,7, и 2,1, H-5); 6,89-6,92 м (3H, ароматический H); 7,26 т (2H, J = 8, H-3’, H-5’); 7,64 д (1H, J = 7,8, H-6); 11,25 с (1H, NH).
Соединения 10-16 были получены аналогично.
1-[5-(2-Метилфенокси)пентил]урацил (10).
1Н ЯМР спектр (ДМСО-D6 / CDCl3) δ , м.д., J (Гц): 1,41 к (2H, J = 7, CH2); 1,64 к (2H, J = 7,3, CH2); 1,74 к (2H, J = 7,3, CH2); 2,12 с (3H, CH3); 3,68 т (2H, J = 7, NCH2); 3,92 т (2H, J = 6,3, OCH2); 5,55 дд (1H, J = 7,8, и 2, H-5); 6,80 т (1H, J = 7,5, ароматический H); 6,87 д (1H, J = 8, ароматический H); 7,09-7,13 м (2H, ароматический H); 7,64 д (1H, J = 7,9, H-6); 11,25 с (1H, NH).
1-[5-(3-Метилфенокси)пентил]урацил (11).
1Н ЯМР спектр (ДМСО-D6/ CDCl3) δ , м.д., J (Гц): 1,40 к (2H, J = 7,8, CH2); 1,64 к (2H, J = 7, CH2); 1,71 к (2H, J = 7,6, CH2); 2,25 с (3H, CH3); 3,67 т (2H, J = 7,2, NCH2); 3,90 т (2H, J = 6,2 OCH2); 5,55 дд (1H, J = 7,8, и 2,1, H-5); 6,68-6,72 м (3H, ароматические Н); 7,11-7,15 м (1H, ароматические Н); 7,63 д (1H, J = 7,9, H-6); 11,23 с (1H, NH).
1-[5-(4-Метилфенокси)пентил]урацил (12).
1Н ЯМР спектр (ДМСО-D6/ CDCl3 δ , м.д., J (Гц): 1,42 к (2H, J = 8, CH2); 1,66 к (2H, J = 7,1, CH2); 1,73 к (2H, J = 7,8, CH2); 2,21 с (3H, CH3); 3,67 т (2H, J = 7,3, NCH2); 3,88 т (2H, J = 6,5, OCH2); 5,49 дд (1H, J = 7,8 и 2, H-5); 6,73 д (2H, J = 8,7, H-3’, H-5’); 7,01 д (2H, J = 8,3 H-2’, H-8’); 7,47 д (1H, J = 7,8, H-6); 11,07 с (1H, NH).
1-[5-(3,5-Диметилфенокси)пентил]урацил (13) . 1Н ЯМР спектр (ДМСО-D6) δ , м.д., J (Гц): 1,37 к (2H, J = 6,8, CH2); 1,62 к (2H, J = 7,2, CH2); 1,67 к (2H, J = 7,2, CH2); 2,21 с (6H, CH3); 3,66 т (2H, J = 7,1, NCH2); 3,88 т (2H, J = 6,4, OCH2); 5,55 дд (1H, J = 7,9, и 2,2, H-5); 6,51 с (2H, H-2’, H-6’); 6,53 с (1H, H-4’); 7,64 д (1H, J = 7,8, H-6); 11,25 с (1H, NH).
1-[5-(4-Трет-бутилфенокси)пентил]урацил (14) . 1Н ЯМР спектр (ДМСО-D6) δ , м.д., J (Гц): 1,23 с (9H, CH3); 1,38 к (2H, J = 7,2, CH2); 1,62 к (2H, J = 7,2, CH2); 1,70 к (2H, J = 7,5, CH2); 3,67 т (2H, J = 7,1, NCH2); 3,90 т (2H, J = 6,7, OCH2); 5,55 дд (1H, J = 7,8, и 2,2, H-5); 6,81 д (2H, J = 8,9, H-3’, H-5’); 7,25 д (2H, J = 8,9, H-2’, H-6’); 7,64 д (1H, J = 7,8, H-6); 11,25 с (1H, NH).
1-[5-(4-Бромфенокси)пентил]урацил (15) . 1Н ЯМР спектр (ДМСО-D6) δ , м.д., J (Гц): 1,39 к (2H, J = 8,3, CH2); 1,62 к (2H, J = 7,2, CH2); 1,71 к (2H, J = 7,2, CH2); 3,66 т (2H, J = 7,2, NCH2); 3,92 т (2H, J = 6,3, OCH2); 5,55 дд (1H, J = 7,8, и 2,2, H-5); 6,87 д (2H, J = 9, H-3’, H-5’); 7,41 д (2H, J = 8,9, H-2’, H-6’); 7,64 д (1H, J = 7,8, H-6); 11,23 с (1H, NH).
1-[5-(4-Цианофенокси)пентил]урацил (16) . 1Н ЯМР спектр (ДМСО-D6) δ , м.д., J (Гц): 1,40 к (2H, J = 7,9, CH2); 1,64 к (2H, J = 7,3, CH2); 1,75 к (2H, J = 7,2 CH2); 3,67 т (2H, J = 7,2, NCH2); 4,05 т (2H, J = 6,5, OCH2); 5,54 дд (1H, J = 7,9, и 2, H-5); 7,07 д (2H, J = 8,8, H-3’, H-5’); 7,62 д (1H, J = 7,9, H-6); 7,72 д (2H, J = 9, H-2’, H-6’); 11,14 с (1H, NH).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
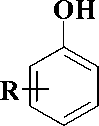
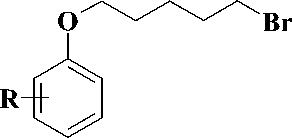
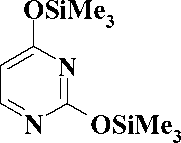
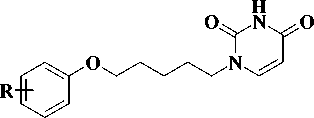
Синтез производных урацила, содержащих в положении 1 различные феноксипентильные фрагменты, был осуществлен во 2-й стадии, как это представлено на рис. 3.
Br Br
K2CO3
CH3COC2H5
1-8
1600C
9-16
Рис. 3. Схема синтеза производных 1-[5-(фенокси)пентил]урацила
Первая стадия заключалась в обработке соответствующего фенола четырехкратным мольным избытком 1,5-дибромпентана в присутствии 1,5-кратного мольного избытка безводного карбоната калия в бутаноне в соответствии с методиками [5—9]. При этом образовывались соответствующие 1-бром-5-(арилокси)пента-ны 1-8 , выход которых составил 49—79 %.
Вторая стадия заключалась в конденсации эквимолярных количеств бромида 1-8 и 2,4-бис (триметилсилилокси)пиримидина. Реакцию проводили в соответствии с известным методом [3] при нагревании 160 оС в течение 1 ч. При этом образовывались целевые 1-[2-(арилокси)пентил]урацилы 9-16 , выход которых был 62—83 %. Образования побочных продуктов N1,N3-дизамещения не обнаружено, что подтверждается данными тонкослойной хроматографии. (табл.)
Свойства синтезированных соединений
|
Comp |
R |
Выход, % |
Т. пл., °С |
R f * |
|
9 |
H |
83 |
151,0—152,5 |
0,53 |
|
10 |
2-CH 3 |
64 |
147,5—149,0 |
0,51 |
|
11 |
3-CH 3 |
72 |
100,7—102,4 |
0,49 |
|
12 |
4-CH 3 |
82 |
146—147 |
0,56 |
|
13 |
3,5-(CH 3 ) 2 |
80 |
96—98 |
0,58 |
|
14 |
t -Bu |
71 |
125—127 |
0,50 |
|
15 |
4-Br |
62 |
174,5—176,0 |
0,43 |
|
16 |
4-CN |
79 |
184,5—185,6 |
0,14 |
* Элюент этилацетат.
Объемные триметилсилильные группы экранируют положение 3-пиримидинового цикла и препят- ствуют взаимодействию неподеленной пары электронов атома азота N3 и алкилирующего агента.
Чистоту полученных соединений ( 9-16 ) определяли методом тонкослойной хроматографии, строение – ПМР-спектроскопией.
ЗАКЛЮЧЕНИЕ
Таким образом, нами синтезированы 8 новых, ранее не описанных в литературе производных урацила, содержащих в положении 1 различные феноксипентильные фрагменты, изучены их спектральные и физико-химические свойства. Соединения этого ряда представляют интерес в плане поиска новых высокоэффективных противовирусных агентов.

![Противовирусные агенты. II. Синтез производных 1- [5-(фенокси) пентил] урацила Противовирусные агенты. II. Синтез производных 1- [5-(фенокси) пентил] урацила](/file/cover/142148891/protivovirusnye-agenty-ii-sintez-proizvodnyh-15fenoksi-pentil-uracila.png)
