Противовирусные агенты. III. Синтез новых 1-бензил-3-ацетанилид-производных урацила
Автор: Парамонова М.П., Бабков Д.А., Озеров А.А., Новиков М.С., Солодунова Г.Н.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 3 (31), 2011 года.
Бесплатный доступ
Обработкой производных 1-бензил урацила хлорацетанилидами, содержащими различные заместители в ароматическом кольце, осуществлен синтез новых 2-[3-бензил-2,6-диоксо-3,6-дигидропиримидин-1(2Н)-ил]-N-фенилацетамидов, выход которых составил 73-96 %. Изучены физико-химические и спектральные свойства синтезированных соединений. Данные соединения представляют интерес в качестве потенциальных агентов антивируса иммунодефицита человека 1 и антицитомегаловируса.
Синтез, бензил урацил, n-алкилирование, потенциальные противовирусные агенты
Короткий адрес: https://sciup.org/142148906
IDR: 142148906 | УДК: 615.3:547.854.4
Текст научной статьи Противовирусные агенты. III. Синтез новых 1-бензил-3-ацетанилид-производных урацила
В настоящее время высокоэффективная антиретровирусная терапия инфекции вируса иммунодефицита человека (ВИЧ) и синдрома приобретенного иммунодефицита (СПИД) заключается в применении комбинации нескольких классов антиретровирусных препаратов: ингибиторов слияния, ингибиторов вирусной протеазы и ингибиторов обратной транскриптазы (ОТ) нуклеозидной (НИОТ) и ненуклеозидной (ННИОТ) природы. Наиболее безопасным из ингибиторов ОТ является применение ННИОТ, однако к препаратам данной группы быстро развивается резистентность [9]. По этой причине поиск высокоэффективных ННИОТ является перспективным и актуальным.
В результате анализа литературных данных было обнаружено, что соединения производные триазола 1 и тетразола 2 (рис. 1) проявляют высокую активность как в отношении ОТ ВИЧ-1 дикого типа, так и в отношении K103N-мутантного штамма ВИЧ-1
в клеточной культуре. Однако эти классы соединений имеет низкую биодоступность и невысокую устойчивость в плазме крови [1—4]. В то же время известно, что производные 3-бензилурацила 3 (рис. 2) проявляют выраженную активность в отношении ВИЧ-1 и цитомегаловируса человека [5, 6].
Мы предположили, что замена тиотриазольного или тетразольного циклов на пиримидиновый фрагмент приведет к созданию химерных аналогов, содержащих бензильный и амидный фрагменты у 1 и 3 атомов азота пиримидинового цикла соответственно, как это показано на рис. 3. Соединения данного ряда до настоящего времени в литературе описаны не были. По этой причине они являются интересным и многообещающим классом соединений, способных ингибировать репродукцию ВИЧ-1 как дикого штамма, так его клинически важные мутантные изоляты, а также репродукцию цитомегаловируса человека.
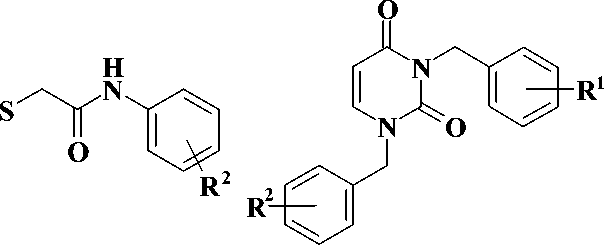
Рис. 2. Производные 3-бензилурацила 3
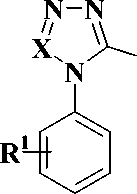
1 (X = R3C)
2 (X = N)
Рис. 1. Производные триазола 1 и тетразола 2
ЦЕЛЬ РАБОТЫ
Синтез 1-бензил-3-ацетанилид-производных урацила, являющихся потенциальными противовирусными агентами (рис. 3)
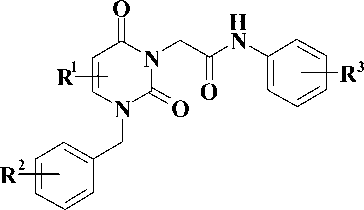
Рис. 3. Синтез 1-бензил-3-ацетанилид-производных урацила
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker Avance 400» (400 МГц) в ДМСО-D6, внутренний стандарт — тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Sorbfil Plates» (Россия), проявление — в парах йода. В качестве элюента использовали 1,2-дихлорэтан-этила-цетат 1:1. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp3.0» (Laboratory Devices Inc., США).
2-(3-Бензил-2,6-диоксо-3,6-дигидропирими-дин-1(2H)-ил)-N-фенилацетамид (6). Суспензию 1,5 г (7,42 ммоль) бензилурацила (4) (R1 = Н) и 1,6 г (11,58 ммоль) прокаленного измельченного карбоната калия в 15 мл диметилформамида (ДМФА) перемешивали при 90 оС в течение 1 часа, реакционную массу охладили, при перемешивании небольшими порциями добавили 1,3 г (7,66 ммоль) хлорацетанилида (5) (R3 = H) и перемешивали еще 2 часа при той же температуре. Затем реакционную массу профильтровали, осадок на фильтре промыли ДМФА, фильтрат упарили при пониженном давлении досуха и обработали 50 мл воды. Осадок отфильтровали и перекристаллизовали из смеси ацетон-изопропанол-ДМФА. Получили 2,39 г продукта, белого цвета, в виде мелких игольчатых кристаллов. Выход 96 %,
Т. пл. 212—213 оC. 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 4,56 с (2H, CH2CO), 4,98 с (2H, PhCH2), 5,82 д (1H, J = 7,9, H-5), 7,06 т (1H, J = 7,3, ароматический H), 7,29-7,40 м (9H, NH, ароматический H).
Соединения 7-20 получали аналогично.
2-(3-бензил-5-метил-2,6-диоксо-3,6-дигидро-пиримидин-1(2H)-ил)-N-фенилацетамид (7). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 1,85 с (3Н, СН3); 4,68 с (2Н, СН2); 4,94 с (2Н, СН2); 7,04-7,08 м (2Н, ароматические Н); 7,30-7,39 м (7Н, ароматические Н); 7,57-7,59 м (1Н, ароматический Н); 7,76 с (1Н, Н-6); 10,29 с (1Н, NH).
2-[3-бензил-5-(фениламино)-2,6-диоксо-3,6-ди-гидропиримидин-1(2H)-ил]-N-фенилацетамид (8). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 4,76 с (2Н, СН2); 5,04 с (2Н, СН2); 6,75 т (1Н, J = 7.3, Н-4’’); 6,85 д (2Н, J = 8.4, H-2’, H-6’); 7,07 т (1Н, J = 7.5, H-4”); 7,15 т (2Н, J = 7,5, H-3’, H-5’); 7,30-7,42 м (8Н, ароматические Н, PhNH); 7,57 д (2Н, J = 8.2, H-2”, H-6”); 7,65 c (1Н, Н-6); 9,92 с (1Н, NH).
2-[3-бензил-5-(N-молфолино)-2,6-диоксо-3,6-дигидропиримидин-1(2H)-ил]-N-фенилацетамид (9). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2.90 т (4Н, J = 4.4, СН2); 3,68 т (4Н, J = 4.7, СН2); 4,68 с (2Н, СН2); 4,98 с (2Н, СН2); 7,06 т (1Н, J = 7.5, Н-4’’); 7,277,39 м (8Н, ароматические Н); 7,55–7,57 м (2Н, Н-6, ароматический Н); 10,09 с (1Н, NH).
2-[3-(2,5-диметилбензил)-2,6-диоксо-3,6-ди-гидропиримидин-1(2H)-ил]-N-фенилацетамид (10). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2,24 с (3Н, СН3); 2,25 с (3Н, СН3); 4,67 с (2Н, СН2); 4,93 с (2Н, СН2); 5,83 д (1Н, J = 7.83, H-5); 6,90 с (1Н, Н-6’); 7,01–7,10 м (3Н, Н-4”, H-3’, H-4’); 7.31 т (2Н J = 7.89, H-3”, H-5”) 7.58 д (2Н, J = 7.95, H-2”, H-6”) 7.69 д (1Н, J = 7.95, H-6); 10,29 с (1Н, NH).
2-[3-(3,5-диметилбензил)-2,6-диоксо-3,6-ди-гидропиримидин-1(2H)-ил]-N-фенилацетамид (11). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2,26 с (6Н, СН3); 4,67 с (2Н, СН2); 4,89 с (2Н, СН2); 5,81 д (1Н, J = 8, Н-5); 6,94 c (3Н, Н-2’, H-4’, H-6’); 7,06 т (1Н, J = 7,3, Н-4’’); 7,31 т (2Н, J = 7,8, H-3’’, H-5’’); 7,59 д (2H, J = 7,9, H-2’’, H-6’’); 7,81 д (1Н, J = 8, Н-6); 10,23 с (1Н, NH).
2-[3-(4-трет-бутилбензил)-2,6-диоксо-3,6-ди-гидропиримидин-1(2H)-ил]-N-фенилацетамид (12). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 1,27 с (9Н, СН3); 4,67 с (2Н, СН2); 4,94 с (2Н, СН2); 5,80 д (1Н, J = 7,9, Н-5); 7,06 т (3Н, J = 7,1, Н-4’’); 7,267,33 м (4Н, H-2’’, H-3’’, H-5’’, H-6’’); 7,39 д (2Н, J = 7,9, H-3’, H-5’); 7,59 д (2H, J = 8, H-2’, H-6’); 7,83 д (1Н, J = 7,8, Н-6); 10,19 с (1Н, NH).
2-[3-(2-метил-5-трет-бутилбензил)-2,6-диок-со-3,6-дигидропиримидин-1(2H)-ил]-N-фенилаце-тамид (13). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 1,24 с (9Н, СН3); 2,25 с (3Н, СН3); 4,66 с (2Н, СН2); 4,91 с (2Н, СН2); 5,78 д (1Н, J = 7,9, Н-5); 6,89 с (1Н, Н-6’); 7,01-7,11 м (3Н, Н-4”, H-3’, H-4’); 7.32 т (2Н J = 7.89, H-3”, H-5”) 7.56 д (2Н, J = 7.95, H-2”, H-6”) 7.66 д (1Н, J = 7.95, H-6); 10,21 с (1Н, NH).
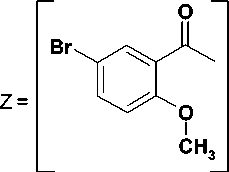
2-[3-[3-(2-Метокси-5-бромбензоил)бензил]-2,6-диоксо-3,6-дигидропиримидин-1(2H)-ил)-N-фе-нилацетамид (14). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 4,48 с (2Н, СН2); 4,88 с (2Н, СН2); 5,70 д (1Н, J = 8, Н-5); 6,90 т (3Н, J = 7.5, Н-4’’); 7.01 д (1Н, J = 9.1, H-5’’); 7,16 т (1Н, J = 7.6, H-5”’); 7,35-7,60 м (9Н, ароматические Н); 7,80 д (1Н, J = 8, Н-6); 10,13 с (1Н, NH).
2-(3-бензил-2,6-диоксо-3,6-дигидропирими-дин-1(2H)-ил)-N-(2-метилфенил)-ацетамид (15). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2,17 с (3Н, СН3); 4,64 с (2Н, СН2); 4,93 с (2Н, СН2); 5,77 д (1Н, J = 7,8, Н-5); 7,04-7,18 м (3Н, ароматические Н); 7,277,34 м (6Н, ароматические Н); 7,81 д (1Н, J = 8, Н-6); 9,57 с (1Н, NH).
2-(3-бензил-2,6-диоксо-3,6-дигидропири-мидин-1(2H)-ил)-N-(4-метилфенил)-ацетамид (16). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2,25 с (3Н, СН3); 4,64 с (2Н, СН2); 4,97 с (2Н, СН2); 5,83 д (1Н, J = 7,9, Н-5); 7,12 д (2Н, J = 8,3, ароматические Н); 7,29-7,36 м (5Н, С6Н5); 7,47 д (2Н, J = 8,3, ароматические Н); 7,87 д (1Н, J = 7,9, Н-6); 10,20 с (1Н, NH).
2-(3-бензил-2,6-диоксо-3,6-дигидропирими-дин-1(2H)-ил)-N-(3,4-диметилфенил)ацетамид (17). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2,16 c (3Н, СН3); 2,18 c (3Н, СН3); 4,62 с (2Н, СН2); 4,97 с
(2Н, СН2); 5,82 д (1Н, J = 7,8, Н-5); 7,05 д (1Н, J = 7,9, ароматический Н); 7,27-7,37 м (5Н, С6Н5); 7,87 д (1Н, J = 7,7, Н-6); 10,11 с (1Н, NH).
2-(3-бензил-2,6-диоксо-3,6-дигидропирими-дин-1(2H)-ил)-N-(3,5-диметилфенил)ацетамид (18). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 2,25 с (6Н, СН3); 4,65 с (2Н, СН2); 4,98 с (2Н, СН2); 5,79 д (1Н, J = 7,9, Н-5); 6,88-6,92 м (1Н, ароматический Н); 7,03-7,10 м (2Н, ароматические Н); 7,29-7,40 м (5Н, С6Н5); 7,80 д (1Н, J = 7,8, Н-6); 7,94 д (2Н, J = 7,9, ароматические Н); 9,34 с (1Н, NH).
2-(3-бензил-2,6-диоксо-3,6-дигидропирими-дин-1(2H)-ил)-N-(2-метоксифенил)ацетамид (19). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 3,86 с (3Н, ОСН3); 4,74 с (2Н, СН2); 4,98 с (2Н, СН2); 5,79 д (1Н, J = 8, Н-5); 6,71 с (1Н, Н-4’); 7,21 м (2Н, Н-2’, H-6’); 7,33-7,40 м (5Н, С6Н5); 7,80 д (1Н, J = 7,8, Н-6); 9,93 с (1Н, NH).
2-(3-бензил-2,6-диоксо-3,6-дигидропирими-дин-1(2H)-ил)-N-(4-феноксифенил)ацетамид (20). 1Н ЯМР спектр (ДМСО-D6) δ, м.д., J (Гц): 4,21 с (2Н, СН2); 4,53 с (2Н, СН2); 5,38 д (1Н, J = 7,8, Н-5); 6,51–6,56 м (4Н, ароматические Н); 6,63-6,66 м (2Н, ароматические Н); 6,84-6,94 м (6Н, ароматические Н); 7,15 д (2Н, J = 8,9, ароматические Н); 7,43 д (1Н, J = 7,8, Н-6); 9,88 с (1Н, NH).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Синтез целевых соединений, представленных на схеме (рис. 4), был осуществлен путем алкилирования бензилурацилов 4 , полученных в соответствии с известныи методами [7, 8], хлорацетанилидами 5 . Реакцию проводили в растворе ДМФА в присутствии 1,5-кратного мольного избытка карбоната калия при комнатной температуре, что приводило к образованию соответствующих 1-бензил-3-ацетанилидов урацила 6-20 , выход которых составил 73—96 %.
Чистоту полученных соединений определяли методом тонкослойной хроматографии, строение – ЯМР-спектроскопией, физико-химические свойства представлены в табл.
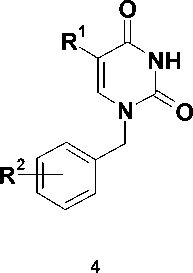
H
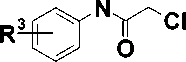
K2CO3, ДМФА
73 - 96 %
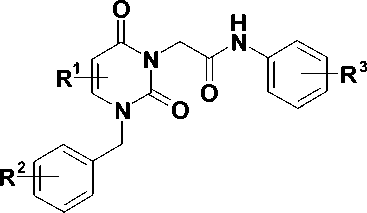
6-20
Рис. 4. Схема синтеза производных урацила
Свойства синтезированных соединений
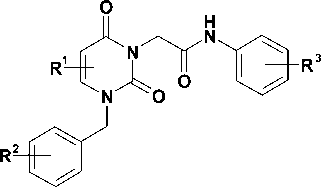
|
Соединение |
R1 |
R2 |
R3 |
R f * |
Выход, % |
Т. пл., ?C |
|
6 |
H |
H |
H |
0,57 |
96 |
212—213 |
|
7 |
5-Me |
H |
H |
0,71 |
90 |
197,5—199 |
|
8 |
5-PhNH |
H |
H |
0,79 |
94 |
290—291,5 |
|
9 |
N-морфолино |
H |
H |
0,34 |
89 |
209—210 |
|
10 |
H |
2,5-Me 2 |
H |
0,65 |
90 |
175—176,5 |
|
11 |
H |
3,5-Ме 2 |
H |
0,61 |
84 |
248—250 |
|
12 |
H |
4- t -Bu |
Н |
0,63 |
90 |
219—220 |
|
13 |
H |
2-Me-5- t -Bu |
H |
0,68 |
88 |
205,5—207 |
|
14 |
H |
3-Z |
H |
0,49 |
76 |
227—228 |
|
15 |
H |
H |
2-Me |
0,48 |
84 |
201—202 |
|
16 |
H |
H |
4-Ме |
0,59 |
83 |
221—222 |
|
17 |
H |
H |
3,4-Me 2 |
0,56 |
73 |
222,5—224 |
|
18 |
H |
H |
3,5-Me 2 |
0,64 |
87 |
214-215 |
|
19 |
H |
H |
2-МеО |
0,61 |
84 |
183-185 |
|
20 |
H |
H |
4-PhO |
0,60 |
85 |
186-187 |
* 1,2-дихлорэтан-этилацетат 1 : 1
ЗАКЛЮЧЕНИЕ
Таким образом, нами синтезированы 15 новых, ранее не описанных в литературе производных урацила, содержащих в положении 1 бензильные, а в положении 3 ацетанилидные фрагменты, изучены их спектральные и физико-химические свойства. Соединения этого ряда представляют интерес в плане поиска новых высокоэффективных противовирусных агентов.


