Психрофильные псевдомонады-эндофиты как потенциальные агенты в биоконтроле фитопатогенных и гнилостных микроорганизмов при холодильном хранении картофеля
Автор: Щербаков А.В., Щербакова Е.Н., Мулина С.А., Роц П.Ю., Дарью Р.Ф., Кипрушкина Е.И., Гончар Л.Н., Чеботарь В.К.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Картофелеводство: наука и технологии
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
При хранении продовольственного и семенного картофеля существенные потери обусловлены высоким фитопатогенным фоном семян и клубней. В связи с этим внимание исследователей привлекают биологические средства защиты на основе биоконтрольных микроорганизмов. Род Pseudomonas бактерий, относящихся к группе PGPR (plant-growth promoting rhizobacteria), включает виды, наиболее эффективно колонизирующие высшие растения и используемые в биопрепаратах. Нами впервые исследованы особенности влияния психрофильного штамма бактерий Pseudo-monas sp. RF13H на сохранность клубней холодоустойчивых промышленных сортов картофеля, рекомендованных для выращивания в Ленинградской области, определена эффективность защиты клубней от ряда фитопатогенных организмов в условиях холодильного хранения, оценена динамика численности интродуцируемого штамма на поверхности клубней в период хранения. С помощью флуоресцентной in situ гибридизации и конфокальной сканирующей лазерной микроскопии впервые изучена локализация клеток бактерий и колонизация ими поверхности клубней при нормальной и пониженной температуре, указывающая на взаимовыгодные условия растительно-микробных отношений. Определив таксономическое положение ряда штаммов псевдомонад методами молекулярно-генетического анализа и охарактеризовав их хозяйственно ценные физиологические свойства (фунгицидная и бактерицидная активность, скорость роста в диапазоне пониженных температур, продукция ауксиноподобных фитогормонов), мы выявили перспективный психрофильный штамм Pseudomonas sp. RF13H и изучили возможности его применения для повышения сохранности и оптимизации биохимических процессов в клубнях картофеля при низкотемпературном хранении. Так, обнаружено снижение частоты фитопатогенных микроорганизмов на поверхности клубней при их обработке Pseudomonas sp. RF13H. Среднее число клубней, пораженных всеми типами инфекций, при такой обработке снизилось более чем на 50 % в сравнении с контролем. Тенденция сохранялась на протяжении 3 мес: в контрольных образцах доля пораженных клубней достигала 30 %, в то время как интродукция биоконтрольного штамма позволила уменьшить этот показатель до 10-13 %. При температуре 4 °С численность биоконтрольного штамма бактерий на поверхности клубней оставалась достаточно стабильной на протяжении 5 мес, существенно снизившись к концу хранения до следовых количеств. Отмечено формирование микроколоний бактерий, которые часто локализованы в углублениях и нишах на поверхности клубня. Кроме того, высокая плотность бактерий была обнаружена на границе между клетками перидермы клубней и в местах экссудации биохимических веществ, которые служат питанием для бактерий. При сравнительном изучении функции ферментов антиоксидантной защиты (каталазы, пероксидазы, супероксиддисмутазы) установлено, что интродукция Pseudomonas sp. RF13H способствует активации окислительно-восстановительных процессов, повышая устойчивость клубней к заражению. Показано, что изучаемый штамм положительно влияет на состав микробиома эпидермиса картофеля. В итоге вследствие индукции собственного иммунитета и создания барьера для проникновения болезнетворного организма заражение клубня снижается.
Картофель, биоконтроль фитопатогенов, флуоресцентная in situ гибридизация
Короткий адрес: https://sciup.org/142214003
IDR: 142214003 | УДК: 635.21:632.3/.4:632.9:579.64 | DOI: 10.15389/agrobiology.2017.1.116rus
Текст научной статьи Психрофильные псевдомонады-эндофиты как потенциальные агенты в биоконтроле фитопатогенных и гнилостных микроорганизмов при холодильном хранении картофеля
В последние годы отмечается быстрый рост резистентности фитопатогенов и появление их новых видов, в том числе распространяющихся вместе с импортируемыми семенами (1, 2). В картофелеводстве с инфици-рованностью клубней связаны как потери при хранении, так и угроза повторного заражения вегетирующих растений. По данным ФАО ООН, в России среднедушевое потребление картофеля одно из самых больших в мире — 130 кг в год (3). Картофель относится к культурам с высоким потенциалом урожайности, но из-за преимущественно вегетативного размножения он
∗ Работа поддержана грантом Российского научного фонда ¹ 14-16-00146. Исследования выполнены с использованием оборудования Центра коллективного пользования «Геномные технологии и клеточная биология» (Всероссийский НИИ сельскохозяйственной микробиологии).
крайне восприимчив к грибным, бактериальным и вирусным патогенам.
Рост устойчивости возбудителей и вспышки заболеваний приводят к увеличению применяемых доз химических препаратов, что, в свою очередь, индуцирует новое повышение устойчивости патогенов. Поэтому для экологической стабильности растениеводства актуальны подходы, предполагающие использование средств защиты на основе биоконтрольных микроорганизмов — естественных обитателей экосистемы (4), которые обладают избирательностью действия и позволяют избежать нежелательных изменений в биоценозах, а также сохранить полезные свойства продукции (5). Большинство таких микроорганизмов синтезируют различные метаболиты, индуцирующие в растении каскад защитных реакций (6). Кроме того, при взаимодействии с растением бактерии могут повышать его жизнеспособность, тем самым регулируя численность фитопатогенов. В результате формируются несколько уровней защиты, включающих прямую конкуренцию с фитопатогеном, продукцию биопленок и антибиотических веществ, а также индукцию собственного иммунитета растения.
Особый интерес представляют эндофитные бактерии (7, 8), обитающие в растительных тканях, что делает их менее зависимыми от внешних факторов. Однажды внедрившись в ткани растения, эндофиты с комплексом хозяйственно полезных признаков могут способствовать формированию длительной защиты макроорганизма от стрессовых факторов (9).
Изучение микробиома у картофеля ( Solanum tuberosum L.) касалось как ризосферы, так и эндосферы (10-12), при этом показано, что биоразнообразие микроорганизмов часто зависит от сорта и фазы развития растения. В основном подобные исследования проводились на вегетирующих частях (13-15), но не клубнях после сбора урожая. В одной из работ, оценивая динамику микробных популяций в клубнях при хранении, авторы ограничились несколькими бактериальными таксонами (16). Среди недавних заслуживающих внимания публикаций следует отметить сообщение об анализе эндофитного миробиома клубней в процессе хранения с использованием как классических методов выделения и идентификации микроорганизмов, так и при помощи высокопроизводительного NGS (next generation sequencing) (17). Отметим, что для отнесения изолята к эндофитам недостаточно выделить его из тканей после поверхностной стерилизации. Необходима визуализация бактерий внутри растения — например, с помощью флуоресцентных маркеров (зондов или белков) (18, 19).
В настоящее время мировая практика использования бактериальных препаратов для хранения картофеля только начала формироваться, в связи с чем возникает множество вопросов о механизмах взаимодействия в сложной системе растение—патоген—антагонист: что происходит с индуцируемым штаммом после нанесения на клубни и в процессе хранения, как изменяется его численность и распределение на поверхности клубней, как температура хранения влияет на эти процессы. Выяснение этого позволит прогнозировать эффект и корректировать применение бактериальных препаратов, а вовлечение в исследования местных сортов — создать полноценную практически значимую модель.
Научная новизна представляемой работы заключается в том, что впервые исследованы особенности влияния психрофильного штамма бактерий Pseudomonas sp. RF13H на сохранность клубней холодоустойчивых сортов картофеля, рекомендованных для выращивания в Ленинградской области (Невский и Сударыня). Определена эффективность защиты клубней от ряда фитопатогенов при холодильном хранении, оценена динамика численности интродуцируемого штамма на поверхности клубней на про- тяжении всего строка хранения. С помощью современных методов визуализации впервые изучена колонизация Pseudomonas sp. RF13H поверхности клубней, характер которой указывает на взаимовыгодные растительномикробные отношения. На основании этих результатов, полученных с использованием промышленных сортов, могут разрабатываться рекомендации для практического применения психрофильного штамма Pseudomonas sp. RF13H в технологиях производства, хранения и репродукции картофеля.
Цель работы — уточнить таксономическую принадлежность пси-хрофильного штамма Pseudomonas sp. RF13H и изучить его биоконтрольную эффективность (сохранность клубней картофеля и происходящие в них биохимические процессы), а также локализацию бактерий на поверхности клубней в условиях низкотемпературного хранения.
Методика . Объектом изучения биоконтрольного эффекта штаммов был картофель ( Solanum tuberosum L.) сортов Невский (среднепоздний) и Сударыня (среднеранний). Партии сортового картофеля были получены из Ленинградского НИИ сельского хозяйства «Белогорка».
Штаммы псевдомонад, включая Pseudomonas sp. RF13H, ранее были выделены из тканей сфагнового мха Sphagnum fallax в составе экстремо-фильного эндофитного сообщества (20) . Культуру выращивали 48 ч при температуре 28 °С, используя жидкую среду TSB (Tryptic Soy Broth, «Schar-lab, S.L.», Испания), после чего готовили рабочую суспензию (108 КОЕ/мл). Клубни картофеля опрыскивали бактериальным препаратом (в контроле — водой), подсушивали на воздухе и закладывали на хранение при комнатной температуре и 4 °С. Использовали тест-культуры основных возбудителей заболеваний вегетативных органов растений семейства пасленовых при холодильном хранении ( Fusarium solani , Alternaria alternata , Pseudomonas solanacearum , Clavibacter michiganensis subsp. sepedonicus ). Микромицеты культивировали на картофельно-декстрозном агаре PDA («BD», США), фито-патогенные бактерии — на голодном картофельном агаре (Всероссийский НИИ сельскохозяйственной микробиологии — ВНИИСХМ). Штаммы фи-топатогенных грибов и бактерий получены из коллекции лаборатории технологии микробных препаратов (ВНИИСХМ).
Для анализа вариабельности V3-V6 участков гена 16S рРНК из чистых 24-часовых культур исследуемых штаммов бактерий выделяли ДНК стандартным методом (лизис клеток с применением лизоцима, протеиназы К и SDS и экстракция смесью фенола с хлороформом). ПЦР проводили в термоциклере Bio-Rad С1000 («Bio-Rad», США). ДНК гена 16S-рРНК амплифицировали с использованием праймеров BD1/FD1 в предусмотренном для них режиме (21). После очистки из геля соответствующие фрагменты секвенировали с внутренними праймерами fD1/rD1, охватывающими вариабельные области V3-V6 гена 16S-рРНК, согласно протоколу фирмы «Beckman Coulter, Inc.» (США) для 8-канального секвенатора SEQ8000 с коммерческим набором SEQ Dye Terminator Cycle Sequencing (DTCS) with Quick Start Kit («Beckman Coulter, Inc.», США).
Видовую принадлежность изолятов определяли с помощью программ BLAST (GenBank, и Ribosomal Database Project . Выравнивание установленных нуклеотидных последовательностей с референсными последовательностями из базы GenBank и построение филогенетических деревьев проводили с использованием UGENE («UniPro», Россия).
При изучении физиологических свойств штаммов сравнивали их фунгицидную и бактерицидную активность, скорость роста в диапазоне пониженных температур (4-10 °С) и продукцию ауксиноподобных фито-118
гормонов. Фунгицидную активность определяли методом колодцев (22), бактерицидную — методом агаровых блоков (23). Численность интродуцированных и аборигенных микроорганизмов на поверхности клубней учитывали при микробиологических посевах (24, 25). Состав ауксинов в экстрактах культуральной жидкости анализировали с помощью системы высокопроизводительной жидкостной хроматографии (ВЖХ, HPLC) Waters ACQUITY UPLC H-class с флуоресцентным детектором («Waters», США).
Активность системы антиоксидантной защиты в клубнях определяли по содержанию в проростках малонового диальдегида (МДА) и пероксидазы (ПО). Перекисное окисление липидов (ПОЛ) оценивали по концентрации окрашенного комплекса, образуемого МДА в кислой среде при температуре около 100 °С (26), активность каталазы (КАТ) — по скорости деградации перекиси водорода, активность ПО — по оптической плотности продуктов окисления гваякола за определенный промежуток времени (27). За единицу активности СОД принимали 50 % ингибирования при образовании формазана в реакции с нитросиним тетразолием (28).
Дизайн олигонуклеотидного зонда для мишени при FISH (флуоресцентная in situ гибридизации) осуществляли с помощью интернет-ре-сурса IDT (28). Разработанный зонд был маркирован флуорохромом 6FAM. Режим гибридизации зонда — 60 °С, 90 мин. Подготовку растительных тканей и гибридизацию проводили по описанным процедурам (29, 30). Препараты анализировали с применением конфокального микроскопа Leica TCS SPE («Leica Mikrosysteme Vertrieb GmbH», Германия). Для детекции флуоресценции олигонуклеотидного зонда использовали лазер (X = 488 нм), флyоресценцию регистрировали в диапазоне 508-566 нм. Изображения визуализировали в программе Leica Confocal Software («Leica Mikrosysteme Vertrieb GmbH», Германия).
Каждый из показателей (фунгицидная и бактерицидная активность, скорость роста колоний при пониженных температурах, активность ферментов и численность микроорганизмов на поверхности клубней) оценивали в трех независимых экспериментах. Анализ содержания ауксинов проводили в 3-кратной повторности. Статистическую обработку числовых значений выполняли с помощью программы DIANA (ВНИИСХМ) при уровне значимости p = 0,05.
Результаты. Такс о но мия ис следуемых из олято в. Род Pseudomonas очень разнообразен, и его таксономия до сих пор претерпевает уточнения (31, 32). На основании полученных морфологических и физиолого-биохимических характеристик 10 изучаемых штаммов из лабораторной коллекции были отнесены в группу « P. fluorescens - P. asplenii - P. poae » .
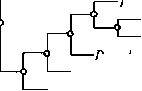
Чтобы получить более полное представление о таксономическом положении изучаемых штаммов, провели анализ вариабельных участков V3-V6 гена 16S-рРНК. Наибольшую вариабельность отмечали на участках в позициях 557-586 и 624-685, соответствующих нуклеотидным позициям в гене 16S-рРНК Escherichia coli (рис. 1, А) . Полученные последовательности были выравнены с доступными референсными последовательностями из базы GenBank. В качестве референсов использовали консенсусные выравнивания для каждого предполагаемого вида — P. fluorescens , P . poae , P . asplenii , P . koreensis , P . moraviensis . Филогенетическое дерево (см. рис. 1, Б), построенное на основе анализа указанных участков, отражало таксономическое положение изученных изолятов следующим образом: штаммы AF12F, RM13D, AF24C оказались более тесно связаны с подгруппой P . koreensis , P. moraviensis , в то время как RM11C, RM14B располагались ближе к виду
P . asplenii . Штаммы RF14J, RF12C, RF14H, RM13C, RF13H, вероятно, следует рассматривать как представителей еще не описанных видов.
А

Б
—Pseudomonas sp. RF12C
—Pseudomonas sp. RF14H
;—Pseudomonas sp. RM13C
__■- - - -Pseudomonas sp. RM 11C
*-—Pseudomonas sp. RM14B
Pseudomonas sp. AF12F
Pseudomonas sp. RM13D
Pseudomonas sp. AF24C
Pseudomonas moraviensis LT62978 8.1
Pseudomonas koreensis KJ937669.1
Pseudomonas asplenii NR 040802.1
__1 1 Pseudomonas poae EU350370.1
; —Pseudomonas fluorescens LN849852.1
1 Pseudomonas sp. RF13H
Pseudomonas sp. RF14J
Рис. 1. Участки в вариабельных фрагментах V3-V6 гена 16S-рРНК исследуемых псевдоманад с заменами и делециями по отношению к референсным последовательностям (А) и филогенетическое дерево, полученное на основе анализа вариабельных участков гена 16S рРНК у 10 исследуемых штаммов психрофильных псевдомонад (Б). Стрелкой показана мишень для гибридизации зонда Z-SpecPs. Филогенетическое дерево построено с помощью программы UGENE.
У всех штаммов мы изучили способность к психрофильному росту и развитию (в диапазоне температур 0-10 °С), подавлению фигопатогенных и гнилостных микроорганизмов, продукцию ауксиноподобных фитогормонов (индолил-3-уксусной, индолил-3-карбоновой, индолил-3-молочной кислот). Как было показано, штаммы псевдомонад различались по скорости роста при пониженных температурах: у большинства он существенно замедлялся при 6-7 °С и полностью подавлялся при 5 °С. Однако в диапазоне 7-10 °С все штаммы в течение 7 сут культивирования на агаре R2A формировали колонии диаметром 3-4 мм. Рост штаммов RF13H и RM14B наблюдался в диапазоне положительных температур, близких к нулю (интервал 2-4 °С): через 7 сут низкотемпературного роста бактерии формировали на поверхности питательной среды колонии диаметром 1-2 мм.
Оценка антагонистической активности в отношении фитопатоген-ных и гнилостных микроорганизмов картофеля (рис. 2, А) показала, что у ряда штаммов (RF13H, RF14J, RM14B, RF12C) она явно выражена (подавление развития возбудителей, вызывающих порчу картофеля при низкотемпературном хранении). По совокупности физиологических свойств мы отобрали штамм Pseudomonas spp. RF13H, который обладал более выраженной активностью в отношении грибов и бактерий, образуя оптически чистые зоны (без включений мицелия тест-культуры фитопатогена) и продуцировал ауксиноподобные фитогормоны (см. рис 2, Б). У этого штамма как перспективного для практического применения мы изучили физиоло- гическую активность при колонизации поверхностных структур клубня.
А

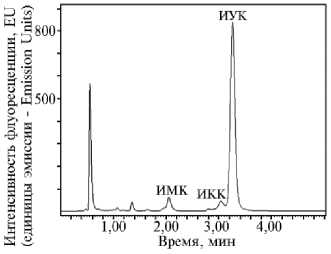
Рис. 2. Физиолого-биохимические (потенциально адаптивные) свойства изучаемых штаммов псевдомонад: А — психрофильный рост, диаметр (мм) зон задержки роста Pseudomonas solanacearum ( PS ), Clavibacter michiganensis subsp. sepedonicus ( CM ), Fusarium solani ( FS ), Alternaria alternata ( AA ) и продукция акусинов (АУ, наличие или отсутствие); Б — результаты анализа культуральной жидкости штамма RF13H, выращенного на среде с L-триптофаном, методом высокопроизводительной жидкостной хроматографии (Waters ACQUITY HPLC H-class с флуоресцентным детектором, «Waters», США): ИМК — индолил-3-молочная кислота, ИКК — индолил-3-карбоновая кислота, ИУК — индолил-3-уксусная кислота.
Б
Динамика численности интродуцированного штамма Pseudomonas sp. RF13H и е го влияние на пр о це с сы хр ан е -ния. Чтобы создать благоприятные условия для адаптации бактерий-антагонистов и проявления их активности, клубни инокулировали монокультурой опытного штамма псевдомонад в послеуборочный (лечебный) период. Его продолжительность по общепринятой технологии хранения картофеля — 14 сут, в течение которых клубни выдерживают при температуре 18 °С. Этот режим также обеспечивает активную суберенизацию в местах механических повреждений и укрепление покровных тканей.
Общая численность мезофильной сапротрофной микрофлоры на единице поверхности клубней в процессе хранения колебалась в пределах 103-104 КОЕ/см2. Интродукция штамма Pseudomnas sp. RF13H повлияла на фитопатогенный фон (рис 3, А), а также соотношение и динамику численности сапрофитной микрофлоры (см. рис. 3, Б) при длительном хранении (в течение 6 мес). Исследуемый микроорганизм достаточно хорошо приживался на поверхности клубней и поддерживал свою численность в течение всего времени эксперимента. Можно отметить, что низкотемпературное хранение в целом положительно сказывалось на штамме RF13H в силу как его физиологических свойств, так и особенностей бактериальной популяции в целом. Известно, что при температуре 4 °С на поверхности твердых питательных сред бактерии разных видов длительно (до полугода) сохраняют жизнеспособность (33). Лимитирующим фактором служит пересыхание питательной среды, вызывающее гибель популяции. То же, вероятно, происходит на поверхности клубней и при нормальной температуре хранения: снижение численности интродуцированного штамма здесь было наиболее выражено, и через 6 мес его находили в остаточных количествах. Численность Pseudomnas sp. RF13H при температуре 4 °С поддерживалась достаточно стабильно на протяжении 5 мес, существенно снизившись только к концу хранения, когда этот штамм обнаруживался в следовых количествах.
А
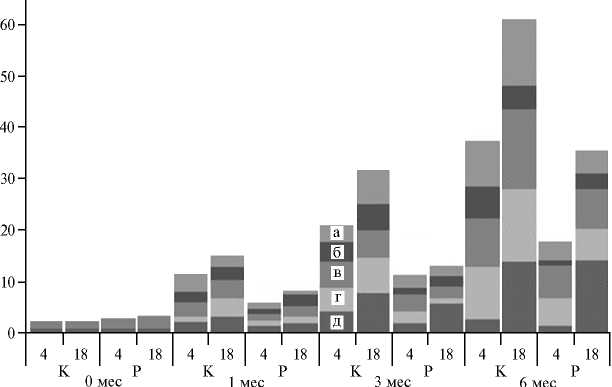
Рис. 3. Фитопатогенная нагрузка на поверхности клубней картофеля ( Solanum tuberosum L.) сорта Невский под влиянием интродуцированного штамма Pseudomnas sp . RF13H (А) и его численность на фоне аборигенной микрофлоры в зависимости от температуры (Б) при хранении: а — Penicil-lium spp., б — Rhizoctonia spp., в — Fusarium spp., г — Phytophtora spp., д — Phoma exiqua ; К и Р — соответственно контроль (необработанные клубни) и интродукция псевдомонад; 1 — контроль, 2 — посторонние микроорганизмы, 3 и 4 — численность штамма Pseudomnas sp . RF13H при хранении соответственно при 4 ° С и 18 ° С.
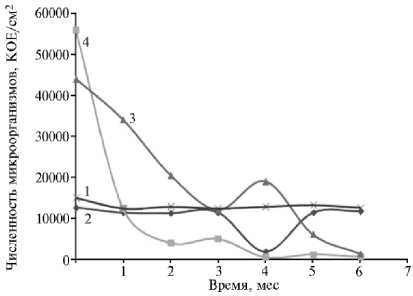
Тем не менее, влияние штамма на состав и численность фитопато-генных грибов (см. рис. 3, А) оказалось довольно значительным, на что указывали результаты фитопатологического анализа. Установлено, что при хранении картофеля наиболее выраженным было развитие фитопатоген-ных микромицетов — Rizoctonia spp., Fusarium spp., Penicillium spp., Phyto-phthora spp., Phoma exiqua. Уже через 30 сут хранения их частота в популяции снижалась (в наибольшей степени при холодильном хранении). Средняя доля клубней, пораженных всеми типами инфекций, при обработке бактериальной культурой через 30 сут снизилась с 11,5 до 5,9 % (при холодильном хранении) и с 15,0 до 8,3 % (при комнатной температуре). Эта тенденция сохранялась на 3-й мес: в контрольных образцах количество пораженных клубней достигало 30 %, в то время как интродукция биокон-трольного штамма позволила снизить показатель до 10-13 %. Через 6 мес при комнатной температуре наблюдалось значительное (до 60,0 %) поражение клубней, при пониженной — примерно вдвое меньшее (37,4 %).
Особую роль в регуляции клеточной активности играют ферменты антиоксидантной защиты (АОЗ), действие которых сводится не только к контролю образования свободных радикалов, но и к выполнению в клетках важных сигнальных функций (как при стрессе, так и в норме) (34-36). Окислительно-восстановительные процессы рассматриваются как одна из основ физиолого-биохимических механизмов, определяющих жизнеспособность и сохранность клубней картофеля. При длительном хранении или неблагоприятных условиях накапливаются продукты перекисного окисления липидов (ПОЛ) и снижается функция антиоксидантной системы (37).
При обработке полезными бактериальными культурами, которая усиливает эту функцию, вследствие повышения собственного иммунитета растения и создания барьера, препятствующего проникновению болезнетворного организма, происходит рост устойчивости к заражению патогенами. Известно, что микроорганизмы, заселяя поверхность картофеля, индуцируют генерацию активных форм кислорода (АФК), поэтому полезную микрофлору можно использовать для реализации защитных ответов растительной клетки при заражении. В этой связи представлялось важным изучить влияние штамма Pseudomonas sp. RF13H на образование АФК и функционирование ферментов антиоксидантной защиты (38).
Продолжительное хранение приводило к резкому подавлению активности супероксиддисмутазы (СОД), каталазы (КАТ) и накоплению продуктов ПОЛ (табл.), в частности малонового диальдегида (МДА). Активность пероксидазы не изменялась при хранении. Повышенная температура способствовала активации свободно-радикальных реакций и ПОЛ, приводящих к снижению жизнеспособности и качества картофеля. В течение 3 мес активность ферментов колебательно уменьшалась во всех образцах. При этом рост активности ферментов коррелировал с усилением ПОЛ. После 6 мес хранения увеличивалась активность как ферментов, так и ПОЛ, что связано с началом выхода картофеля из физиологического покоя. При обработке биоконтрольным штаммом все исследуемые ферменты заметно активировались, что свидетельствует о повышении защитного потенциала клубней при длительном хранении.
Показатели активности про- и антиоксидантной системы клубней картофеля ( Solanum tuberosum L.) сорта Невский при обработке биоконтрольным штаммом Pseudomonas sp. RF13H в зависимости от температуры хранения
|
Срок хранения, мес |
Контроль (обработка водой) |
Опыт |
||||||
|
ПОЛ |
СОД |
КАТ |
ПО |
ПОЛ |
СОД |
КАТ |
ПО |
|
|
0 |
8,4 |
0,05 |
Хране 0,51 |
н и е при 4 ° С 60,8 8,6 |
0,57 |
0,57 |
69,4 |
|
|
1 |
6,7 |
0,03 |
0,34 |
74,5 |
6,3 |
1,61 |
0,56 |
104,8 |
|
3 |
6,3 |
0,07 |
0,13 |
50,1 |
5,8 |
1,23 |
0,43 |
112,6 |
|
6 |
9,8 |
0,05 |
0,36 |
84,3 |
6,8 |
1,83 |
0,78 |
120,1 |
|
0 |
8,7 |
0,05 |
Хране 0,54 |
ние при 60,2 |
18 ° С 8,5 |
0,74 |
0,56 |
106,4 |
|
1 |
9,4 |
0,04 |
0,38 |
79,3 |
6,9 |
1,83 |
0,66 |
120,5 |
|
3 |
10,1 |
0,06 |
0,25 |
67,2 |
6,2 |
1,98 |
0,71 |
110,3 |
|
6 |
12,3 |
0,08 |
0,41 |
88,9 |
7,3 |
2,11 |
0,84 |
124,7 |
|
НСР 05 |
0,80 |
0,01 |
0,50 |
5,40 |
2,10 |
0,30 |
0,10 |
7,10 |
|
Примеча |
ние. СОД |
супероксиддисмутаза |
, ед.; ПОЛ |
— перекисное |
окисления |
липидов, мкмоль/г; |
||
КАТ — каталаза, ммоль/(мин•г); ПО — пероксидаза, мкмоль/(мин•г). Активность ПОЛ, КАТ и ПО указана в расчете на 1 г сырой массы.
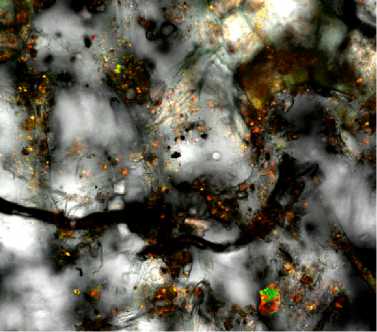
Стратегия колонизации штаммом Pseudomonas sp. RF13H по верхно сти клубн е й карто ф еля. Для изучения приживаемости интродуцированного штамма RF13H в условиях холодильного хранения картофеля мы разработали олигонуклеотидный зонд Z-SpecPs (5'^3': CAAACCACTACGCGCGCTTAC), который специфически связывался с соответствующей уникальной мишенью при флуоресцентной FISH-гибридизации in situ (см. рис 1, А). Через 24 ч после инокуляции клубней особенностью локализации биоконтрольного микроорганизма бактерий, визуализированного при помощи зонда Z-SpecPs и конфокальной сканирующей лазерной микроскопии, было неупорядоченное и неравномерное распределение на наружном слое покровных тканей (рис. 4, А, Б). В перидерме покровных тканей наблюдали нескольких рядов живых (феллоген и феллодерма) и омертвевших клеток (феллема); они очень плотно упакованы, имеют прямоугольную форму, встречаются изодиаметрические (округлые) и вытянутые клетки. Покровный опробковевший слой защищает клубни 123
от потери влаги, проникновения фитопатогенных микроорганизмов и от других неблагоприятных внешних воздействий. Большинство клеток штамма RH13H в течение первых суток после интродукции не занимали определенных ниш на поверхности, и только незначительная часть локализовалась в местах нарушения верхних слоев перидермы.
А

Рис. 4. Локализация интродуцированных бактерий Pseudomonas sp. RF13H на поверхности клубней картофеля сорта Сударыня через 24 ч после инокуляции: А — грибной мицелий, флуоресценция указывает на скопления клеток штамма RF13H; Б — разрозненные неупорядоченно локализованные микроколонии бактерий по поверхности клубня, высокая численность бактерий на единице площади. FISH-гибридизация (флуорохром 6FAM, Cy3) с конфокальной микроскопией (Leica TCS SPE, «Leica Mikrosysteme Vertrieb GmbH», Германия).
Б
А
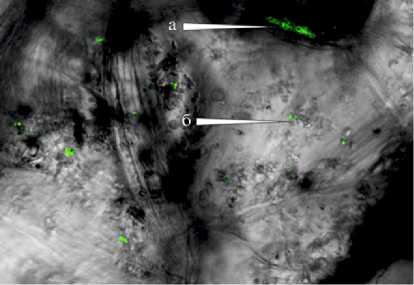
Рис. 5. Локализация интродуцированных бактерий Pseudomonas sp. RF13H на поверхности клубней картофеля сорта Невский через 2 мес хранения: А — наиболее распространенная локализация: стыки клеток перидермы (a) и поверхность самих клеток (б); Б, В — формирование микроколоний биоконтролного штамма RF13H в микротрещинах (поранениях), царапинах поверхности; Г — активная колонизация внутреннего пространства чечевичек. FISH-гибридизация (флуорохром 6FAM) с конфокальной микроскопией (Leica TCS SPE, «Leica Mikrosysteme Vertrieb GmbH», Германия).
Б В Г
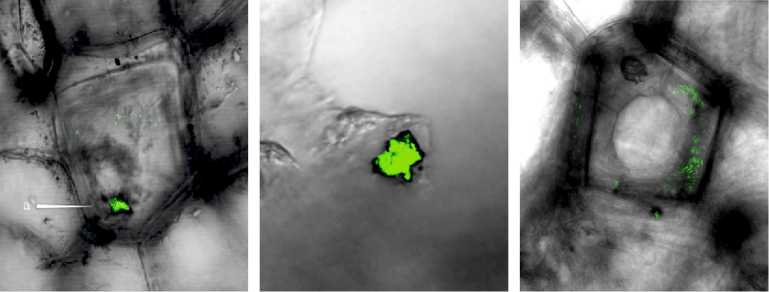
Конфокальная микроскопия поверхности клубней выявила неравномерность ее рельефа. Через 2 мес холодильного хранения клубней, обработанных суспензией биоконтрольного штамма, наблюдали формирова- ние его микроколоний, которые часто располагались в различных углублениях и нишах на поверхности, трещинах в кожице, в царапинах, порезах, местах ушибов, механических повреждений (рис. 5, А, Б). По-видимому, вещества, которые накапливаются при механических повреждениях (индо-лилуксусная, аскорбиновая, хлорогеновая кислоты, гиббереллин, аденозин-трифосфорная кислота) (39) и стимулирующие раневую реакцию (образование раневой перидермы) привлекательны для интродуцированных бактерий.
Кроме того, высокую плотность инокулята отмечали на границе между клетками перидермы клубней (см. рис. 5, А, a), где бактерии обычно располагались вдоль узких удлиненных продольных клеток, дифференцированных в зоне вторичной покровной ткани. Вероятнее всего, небольшие, прямоугольные, слегка утолщенные и плотно сложенные клетки с тонкими оболочками — это метаболически активные клетки феллогена. Они имеют густую вязкую цитоплазму и многочисленные органоиды, связанные с процессами синтеза, которые обеспечивают деление ядра и цитоплазмы (40). Можно предположить, что биохимическая активность в феллогене способствует формированию микроколоний биоконтрольного штамма. В то же время было установлено, что он способен активно колонизировать чечевички — микроскопические щели (отверстия) на поверхности, через которые в клубень поступает кислород воздуха и удаляется углекислый газ и водяной пар (дыхание клубня) (см. рис. 5, Г).
При микроскопировании поверхностных тканей клубня был обнаружен грибной мицелий, занимающий некоторые локальные участки пораженной перидермы. Скопления бактериальных клеток интродуцированных псевдомонад выявлялись в непосредственной близости от мицелия (см. рис. 4, А). Наблюдали раннюю фазу развития гриба на верхнем слое клеток с формированием внутриклеточного (изредка — межклеточного) мицелия. Яйцевидный или лимоновидные зооспорангии, схожие с зооспорангиями Phytophthora infestans , имели тонкую гладкую оболочку и хорошо заметный бугорок на вершине, однако на разрезе клубня мы не наблюдали ржаво-бурой окраски, характерной для поражения фитофторозом.
Следует еще раз акцентировать внимание на том обстоятельстве, что существенную роль в обеспечении эффективности интродуцированного штамма, по-видимому, сыграло выдерживание клубней в течение 14 сут при 18 °С. Оно повысило приживаемость и стабильность развития биоконтрольных бактерий, их адаптацию к соответствующей экологической нише. Это важно для успешного вступления в конкурентные взаимоотношения с уже сложившейся аборигенной микрофлорой, для синтеза и накопления антифунгальных метаболитов. Описана корреляция механизмов адаптации и синтеза биоактивных соединений, хемотаксических характеристик клеток популяции с длительностью инкубации (41). Растение-хозяин, со своей стороны, тоже влияет на результат биоконтроля: количественный состав интродуцированных бактерий зависит от физиологического состояния, сорта и вида биологического объекта, а секреция клетками клубней питательных веществ стимулирует хемотаксис микроорганизмов. Всевозможные углубления, микротрещины и ниши обеспечивают физическое обособление бактерий и служат местом скопления и секреции метаболитов, жидкостей и т.д., создавая благоприятные условия для поддержания физиологической активности биоконтрольного штамма.
Визуализация интродуцированных бактерий штамма Pseudomonas sp. RF13H in vivo на поверхности клубней в период хранения свидетельствует о высокой адаптивности этих бактерий в условиях пониженных температур, что имеет большое значение при конкуренции за источники питания и сайты локализации в условиях эпифитного микробиома.
Таким образом, интродуцируемые биоконтрольные бактерии, сдерживая развитие патогенного фона и уменьшая потери при хранении, обладают большим потенциалом для обеспечения экологически чистых продуктов питания. Обнаруженная нами способность штамма Pseudomonas sp. RF13H колонизировать растения и одновременно защищать их от фитопатогенов делает его перспективным для агротехнологий.
Список литературы Психрофильные псевдомонады-эндофиты как потенциальные агенты в биоконтроле фитопатогенных и гнилостных микроорганизмов при холодильном хранении картофеля
- Phatak H.C. The role of seed and pollen in the spread of plant pathogens particularly viruses. Tropical Pest Management, 2009, 26(3): 278-285 ( ) DOI: 10.1080/09670878009414413
- Darrasse A., Arnaud Darsonval A., Boureau T., Brisset M.-N., Durand K., Jacques M.-A. Transmission of plant-pathogenic bacteria by nonhost seeds without induction of an associated defense reaction at emergence. Appl. Environ. Microbiol., 2010, 76(20): 6787-6796 ( ) DOI: 10.1128/AEM.01098-10
- Russian Federation. Режим доступа: http://www.fao.org/faostat/en/#country/185. Без даты.
- Bale J.S., van Lenteren J.S., Bigler F. Biological control and sustainable food production. Phil. Trans. R. Soc. B, 2008, 363(1492): 761-776 ( ) DOI: 10.1098/rstb.2007.2182
- Vuro M. Enhancing biocontrol agents and handling risks/M. Vurro, J. Gressel, T. Butt, G.E. Harman, A. Pilgeram, R.J. Leger, D.L. Nuss (eds.). IOS Press, Amsterdam, 2001.
- Rosenblueth M., Martínez-Romero E. Bacterial endophytes and their interactions with hosts. Mol. Plant-Microbe Interact., 2006, 19: 827-837 ( ) DOI: 10.1094/MPMI-19-0827
- Holliday P. A dictionary of plant pathology. Cambridge University Press, Cambridge, 1989 ( ) DOI: 10.1017/S0014479700001393
- Schulz B., Boyle C. What are endophytes? In: Microbial root endophytes/B.J.E. Schulz, C.J.C. Boyle, T.N. Sieber (eds.). Springer-Verlag, Berlin, 2006: 1-13.
- Максимов И.В., Абизгильдина Р.Р., Пусенкова Л.И. Стимулирующие рост растений микроорганизмы как альтернатива химическим средствам защиты от патогенов. Прикладная биохимия и микробиология, 2011, 47: 373-385 ( ) DOI: 10.1134/S0003683811040090
- Manter D.K., Delgado J.A., Holm D.G., Stong R.A. Pyrosequencing reveals a highly diverse and cultivar-specific bacterial endophyte community in potato roots. Microb. Ecol., 2010, 60: 157-166 ( ) DOI: 10.1007/s00248-010-9658-x
- İnceoğlu O., Falcao Salles J., van Elsas J.D. Soil and cultivar type shape the bacterial community in the potato rhizosphere. Microb. Ecol., 2012, 63: 460-470 ( ) DOI: 10.1007/s00248-011-9930-8
- Weinert N., Piceno Y., Ding G.C., Meincke R., Heuer H., Berg G., Schloter M., Andersen G., Smalla K. PhyloChip hybridization uncovered an enormous bacterial diversity in the rhizosphere of different potato cultivars: many common and few cultivar-dependent taxa. FEMS Microbiol. Ecol., 2011, 75: 497-506 ( ) DOI: 10.1111/j.1574-6941.2010.01025.x
- Andreote F.D., Rocha U.N., Araújo W.L., Azevedo J.L., van Overbeek L.S. Effect of bacterial inoculation, plant genotype and developmental stage on root-associated and endophytic bacterial communities in potato (Solanum tuberosum). Antonie Van Leeuwenhoek, 2010, 97: 389-399 ( ) DOI: 10.1007/s10482-010-9421-9
- Reiter B., Pfeifer U., Schwab H., Sessitsch A. Response of endophytic bacterial communities in potato plants to infection with Erwinia carotovora subsp. atroseptica. Appl. Environ. Microbiol., 2002, 68: 2261-2268 ( ) DOI: 10.1128/AEM.68.5.2261-2268.2002
- Garbeva P., Overbeek L.S.S., Vuurde J.W., Elsas J.D.D. Analysis of endophytic bacterial communities of potato by plating and denaturing gradient gel electrophoresis (DGGE) of 16S rDNA based PCR fragments. Microb. Ecol., 2001, 41: 369-383 ( ) DOI: 10.1007/s002480000096
- Perombelon M.C.M., Gullings-Handley J., Kelman A. Population dynamics of Erwinia carotovora and pectolytic Clostridium spp. in relation to decay of potatoes. Phytopathology, 1979, 69: 167-173 ( ) DOI: 10.1038/srep11606
- Koiv V., Roosaare M., Vedler E., Kivistik P.A., Toppi K., Schryer D.W., Remm M., Tenson T., Mae A. Microbial population dynamics in response to Pectobacterium atrosepticum infection in potato tubers. Scientific Reports, 2015, Article number 11606: 1-18 ( ) DOI: 10.1038/srep11606
- Andreote F.D., de Araújo W.L., de Azevedo J.L., van Elsas J.D., da Rocha U.N., van Overbeek L.S. Endophytic colonization of potato (Solanum tuberosum L.) by a novel competent bacterial endophyte, Pseudomonas putida strain P9, and its effect on associated bacterial communities. Appl. Environ. Microbiol., 2009, 75: 3396-3406 ( ) DOI: 10.1128/AEM.00491-09
- Verma V.C., Gange A.C. Advances in endophytic research. Springer Science & Business Media, Berlin, 2013 (ISBN 978-81-322-1575-2).
- Щербаков А.В. Эндофитные сообщества сфагновых мхов как источник бактерий -эффективных ассоциантов сельскохозяйственных культур. Автореф. канд. дис. СПб, 2014.
- Коростик Е.В., Пинаев А.Г., Ахтемова Г.А., Андронов Е.Е. Универсальные 16S-рРНК праймеры для описания генетического разнообразия почвенных прокариот. Экологическая генетика, 2006, 4(4): 32-37.
- Magnusson J., Schnurer, J. Lactobacillus coryniformis subsp. coryniformis strain Si3 produces a broad-spectrum proteinaceous antifungal compound. App. Envir. Microbiol., 2001, 67(1): 1-5 ( ) DOI: 10.1128/AEM.67.1.1-5.2001
- Зенова Г.М., Степанов А.Л., Лихачев А.А., Манучарова Н.А. Практикум по биологии почв. М., 2002.
- Теппер Е.З., Шильникова В.К. Практикум по микробиологии. М., 2004.
- Синькевич М.С., Нарайкина Н.В., Трунова Т.И. Процессы, препятствующие повышению перекисного окисления липидов у холодостойких растений при гипотермии. Физиология растений, 2011, 58: 875-882.
- Kumar G.N., Knowles N.R. Changes in lipid peroxidation and lipolytic and free-radical scavenging enzyme during aging and sprouting of potato (Solanum tuberosum L.) seed-tubers. Plant Physiol., 1993, 102: 115-124 ( ) DOI: 10.1104/pp.102.1.115
- Нарайкина Н.В., Синькевич М.С., Демин И.Н., Селиванов А.А., Мошков И.Е., Трунова Т.И. Изменения активности изоформ СОД при низкотемпературной адаптации у растений картофеля (Solanum tuberosum L.) дикого типа и трансформированных геном 12-ацил-липидной десатуразы. Физиология растений, 2014, 61: 359-366.
- Integrated DNA Technologies. Режим доступа: https://eu.idtdna.com/calc/analyzer. Без даты.
- Cardinale M., Vieira de Castro J., Muller H., Berg G., Grube M. In situ analysis of the bacterial community associated with the reindeer lichen Cladonia arbuscular reveals predominance of Alphaproteobacteria. FEMS Microbiol. Ecol., 2008, 66: 63-71 ( ) DOI: 10.1111/j.1574-6941.2008.00546.x
- Щербаков А.В., Брагина А.В., Кузьмина Е.Ю., Берг К., Мунтян А.Н., Макарова Н.М., Мальфанова Н.В., Кардинале М., Берг Г., Чеботарь В.К., Тихонович И.А. Эндофитные бактерии сфагновых мхов как перспективные объекты сельскохозяйственной микробиологии. Микробиология, 2013, 82(3): 312-322.
- Peix A., Ramírez-Bahena M.H., Velázquez E. Historical evolution and current status of the taxonomy of genus Pseudomonas. Infection, Genetics and Evolution, 2009, 9(6): 1132-1147 ( ) DOI: 10.1016/j.meegid.2009.08.001
- Cornelis P. Pseudomonas: genomics and molecular biology. Horizon Scientific Press, Pool, 2008 (ISBN 978-1-904455-19-6).
- Toth E.M., Borsodi A.K, Felfoldi T., Vajna B., Sipos R., Marialigeti K. Practical microbiology. Eötvös Loránd Tudományegyetem, Budapest, 2013.
- Wegener C.B., Jansen G. Antioxidant capacity in cultivated and wild Solanum species: The effect of wound stress. Food Funct., 2010, 1: 209-218 ( ) DOI: 10.1039/C0FO00063A
- Grace S.C. Phenolics as antioxidants. In: Antioxidants and reactive oxygen species in plants/N. Smirnoff (ed.). Blackwall Publishing Ltd, Oxford, 2005.
- Wegener C.B., Jansen G. Antioxidants in different potato genotypes: effect of drought and wounding etress. Agriculture, 2013, 3: 131-146 ( ) DOI: 10.3390/agriculture3010131
- Верхотуров В.В., Топорищева В.К. Состояние антиоксидантной системы ячменя при замачивании и солодоращении. Хранение и переработка сельхозсырья, 2003, 9: 26-30.
- Кипрушкина Е.И. Воздействие низкой температуры на динамику численности и проявление биоконтролирующего эффекта бактериями родов Pseudomonas и Bacillus. Вестник Международной академии холода, 2007, 3: 34-38.
- Колодязная В.С., Кипрушкина Е.И. Холодильная технология пищевых продуктов (биохимические и физико-химические основы). СПб, 2008.
- Паутов А.А. Морфология и анатомия вегетативных органов растений. СПб, 2012.
- Олескин А.В., Ботвинко И.В. Колониальная организация и межклеточная коммуникация у микроорганизмов. Микробиология, 2000, 69: 309-327


