Пучково-плазменные технологии переработки целлюлозы и лигнинов
Автор: Кхин Маунг Хтау, Хтет Вэй Ян Чжо, Васильева Т.М.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Физика
Статья в выпуске: 1 (41) т.11, 2019 года.
Бесплатный доступ
Рассмотрена возможность применения неравновесной низкотемпературной плазмы для обработки биополимеров (целлюлозы, лигнина и его производных). Разработаны следующие методики, основанные на плазменно-стимулированных процессах: - деструкция твердых порошков биополимеров в электронно-пучковой плазме (ЭПП), генерируемой при инжекции электронного пучка в плотные газообразные среды; - функционализация полисахаридных материалов и лигнинов в гибридной плазме (ГП), которая генерируется при инжекции электронного пучка в ВЧ газоразрядную плазму. При ЭПП-стимулированной деструкции целлюлозы наблюдалось образование олигосахаридов с молекулярной массой 800-2000 Да и степенью полимеризации, варьирующейся от димеров до гептамеров, также показана частичная деструкция лигниновых порошков. Обработка ЭПП и ГП полисахаридных губок изменяла морфологию поверхностей, улучшала гидрофильность и приводила к образованию химически активных полярных кислородсодержащих групп. В ГП была выполнена прививка белка крови тромбина и молочной кислоты на поверхность из целлюлозных губок, гидролизованного лигнина и лигносульфонатов соответственно.
Целлюлоза, лигнин, порошки, модифицирование поверхности, электронно-пучковая плазма, гибридная плазма
Короткий адрес: https://sciup.org/142220467
IDR: 142220467 | УДК: 544.558;544.528
Текст научной статьи Пучково-плазменные технологии переработки целлюлозы и лигнинов
В последнее время во всем мире отмечается увеличение использования биоматериалов в качестве недорогих и возобновляемых источников для создания новых функциональных полимерных биокомпозитов. Самым распространенным возобновляемым биоматериалом на Земле является лигноцеллюлозная биомасса, которая состоит из трех основных биологических полимеров: целлюлозы, гемицеллюлозы и лигнина. В свою очередь целлюлоза (главным образом, в виде растительных волокон) представляет собой наиболее распространенный природный полимер, а лигнин - второе по распространенности вещество в природе после целлюлозы. Структурные формулы целлюлозы и лигнина представлены на рис. 1. В отличие от кристаллических полисахаридов лигнин обладает нелинейной аморфной структурой и состоит из метоксилированных пропиловых фениловых блоков.
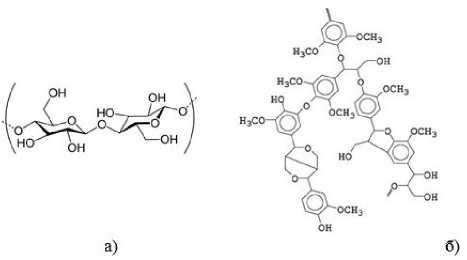
Рис. 1. Структурные формулы целлюлозы (а), лигнина, (б)
Интерес к использованию целлюлозы и лигнинов в различных сферах деятельности человека. связан не только с их широким распространением в природе и вознобновляемостью их сырьевых источников, но и с уникальным комплексом физико-химических, механических и биологических особенностей: прочностью, низкой токсичностью, высокой комплексообразующей активностью, возможностью химической модификации, хорошей совместимостью с тканями организма, способностью к биодеградации, возможностью получения наноструктур (например, наноцеллюлозы) [1-4]. Среди областей, где применяется целлюлоза, можно назвать целлюлозно-бумажную промышленность, текстильное производство, энергетику, сельское хозяйство, биотехнологию и медицину. Лигнин, являясь ароматическим соединением, представляет собой ценное перспективное сырье для органического синтеза и получения биотоплива, что делает его перспективной альтернативой нефти.
Традиционным методом переработки целлюлозы является химический гидролиз, которому присущ целый ряд ограничений и недостатков [1]: многостадийность, длительность, образование значительных количеств побочных продуктов, что требует весьма трудоемкого выделения целевых соединений, применения концентрированных растворов кислот и щелочей, необходимости обезвреживания отходов, высокой температуры процесса. Лигнин вообще трудно подвергается какой-либо химической переработке и модификации и поэтому в основном используется в качестве топлива, несмотря на. наличие большого количества, потенциальных коммерческих применений [5]. Таким образом, разработка, новых экологически чистых методов переработки природных полимеров, основанных на. нетрадиционных воздействиях на. вещество, остается крайне актуальной задачей.
Плазмохимическая модификация/предобработка природного сырья позволяет не только сократить экономические и временные затраты на. следующих этапах его переработки, но и добиться увеличения выхода, целевых продуктов (например, низкомолекулярных водорастворимых олигосахаридов, мономерных ароматических веществ, биотоплива), способных улучшить качество и технологические свойства, производимых из них материалов.
Цель работы - прямое экспериментальное доказательство возможности управляемой деструкции целлюлозы и модификации лигнина в низкотемпературной неравновесной плазме, а именно электронно-пучковой плазме (ЭПП) и гибридной плазме.
2. Экспериментальная установка
В настоящей работе для обработки целлюлозы использовалась ЭПП, которая генерируется при инжекции электронного пучка в плотные газообразные среды [6]. Получаемая ЭПП сильно неравновесна: в ее составе присутствуют молекулы, атомы, радикалы и ионы в основном и в возбужденном состояниях, а также электроны плазмы и электроны инжектируемого пучка. Концентрации тяжелых частиц плазмы существенно превышают их равновесные значения, что и определяет высокую химическую активность ЭПП. Экспериментально доказано, что температуру в процессе модификации материалов удается поддерживать на уровне 300-400 К без потери высокой химической активности ЭПП, что позволяет работать с термолабильными соединениями, в том числе и с полисахаридами.
Деструкция порошков целлюлозы проводилась в электронно-пучковом плазмохимическом реакторе, устройство и принцип действия которого представлены в [6]. С целью увеличения массы обрабатываемого порошка были разработаны специальные дополнительные устройства, в реакционном объеме которых организовано перемешивание значительного количества порошка в процессе обработки. Рисунок 2а иллюстрирует процесс ЭПП-обработки. Сформированный в высоком вакууме (~ 10—5 Торр) электронный пучок (ЭП) (3) инжектировался в заполненную плазмообразующей средой реакционную камеру (6) через газодинамическое выводное окно (4), при этом формировалось облако химически активной ЭПП (7). ЭП сканировали в круглый растр с помощью электромагнитной системы (5), что повышало равномерность обработки материала (8).
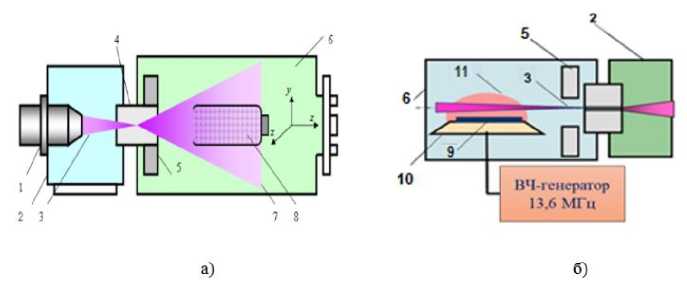
Рис. 2. Схема, плазмохимического реактора, и процедура, (а) генерации электронно-пучковой плазмы и (б) генерации гибридной плазмы-стимулированной деструкции порошков целлюлозы: 1 - электронная пушка; 2 - высоковакуумная камера; 3 - электронный пучок; 4 - выводное устройство;
5 - электромагнитная отклоняющая система; 6 - рабочая камера; 7 - облако ЭПП; 8 - кварцевая труба; 9 - обработанный субстрат, 10 - ВЧ-генератор, 11 - ВЧ-разряда
Температура, образцов измерялась оптическим пирометром Optris LS (Optris GmbH, Германия) и не превышала 50 °C. Сила тока пучка 1ъ подбиралась таким образом, чтобы поддерживать постоянным указанное значение температуры и варьировалась в пределах 1 < 1ь < 100 мА. Энергия электронов на входе в реакционную камеру была постоянной и составляла 30 кэВ. В экспериментах в качестве плазмообразующего газа использовались кислород, аргон и аммиак. Величины давления плазмообразующих газов варьировались в пределах 1-10 Торр.
Гибридную плазму получали путем инжекции ЭП в область ВЧ-разряда, для генерации которого использовали ВЧ-генератор GenesisGHW-12 (MKSInstruments, Великобритания) с частотой 13,6 МГц и эффективной мощностью 20 Вт. В качестве плазмообразующей среды использовали химический чистый кислород и гелий при давлении 0,5 Торр.
В работе были использованы порошок микрокристаллической целлюлозы (средневязкостная масса 1000 кДа), а также полученные на ее основе губки, гидролизный лигнин и лигносульфонаты.
3. Результаты
Обработка целлюлозы в ЭПП придавала исходным соединениям новые физикохимические свойства. Отмечалось снижение степени кристалличности целлюлозы и формирование водорастворимых продуктов. По данным гельпроникающей ВЭЖХ, молекулярная масса для наибольшего пика у соединений, полученных в процессе ЭПП-деструкции целлюлозы, варьировалась в пределах 800-2000 Да. Таким образом происходило образование олигосахаридов со степенью полимеризации от димеров до гептамеров, что связано с действием активных форм кислорода на 3 — 1, 4 гликозидные связи биополимера. При этом следует особо отметить два фундаментальных результата [6]:
-
1) пороговый характер зависимости, связывающей степень деструкции полимера с длительностью пучково-плазменного воздействия;
-
2) вероятность появления побочных, не растворимых в воде соединений в составе продуктов пучково-плазменной модификации биополимеров - эффекта, обусловленного обратной полимеризацией образующихся низкомолекулярных продуктов при неоптимальном выборе условий обработки.
В то же время обработка в ЭПП лигнина практически не влияла на размер макромолекул.


а) б)
SEM-фотографии поверхности губки до и после модификации в ЭПП, увеличение х100 : а) - исходный образец, б) - образец, обработанный в ЭПП кислорода.


а) б)
SEM-фотографии поверхности губки до и после модификации в ЭПП, увеличение х5000 : а) - исходный образец, б) - образец, обработанный в ЭПП кислорода.
Рис. 3. Обработка, губок целлюлозы в ЭПП
В гибридной плазме удалось реализовать прочное ковалентное связывание полисахаридной основы губки и белка тромбина, который является естественным активатором свертывания крови. Плазменно-стимулированный синтез проводили по следующей схеме:
1. Активация и функционализация поверхности полисахаридной губки посредством ее обработки в течение 10 мин в гибридной плазме кислорода (0,5 Торр) при эффективной мощности ВЧ-разряда 50 Вт, ток ЭП варьировали в пределах І^, = 0,4 — 0, 6 мA, U = 30 кэВ.
2. Нанесение на активированную поверхность губки раствора тромбина (активность 500 NIH), которое производили сразу же после ее извлечения из реакционной камеры.
3. Обработка губки с нанесенным тромбином в плазме ВЧ-разряда (эффективная мощность 20 Вт, плазмообразующий газ - гелий при давлении 0,5 Торр) в течение 10 мин и Ts = 30 °C. Предполагалось, что данный этап будет способствовать формированию прочных ковалентных связей между активными группами функционализированного полисахарида и тромбина.
4. Выводы
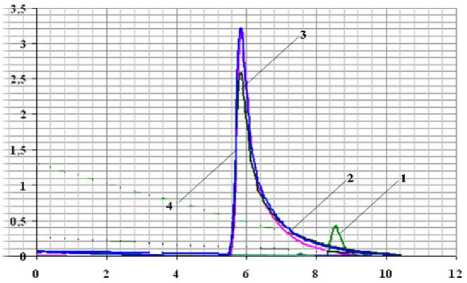
Рис. 4. Гель-пропикающая хроматография биополимерных материалов, полученных в гибридной плазме: 1 - тромбин; 2 - целлюлозная губка, обработанная в гибридной плазме О2; 3 - целлюлозная губка с привитым тромбином, полученная в гибридной плазме О2; 4 - целлюлозная губка с привитым тромбином, полученная в гибридной плазме аммиака.
На хроматограмме коммерческого препарата, тромбина, определялся пик, соответствующий его молекулярной массе (~ 40 кДа) со временем элюирования 8,58 мин. В то же время на. хроматограмме образцов, полученных в ходе плазмохимического синтеза, пик индивидуального тромбина, отсутствовал, что свидетельствует о прочном связывании белка, с полисахаридной матрицей. В дальнейших экспериментах методика, была, использована, для прививки молочной кислоты на. поверхность гидролизного лигнина, и лигносульфонатов.
Экспериментально доказана, возможность получения низкомолекулярных водорастворимых олигосахаридов целлюлозы в ЭПП кислорода. При этом наблюдается пороговый характер зависимости, связывающей степень деструкции полимера, с длительностью пучковоплазменного воздействия, что позволяет оптимизировать процесс обработки и исключить непроизводительные энергозатраты.
В гибридной плазме возможно осуществлять ковалентное связывание биологически активных молекул с биополимерным субстратом. Полученные материалы в дальнейшем могут служить основой для создания эффективных сорбентов, гемостатических средств, нанобиосенсоров и т.п.
Работа, выполнена, при поддержке Минобрнауки, проект № 10А.100.
Список литературы Пучково-плазменные технологии переработки целлюлозы и лигнинов
- Zargar V., Asghari M., Dashti A. A Review on Chitin and Chitosan Polymers: Structure, Chemistry, Solubility, Derivatives, and Applications//Chem. Bio Eng. Reviews. 2015. V. 2. P. 226.
- Biederman H. Plasma polymers and some biomedical applications//European Cells and Materials 2003. V. 6. P. 28.
- Klemm D., Heublein B., Fink H.P., Bohn A. Cellulose: fascinating biopolymer and sustainable raw material//Angew. Chem. Int. Edit. 2005. V. 44. P. 3393.
- Yan Xue, Zihao Moua, Huining Xiao. Nanocellulose as a sustainable biomass material: structure, properties, present status and future prospects in biomedical applications//Nanoscale. 2017. V. 9. P. 14758.
- Patel M., Zhang X., Kumar A. Techno-economic and life cycle assessment on lignocellulosic biomass thermochemical conversion technologies: A review//Renewable and Sustainable Energy Reviews. 2016. V. 53. P. 1499.
- Vasilieva T., Chuhchin D., Lopatin S., Varlamov V., Sigarev A., Vasiliev M. Chitin and cellulose processing in low-temperature electron beam plasma//Molecules. 2017. V. 22. P. 1908. 22111908 DOI: 10.3390/molecules


